文章信息
- 宋宇琴, 李洁, 付丽娇, 李娜, 李六林.
- Song Yuqin, Li Jie, Fu Lijiao, Li Na, Li Liulin.
- ‘壶瓶枣’果实表面特征变化及其与吸水和裂果的关系
- Change of Fruit Surface Characteristics and Its Relationship with Water Absorption and Fruit Cracking in Ziziphus jujuba 'Huping'
- 林业科学, 2018, 54(12): 52-59.
- Scientia Silvae Sinicae, 2018, 54(12): 52-59.
- DOI: 10.11707/j.1001-7488.20181206
-
文章历史
- 收稿日期:2018-04-17
- 修回日期:2018-09-17
-
作者相关文章
2. 山西农业大学林学院 太谷 030801;
3. 山西林业职业技术学院林学系 太原 030009
2. College of Forestry, Shanxi Agricultural University Taigu 030801;
3. Department of Forestry, Shanxi Forestry Vocational Technical College Taiyuan 030009
枣(Ziziphus jujuba)裂果发生十分普遍,许多枣主产区的品质优良的主栽品种遇雨均易裂果(张志善等,1991;苑赞等,2013;赵爱玲,2014),在秋季多雨的年份,枣因裂果引起的损失可高达90%以上(高京草等,2008;王振亮等,2011)。降雨导致的裂果与水分进入果实直接相关,有关引起果实开裂的水分吸收途径在甜樱桃(Prunus avium)、葡萄(Vitis spp.)等柔软的肉质果上研究较为深入,通常认为果实表面吸水会导致裂果,同时通过果实维管束系统的水分吸收也可能导致裂果(Knoche, 2015)。而枣果实结构较为特殊,果肉硬度较大,而果皮硬脆,果梗短而细,不同于甜樱桃等柔软的肉质果。关于引起枣果实开裂的水分吸收途径,多数学者认为根系吸水引起裂果的作用有限(陈辉惶等,2013)。部分研究者认为枣果实表面吸水是导致裂果的主要原因,易裂的'壶瓶枣'果实通过果面的相对吸水量在着色期和全红期均大于抗裂的'圆铃枣'(付丽娇,2014);'壶瓶枣'果实着色期梗洼下的果肉空腔增大,果梗维管束与果实内部维管束的连接发生部分中断,降低了维管束的运输能力,而此时果实表皮细胞增大,排列疏松,果面吸水能力增强(郝燕燕等,2013),且果实在发育后期,果梗导管断裂、堵塞,水分运输能力受损(丁改秀等,2014),而果皮细胞凋亡,果实表面自由水分在水势梯度的驱动下大量进入果肉导致裂果(王保明等,2013)。陈辉惶等(2013)认为枣果实表面和叶片直接吸水对裂果起主导作用,张鹏飞等(2014)认为叶片吸收的水分对裂果的影响更大。为了进一步验证枣果实吸水的主要途径,本试验从枣果实可能的吸水途径、果实不同部位吸水量的差异以及果面结构与吸水裂果的关系等方面进行了研究,以期为阐明枣果实的水分吸收机制提供理论的依据。
1 材料与方法 1.1 试验材料试验于2013—2015年进行,'壶瓶枣'果实取自山西省太谷县桃园堡村枣园。
1.2 试验方法 1.2.1 枣果实染液示踪试验果梗吸水分布的染液示踪:在'壶瓶枣'果实膨大期进行红墨水染液示踪试验,将果梗浸入稀释5倍红墨水溶液中,浸泡2 h后,分别将果实进行纵切和横切,观察并拍照记录果实截面的染色分布情况。
果面吸水分布的染液示踪:分别用稀释5倍的红墨水和0.33%的番红染液对白熟期和着色期的'壶瓶枣'果实进行浸泡处理,体视镜下观察并拍照记录果实染色分布情况。
梗洼吸水分布的染液示踪:将着色期'壶瓶枣'果实的果梗端进行蜡封处理,防止水分和染液进入。然后将果梗端垂直向上固定果实,在梗洼部位用滴管滴满稀释5倍红墨水溶液,保持8 h,期间不断补充溶液,使溶液体积维持在一定范围内。处理后的果实体视镜下观察染色情况并拍照记录。
1.2.2 枣果实不同部位吸水量的测定为了排除离体枣果采样运输过程中可能对果梗和梗洼结合部位造成的人为损伤影响试验结果的准确性,本试验自制打孔泡沫塑料板,孔径2.5 cm,从树冠外围中部选取发育正常、无病虫害和机械伤的着色期果实(半红果),用剪刀从枝条上轻轻剪下果实,保留果梗,置于泡沫塑料板孔内,果梗朝上,泡沫箱中冷藏带回实验室备用。
取膨大期和着色期'壶瓶枣'果实各30个,平均分为3组(A、B、C),每组10个果实,分别进行如下处理:A组:蜡封果梗;B组:蜡封果梗和梗洼;C组:CK,无蜡封。蜡封采用加热融化后冷却至60~70 ℃石蜡对枣果实进行处理。枣果实分别编号,测量果实的初质量,记为W0,然后分别将果实浸入蒸馏水中,纱布覆盖,使果实完全浸没,处理10 h,每隔2 h擦干称质量1次,记为Wt(t=2、4、6、8、10 h)。枣果实的绝对吸水量、相对吸水量和相对吸水速率分别通过下面的公式计算:果实绝对吸水量W=Wt-W0;果实相对吸水量Wr=(Wt-W0)/W0。果实不同部位的吸水量差异的计算公式:
整果吸水量ww=WC;
果梗吸水量wst=WC-WA;
梗洼吸水量wcd=WA-WB;
果面吸水量wsur=WB。
在浸水过程中发生开裂的果实不计入吸水量平均值的计算中。
1.2.3 枣果实表面结构观测体视镜观察:分别于果实膨大期、白熟期、着色期和全红期进行取样,Olympus SZX16体视显微镜下观察裂果敏感性不同的枣品种以及同一枣品种的不同部位的果面结构,Image-pro 6.3软件拍照测量。
扫描电镜观察:每份样品分别取5个果实,切取果胴部位的果皮组织,大小约为5 mm×10 mm,厚度约为1 mm,置于2.5%的戊二酸溶液中固定,4 ℃保存,于南京农业大学生物学实验教学中心电镜室进行样品的制备和观测拍照,扫描电镜型号为Hitachi S-3000N。
1.3 数据分析试验数据通过Excel软件进行计算和作图,方差分析采用SAS 9.0软件进行。
2 结果与分析 2.1 枣果实吸水途径和水分分布 2.1.1 果梗吸水分布通过红墨水染液示踪可以看出(图 1),水分通过果梗维管系统吸收后主要沿着果实中维管束的走向进行运输和分布,在一定时间内,主要分布在维管束及其周围的果肉细胞中。距离果梗较近、主维管束分布较多的果肩染色分布较多,距离果梗端较远、主维管束分布相对较少的果顶部位染色较少。
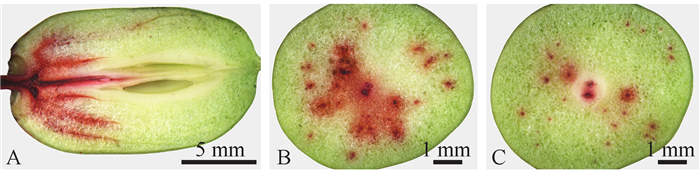
|
图 1 膨大期'壶瓶枣'果实通过果梗吸收的红墨水染液在果实中的分布 Fig. 1 The distribution of the red ink in 'Huping' jujube fruit via fruit stem absorption during the inflating stage A:枣果纵切面;B:果肩部位横切面;C:果顶部位横切面。 A:Fruit longitudinal section; B:The cross section at the stem-end of the fruit; C:The cross section at the calyx-end of the fruit. |
着色期'壶瓶枣'果实果梗吸水的红墨水染液示踪(图 2)表明,着色期果实中染液的运输困难,除了个别果肉主维管束中可以观察到染液的分布外(图 2D~F),其余染液仅在果实梗洼部位的主维管束中有少量分布(图 2B, C),证明枣果实着色期维管束系统的木质部运输能力极显著下降。此外,处理果实的横截面上可以观察到果实外层果肉区域呈暗色分布(图 2D),细胞吸水较多,表明枣果存在通过果梗的渗透吸水,且吸水量较多。
|
图 2 着色期'壶瓶枣'果实红墨水溶液浸泡果梗8 h染液分布 Fig. 2 The dye distribution in 'Huping' jujube coloring stage after the fruit surface being incubated in red ink solution for 8 hours |
枣果实果面吸水的番红染液示踪表明,果面的皮孔和微裂隙是水分进入果实的重要通道(图 3A)。但由于果皮细胞排列紧密,水分传输主要依赖共质体途径,因此通过果点的果肉纵切面上很难观察到番红染色(图 3B, C),但果肉细胞很饱满(图 3E),近皮部细胞膨胀明显(图 3F),水分依赖渗透吸收进入果实细胞。

|
图 3 着色期'壶瓶枣'果实番红染液浸泡果面8 h染液分布 Fig. 3 The dye distribution in 'Huping' jujube coloring stage after the fruit surface being incubated in the safranine dye solution for 8 hours A-F:体视镜观察结果;G:徒手切片透射显微镜观察结果。 A-F: The stereoscopic observation results; G: The observation results of the hand slices through transmission microscope. |
极少数可能通过果面气孔或微裂隙有空腔连接到维管束的地方观察到番红染液进入果肉维管束(图 3D)。此外通过徒手切片在透射显微镜下可以观察到果点下面水分在果肉近皮部的分布(图 3D),表明枣果实果面存在进入果实内部的质外体途径,水分通过质外体途径进入果实,最初分布在果肉空腔,可观察到果肉中分布的液块。
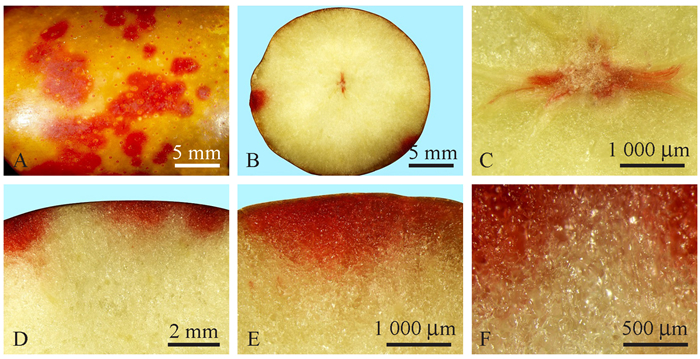
红墨水染色法是检测种子生活力的常规方法,染色效果不同于番红染液。白熟期'壶瓶枣'果实的果面在红墨水溶液中浸泡后,会在果面形成局部染色斑(图 4A, D, E),体视镜下观察发现染色斑分布于角质层下气孔周围的果肉中(图 4F),色斑边界清晰(图 4D~F),证明染液并不是通过渗透吸水进入果实中的;而且同时观察到多数开放气孔并未有染液的进入(图 4B),因此红墨水染液很可能是通过部分开放气孔与内部果肉空腔连通形成的质外体途径进入果实的。
|
图 4 白熟期'壶瓶枣'果实红墨水溶液浸泡果面8 h染液分布 Fig. 4 The dye distribution in 'Huping' jujube white-ripe stage after the fruit surface being incubated in the red ink solution for 8 hours |
着色期'壶瓶枣'果实,整果在红墨水溶液中浸泡后,能在果面观察到大面积的染色斑,染色斑边界模糊(图 5A, D~F)。果面观察到的局部染色证明果实表面角质层的水分运输屏障功能依然存在。染色斑边界模糊,在果肉中呈类似倒锥形分布,证明染液通过果实表面的某一点进入果实,进入果实后伴随着渗透吸水的作用在果肉中扩散分布。此时果梗维管系统也有染色分布,但运输距离很短,仅分布于果梗维管束进入果实的分支处(图 5B, C)。
|
图 5 着色期'壶瓶枣'果实红墨水溶液浸泡整果8 h染液分布 Fig. 5 The dye distribution in 'Huping' jujube coloring stage after the whole fruit being incubated in the red ink solution for 8 hours |
此外,在清水浸果对照试验中,可以观察到浸水处理后果实横截面出现明显的水渍斑(图 6B),体视镜下观察发现果肉空腔结构中充满水分(图 6C),再次证明枣果实存在果面吸水的质外体途径。

|
图 6 着色期'壶瓶枣'果实浸水8 h后果肉中出现水渍斑 Fig. 6 The water stains distribution in 'Huping' jujube coloring stage after the whole fruit being incubated in water for 8 hours A:对照果实横截面;B:浸水果实横切面;C:水渍。 A: The cross section of CK fruit; B:The cross section of soaked fruit; C:The water stains. |
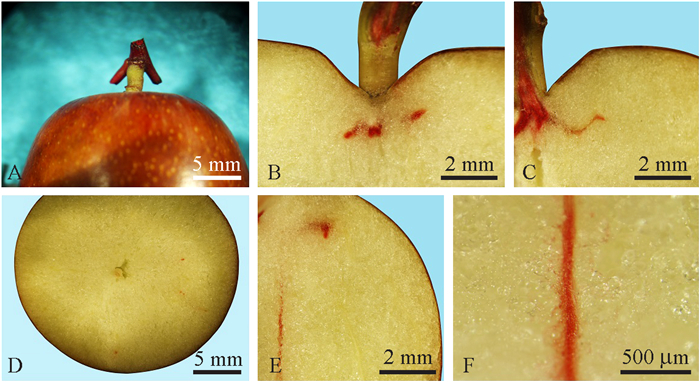
'壶瓶枣'果实蜡封果梗端后(图 7A),梗洼用红墨水溶液浸泡8 h,结果显示在梗洼疤痕表面残留染液较多,疤痕略有肿胀(图 7B),但果实沿果梗的纵切面显示,红墨水染液并未进入果实内部(图 7C)。

|
图 7 着色期'壶瓶枣'果实红墨水溶液浸泡梗洼8 h染色分布 Fig. 7 The dye distribution in 'Huping' jujube coloring stage after the stalk cavity being incubated in red ink solution for 8 hours |
在离体浸水试验中,'壶瓶枣'着色期果实不同部位的相对吸水量均随着浸水时间的延长而显著增加(图 8),果面的相对吸水量大于果梗,而果梗的相对吸水量大于梗洼。
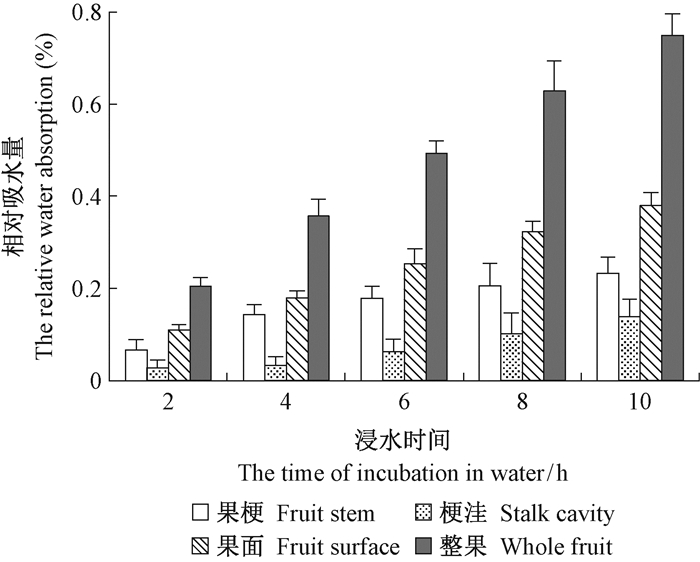
|
图 8 '壶瓶枣'着色期果实浸水过程中相对吸水量的变化 Fig. 8 The relative water absorption change in 'Huping' jujube fruit during its coloring period and incubation |
'壶瓶枣'易裂果的着色期果实浸水处理10 h后的总相对吸水量大于不易裂果的膨大期,果实不同部位相对吸水量变化较大:枣果实膨大期的果梗相对吸水量占到果实总相对吸水量的61.35%,着色期则降至30.93%;而果实的果面相对吸水量占比则从膨大期的25.39%增至着色期的50.62%;梗洼相对吸水量占比从膨大期的13.26%增至着色期的18.45%(图 9)。
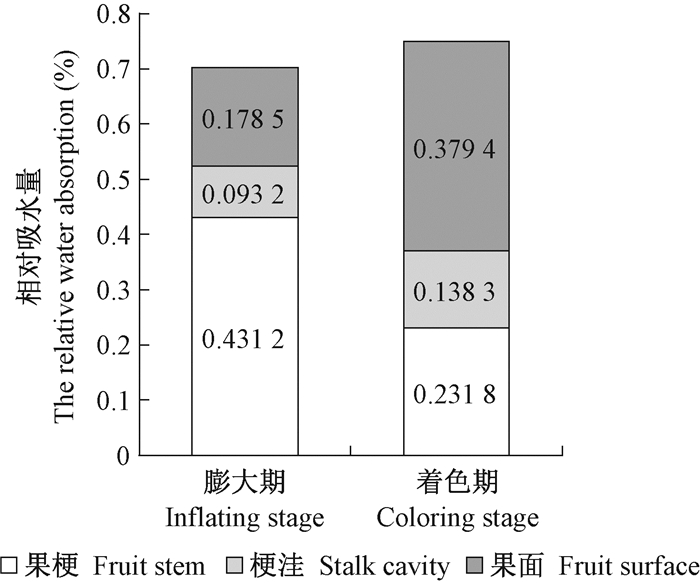
|
图 9 '壶瓶枣'膨大期和着色期果实相对吸水量的差异 Fig. 9 The relative water absorption differences of 'Huping' jujube fruit during its inflating and coloring stage |
在'壶瓶枣'果实的浸水处理过程中,果面的相对吸水量占到果实总相对吸水量的51%~54%,果梗的相对吸水量占到31%~40%,梗洼的相对吸水量占到9%~18%。在浸水处理的前2 h,果面相对吸水量占到果实总吸水量的54%,至浸水处理10 h,一直保持在51%。果梗相对吸水量占比从浸水4 h开始至浸水10 h呈逐渐下降趋势,从40%下降到31%。而梗洼相对吸水量则从浸水4 h开始一直呈增加趋势,从9%增加到了18%,增加了一倍(图 10)。

|
图 10 '壶瓶枣'果实不同部位在浸水过程中相对吸水量占比 Fig. 10 The proportion of the relative water absorption in different parts of 'Huping' jujube fruit during incubation |
伴随着'壶瓶枣'果实的发育进程,气孔逐渐木栓化形成皮孔,并处于完全开放状态(图 11A)。果实白熟期,部分皮孔逐步发生堵塞形成肿胀的木栓化果点(图 11D)。堵塞果点在进一步的发育成熟和着色的过程中容易形成微裂口(图 11E~I),有的呈“一字型”开裂(图 11H),有的呈“T字形”(图 11E)和“三角形”(图 11I)开裂,也有的从中间不规则撑裂(图 11G)或者由于果点比较坚硬而环绕果点开裂(图 11F)。还有大部分皮孔在果实着色后仍然保持开放状态(图 11B),并在果实发育后期部分开放的皮孔沿着纵径方向开裂(图 11C)。

|
图 11 '壶瓶枣'果实发育过程中表面气孔的变化 Fig. 11 The change of stomata on 'Huping' jujube fruit surface during fruit development |
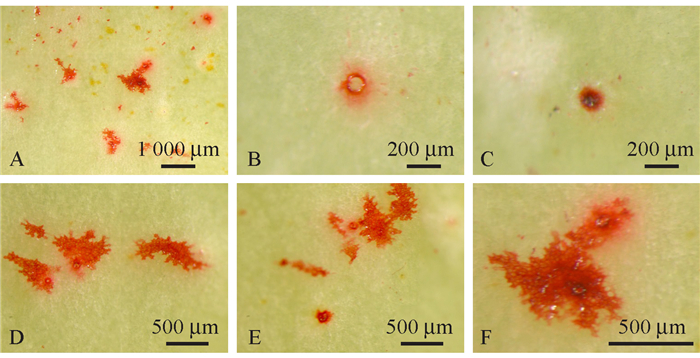
在'壶瓶枣'果实着色的成熟期,气孔形成的皮孔逐步被堵塞(图 12A~C),以及沿着气孔的纵向撕裂的微裂口(图 12E)。当然也存在未堵塞的皮孔(图 12F)和圆形孔洞(图 12D),其周围分布有大小不一的微裂纹。

|
图 12 着色期'壶瓶枣'果实表面皮孔状态 Fig. 12 The lenticels state of 'Huping' jujube fruit in coloring stage |
皮孔周围特化的组织由大量排列密集、体积较小的木栓化细胞构成。同时我们可以看到皮孔中心表皮层细胞的明显断裂(图 13A)和皮孔周围表皮层下显著的空腔结构(图 13B~E,黑色箭头所指部位),以及部分皮孔的特化组织附近皮下层明显的撕裂(图 13E, F,红色箭头所指部位)。皮孔下的果肉组织往往可以观察到较大的空腔结构(图 13D, F)。
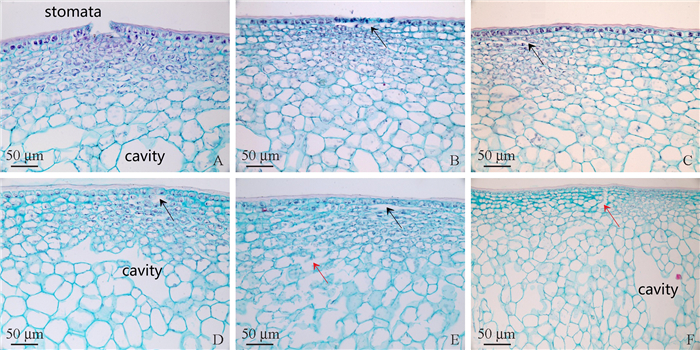
|
图 13 '壶瓶枣'果实的皮孔结构 Fig. 13 The lenticels structure of 'Huping' jujube fruit |
枣果实表面的微裂隙根据来源不同分为3类。一类来源于气孔,气孔开裂形成的微裂隙(图 14A)很多开裂往往是2个甚至更多气孔微裂隙贯穿以后形成的肉眼可见裂痕(图 14D,E),而早期“T字型”的气孔微裂隙往往导致了“T字型”的宏观裂缝(图 14F);另一类来源于花器官脱落形成的疤痕,特别是雄蕊脱落后形成的疤痕(图 14B),果实纵裂往往与其相关;第三类来源于角质层的撑裂,有时也包括一些机械伤痕,多分布于果肩和果顶部位,往往成片分布(图 14C)。
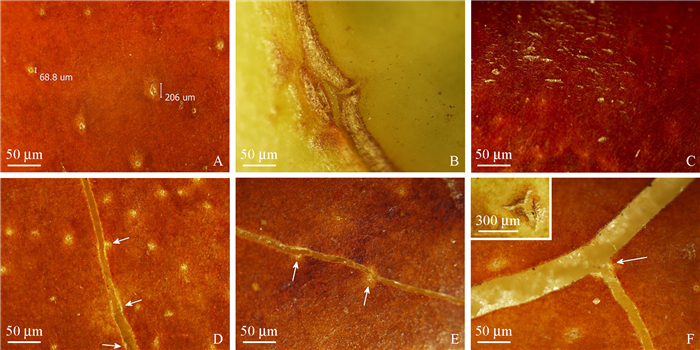
|
图 14 枣果实微裂隙和通过气孔的宏观裂缝 Fig. 14 The microcracks and macrocracks through the stomata on jujube fruit |
角质层微裂隙包括有成片分布的龟裂纹(图 15A),条状分布的平行短裂纹(图 15B)以及相对较大的单一裂纹(图 15C);有的裂纹从果实表面撕裂,相对较浅(图 15A~C),有的从内部开裂,微裂隙穿透了角质层,直达果实内部(图 15D~F)。通过气孔撕裂的微裂隙多数沿着气孔纵径开裂(图 15G),但也有少数沿气孔横径裂开(图 15H)。最后果实宏观开裂,裂缝深达果肉(图 15I)。
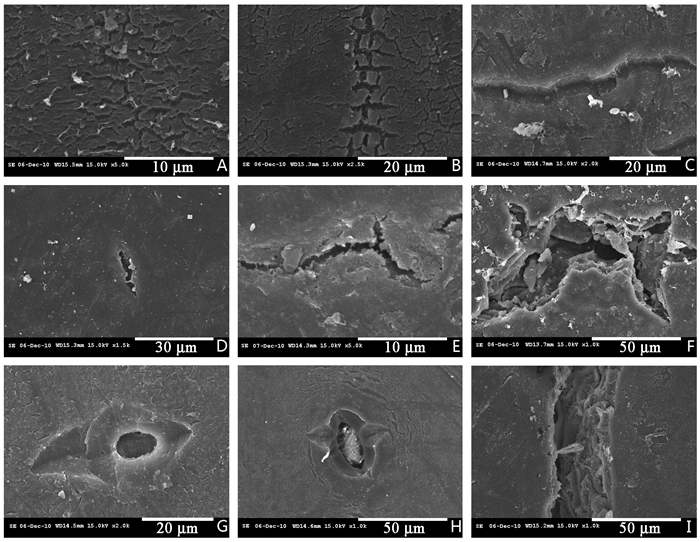
|
图 15 '壶瓶枣'果实表面微裂隙的超微结构 Fig. 15 The ultrastructures of microcracks on the fruit surface of 'Huping' jujube |
关于枣果实的果梗吸水,有研究认为在枣果实成熟过程中,着色期果实梗洼下的果肉空腔变大,果梗维管束与果实内部维管束的连接发生部分中断,维管束运输能力下降(郝燕燕等,2013),但笔者在试验中观察发现因梗洼下空腔形成而发生断裂的维管束是通向果核内部的2条主维管束,而通向果肉中的其余10条主维管束在梗洼空腔上部的位置就已经转向果实横截面方向分布,并没有因为梗洼空腔的产生和变大而发生断裂。丁改秀等(2014)研究发现,'壶瓶枣'果梗在幼果期的正常导管比例为97.22%,白熟期降至34.95%,半红期和全红期进一步下降到13%左右,并认为'壶瓶枣'果实发育后期,果梗导管出现断裂、畸形、退化、堵塞等现象,其运输能力受损或丧失,导致根系吸收的水分难以通过维管束系统大量进入果实,从而不会引发大量裂果。但果梗导管的变化主要影响的是木质部的水分运输,维管束韧皮部的水分运输主要依赖于渗透吸水,在葡萄和甜樱桃上的研究均表明果实成熟过程中果梗维管系统的木质部水分运输能力的显著降低和韧皮部吸水能力的逐步增加(Coombe et al., 2000; Brüggenwirth et al., 2016)。且进一步的研究表明'壶瓶枣'果实的果梗吸水能力(包括木质部吸水和韧皮部吸水)在易裂果的着色期仍然较高,与白熟期相近,显著高于全红期;而染液示踪试验证明,着色期果实的果梗木质部运输存在较大阻力(付丽娇,2014)。在裂果多发的着色期,果梗渗透吸水能力增加,果梗总吸水能力仍然较高。在本试验中,离体果实浸水后的果梗吸水量仍可以占到果实总吸水量的三分之一,因此果实着色期等果梗吸水能力不容忽视。但不同抗裂果性枣品种的果梗吸水研究表明,果梗吸水能力与枣果实的抗裂果性关系不大(付丽娇,2014)。
关于枣果实的果面吸水途径,王保明等(2013)研究发现半红期的'壶瓶枣'果皮细胞发生凋亡甚至死亡,细胞质膜相对透性增大,并认为裂果是由于果皮外部自由水分在水势梯度的驱动下,大量进入果肉中,引起果肉细胞膨胀而导致的裂果。本试验中通过红墨水溶液浸泡枣果,在枣果实近皮部的果肉中形式倒锥形分布,证明染液通过果实表面的某一点进入果实,之后通过渗透扩散,染液的均匀扩散说明细胞膜半透性丧失,与王保明等(2013)关于着色期枣果实的果皮细胞程序化死亡和细胞质膜透性增加的研究结果较为一致。同时本试验中还发现了枣果实表面存在水分进入果实的质外体途径,证明枣果实的果面吸水并不完全是通透渗透势的驱动,但是质外体途径吸水的动力尚不明确,可能与枣果实类似于海绵立体网状的果肉结构有关,水分可以通过质外体途径大量进入果肉空腔,果肉细胞又可通过渗透吸收,从相邻的空腔中直接吸水水分,同时考虑到海绵状的果肉结构可能造成果肉细胞吸水膨胀对果皮形成的压力有限,而在试验中观察到近皮部果肉细胞的显著膨胀,因此认为引起裂果的内部膨胀压力可能更多的来自于果实近皮部的细胞吸水膨胀。而且通过对比'壶瓶枣'果实白熟期和着色期的果面红墨水染色差异,证明着色期果面渗透吸水能力增大。
此外,有研究表明着色期壶瓶枣在梗洼引入染液后,染液会沿着梗洼部位向果实扩散,并认为降雨时水分在梗洼处的积累渗透进入果实可能导致裂果(郝燕燕等,2013)。但考虑到枣果实的果梗细小,在采样过程中容易受到机械损伤,本试验在排除果梗可能受到机械损伤的前提下取样,发现果肩部位的纵切面上果梗与果实的连接部位表皮包括角质层是完全闭合的,染液示踪试验中梗洼部位染液无法通过此区域进入果实内部,梗洼疤痕圈在染液浸泡中发生轻微肿胀,且梗洼疤痕圈是花器官脱落后形成,主要由周皮组织构成,表面无角质层,因此,梗洼疤痕处可能是果实渗透吸水的一个重要部位。
从水分来源上看,果实吸水的途径可能包括:土壤水分、雨天果实表面附着的水分和叶片表面附着的水分、空气中水分等。有研究认为,根系吸水不足以导致裂果(陈辉惶等,2013),但是降雨引起裂果是个逐渐发生的过程,包括降雨过程中的开裂和雨后的开裂。降雨条件下枣树蒸腾速率很低,由根系进入果实的水分也随之减少,但是雨停后的数小时内,即使是夜晚,由于树体和根系土壤中过多的水分急需排除,蒸腾速率显著升高,因此雨后裂果中,根系吸水可能对裂果产生影响。此外,有研究认为降雨引起的枣裂果与水分停留在叶面上时间的长短密切相关,叶片吸水可能作为水分进入果实的一种途径,对裂果起到重要作用(张鹏飞等,2014),由于着色期枣果实果梗的渗透吸水能力较强,不排除水分从叶片大量进入果实的可能性,但是枣果梗过于短和细,很难测量径流变化,验证难度较大。空气中水分以气体状态进入果实的可能性很小,甜樱桃上的研究认为果实会发生水蒸气吸收的平衡湿度是98%左右,气态吸水不可能成为引起果实开裂的一个重要因素(Knoche, 2015)。因此,在降雨条件下,枣果实以果面吸水和可能的经由叶片吸水从果梗进入果实的途径为主;在雨后的数小时内,枣果实表面雨水蒸干以前,枣果实的果面吸水和果梗吸水可能都在发挥作用。
3.2 枣果实表面结构与裂果枣果实表面有大量气孔(皮孔),但在裂果中作用未见详细报道。甜樱桃上研究发现果实表面气孔与蒸腾显著相关(Peschel et al., 2012)。本课题组前期研究发现,枣裂果率与枣果实的表面气孔大小和气孔开度均呈显著正相关,而与气孔频度无关(付丽娇,2014)。'壶瓶枣'果实在白熟期后,果皮表面蜡质层出现裂纹(Li et al., 2018),本试验在枣果实发育成熟过程中观察到果实表面的逐渐形成并分布的大量微裂隙。Peschel等(2005)在甜樱桃上的研究认为,微裂隙是作为渗透障碍的角质层允许水分经黏性流进入果实的重要途径,在果实吸水中具有重要作用,并且认为角质膜上的微裂隙的形成是宏观裂果的前提。本试验中观察到伴随着枣果实的着色过程,会形成沿着气孔纵径撕裂的微裂隙和平行于裂缝的沿着气孔开裂的微裂隙以及宏观开裂的裂缝明显通过2个以上的果点,同时着色期果面相对吸水量增至膨大期的2倍左右,因此认为果面气孔及其在生长发育过程中形成的微裂隙在果实吸水开裂中起重要作用。
4 结论着色期'壶瓶枣'果实的浸水处理过程中,果面的相对吸水量占到果实总相对吸水量的51%~54%,果梗的相对吸水量占到31%~40%,梗洼的相对吸水量占到9%~18%。枣果实表面同时存在水分进入果实的共质体途径和质外体途径。
枣果实成熟过程中,气孔逐渐木栓化形成皮孔,部分皮孔发生堵塞形成肿胀的木栓化果点,堵塞果点在进一步发育成熟和着色过程中容易撑裂形成微裂隙。部分开放状态的皮孔在果实发育后期形成沿纵径方向的微裂隙;枣果实上的宏观裂纹常常经过2个以上的果点连接成线、交叉裂口的交叉点为果点所在位置,且着色期果实的果面吸水量较膨大期果实成倍增加,因此认为,枣果实表面气孔及其形成的微裂隙是引起果实宏观开裂的诱因之一。
陈辉惶, 李建贵, 侍瑞, 等. 2013. 阿克苏地区骏枣果实水分吸收变化与裂果关系研究. 新疆农业大学学报, 36(4): 304-309. (Chen H H, Li J G, Shi R, et al. 2013. A study on relationships of Jun jujube water absorption law and cracking fruit in Akesu region. Journal of Xinjiang Agricultural University, 36(4): 304-309. DOI:10.3969/j.issn.1007-8614.2013.04.009 [in Chinese]) |
丁改秀, 王保明, 王小原, 等. 2014. 壶瓶枣果实发育过程中果柄导管形态变化与裂果关系. 中国农业科学, 24(47): 4886-4894. (Ding G X, Wang B M, Wang X Y, et al. 2014. Changes of anatomical structure of xylem vessels in stalk during Huping jujube fruit development and its relation of fruit cracking. Scientia Agricultura Sinica, 24(47): 4886-4894. [in Chinese]) |
付丽娇. 2014. 水分进入枣果实的途径及与裂果的关系. 太谷: 山西农业大学硕士学位论文. (Fu L J. 2014. The relationship between water entering pathway and jujube fruit cracking. Taigu: MS thesis of Shanxi Agricultural University. [in Chinese]) |
高京草, 王长柱, 高文海. 2008. 从2007年枣大面积裂果谈我国枣产业结构调整. 中国果树, (4): 65-65. (Gao J C, Wang C Z, Gao W H. 2008. Discussion on the structural adjustment of China's jujube industry from the large-area cracking fruits in 2007. China Fruits, (4): 64-65. [in Chinese]) |
郝燕燕, 赵丽琴, 张鹏飞, 等. 2013. 枣离体果实水分吸收与质外体运输的研究. 园艺学报, 40(3): 433-440. (Hao Y Y, Zhao L Q, Zhang P F, et al. 2013. Studies on water uptake and apoplastic transport in detached Chinese jujube fruits. Acta Horticulturae Sinica, 40(3): 433-440. [in Chinese]) |
王保明, 丁改秀, 王小原, 等. 2013. 枣果实裂果的组织结构及水势变化的原因. 中国农业科学, 46(21): 4558-4568. (Wang B M, Ding G X, Wang X Y, et al. 2013. Changes of histological structure and water potential of Huping jujube fruit cracking. Scientia Agricultura Sinica, 46(21): 4558-4568. DOI:10.3864/j.issn.0578-1752.2013.21.019 [in Chinese]) |
王振亮, 田银萍, 刘孟军, 等. 2011. 不同品种枣树果实的抗裂性及其抗裂机理. 经济林研究, 29(3): 74-77. (Wang Z L, Tian Y P, Liu M J, et al. 2011. Crack resistance and its mechanism of different Chinese jujube cultivars. Nonwood Forest Research, 29(3): 74-77. DOI:10.3969/j.issn.1003-8981.2011.03.014 [in Chinese]) |
苑赞, 卢艳清, 赵锦, 等. 2013. 枣抗裂果种质的筛选与评价. 中国农业科学, 23(46): 4968-4976. (Yuan Z, Lu Y Q, Zhao J, et al. 2013. Screening and evaluation of germplasms with high resistance to fruit cracking in Ziziphus jujuba Mill. Scientia Agricultura Sinica, 23(46): 4968-4976. [in Chinese]) |
张鹏飞, 高美英, 纪薇, 等. 2014. 叶片和果实吸水力对枣裂果的影响研究. 核农学报, 28(12): 2269-2274. (Zhang P F, Gao M Y, Ji W, et al. 2014. Effects of leaf and fruit water absorbing on fruit cracking in Chinese jujube. Journal of Nuclear Agricultural Sciences, 28(12): 2269-2274. DOI:10.11869/j.issn.100-8551.2014.12.2269 [in Chinese]) |
张志善, 郭绐仙. 1991. 山西省枣树裂果情况调查初报. 经济林研究, 9(1): 58-62. (Zhang Z S, Guo Y X. 1991. Investigations of jujube fruit dehiscence in Shanxi province. Nonwood Forest Research, 9(1): 58-62. [in Chinese]) |
赵爱玲. 2014. 枣抗裂果种质资源的筛选和鉴定评价. 太谷: 山西农业大学硕士学位论文. (Zhao A L. 2014. Selection and evaluation on crack-resistant jujube germplasm. Taigu: MS thesis of Shanxi Agricultural University. [in Chinese]) |
Brüggenwirth M, Winkler A, Knoche M. 2016. Xylem, phloem, and transpiration flows in developing sweet cherry fruit. Trees, 30(5): 1821-1830. DOI:10.1007/s00468-016-1415-4 |
Coombe B G, McCarthy M G. 2000. Dynamics of grape berry growth and physiology of ripening. Aust J Grape Wine Res, 6(2): 131-135. DOI:10.1111/j.1755-0238.2000.tb00171.x |
Knoche M. 2015. Water uptake through the surface of fleshy soft fruit: barriers, mechanism, factors, and potential role in cracking. Abiotic Stress Biology in Horticultural Plants: 147-166. |
Li N, Song Y, Li J, et al. 2018. Development of the cuticular membrane and biomechanical properties in Hupingzao (Ziziphus jujuba Mill. 'Hupingzao'). Scientia Horticulturae, 229: 25-32. DOI:10.1016/j.scienta.2017.09.019 |
Peschel S, Knoche M. 2005. Characterization of microcracks in the cuticle of developing sweet cherry fruit. Journal of the American Society for Horticultural Science, 130(4): 487-495. |
Peschel S, Knoche M. 2012. Studies on water transport through the sweet cherry fruit surface: Ⅻ. Variation in cuticle properties among cultivars. Journal of the American Society for Horticultural Science, 137(6): 367-375. |
 2018, Vol. 54
2018, Vol. 54
