文章信息
- 苑冉, 李欣悦, 吴韶平, 曹传旺.
- Yuan Ran, Li Xinyue, Wu Shaoping, Cao Chuanwang.
- CO2浓度升高对舞毒蛾生长发育和体内解毒酶及保护酶活性的影响
- Effects of Elevated CO2 Concentration on Growth and Development of Lymantria dispar (Lepidoptera: Lymantridae), as well as on Activities of Detoxifying Enzymes and Protective Enzymes in the Body
- 林业科学, 2018, 54(12): 102-109.
- Scientia Silvae Sinicae, 2018, 54(12): 102-109.
- DOI: 10.11707/j.1001-7488.20181211
-
文章历史
- 收稿日期:2017-07-09
- 修回日期:2017-09-21
-
作者相关文章
由于CO2是太阳能量转化和储存以及地球生物圈赖以生存和平衡的基础,其浓度升高强烈地影响着农林生态系统(宋莉英等,2006)。全球气候变化已在世界范围内引起广泛关注,政府间气候变化专门委员会(IPCC)第4次评估报告显示,2005年大气中CO2浓度已达397.6 μL·L-1,第5次评估报告预计2090年将达到809 μL·L-1左右(Pan et al., 2014)。全球气候变暖、大气CO2浓度不断升高不仅会影响植物化学物质组成,也会对植食性害虫产生间接或直接影响(戈峰等,2006)。许多研究表明CO2浓度升高对不同寄主植物体内营养物质和不同植食性昆虫行为和生理生化等方面产生不同的影响。Bezemer等(1998)通过研究CO2浓度升高对43种植食性昆虫与寄主植物相互作用关系,发现CO2浓度影响寄主次生物质变化,从而对昆虫生长发育产生影响。Hughes等(2001)研究了CO2浓度增加对5种蚜虫种群的影响,发现桃蚜(Myzus persicae)种群数量增加,豌豆蚜(Acyrthosiphon pisum)种群数量下降,而夹竹桃蚜(Aphis nerii)、月见草蚜(Aphis oenotherae)和茄沟无网蚜(Aulacorthum solani)不受影响。邓永学等(2002)报道谷蠹(Rhizopertha dominica)成虫对高CO2敏感而赤拟谷盗(Tribolium castaneum)卵和幼虫敏感性高于蛹和成虫。高CO2浓度下饲养的棉铃虫(Helicoverpa armigera)幼虫比正常大气环境下发育延缓,虫体质量降低,食量和排粪量增加(吴刚等,2006)。高浓度CO2胁迫下寄主植物体内次生物质变化能够诱导昆虫体内保护酶系和解毒酶系的相应改变,以消除或分解这些有毒次生物质而使自身减少或免受伤害。Sun等(2010)研究发现麦长管蚜(Sitobion avenae)体内乙酰胆碱酯酶(acetylcholinesterase,AChE)的活性随着CO2浓度升高而增强,同时超氧化物歧化酶(superoxide dismutase, SOD)的活性也提高。CO2浓度升高导致西花蓟马(Frankliniella occidentalis)和花蓟马(F. intonsa)成虫体内羧酸酯酶(carboxylesterase,CarE)、多功能氧化酶(mixed-functional oxidase,MFO)和SOD酶活性升高,而AChE、过氧化氢酶(catalase, CAT)和过氧化物酶(peroxidase, POD)活性的变化主要受蓟马种类的影响,体内解毒酶或保护酶活性的改变可能是蓟马适应高浓度CO2环境的策略之一(刘建业等,2014)。
舞毒蛾(Lymantria dispar)(鳞翅目Lepidoptera:毒蛾科Lymantridae)是世界性林业食叶害虫,能取食杨(Populus)、柳(Salix)、桦树(Betula)等500多种寄主植物。国外研究报道CO2浓度变化可改变寄主植物——北美白桦(Betula papyrifera)、北美乔松(Pinus strobus)、黄桦(Betula allegheniensis)和灰桦(Betula populifolia)、美洲山杨(Populus tremuloides)、美洲红花槭(Acer rubrum)和美洲糖槭(Acer saccharum)体内N、单宁酸、碳水化合物、酚类含量等,从而影响舞毒蛾生长率、发育时间、体质量、蛹质量等发育指标(Roth et al., 1994; Traw et al., 1996; Lindroth et al., 1997; 1998; Williams et al., 2000; 2003)。然而,有关CO2浓度升高对舞毒蛾生长发育以及生理生化响应机制未见报道。本研究测定了不同CO2浓度下取食人工饲料舞毒蛾的生长发育以及体内解毒酶和保护酶的活性变化,以期为全球气候变化下舞毒蛾适应性和种群变化趋势提供理论依据。
1 材料与方法 1.1 供试昆虫与处理舞毒蛾卵块和饲料购自于中国林业科学研究院森林生态与环境保护研究所,在光照60%光照周期为14 L:10D,温度(25±1)℃,湿度70%±5%的可控CO2人工智能气候箱中孵化(HPG-400HX;PRX-600 L-CO2,赛福),从卵开始孵化一直饲养至舞毒蛾成虫产卵,对照组为正常大气CO2浓度(397 μL·L-1)人工气候箱内饲养。
1.2 生长发育指标测定在不同CO2浓度下分别随机放入相同数量的舞毒蛾卵50粒,卵均来源于产后4个月,放置于恒温(25±1)℃的人工气候箱中,待孵化完全后根据其孵化时间及孵化数量计算孵化率。将同一时间孵化的幼虫放在同一个装有人工饲料的塑料盒中饲养,试验分为3组。每天观察记录幼虫的发育进度参数,幼虫每蜕皮1次增加1个龄期即观察幼虫是否蜕皮计算幼虫发育历期(1~6龄龄期),蛹历期(化蛹当天到羽化前的天数)即从幼虫刚化蛹时的白色逐渐变为淡棕色最后变为深褐色蛹;成虫历期(羽化到成虫死亡的天数)、成虫产卵量(将当天羽化的成虫按雌雄比1:1配对放置于养虫笼中,并给予3%的蔗糖水补充营养,每天定时更换产卵纸,并记录产卵量),分别计算平均发育历期(天)、平均产卵量(粒)和平均孵化率(%)。
1.3 营养利用测定分别选取在397、550和750 μL·L-1 CO2浓度下饲养舞毒蛾3龄幼虫,饥饿24 h后称取鲜质量分别放入空塑料盒中,每盒10头,放入称量后的人工饲料饲喂,48 h后取出幼虫、剩余饲料及粪便,50 ℃下烘烤24 h,再升温至120 ℃下烘至恒质量,分别称其干质量,重复3次。另取饥饿24 h的10头3龄幼虫及称质量后的新鲜饲料,分别测定鲜质量和干质量,以确定试前幼虫干湿比及饲料的干湿比,推算试验前饲料的干质量和试虫干质量。各营养指标的计算参照Waldbauer (1964)的方法。相对生长率(RGR)= (D-C)/[(C+D)/2]×100%;相对取食率(RCR)= (A-B)/[(C+D)/2]×100%;食物利用率(ECI)= (D-C)/(A-B)×100%;食物转化率(ECD)= (D-C)/(A-B
将舞毒蛾3龄幼虫用1.15%氯化钾溶液漂洗,加入预冷的0.1 mol·L-1磷酸缓冲液(含1 mmol·L-1 EDTA-Na2,0.1 mmol·L-1 PMSF和0.1 mmol·L-1 DTT)在冰上用玻璃匀浆器充分匀浆,4 ℃12 000 r·min-1离心30 min,上清液用滤纸抽滤,即为酶液。GST比活力测定按照试剂盒说明书(南京建成生物工程研究所生产)进行。测定管加入0.3 mL的基质液(用谷光甘肽标准品与试剂一应用液配制),0.1 mL酶液;对照管加入0.3 mL的基质液,分别混匀在37 ℃水浴10 min后,测定管和对照管分别加入1 mL的试剂二应用液和1 mL无水乙醇,对照管再加入0.1 mL酶液混匀,3 500~ 4 000 r·min-1离心10 min,取上清液做显色反应。显色反应:在空白管中加入2 mL GSH标准应用液、2 mL试剂三应用液和0.5 mL试剂四应用液,标准管加入2 mL 20 μmol·mL-1 GSH标准溶液,2 mL试剂三应用液和0.5 mL试剂四应用液,测定管和对照管分别加入2 mL上清液,2 mL试剂三应用液和0.5 mL试剂四应用液,混合后室温放置15 min,1 cm光径,双蒸水调零412 nm测各管OD值。GST活性以每毫克蛋白质中酶活性单位表示(U·mg-1蛋白质)。
1.5 过氧化氢酶(CAT)活性测定将舞毒蛾3龄幼虫用预冷的50 mmol·L-1磷酸缓冲液(含1%PVP、0.04%苯基硫脲、10 mmol·L-1 EDTA,pH 7.0)在冰浴中用玻璃匀浆器研磨,匀浆液经超声破碎10 min后,于4 ℃4 000 r·min-1离心30 min,上清液即为酶液。CAT活性测定参照Cohen等(1970)方法。在试管中分别加入2 mL 0.1 mol·L-1 pH7.0磷酸缓冲液,1 mL 0.08% H2O2和50 μL原酶液,空白用1 mL的蒸馏水代替H2O2,240 nm下测定OD值,每1 min记数1次,记录3 min,每个处理重复3次。单位以ΔOD·μg-1min-1蛋白质表示。
1.6 超氧化物歧化酶(SOD)活性测定将舞毒蛾3龄幼虫用预冷的50 mmol·L-1 pH7.0磷酸缓冲液(含1%PVP、0.04%苯基硫脲和10 mmol ·L-1 EDTA)冰浴上用玻璃匀浆器充分匀浆,于4 ℃ 4 000 r·min-1离心15 min,上清液即为酶液。反应体系为3 mL,其中含有50 mmol·L-1pH7.0磷酸缓冲液,13 mmol·L-1甲硫氨酸,0.1 mmol·L-1EDTA,75 μmol·L-1NBT和50 μL酶液,最后加入4 μmol·L-1核黄素,以不加酶液管作为最大光还原管,4 000 lx下光照10 min后,立即避光迅速测定OD560值,以未光照的相同反应管作为对照管,重复测定3次,计算SOD酶活性,以达到50%抑制率所需的酶量为一个酶活性单位(U),酶活性大小以每毫克蛋白质中酶活性单位(U·mg-1蛋白质)表示。
1.7 细胞色素P450酶活性测定将舞毒蛾3龄幼虫加入3 mL 0.1 mol·L-1 pH7.5磷酸盐缓冲液,冰浴上用玻璃匀浆器匀浆,4 ℃10 000 r·min-1离心20 min,上清液用滤纸过滤2次,作为细胞色素P450酶液。将1 mL原酶液、800 μL 0.1 mol·L-1 pH 7.5磷酸缓冲液、100 μL 4.8 mmol·L-1 NADPH,100 μL 20 mmol·L-1对硝基苯甲醚底物放入10 mL离心管中充分振荡混匀,30 ℃水浴温育30 min,加入40 μL浓盐酸终止反应,再加入5 mL氯仿,剧烈振荡20 min,静置3~5 min,4 ℃ 4 200 r·min-1离心15 min,吸取下层清液3 mL并转移至10 mL离心管中,加入3 mL 0.5 mol·L-1 NaOH溶液,剧烈震荡15 min,静置5 min,吸取上层萃取液为待测液。空白对照组采用3 mL NaOH溶液,每个处理3次重复,于412 nm测定生成对硝基苯酚OD值,再根据对硝基苯酚标准曲线求出对硝基苯酚含量。以3 mL 0.5 mol·L-1 NaOH溶液中加入不同浓度对硝基苯酚,剧烈震荡15 min,静置5 min,吸取上层萃取液测定412 nm下OD值,根据OD值和对硝基苯酚浓度制作标准曲线。根据反应时间、对硝基苯酚的生成量和蛋白质含量计算细胞色素P450比活力(pmol·min-1mg-1蛋白质)。按照Bradford(1976)考马斯亮蓝法测定舞毒蛾蛋白含量。
1.8 数据统计分析采用SPSS17.0软件的Student-Newman-Keuls作多重比较,对不同CO2浓度下不同发育指标、营养利用、解毒酶和保护酶进行显著性差异分析,显著水平为P<0.05。
2 结果与分析 2.1 CO2浓度升高对舞毒蛾生长发育影响如表 1所示:随着CO2浓度升高孵化历期随之增加,550和750 μL·L-1 CO2浓度下舞毒蛾卵孵化历期分别比397 μL·L-1 CO2浓度下增长了22.38%和63.57%,且平均孵化历期在750 μL·L-1时最长,为36.46 h,各浓度间有显著差异性(df=2, 6;F=80.866;P < 0.001)。但550 μL·L-1浓度下孵化率比397 μL·L-1CO2浓度孵化率降低了13.00%,而750 μL·L-1浓度下孵化率比397 μL·L-1增长了24.94%,各浓度间有显著差异性(df=2, 9;F=25.392;P < 0.001)。产卵量在550 μL·L-1 CO2浓度时比397 μL·L-1CO2浓度下增加了5.60%,而CO2浓度为750 μL·L-1则比397 μL·L-1CO2浓度时降低了32.95%。各浓度之间有显著性差异(df=2, 12;F=5.675;P=0.018)。
|
|
CO2浓度升高对舞毒蛾幼虫的影响表现为增加了各龄期幼虫的发育历期(表 2),特别是750 μL·L-1 CO2浓度显著增加了1、2、4、6龄和幼虫总发育历期,而CO2浓度升高则缩短蛹和成虫发育历期。
|
|
随着CO2浓度的增加舞毒蛾相对生长率增加(表 3),在CO2浓度为550 μL·L-1和750 μL·L-1时分别比397 μL·L-1增加了42.13%和61.22%,但差异不显著(df=2, 6;F=1.69;P=0.261)。相对取食量随着CO2浓度升高而降低,550 μL·L-1和750 μL·L-1时比397 μL·L-1分别降低了43.12%和49.54%(df=2, 6;F=101.233;P < 0.01);CO2浓度为550 μL·L-1和750 μL·L-1时,食物利用率分别为397 μL·L-1CO2的2.49倍和2.77倍(df=2, 6;F=6.28;P=0.034)。CO2浓度为550 μL·L-1和750 μL·L-1时,食物转化率为397 μL·L-1 CO2的2.83倍和2.84倍(df=2, 6;F=7.606;P=0.023);近似消化率在CO2浓度为550 μL·L-1和750 μL·L-1时分别为397 μL·L-1CO2的87.07%和97.91%(df=2, 6;F=41.086;P < 0.05)。研究结果表明CO2对舞毒蛾3龄幼虫相对生长率无显著性影响,对相对取食量、食物利用率、食物转化率和近似消化率有显著影响。
|
|
舞毒蛾3龄幼虫体内2种保护酶的活性随着CO2浓度升高主要表现为诱导增加(图 1)。CO2浓度为550 μL·L-1时,CAT的活性比397 μL·L-1CO2浓度处理组降低了20.94%,而750 μL·L-1时CAT的活性比397 μL·L-1CO2浓度时增加32.05%;SOD活性在550 μL·L-1和750 μL·L-1时比397 μL· L-1CO2浓度处理组分别增加了1.34%和13.47%。而2种解毒酶的活性随着CO2浓度的升高,细胞色素P450酶的活性在CO2浓度为550 μL·L-1和750 μL·L-1时比397 μL·L-1CO2浓度处理组分别增加了78.79%和93.5%。GST活性在550 μL·L-1 CO2浓度处理下最高,分别比397 μL·L-1和750 μL·L-1CO2浓度处理组活性增加71.03%和50%(P < 0.05)(图 2)。
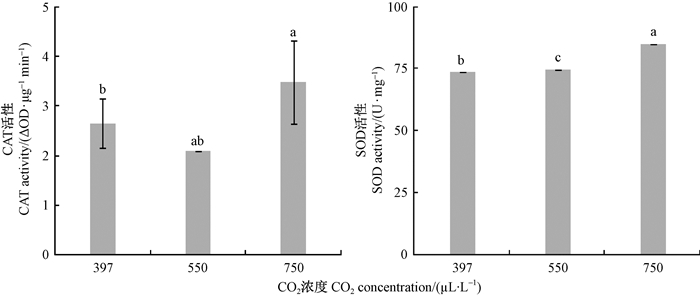
|
图 1 不同CO2浓度对舞毒蛾3龄幼虫CAT和SOD酶活性的影响 Fig. 1 Effects of different CO2 concentration on CAT and SOD activities in 3rd instar larvae of L. dispar 图中垂直线表示标准误差,不同小写字母表示差异显著性(P < 0.05)。The vertical line represents the standard error, different lowercase letters indicate significant difference at 0.05 level.下同The same below. |

|
图 2 不同CO2浓度对舞毒蛾3龄幼虫P450和GST活性的影响 Fig. 2 Effects of different CO2 concentration on P450 and GST activities in 3rd instar larvae of L.dispar |
气候变暖是当前全球气候变化最显著的特征,其主要原因是CO2等温室气体的增加,大气中CO2浓度升高强烈地影响到农林生态系统的结构与功能,它通过改变植物体内化学物质的成分和含量间接影响植食性昆虫以及以之为食的天敌昆虫(戈峰,2011)。大气CO2浓度升高主要通过影响棉花(Gossypium)营养组成和次生代谢物质的含量导致棉蚜(Aphis gossypii)种群发育历期缩短,繁殖力提高,且随着处理世代的增加,发育明显加快,繁殖力增加的幅度加大(陈法军等,2004)。研究表明高浓度的CO2使棉铃虫产卵率增加,亚洲玉米螟(Ostrinia furnacalis)幼虫和化蛹期延长以及死亡率增加(Akbar et al., 2016; Xie et al., 2015)。Manimanjari等(2014)报道CO2会使草地贪夜蛾(Spodoptera frugiperda)的生长发育周期延长。Kopper等(2003)的研究表明CO2处理对天幕毛虫(Malacosomaneus triatestacea)幼虫的发育时间、取食量和蛹质量影响很小或几乎没有影响。Traw等(1996)的研究结果表明,700 μL·L-1 CO2浓度处理下,取食黄桦的舞毒蛾雌虫其蛹质量比对照减轻了38%,而雄虫的蛹质量在不同CO2处理间却没有差异。吴珊珊等(2013)的研究表明,在CO2浓度升高处理下随氮肥量的增加,卵历期延长,若虫存活率降低,雌虫生殖力明显下降,雌成虫寿命明显缩短。本文研究结果表明高浓度CO2(750 μL·L-1)显著增加了舞毒蛾幼虫发育历期,而蛹和成虫发育历期没有显著变化,雌成虫产卵量和孵化历期显著降低,而孵化率显著增加,这表明舞毒蛾蛹和成虫对CO2抗逆能力强于幼虫和卵。舞毒蛾通过延长幼虫发育时间来增加抗逆能力,特别是通过卵的胚胎发育以提高孵化能力,维持后代种群的繁衍。国外也研究报道了CO2浓度水平、树种以及CO2与树种相互作用对舞毒蛾生长发育的影响,例如CO2浓度增加可减少北美白桦的N和单宁酸含量,抑制了舞毒蛾幼虫的生长(Roth et al., 1994)。
吴刚等(2006)的研究表明高浓度CO2(750 μL·L-1)降低了棉铃虫相对消耗率、生长效率、食物转化率和近似消化率。高浓度CO2会使亚洲玉米螟幼虫的取食量和排粪量都显著增加,但食物的近似消化率、毛转化率、净转化率及相对消耗率、相对生长率与对照比较并无显著差异(赵磊等,2015)。王晓伟等(2006)的研究表明高浓度CO2处理下松红头锯角叶蜂(Neodiprion lecontei)幼虫的体质量增量比对照组幼虫的增量减少,相对生长率下降,化蛹时间增加。高浓度CO2处理下斜纹夜蛾(Prodenia litura)幼虫取食更多的叶片,对叶片的消化能力增强,即相对取食消耗率和近似消化率显著增加(朱敏等,2015)。高浓度CO2胁迫下,舞毒蛾幼虫改变对食物的营养利用以维持自身生长发育,本文研究结果表明由于CO2升高,舞毒蛾3龄幼虫相对取食率和近似消化率降低,虫体生长受阻,然而同时食物利用率和食物转化率增加,虫体生长得到促进,这表明舞毒蛾通过增加食物的利用和转化来维持生长,从而抵抗CO2的胁迫。
大气CO2浓度升高不仅对昆虫生长发育和繁殖力有影响,也作用于昆虫内部正常的生理代谢。SOD、CAT和POD是生物体内普遍存在的防御氧化损伤的重要保护酶,这3种保护酶处于一种动态平衡的状态,使自由基维持在一个低水平,起到保护生物机体的作用(李周直等,1994)。解毒酶对分解外源毒物、维持正常生理代谢起到重要的作用。吴刚等(2006)报道高CO2浓度下棉铃虫的SOD、AChE和淀粉酶的活性增加,而谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)的活性则下降。西花蓟马成虫体内的CarE、AChE、MFO、CAT和POD酶活性随着CO2浓度的升高而显著上升(刘建业等,2014)。陈晓燕等(2016)研究表明黏虫(Mythimna separata)不同龄期幼虫体内解毒酶CarE、AChE、MFO和GST活力均随着CO2浓度升高而显著上升;而保护酶SOD酶活性下降,CAT酶活性显著升高。类似地,CO2浓度升高对舞毒蛾体内CAT、SOD、P450和GST酶活性主要表现为诱导增加,这表明舞毒蛾机体对CO2逆境胁迫有自身的应激反应,其中舞毒蛾SOD和P450活性随着CO2浓度增加而逐渐增强,可作为CO2逆境胁迫监测的生物化学标志物。而有关CO2浓度升高时寄主植物次生物质改变对舞毒蛾保护酶和解毒酶系的影响有待进一步的研究。
4 结论本研究利用封闭CO2人工气候箱探讨了CO2浓度升高对舞毒蛾个体生长发育、食物利用以及体内一些生理生化的直接影响机制。舞毒蛾通过延长发育历期、提高产卵量和孵化率以及增加体内解毒酶和保护酶活性,对高CO2浓度胁迫作出应答,这些初步研究结果为全球气候变化下林业重大食叶害虫应急防控与可持续综合防御体系建立提供了基础资料。
陈法军, 戈峰, 刘向辉. 2004. 棉花对大气CO2浓度升高的响应及其对棉蚜种群发生的作用. 生态学报, 24(5): 991-996. (Chen F J, Ge F, Liu X H. 2004. Responses of cotton to elevated CO2 and the effects on cotton aphid occurrences. Acta Ecologica Sinica, 24(5): 991-996. DOI:10.3321/j.issn:1000-0933.2004.05.020 [in Chinese]) |
陈晓燕, 李永川, 郝诗, 等. 2016. CO2浓度升高对粘虫幼虫体内酶活性的影响. 应用昆虫学报, 53(3): 554-563. (Chen X Y, Li Y C, Hao S, et al. 2016. Effects of elevated CO2 concentration on enzyme activity of oriental armyworm, Mythimna separate (Walker)(Lepidoptera: Noctuidae) larvae. Chinese Journal of Applied Entomology, 53(3): 554-563. [in Chinese]) |
邓永学, 赵志模, 李隆术. 2002. 高浓度CO2气调防治谷蠹及杂拟谷盗的研究. 粮食储藏, 31(1): 3-6. (Deng Y X, Zhao Z M, Li L S. 2002. The control of Rhyzopertha dominica (FEB.) (Coleoptera:Bostrichidae) and Tribolium confusum Jacquelin duVal (Coleoptera: Tenebrionidae) with high concentration carbon dioxide controlled atmospheres. Grain Storage, 31(1): 3-6. DOI:10.3969/j.issn.1000-6958.2002.01.001 [in Chinese]) |
戈峰. 2011. 应对全球气候变化的昆虫学研究. 应用昆虫学报, 48(5): 1117-1122. (Ge F. 2011. Challenges facing entomologists in a changing global climate. Chinese Journal of Applied Entomology, 48(5): 1117-1122. [in Chinese]) |
戈峰, 陈法军. 2006. 大气CO2浓度增加对昆虫的影响. 生态学报, 26(3): 936-944. (Ge F, Chen F J. 2006. Impacts of elevated CO2 on insects. Actaecologica Sinica, 26(3): 936-944. [in Chinese]) |
李周直, 沈惠娟, 蒋巧根, 等. 1994. 几种昆虫保护酶系统活力的研究. 昆虫学报, 37(4): 399-403. (Li Z Z, Shen H J, Jiang Q G, et al. 1994. A study on the activities of endogenous enzymes of protective system in some insects. Acta Entomologica Sinica, 37(4): 399-403. DOI:10.3321/j.issn:0454-6296.1994.04.002 [in Chinese]) |
刘建业, 钱蕾, 蒋兴川, 等. 2014. CO2浓度升高对取食不同寄主的西花蓟马和花蓟马生理酶活性的影响. 昆虫学报, 57(7): 754-761. (Liu J Y, Qian L, Jiang X C, et al. 2014. Effects of elevated CO2 concentration on the activities of detoxifying enzymes and protective enzymes in adults of Frankliniella occidentalis and and F. intonsa (Thysanoptera: Thripidae). Acta Entomologica Sinica, 57(7): 754-761. [in Chinese]) |
宋莉英, 吴海昌, 彭少麟. 2006. 二氧化碳浓度升高对植物入侵的影响. 生态环境, 15(1): 158-163. (Song L Y, Wu H C, Peng S L. 2006. Studies on effects of elevated atmospheric CO2 on plant invasion. Ecology and Environment, 15(1): 158-163. DOI:10.3969/j.issn.1674-5906.2006.01.034 [in Chinese]) |
王晓伟, 姬兰柱, 王桂清, 等. 2006. 大气CO2浓度升高对森林食叶昆虫的潜在影响. 应用生态学报, 17(4): 720-726. (Wang X W, Ji L Z, Wang G Q, et al. 2006. Potential effects of elevated carbon dioxide on forest leaf-feeding insects. Chinese Journal of Applied Ecology, 17(4): 720-726. DOI:10.3321/j.issn:1001-9332.2006.04.032 [in Chinese]) |
吴刚, 陈法军, 戈峰. 2006. CO2浓度升高对棉铃虫生长发育和繁殖的直接影响. 生态学报, 26(6): 1733-1738. (Wu G, Chen F J, Ge F. 2006. Direct effects of elevated CO2 on growth, development and reproduction of cotton bollworm Helicoverpa armigera Hǜbner. Acta Ecologica Sinica, 26(6): 1733-1738. [in Chinese]) |
吴珊珊, 孟玲, 李保平. 2013. 高CO2浓度和施氮量对褐飞虱生长发育及繁殖的影响. 南京农业大学学报, 36(1): 59-64. (Wu S S, Meng L, Li B P. 2013. Effects of elevated CO2 and nitrogen fertilization on development and reproduction of the rice planthopper Nilaparvata lugens. Journal of Nanjing Agricultural University, 36(1): 59-64. [in Chinese]) |
赵磊, 杨群芳, 解海翠, 等. 2015. 大气CO2浓度升高对亚洲玉米螟生长发育及繁殖的直接影响. 生态学报, 35(3): 2-11. (Zhao L, Yang Q F, Xie H C, et al. 2015. Direct effects of the elevated atmospheric carbon dioxide levels on the growth, development and reproduction of Ostrinia furnacalis. Acta Ecologica Sinica, 35(3): 2-11. [in Chinese]) |
朱敏, 孟玲, 李保平. 2015. 高CO2浓度和固氮菌对斜纹夜蛾幼虫食物利用效率的影响. 生态学报, 35(2): 334-339. (Zhu M, Men L, Li B P. 2015. Effects of elevated CO2 and nitrogen-fixing bacteria on food utilization efficiency in Prodenia litura Fabricius (Lepidoptera: Noctuidae). Acta Ecologica Sinica, 35(2): 334-339. [in Chinese]) |
Akbar S M D, Pavani T, Nagaraja T, et al. 2016. Influence of CO2 and temperature on metabolism and development of Helicoverpa armigera (Noctuidae:Lepidoptera). Environmental Entomology, 45(1): 229-236. DOI:10.1093/ee/nvv144 |
Bezemer T M, Jones T H. 1998. Plant-insect herbivore interactions in elevated atmospheric CO2 quantitative analyses and guild effects. Oikos, 82(2): 212-222. DOI:10.2307/3546961 |
Bradford. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Analytical Biochemistry, 72(1/2): 248-254. |
Cohen G P, Dembieck D, Marcus J, et al. 1970. Measurement of catalse activity in tissue extracts. Analytical Biochemistry, 34: 30-38. DOI:10.1016/0003-2697(70)90083-7 |
Hughes L, Bazzaz F. 2001. Effects of elevated CO2 on five plant-aphid interactions. Entomologia Experimentalis et Applicata, 99(1): 87-96. DOI:10.1046/j.1570-7458.2001.00805.x |
Kopper B J, Lindroth R L. 2003. Effects of elevated carbon dioxide and ozone on the phytochemistry of aspen and performance of an herbivore. Oecologia, 134(1): 95-103. DOI:10.1007/s00442-002-1090-6 |
Lindroth R L, Kinney K K. 1998. Consequences of enriched atmospheric CO2 and defoliation for foliar chemistry and gypsy moth performance. Journal of Chemical Ecology, 24(10): 1677-1695. DOI:10.1023/A:1020820612833 |
Lindroth R L, Roth S, Kruger E L, et al. 1997. CO2-mediated changes in aspen chemistry: Effects on gypsy moth performance and susceptibility to virus. Global Change Biology, 3(3): 279-289. DOI:10.1046/j.1365-2486.1997.00077.x |
Manimanjari D, Srinivasa Rao M, Swathi P, et al. 2014. Temperature and CO2 dependent life table parameters of Spodoptera litura (Noctuidae: Lepidoptera) on sunflower and prediction of pest scenarios. Journal of Insect Science, 4(1): 1-7. |
Roth S K, Lindroth R L. 1994. Effects of CO2-mediated changes in paper birch and white pine chemistry on gypsy moth performance. Oecologia, 98(2): 133-138. DOI:10.1007/BF00341464 |
Sun Y C, Su J W, Ge F. 2010. Elevated CO2 reduces the response of Sitobion avenae (Homoptera: Aphididae)to alarm pheromone. Agriculture Ecosystems and Environment, 135(1): 140-147. |
Pan S F, Tian H, Dangal S R S, et al. 2014. Complex spatiotemporal responses of global terrestrial primary production to climate change and increasing atmospheric CO2 in the 21st century. PLoS One, 9(11): 1-20. |
Traw M B, Lindroth R L, Bazzaz F A. 1996. Decline in gypsy moth (Lymantria dispar) performance on an elevated CO2 atmosphere depends upon host plant species. Oecologia, 108(1): 113-120. DOI:10.1007/BF00333222 |
Waldbauer G P. 1964. The consumption, digestion and ultilization of solanaceous and non-salanaceous plants by larvae of the tobacco hornworm, Protoparce sexta (Johan)(Lepidoptera:Sphingidae). Entomologia Experimentalis et Applicata, 7: 253. DOI:10.1111/eea.1964.7.issue-3 |
Williams R S, Lincoln D E, Norby R J. 2003. Development of gypsy moth larvae feeding on red maple saplings at elevated CO2 and temperature. Oecologia, 137(1): 114-122. DOI:10.1007/s00442-003-1327-z |
Williams R S, Norby R J, Lincoln D E. 2000. Effects of elevated CO2 and temperature-grown red and sugar maple on gypsy moth performance. Global Change Biology, 6(6): 685-695. DOI:10.1046/j.1365-2486.2000.00343.x |
Xie H, Zhao L, Yang Q, et al. 2015. Direct effects of elevated CO2 levels on the fitness performance of Asian corn borer(Lepidoptera: Crambidae) for multigenerations. Environmental Entomology, 44(4): 1250-1257. DOI:10.1093/ee/nvv102 |
 2018, Vol. 54
2018, Vol. 54

