文章信息
- 丁新景, 敬如岩, 黄雅丽, 陈博杰, 马风云
- Ding Xinjing, Jing Ruyan, Huang Yali, Chen Bojie, Ma Fengyun
- 基于高通量测序的4种不同树种人工林根际土壤细菌结构及多样性
- Bacterial Structure and Diversity of Rhizosphere Soil of Four Tree Species in Yellow River Delta Based on High-Throughput Sequencing
- 林业科学, 2018, 54(1): 81-89.
- Scientia Silvae Sinicae, 2018, 54(1): 81-89.
- DOI: 10.11707/j.1001-7488.20180109
-
文章历史
- 收稿日期:2016-07-13
- 修回日期:2017-04-09
-
作者相关文章
2. 山东农业大学林学院 山东农业大学生态与环境实验室 泰安 271018;
3. 中国科学院大学 北京 100049
2. Forestry College, Shandong Agricultural Unversity Laboratory of Ecology and Environment of Shandong Agricultural Unversity Tai'an 271018;
3. University of Chinese Academy of Sciences Beijing 100049
微生物在土壤中非常活跃, 几乎参与土壤中的一切生理生化反应, 在推动地球物质循环、生态系统能量流动和维持生态系统正常运转中发挥着重要作用, 是维护森林生态系统正常运转的重要组成部分(Young et al., 2004; Wiehe et al., 1995)。土壤微生物中细菌数量最大、种类最多, 且生物学特性各异, 繁殖速度较快(Kennedy, 1999; 丁新景等, 2017)。研究指出, 土壤、细菌和植物三者之间存在复杂的互作关系(艾超等, 2015), 植物根际土壤作为细菌与根系相互作用的媒介, 在细菌和根系共同作用下形成了复杂的土壤微生态系统(Ryan et al., 2001;汪其同等, 2015)。土壤细菌是陆地生态系统植物多样性和生产力的重要驱动者, 地上植物生长和地下细菌群落之间有着密切联系。细菌可促进土壤中有机残体的分解和潜在养分的转化, 提高土壤供肥能力, 释放出的CO2可供植物进行光合作用; 细菌种类越多、数量越大, 土壤细菌活性越强, 越能促进植物生长。对根际土壤中细菌群落结构及多样性进行研究, 能够了解植物根系对土壤细菌的影响及细菌活动规律, 探索土壤、植物和细菌三者之间的复杂关系, 也有助于进一步认识植物根系-细菌共生体系的协同进化机制(Berg et al., 2014; 丁新景等, 2017)。
近年来, 鉴于土壤细菌群落结构及多样性在生态系统中的重要意义, 相关研究受到了广泛关注。但由于土壤细菌群落结构复杂、数量巨大以及研究技术的限制, 人们对细菌群落的了解仍不够深入。传统研究方法主要是纯培养技术, 但只能分离到1%~10%的细菌, 导致严重的细菌多样性信息丢失; 另外, 因其操作步骤繁杂、试验耗时长、成本高、难以检测痕量细菌等原因而不能达到深入研究的目的(贺纪正等, 2013)。高通量测序技术(又称新一代测序技术或第二代测序技术)是一种以末端终止原理建立的焦磷酸测序技术, 具有无需克隆、通量高等优点, 能够将获得的样本基因信息与已构建的大量基因信息库进行比较分析, 进而高效、全面地认识土壤微生物, 目前已经被广泛应用于土壤微生物遗传多样性的研究。柳春林等(2012)应用高通量技术分析鼎湖山森林土壤细菌多样性、寇文伯等(2015)应用高通量技术分析鄱阳湖细菌群落结构, 均取得了较好效果。
黄河三角洲是我国重要的盐碱地分布区之一, 土壤盐碱化程度较为严重, 已成为制约地区经济发展的重要因素。为改善当地生态环境, 20世纪80年代开始营建大面积的人工林。人工林营建选择具有耐盐、抗旱特性的树种, 在防风固沙、水土保持和土壤改良等方面发挥了重要作用, 是保护当地环境的重要措施之一(Wang et al., 2015;杜振宇等, 2014; 丁新景等, 2017)。营建人工林必然带来土壤生物学性质的变化, 尤其是最为敏感的土壤微生物群落结构会发生相应改变, 这将影响到土壤生态系统的功能发挥和结构稳定, 但目前有关这方面的研究鲜有涉及。鉴于此, 本研究采用高通量测序技术, 对黄河三角洲地区栽植面积较大、具有代表性的刺槐(Robinia pseudoacacia)、绒毛白蜡(Fraxinus velutina)、臭椿(Ailanthus altissima)和榆(Ulmus pumila)4种树种人工林根际土壤细菌结构及多样性进行研究, 揭示人工林改善土壤生产力的微生物学机制, 为人工林的栽培和管理提供理论依据。
1 材料与方法 1.1 研究区概况研究区位于山东省东营市河口区(37°59′14″—37°88′23″ N, 118°53′27″—118°55′41″ E), 研究区东侧和北侧临渤海。该地区属暖温带半湿润季风气候, 年均地温15.06 ℃, 年均气温12.83 ℃, 年均无霜期220天, 冻土期44天, 年均日照时间约2 728.52 h, 年均相对湿度65%, 年均降水量550~690.57 mm, 全年降水分布不均, 夏季降水占全年的69.25%, 冬季仅占全年的2.46%, 平均蒸散量750~2 400 mm, 超过10 ℃有效积温约4 300 ℃(曹帮华等, 2008; 丁新景等, 2016)。土壤为滨海盐土和盐化潮土, 砂壤占24.2%, 轻壤占46.1%, 中壤占14.8%, 重壤占10.1%, 黏土占4.8%(夏江宝等, 2015)。
研究区人工林为1985年营建, 株行距为3 m×3 m。栽植树种主要有刺槐、臭椿、绒毛白蜡、榆树、杨树(Populus spp.)、苦楝(Melia azedarach)和国槐(Sophora japonica)等。林下草本植物有茅草(Imperata cylindica)、牵牛(Pharbitis nil)和荻(Triarrherca saccharifora)等(丁新景等, 2017)。试验区人工林生长情况见表 1。
|
|
2014年11月在臭椿、榆树、绒毛白蜡和刺槐4种人工林中分别设置3个标准地, 标准地大小为20 m×20 m。在每个标准地中选择1株标准木, 在距树干基部50 cm处设置东西南北4个取样点, 采集直径≤2 mm的树木细根, 抖落掉细根上黏附的土壤作为植物根际土壤, 将相同人工林标准地获取的根际土壤等量混匀。试验共取12个根际土样。将每个标准地根际土样分为2份:1份装入已消毒的密封塑料袋中, 液氮保存带回实验室; 1份自然风干过0.20 mm筛, 用于土壤理化性质测定。另外, 采用环刀法取样测定人工林土壤含水量。
1.2.2 土壤理化性质测定土样pH测定采用电位法(水土比为1:2.5), 土壤电导率测定采用电导法(水土比为1:5), 土壤含水量测定采用环刀法; 速效氮含量测定采用碱解扩散法, 速效磷含量测定采用浸提钼锑抗比色法, 速效钾含量测定采用火焰光度法, 有机质含量测定采用重铬酸钾氧化-外加热法(刘方春等, 2012; 丁新景等, 2017)。
1.2.3 土壤微生物DNA提取、测序及处理采用CTAB方法提取根际土壤样本基因组DNA(刘璐等, 2015), 利用琼脂糖凝胶电泳、OD280检测DNA的浓度和纯度。用无菌水在离心管中稀释样品质量浓度至1 ng·μL-1, 以稀释后样品基因组DNA为模板, 依据测序区域的选择, 使用带有Barcode的特异引物(New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer)以及高效和高保真酶进行PCR。试验引物的对应区域为:16S V4区引物为515F-806R。用Next® UltraTM DNA Library Prep Kit for Illumina建库试剂盒(New England Biolabs公司生产)构建文库, 文库构建后经Qubit定量和文库检测合格, 应用MiSeq进行上机测序(丁新景等, 2017)。
Illumina MiSeq测序平台得到的下机数据(raw data)有一些质量不高, 会干扰分析结果, 因此在进行下一步分析前, 将下机数据根据Barcode序列拆分为不同的样品数据, 去除Barcode序列以及PCR扩增引物序列; 对每个样品的reads使用FLASH进行拼接, 得到原始Tags数据(raw tags); 原始Tags数据经更严格的过滤处理(Bokulich et al., 2013; 丁新景等, 2017), 得到高质量的Tags数据(clean tags):原始Tags数据从连续低质量值(默认质量阈值≤3)碱基数达到设定长度(默认长度为3)的第1个低质量碱基位点截断; 经过截取Tags后得到的Tags数据集, 进一步处理过滤掉其中连续高质量碱基长度小于Tags长度75%的Tags数据(Caporaso et al., 2010; 丁新景等, 2017)。对高质量的Tags序列与(UCHIME Algorithm)数据库进行比对(Edgar et al., 2011), 检测嵌合体序列并去除嵌合体序列(Haas et al., 2011; 丁新景等, 2017)。
1.2.4 物种注释与丰度计算采用Uparse软件聚类分析所有样品Effective Tags序列(王伏伟等, 2015), 将序列聚类成为OTUs(默认97%的一致性), 构建OTUs时选取代表性序列(OTUs中出现频数最高的序列), 用GreenGene和RDP Classifier数据库将代表性序列集合注释分析样品物种。结合物种组成信息得到根际土壤样品中细菌物种丰度(丁新景等, 2017)。
1.2.5 多样性计算利用QIIME(Version1.7.0)软件依据样本文库的OTUs丰度信息计算土壤样品的细菌多样性:物种数、Chao1指数、Shannon指数和Simpson指数(柳春林等, 2012; 丁新景等, 2017)。应用SPSS 22.0软件进行细菌丰度和土壤理化性质相关性分析以及细菌丰度差异比较。
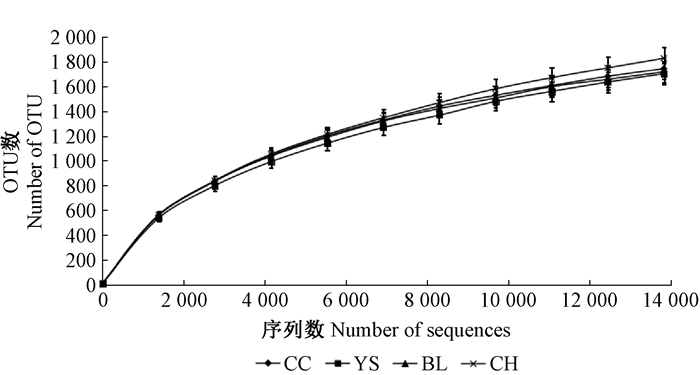
2 结果与分析 2.1 测序数据分析从黄河三角洲臭椿、榆树、绒毛白蜡和刺槐4种人工林根际土壤中分别获得32 458、48 368、36 885和31 059条原始序列, 其中有效序列分别为32 222、47 759、36 251和30 246条。采用对测序获得的序列进行随机抽样的方法, 以抽到的序列数与其所代表的OTU数构建稀释曲线(图 1)。从图 1可以看出, 4种人工林根际土壤样品的稀释曲线均趋于平坦, 表明测序数据合理, 更多的测序数据对发现新的OTU贡献率较小。
|
图 1 细菌稀释曲线分析 Figure 1 Rarefaction curve analysis of OTUs CC:臭椿人工林 A.altissima plantations; YS:榆树人工林 U.pumila plantations; BL:绒毛白蜡人工林 F.velutina plantations; CH:刺槐人工林 R.pseudoacacia plantations。下同 The same below. |
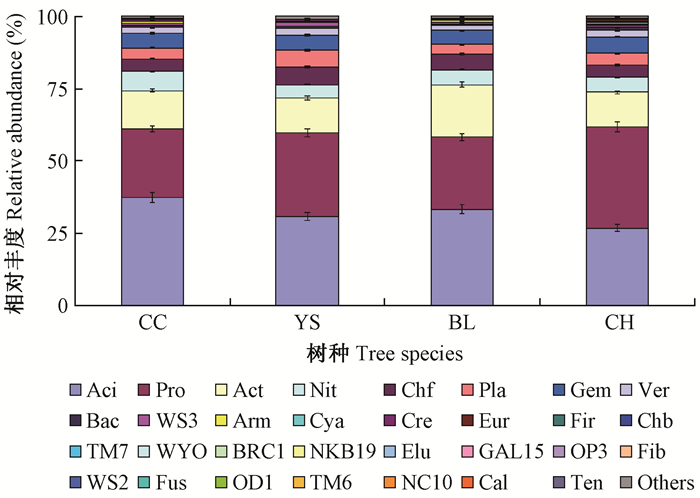
在相似水平为97%的条件下, 与Gold database数据库对比, 对所得序列进行聚类分析, 结果见图 2。4种人工林根际土壤细菌共有31门, 臭椿、榆树、绒毛白蜡和刺槐人工林根际土壤细菌分别有27、26、28、28门。酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、硝化螺旋菌门(Nitrospirae)、绿弯菌门(Chloroflexi)、浮游菌门(Planctomycetes)、芽单胞菌门(Gemmatimonadetes)和疣微菌门(Verrucomicrobia)8门细菌在4种人工林根际土壤中相对丰度超过1%, 是根际土壤中的主要群落。酸杆菌门、变形菌门和放线菌门3门细菌在4种人工林根际土壤中相对丰度均大于10%, 显著高于其他细菌, 是根际土壤中的优势菌落。酸杆菌门细菌在臭椿、榆树和绒毛白蜡人工林根际土壤中丰度最高, 4种人工林根际土壤细菌中的丰度介于26.79%~37.24%之间。变形菌门细菌在4种人工林根际土壤中为丰度介于23.80%~35.00%之间, 刺槐根际土壤中的丰度显著高于其他3种人工林。放线菌门细菌在4种人工林根际土壤中的丰度介于11.89%~18.16%之间。变形菌门、WS3、蓝藻菌门(Cyanobacteria)、广古菌门(Euryarchaeota)、厚壁菌门(Firmicutes)、OD1和软皮菌门(Tenericutes)7门细菌在4种人工林根际土壤中的丰度差异显著, 其中, OD1、软皮菌门细菌仅分布在刺槐根际土壤中, 在其他3种人工林根际土壤中未检测到。
|
图 2 门水平土壤细菌群落结构 Figure 2 Soil bacterial community on the phylum level Aci.酸杆菌门 Acidobacteria; Pro.变形菌门 Proteobacteria; Act.放线菌门 Actinobacteria; Nit.硝化螺旋菌门 Nitrospirae; Chf.绿弯菌门 Chloroflexi; Pla.浮游菌门 Planctomycetes; Gem.芽单胞菌门 Gemmatimonadetes; Ver.疣微菌门 Verrucomicrobia; Bac.拟杆菌门 Bacteroidetes; Arm.装甲菌门 Armatimonadetes; Cya.蓝细菌门 Cyanobacteria; Cre.泉古菌门 Crenarchaeota; Eur.古生菌门 Euryarchaeota; Fir.硬壁菌门 Firmicutes; Chb.绿菌门 Chlorobi; Elu.迷踪菌门 Elusimicrobia; Fib.纤维杆菌门 Fibrobacteres; Fus.梭杆菌门 Fusobacteria; Cal.蓝藻门 Caldithrix; Ten.无壁菌门 Tenericutes; WS3, TM7, WYO, BRC1, NKB19, GAL15, OP3, WS2, OD1, TM6, NC10.未定菌 Unclassified; Oth.其他 Others. |
4种人工林根际土壤细菌多样性分析结果见表 2。刺槐根际土壤细菌物种数、Chao1指数和Shannon多样性指数在4种人工林中最高, 分别为1 828.49、2 602.81和8.92, 其中Chao1指数显著高于其他3种人工林(P < 0.05)。榆树根际土壤细菌物种数、白蜡根际土壤细菌Chao1指数在4种人工林中最低, 分别为1 703.36和2 161.69。臭椿、绒毛白蜡根际土壤细菌Simpson指数显著高于榆树、刺槐(P < 0.05), 臭椿与白蜡、榆树与刺槐之间细菌多样性差异不显著(P>0.05)。
|
|
不同树种人工林根际土壤理化性质见表 3。4种人工林根际土壤均为碱性(pH均大于8.3), 其中臭椿根际土壤pH最高, 显著高于其他人工林(P < 0.05)。榆树根际土壤碱解氮、有效磷、速效钾和有机质含量显著低于其他3种人工林(P < 0.05)。刺槐根际土壤有效磷含量最高, 为3.47 mg ·kg-1, 显著高于其他3种人工林, 臭椿、榆树和绒毛白蜡根际土壤有效磷含量分别是刺槐的43.52%、33.72%和39.48%。臭椿根际土壤含水量、速效钾、碱解氮和有机质含量最高, 其中土壤含水量、有机质含量显著高于其他3种人工林, 榆树、绒毛白蜡和刺槐根际土壤的含水量分别是臭椿的51.22%、48.47%和57.56%, 有机质含量分别是臭椿的32.65%、49.33%和45.54%。
|
|
表 4可知, 有效磷、碱解氮和速效钾含量对根际土壤中主要细菌丰度影响较大。速效钾含量与7类主要细菌丰度相关关系显著, 其中与绿弯菌门、疣微菌门细菌丰度呈极显著负相关。有效磷、碱解氮含量分别与4类主要细菌丰度相关关系显著, 其中有效磷含量与浮游菌门细菌丰度呈极显著正相关, 碱解氮含量与芽单胞菌门、绿弯菌门细菌丰度呈极显著负相关。另外, 硝化螺旋菌门细菌丰度与土壤含水量、有机质含量呈极显著正相关, 芽单胞菌门细菌丰度与电导率呈显著负相关。
|
|
由表 5可知, 土壤电导率与细菌物种数呈显著负相关; 有效磷含量与Chao1指数、Shannon指数呈显著正相关, 与物种数呈极显著正相关; 土壤含水量、碱解氮和有机质含量与Simpson指数呈显著正相关, 速效钾含量与Simpson指数呈极显著正相关; 土壤pH与细菌多样性指数无显著相关关系。
|
|
黄河三角洲土壤中主要有8类细菌, 其中, 酸杆菌门、变形菌门和放线菌门细菌未与土壤理化性质指标呈极显著相关关系, 其余5类细菌丰度与1种或2种土壤理化性质指标呈极显著相关关系。另外酸杆菌门和变形菌门、放线菌门3门细菌丰度显著高于其他细菌, 是人工林根际土壤中的优势群落, 这与其生态位宽度较大、受环境影响较小有关; 而其他5类细菌受到1种或2种土壤环境因素限制, 生长受到抑制, 丰度较小(辛晓静等, 2016; 丁新景等, 2017)。
研究表明, 酸杆菌门细菌在酸性土壤环境中丰度较高, 如鼎湖山森林土壤(pH为3.00~4.50)中酸杆菌门丰度介于53.3%~67.8%之间(柳春林等, 2012), 三江平原土壤(pH为5.39~5.85)中酸杆菌门丰度为53.0%(隋心等, 2015)。这可能是由于酸杆菌门细菌是嗜酸性细菌, 酸性土壤环境有利于细菌的生理活动。黄河三角洲人工林根际土壤中酸杆菌门细菌丰度为26.79%~37.24%, 低于鼎湖山和三江平原, 可能是由于该地区的碱性土壤环境不利于酸杆菌门细菌的生理代谢活动(丁新景等, 2017)。4个树种人工林根际土壤中酸杆菌门细菌丰度较低, 但根际细菌多样性(Chao1指数2 161.69~2 602.81)却高于汪其同等(2015)(Chao1指数1 931.62~2 260.43)、隋心等(2015)(Chao1指数709~745)在非碱性土壤中的研究结果, 可能是由于碱性土壤环境不利于酸杆菌门生长, 减小了其他细菌的竞争压力, 有利于其他细菌的生长代谢, 从而提高了人工林根际土壤细菌多样性(Stewart et al., 2016; 丁新景等, 2017)。
4个树种人工林根际土壤中检测出芽单胞菌门细菌, 而此类细菌在其他地区土壤中丰度较低甚至未被发现, 如在三江平原土壤中芽单胞菌门丰度只有1%(隋心等, 2015; 杨菁等, 2015)。黄河三角洲人工林土壤中芽单胞菌门细菌丰度较高, 介于4.74%~5.67%之间, 而且芽单胞菌门细菌丰度与土壤电导率呈极显著正相关, 这主要是因为芽单胞菌门细菌部分具有耐盐或嗜盐的特性, 适宜在含盐量较高的黄河三角洲土壤中生长(罗明等, 2009)。
3.2 土壤理化性质与细菌大量研究表明, 土壤细菌多样性与土壤理化性质密切相关(隋心等, 2015; 杨菁等, 2015)。本研究发现, 土壤电导率与细菌物种数呈显著负相关关系, 这可能是由于土壤盐分较高造成土壤中细菌渗透胁迫, 抑制细菌的代谢活动, 降低了细菌多样性(刘方春等, 2014)。另外, 盐胁迫抑制植物根系生长并减少根系分泌物, 作为细菌营养物质的主要来源, 根系分泌物减少, 因此细菌的种类和数量降低(路海玲等, 2011)。
黄河三角洲土壤含水量、有效磷含量与Chao1指数或Shannon指数呈显著正相关关系, 这是因为一定的土壤水分条件可为细菌生长繁殖创造良好的条件, 而较高的土壤有效磷含量可为细菌生长提供磷元素, 因此土壤含水量、有效磷含量与土壤细菌多样性具有较强的相关关系(Steenwerth et al., 2002; 区余端等, 2009; 安韶山等, 2011)。
3.3 不同树种对土壤细菌的影响黄河三角洲4种人工林根际土壤细菌结构和多样性存在差异, 其中刺槐根际土壤细菌多样性显著高于其他3种人工林。陈为峰等(2010)研究表明, 不同树种根系对根际细菌群落影响不同, 作为根际土壤细菌营养物质的主要来源, 根系分泌物的数量与质量是影响根际细菌群落的重要因素。不同植物根系分泌物中各种低分子质量糖、无机离子和有机酸等物质种类和数量存在一定差异(李梓正等, 2010), 特别是根系分泌物中的类黄酮、酚类化合物柠檬酸、苹果酸、草酸、阿魏酸、氢氰酸、苯甲酸、肉桂酸和皂角苷等差异较大(Sun et al., 2016;Zhu et al., 2016), 因而影响了根际土壤细菌群落组成。另外, 不同植物根系的生长代谢和凋落物基质质量也存在差异, 根系代谢和凋落物分解会影响土壤(特别是根际土壤)的pH、土壤颗粒大小、湿度、透气性、土壤紧实度及土壤中P、K、N、有机质含量等理化性质, 从而造成不同植物根际土壤中细菌群落结构和多样性差异(刘文娜等, 2006; 丁新景等, 2017)。
4 结论酸杆菌门、变形菌门和放线菌门3门细菌是黄河三角洲臭椿、榆树、绒毛白蜡和刺槐4个树种人工林根际土壤中的优势菌落, 硝化螺旋菌门、绿弯菌门、浮游菌门、芽单胞菌门和疣微菌门5门细菌是根际土壤中的主要群落。变形菌门、WS3、蓝藻菌门、广古菌门、厚壁菌门、OD1和软皮菌门7门细菌丰度在4种树种人工林根际土壤中差异显著。刺槐根际土壤细菌多样性显著高于臭椿、榆树和绒毛白蜡。土壤电导率和碱解氮、有效磷、速效钾含量是细菌结构和多样性的主要影响因素。
艾超, 孙静文, 王秀斌, 等. 2015. 植物根际沉积与土壤微生物关系研究进展[J]. 植物营养与肥力学报, 21(5): 1343-1351. (Ai C, Sun J W, Wang X B, et al. 2015. Advances in the study of the relationship between plant rhizodeposition and soil microorganism[J]. Journal of Plant Nutrition and Fertilizer, 21(5): 1343-1351. [in Chinese]) |
安韶山, 李国辉, 陈利顶. 2011. 宁南山区典型植物根际与非根际土壤微生物功能多样性[J]. 生态学报, 31(18): 5225-5234. (An S S, Li G H, Chen L D. 2011. Soil microbial functional diversity between rhizosphere and non-rhizosphere of typical plants in the hilly area of southern Nixia[J]. Acta Ecologica Sinica, 31(18): 5225-5234. [in Chinese]) |
曹帮华, 吴丽云, 宋爱云, 等. 2008. 滨海盐碱地刺槐(Robinia pseudoacacia)混交林土壤水盐动态[J]. 生态学报, 28(3): 939-945. (Cao B H, Wu L Y, Song A Y, et al. 2008. The soilwater and soil salt distribution in coastal saline-alkali area:a comparison of pure and mixed plantations[J]. Acta Ecologica Sinica, 28(3): 939-945. [in Chinese]) |
陈为峰, 史衍玺. 2010. 黄河三角洲新生湿地不同植被类型土壤的微生物分布特征[J]. 草地学报, 18(6): 859-864. (Chen W F, Shi Y X. 2010. Distribution characteristics of microbes in new-born wetlands of the Yellow River Delta[J]. Acta Agrestia Sinica, 18(6): 859-864. DOI:10.11733/j.issn.1007-0435.2010.06.020 [in Chinese]) |
丁新景, 敬如岩, 黄雅丽, 等. 2017. 黄河三角洲刺槐根际与非根际细菌结构及多样性[J]. 土壤学报, 54(5): 1293-1298. (Ding X J, Jing R Y, Huang Y L, et al. 2017. Bacterial structure and diversity of rhizosphere and bulk soil of Robinia pseudoacacia forests in Yellow River Delta[J]. Acta Pedologica Sinica, 54(5): 1293-1298. [in Chinese]) |
丁新景, 解国磊, 敬如岩, 等. 2016. 黄河三角洲不同人工刺槐混交林凋落物分解特性[J]. 水土保持学报, 30(4): 249-253. (Ding X J, Xie G L, Jing R Y, et al. 2016. Decomposition characteristics of litter in different mixed forest of Robinia pseudoacacia in Yellow River Delta[J]. Journal of Soil and Water Conservation, 30(4): 249-253. [in Chinese]) |
杜振宇, 刘方春, 马丙尧, 等. 2014. 滨海盐碱地人工刺槐绒毛白蜡混交林的根系分布与细根生长[J]. 林业科学, 50(3): 10-15. (Du Z Y, Liu F C, Ma B Y, et al. 2014. Root distribution and fine root growth in mixed plantation of Robinia pseudoacacia and Fraxinus velutina in coastal saline-alkali area[J]. Scientia Silvae Sinicae, 50(3): 10-15. [in Chinese]) |
贺纪正, 李晶, 郑袁明. 2013. 土壤生态系统微生物多样性-稳定性关系的思考[J]. 生物多样性, 21(4): 411-420. (He J Z, Li J, Zheng Y M. 2013. Thoughts on the microbial diversity-stability relationship in soil ecosystems[J]. Biodiversity Science, 21(4): 411-420. [in Chinese]) |
寇文伯, 黄正云, 张杰, 等. 2015. 鄱阳湖湖泊细菌群落组成及结构—以松门山为例[J]. 生态学报, 35(23): 7608-7614. (Kou W B, Huang Z Y, Zhang J, et al. 2015. Bacterial community structure and composition in Lake Poyang:a case study in the Songmenshan region, China[J]. Acta Ecologica Sinica, 35(23): 7608-7614. [in Chinese]) |
李梓正, 朱立博, 林叶春, 等. 2010. 呼伦贝尔草原不同退化梯度土壤细菌多样性季节变化[J]. 生态学报, 30(11): 2883-2889. (Li Z Z, Zhu L B, Lin Y C, et al. 2010. Seasonal variation of soil bacterial community under different degrees of degradation of Hulunbuir grassland[J]. Acta Ecologica Sinica, 30(11): 2883-2889. [in Chinese]) |
柳春林, 左伟英, 赵增阳, 等. 2012. 鼎湖山不同演替阶段森林土壤细菌多样性[J]. 微生物学报, 52(12): 1489-1496. (Liu C L, Zuo W Y, Zhao Z Y, et al. 2012. Bacterial diversity of different successional stage forest soils in Dinghushan[J]. Acta Microbiologica Sinica, 52(12): 1489-1496. [in Chinese]) |
刘方春, 邢尚军, 马海林, 等. 2012. PGPR生物肥对甜樱桃(Cerasus pseudocerasus)根际土壤生物学特征的影响[J]. 应用与环境生物学报, 18(5): 722-727. (Liu F C, Xing S J, Ma H L, et al. 2012. Effect of PGPR fertilizer on biological characteristics in Cerasus pseudocerasus rhizosphere[J]. Chinese Journal of Applied and Environmental Biology, 18(5): 722-727. DOI:10.3724/SP.J.1145.2012.00722 [in Chinese]) |
刘方春, 邢尚军, 马海林, 等. 2014. 持续干旱对樱桃根际土壤细菌数量及结构多样性影响[J]. 生态学报, 34(3): 642-649. (Liu F C, Xing S J, Ma H L, et al. 2014. Effects of continuous drought on soil bacteria populations and community diversity in sweet cherry rhizosphere[J]. Acta Ecologica Sinica, 34(3): 642-649. [in Chinese]) |
刘璐, 何寻阳, 谢强, 等. 2015. 桂西北喀斯特常见豆科植物根瘤菌的遗传多样性[J]. 应用生态学报, 26(12): 3663-3669. (Liu L, He X Y, Xie Q, et al. 2015. Genetic diversity of rhizobia isolated from common legumes in the Karst area Northwest Guangxi[J]. Chinese Journal of Applied Ecology, 26(12): 3663-3669. [in Chinese]) |
刘文娜, 吴文良, 王秀斌, 等. 2006. 不同土壤类型和农业用地方式对土壤微生物量碳的影响[J]. 植物营养与肥料学报, 12(3): 406-411. (Liu W N, Wu W L, Wang X B, et al. 2006. Effects of soil type and land use pattern on microbial biomass carbon[J]. Plant Nutrition and Fertilizer Science, 12(3): 406-411. DOI:10.11674/zwyf.2006.0320 [in Chinese]) |
路海玲, 孟亚利, 周玲玲, 等. 2011. 盐胁迫对棉田土壤微生物量和土壤养分的影响[J]. 水土保持学报, 25(1): 196-200. (Lu H L, Meng Y L, Zhou L L, et al. 2011. Effects of salt stress on soil microbial biomass and soil nutrient in cotton field[J]. Journal of Soil and Water Conservation, 25(1): 196-200. [in Chinese]) |
罗明, 韩剑, 蒋平安, 等. 2009. 新疆罗布泊地区可培养嗜盐细菌多样性[J]. 生物多样性, 17(3): 288-295. (Luo M, Han J, Jiang P A., et al. 2009. Diversity of culturable halophilic bacteria isolated from Lop Nur region in Xinjiang[J]. Biodiversity Science, 17(3): 288-295. DOI:10.3724/SP.J.1003.2009.08251 [in Chinese]) |
区余端, 苏志尧, 彭桂香, 等. 2009. 车八岭山地常绿阔叶林冰灾后土壤微生物群落功能多样性[J]. 生态学报, 29(11): 6156-6164. (Ou Y D, Su Z Y, Peng G X, et al. 2009. Soil microbial functional diversity in a montane evergreen broadleaved forest of Chebaling following the huge ice storm in south China[J]. Acta Ecologica Sinica, 29(11): 6156-6164. DOI:10.3321/j.issn:1000-0933.2009.11.050 [in Chinese]) |
隋心, 张荣涛, 钟海秀, 等. 2015. 利用高通量测序对三江平原小叶章湿地土壤细菌多样性的研究[J]. 土壤, 47(5): 919-925. (Sui X, Zhang R T, Zhong H X, et al. 2015. Study on Bacterial Diversity of Deyeuxia angustifolia Wetland by Application of High-throughput Sequencing Technology in Sanjiang Plain[J]. Soil, 47(5): 919-925. [in Chinese]) |
王伏伟, 王晓波, 李金才, 等. 2015. 施肥及秸秆还田对砂姜黑土细菌群落的影响[J]. 中国生态农业学报, 23(10): 1302-1311. (Wang F W, Wang X B, Li J C, et al. 2015. Effects of fertilization and straw incorporation on bacterial communities in lime concretion black soil[J]. Chinese Journal of Eco-Agriculture, 23(10): 1302-1311. [in Chinese]) |
汪其同, 朱婉芮, 刘梦玲, 等. 2015. 基于高通量测序的杨树人工林根际和非根际细菌群落结构比较[J]. 应用环境与生物学报, 21(5): 967-973. (Wang Q T, Zhu W R, Liu M L, et al. 2015. Comparison on bacterial community of rhizosphere and bulk soil of poplar plantation based on pyrosequencing[J]. Chinese Journal of Applied and Environmental Biology, 21(5): 967-973. [in Chinese]) |
夏江宝, 陈印平, 王贵霞, 等. 2015. 黄河三角洲盐碱地不同造林模式下的土壤碳氮分布特征[J]. 生态学报, 35(14): 4633-4641. (Xia J B, Chen Y P, Wang G X, et al. 2015. Distribution characteristics of soil carbon and nitrogen under different afforestation modes of saline land in the Yellow River Delta[J]. Acta Ecologica Sinica, 35(14): 4633-4641. [in Chinese]) |
夏江宝, 许景伟, 李传荣, 等. 2011. 黄河三角洲盐碱地道路防护林对土壤的改良效应[J]. 水土保持学报, 25(6): 72-75. (Xia J B, Xu J W, Li C R, et al. 2011. Effect of different road protection forests on soil improvement in saline land of the Yellow River Delta[J]. Journal of Soil and Water Conservation, 25(6): 72-75. [in Chinese]) |
杨菁, 周国英, 田媛媛, 等. 2015. 降香黄檀不同混交林土壤细菌多样性的差异分析[J]. 生态学报, 35(24): 1-11. (Yang J, Zhou G Y, Tian Y Y, et al. 2015. Differential analysis of soil bacteria diversity in different mixed forests of Dalbergia odorifera[J]. Acta Ecologica Sinica, 35(24): 1-11. [in Chinese]) |
辛晓静, 刘磊, 申俊芳, 等. 2016. 羊草基因型数目与氮添加对土壤微生物群落的交互影响[J]. 生态学报, 36(13): 3934-3932. (Xin X J, Liu L, Shen J F, et al. 2016. Interactions between genotypic number and nitrogen addition on soil microbial communities in the population of Leymus chinensis[J]. Acta Ecologica Sinica, 36(13): 3923-3932. [in Chinese]) |
Berg G, Grube M, Schloter M, et al. 2014. Unraveling the plant microbiome:looking back and future perspectives[J]. Front Microbiol, 5(148): 1-7. |
Bokulich N A, Subramanian S, Faith J J, et al. 2013. Quality-filtering vastly improves diversity estimates from illumina amplicon sequencing[J]. Nature Methods, 10(1): 57-59. DOI:10.1038/nmeth.2276 |
Caporaso JG, Kuczynski J, Stombaugh J, et al. 2010. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
Edgar R C, Haas B J, Clemente J C, et al. 2011. Uchime improves sensitivity and speed of chimera detection[J]. Bioinformatics, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381 |
Haas B J, Gevers D, Earl A M, et al. 2011. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J]. Genome Research, 21(3): 494-504. DOI:10.1101/gr.112730.110 |
Kennedy A C. 1999. Bacterial diversity in agroecosystems[J]. Agriculture Ecosystems & Environment, 74(99): 65-76. |
Ryan P R, Jones D L, Delhaize E. 2001. Function and mechanism of organic anion exudation from plant roots[J]. Annual Review Of Plant Physiology and Plant Molecular Biology, 52: 527-560. DOI:10.1146/annurev.arplant.52.1.527 |
Steenwerth K L, Jackson L E, Calderón F J, et al. 2003. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal california[J]. Soil Biology & Biochemistry, 35(3): 489-500. |
Stewart K M, Bowyer R T, Kie J, et al. 2016. Niche partitioning among mule deer, elk, and cattle:Do stable isotopes reflect dietary niche?[J]. Ecoscience, 10(3): 297-302. |
Sun L, Lu Y, Kronzucker H J, et al. 2016. Quantification and enzyme targets of fatty acid amides from duckweed root exudates involved in the stimulation of denitrification[J]. Journal of Plant Physiology, 198: 81-88. DOI:10.1016/j.jplph.2016.04.010 |
Wang H, Pu R L, Zhu Q, et al. 2015. Mapping health levels of Robinia pseudoacacia forests in the Yellow River Delta, China, using IKONOS and Landsat 8 OLI imagery[J]. International Journal of Remote Sensing, 36(4): 1114-1135. |
Wiehe W, Höflich G. 1995. Survival of plant growth promoting rhizosphere bacteria in the rhizosphere of different crops and migration to non-inoculated plants under field conditions in north-east germany[J]. Microbiological Research, 150(2): 201-206. DOI:10.1016/S0944-5013(11)80057-1 |
Young I M, Crawford J W. 2004. Interactions and self-organization in the soil-microbe complex[J]. Science, 304(5677): 1634-1637. DOI:10.1126/science.1097394 |
Zhu S, Vivanco J M, Manter D K. 2016. Nitrogen fertilizer rate affects root exudation, the rhizosphere microbiome and nitrogen-use-efficiency of maize[J]. Applied Soil Ecology, 107: 324-333. DOI:10.1016/j.apsoil.2016.07.009 |
 2018, Vol. 54
2018, Vol. 54

