文章信息
- 史文辉, 李国雷, 苏淑钗, 刘勇, 贾黎明, 尚治国
- Shi Wenhui, Li Guolei, Su Shuchai, Liu Yong, Jia Liming, Shang Zhiguo
- 子叶切除与苗圃施肥对栓皮栎容器苗造林效果的影响
- Combined Effects of Cotyledon Excision and Nursery Fertilization on Field Performance of Quercus variabilis Container Seedlings
- 林业科学, 2018, 54(1): 64-73.
- Scientia Silvae Sinicae, 2018, 54(1): 64-73.
- DOI: 10.11707/j.1001-7488.20180107
-
文章历史
- 收稿日期:2017-02-06
- 修回日期:2017-03-16
-
作者相关文章
2. 城乡生态环境北京实验室 北京 100083;
3. 河南省栾川县林木种子站 洛阳 471500
2. Beijing Laboratory of Urban and Rural Ecological Environment Beijing 100083;
3. Forest Treeseed Station of Luanchuan County, Henan Province Luoyang 471500
栎属(Quercus)植物作为温带落叶阔叶林的主要建群树种以及亚热带常绿阔叶林的优势树种之一, 在我国乃至世界范围内的森林植被建设中具有非常重要的地位。成熟的栎属植物种子富含淀粉且粒度较大, 易被啮齿类动物、鸟类等捕食动物发现并搬运或取食, 但栎属植物种子近胚轴端因单宁含量较高而味苦涩, 被取食部位通常为子叶远端(Steele et al., 1993; Zhang et al., 2016), 免于遭受取食的完整胚轴端仍具有萌发成苗的能力(赵雪峰等, 2009)。子叶部分丢失可以加快栎属植物种子萌发并提高萌发率(Steele et al., 1993; Branco et al., 2002; Giertych et al., 2011; Yang et al., 2012), 其原因可能在于子叶部分丢失后可刺激种子内部IAA等萌发促进性物质的合成(Prewein et al., 2006), 同时改变种子内部渗透膨压, 利于种子吸水萌发(Finch-Savage et al., 1994)。因此, 栎属植物的大粒种子特性促进种子与捕食动物间形成了互利并存的自然模式。
栎属植物的大粒种子繁衍策略虽然有利于传播扩散和萌发, 但子叶养分是栎属植物苗木建成最重要的营养库, 子叶过度丢失必然导致养分亏缺, 进而影响苗木建成和发育(Grossman et al., 2003; 刘艳等, 2013)。因此, 子叶丢失程度与苗木发育之间的数量关系受到广泛关注, 在夏栎(Quercus robur)、欧洲栓皮栎(Q.suber)和栓皮栎(Q.variabilis)等栎属树种的自然更新中已有所报道(Howe et al., 1982; Branco et al., 2002; 武高林等, 2006; Yi et al., 2016)。为了进一步实现特定立地环境所需目标苗木的精准培育并提高造林的适合度, 将收集的种子在苗圃进行集约培育, 然后植苗造林已成为栎属林分重要的更新方式(李国雷等, 2011; 2012)。然而栎属植物种子萌发持续时间较长, 集约育苗过程中先萌发的苗木影响周围后萌发苗木获取光照和水分, 进而加大苗木规格差异, 不利于苗圃管理且合格苗率降低(Suszka, 2006)。子叶部分丢失对萌发整齐性的促进作用可用于温室苗木培育。在温室育苗条件下, 温湿度和光照等苗木生长环境相对于自然条件更加适宜, 苗木建成期较短, 子叶养分的转移时间相对更加集中且转移速度较自然环境下更快(Tinus, 1982; Landis, 1989); 同时能够根据苗木生长需求灵活施肥, 苗木对子叶养分的依赖程度、苗木生物量的积累以及养分贮存不同于自然条件下的苗木发育; 此外, 温室容器苗木根系生长于有限空间内, 其根系结构和生长发育状况与自然条件下亦有所不同(Landis, 1989)。因此, 子叶丢失程度对温室容器苗生长及其造林更新效果的影响可能不同于自然更新, 且苗圃肥力条件不同, 子叶丢失程度的影响效果亦可能有所差异(Milberg et al., 2008; Mancilla-Leytón et al., 2013)。
栓皮栎为我国栎属植物典型代表树种, 耐干旱瘠薄能力强, 树皮木栓层发达(罗伟祥等, 2009; 李国雷等, 2012; 陈闯等, 2015), 是我国暖温带大面积分布的主要造林树种和软木生产的主要原料树种(罗伟祥等, 2009)。近年来, 随着我国宜林地造林面积的逐渐减小以及容器苗木地位的日益突出, 容器苗造林在困难立地栓皮栎林分更新中发挥着重要作用, 因此苗圃阶段苗木质量调控措施对栓皮栎植被恢复效果的影响研究极为必要。鉴于此, 本研究通过苗圃施肥设置2种肥力条件, 并采用切除法模拟自然界中栓皮栎种子子叶丢失程度, 探究其容器苗造林后生长差异, 定量分析种子养分和苗圃补充养分对栓皮栎容器苗造林效果的调控作用, 为丰富苗木质量调控技术提供参考。
1 材料与方法 1.1 试验地概况与试验材料容器苗苗圃培育于中国林业科学研究院温室内(116°13′E, 40°40′N)。试验用种子于2011年9月初单株采于北京市平谷区四座楼林场(117°148′E, 40°282′N; 海拔316~467 m)。所采种子用50 ℃温水浸泡1 h以杀死潜藏在种子内的幼虫和虫卵, 并摒弃漂浮在水面上的劣种, 剩余种子沥水后平铺在吸水纸上, 置于阴凉地方阴干12 h, 随后装入带有透气孔的塑料自封袋置于2 ℃冷藏柜中保存。育苗容器选用体积1 050 mL、口径10 cm×深度20 cm的国产塑料营养钵。育苗基质采用丹麦Pindstrup Mosebrug A/S公司进口草炭土和珍珠岩混合基质, 体积比为3[DK]:1, 基质装入容器前经过多菌灵消毒。
造林地位于河北省承德市平泉县北京林业大学北方基地(118°40′E, 41°13′N; 海拔765 m)。造林地坡度小于2°, 土层厚度45~60 cm, 土壤为砂质黏壤土, 平均pH6.2, 有机碳含量0.7%, 土壤全氮、有效磷和速效钾含量分别为628.7、139.5和113.5 mg ·kg-1。造林当年年均气温7.2 ℃, 年降水量509.6 mm。
1.2 试验设计 1.2.1 苗圃阶段苗圃试验采用子叶切除强度和苗圃施肥2种处理措施相结合的双因素完全随机试验设计。因素A:子叶切除强度。2012年2月24日, 将贮藏的种子取出, 设置E1/3、E1/2、E2/3 3种切除强度(按照种子长度比分别切除1/3、1/2、2/3胚芽远端)和不切除对照(E0), 切除后种子播入容器中, 覆盖基质厚度1~2 cm。因素B:苗圃施肥。设置不施肥(N0, 无化学肥料添加)和施肥(N100, 100 mg N ·seedling-1)2种处理模式(Li et al., 2014), 以模拟自然立地养分亏缺和充裕2种环境条件。试验共计8个处理, 5次重复, 每次重复45株, 共计1 800株苗木。
为了避免梯度施肥对子叶养分的干扰, 施肥处理组苗木采用平均施肥方式, 自3月26日出苗率基本稳定且苗木展叶2轮即开始进行随水施肥, 每周1次, 每次每株20 mL, 共施15次, 同时每次等量施加磷钾肥和微量肥料。氮肥施用尿素, 磷钾肥施用KH2PO4, 每株累计施26.2 mg P、33 mg K; 微量肥料施用EDTA-2N和DTPA, 施入量分别为每株4.5和1.4 mg(Li et al., 2014)。每次施肥溶液中, 尿素、KH2PO4、EDTA-2N和DTPA浓度分别为725.0、383.3、15.0和4.65 mg ·kg-1。不施肥处理组苗木加入等体积自来水, 即每株20 mL以保证处理间水分平衡。
采用标准化育苗程序进行温室苗木培育, 生长季末将苗木移至室外炼苗, 待全部落叶后抽样进行苗圃生长量测定, 并将剩余苗木移入假植坑进行假植。假植初期每2~3周灌水1次, 待气温降至0 ℃以下时灌冻水后用防寒布封存, 以备后续造林试验用。
1.2.2 造林阶段2013年3月初, 将苗圃所培育的8种处理苗木运往造林地, 每处理每区组选取15株生长均匀的苗木按照双因素完全随机区组试验设计布设造林, 设5个区组, 共计600株, 株行距1.3 m×1.0 m, 区组内每处理15株苗木单行排列。造林定植后立即灌透水1次。生长季对造林地进行2次人工除草。
1.3 试验方法 1.3.1 苗圃容器苗本底测定2012年11月中旬, 每处理每次重复随机抽取8株苗木进行单株苗高、地径测定, 测定后苗木破坏取样。苗木根系用清水小心冲洗干净后, 将根系和地上部分剪开分别装袋, 70 ℃下烘干24 h, 测定生物量。
1.3.2 造林苗木叶片光合参数测定造林试验初期, 每区组选取各处理生长良好的1株苗木挂牌标记, 固定生长季光合测定样株。8月中旬苗木进入速生期末期, 即开始苗木光合参数测量。测量时从顶叶向下第3~4片功能叶中选取叶片, 利用Li-6400便携式光合系统分析仪(LI-COR, USA)在晴天9:00—17:00采用控制环境条件下光合曲线测定方法, 设置流速500 μmol ·s-1, 叶室温度28 ℃, 利用CO2注入系统将CO2浓度固定为400 μmol ·mol-1, 分别测定0、20、50、100、150、200、400、600、800、1 000、1 200、1 500、1 800、2 100、2 400和2 700 μmol ·m-2 s-1 16个水平下所选叶片的净光合速率(Pn)。测定时每1种光强下停留3 min, 每次重复测定4次, 取平均值。
1.3.3 造林苗季末评价11月初统计造林苗成活率并单株测定所有造林苗的苗高、地径。每区组内各处理行由北向南选取第3、5、7、9、11株苗木破坏取样。取样苗木冲洗干净后分地上部分、主根和侧根3部分分别装袋。70 ℃下烘干24 h, 测定生物量。粉碎, 过60目筛后准确称取样品0.200 g, 用浓H2SO4-H2O2法消化后, 凯氏定氮法测定全氮, 钼锑抗比色法测定全磷, 火焰光度计法测定全钾。
1.4 数据统计与分析采用非直角双曲线修正模型结合SPSS 18.0软件的非线性回归, 计算光响应曲线的相关参数并模拟光响应曲线。非直角双曲线模型(Thomley, 1998)公式为:
| $ {P_{\rm{n}}} = {\rm{AQY}} \times {\rm{PPFD}} + {P_{{\rm{max}}}} - \sqrt {\frac{{{{({\rm{AQY}} \times {\rm{PPFD}} + {P_{{\rm{max}}}})}^2} - 4k \times {\rm{AQY}} \times {\rm{PPFD}} \times {P_{{\rm{max}}}}}}{{2k}}} - {R_{{\rm{day}}}}。$ | (1) |
式中:Pn为净光合速率; AQY为表观量子产量; Pmax为最大光合速率; PPFD为光量子通量密度; k为光响应曲线曲角; Rday为暗呼吸速率。
采用SPSS18.0双因素方差分析, 探究子叶切除强度和苗圃施肥量及其交互效应对苗高、地径、生物量、氮、钾含量及光合参数的影响。当存在交互效应时, 探究8个处理组合对指标的影响; 若不存在交互效应, 则分析主效应。形态指标以单株苗木为单位进行分析, 即n=40;测定养分指标时将同一重复的8株或5株苗木首先进行合并, 以每重复为单位进行分析, 即n=5;光合指标采取单株平均值进行分析, 即n=5。利用Excle 2016和SigmaPlot12.5软件对数据进行处理并绘图。
2 结果与分析 2.1 子叶切除与苗圃施肥对栓皮栎容器苗生长的影响苗圃阶段苗木生长主要受子叶切除和苗圃施肥主效应的影响(表 1)。与不切除处理(E0)相比, E2/3处理容器苗苗高、地径、茎和根生物量均显著减小, 下降幅度分别为8.5%、7.6%、27.3%和17.3%, 但根茎比显著增大, 表明子叶养分丢失可促进生物量向根系分配; E1/2处理苗木茎生物量显著减小13.3%;E1/3处理仅减小9.6%苗木根系生物量。施肥(N100)对容器面苗高、地径、生物量增长均有显著促进作用, 但不能缓解子叶切除的影响效果。
|
|
双因素方差分析结果(表 2)显示, 苗木成活率仅受子叶切除的影响, 且与不切除处理(E0)相比, 只有E2/3处理导致苗木造林成活率降低6%。
|
|
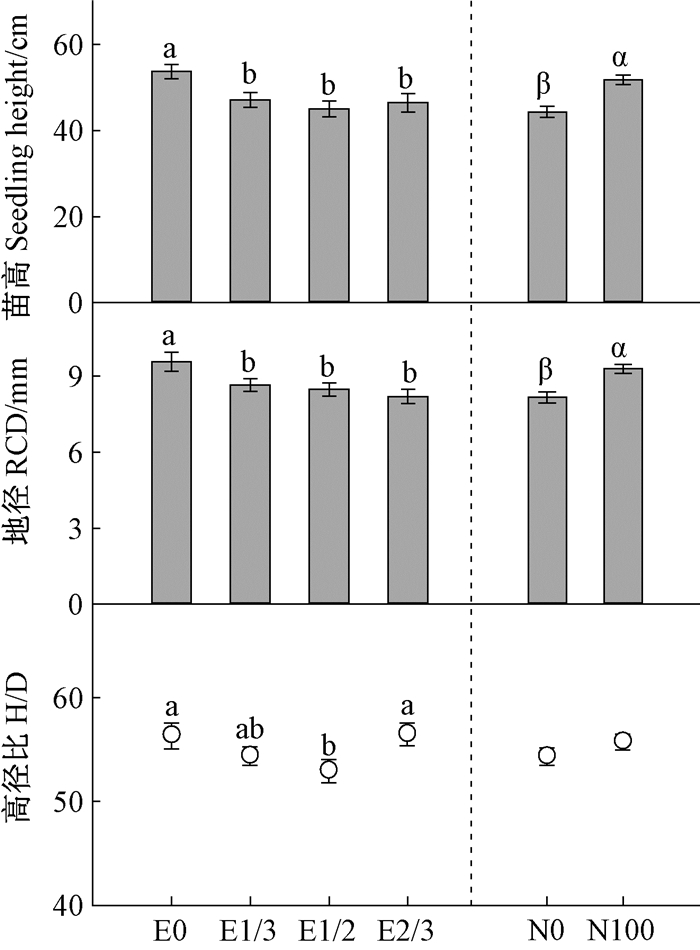
造林苗木苗高、地径同苗圃阶段一样受子叶切除和苗圃施肥主效应的影响, 而高径比只受子叶切除的影响(表 3)。E1/3、E1/2和E2/3处理造林苗木苗高较不切除处理(E0)减小12.3%~16.3%, 地径减小9.6%~14.3%(图 1), 且E1/2处理苗木高径比显著小于其他处理。苗圃施肥(N100)条件下培育的苗木在第1个造林季末苗高较不施肥(N0)增大14.3%, 地径增粗12.1%。
|
|
|
图 1 子叶切除与苗圃施肥主效应对栓皮栎造林苗木苗高、地径、高径比的影响 Figure 1 Main effects of cotyledon excision and nursery fertilization on Q.variabilis seedling height, RCD and H/D at the end of the outplanting season 图中数值为平均值±标准误。不同小写英文字母表示子叶切除主效应F检验结果, 不同希腊字母表示苗圃施肥主效应F检验结果, 字母不同表示差异显著(P < 0.05)。 Values are means ± standard error.Different lowercase English letters in the same column indicate significant difference derived from the main effect of CE at 0.05 level according to F test, and different lowercase Greek letters indicate significant difference derived from the main effect of NF. |
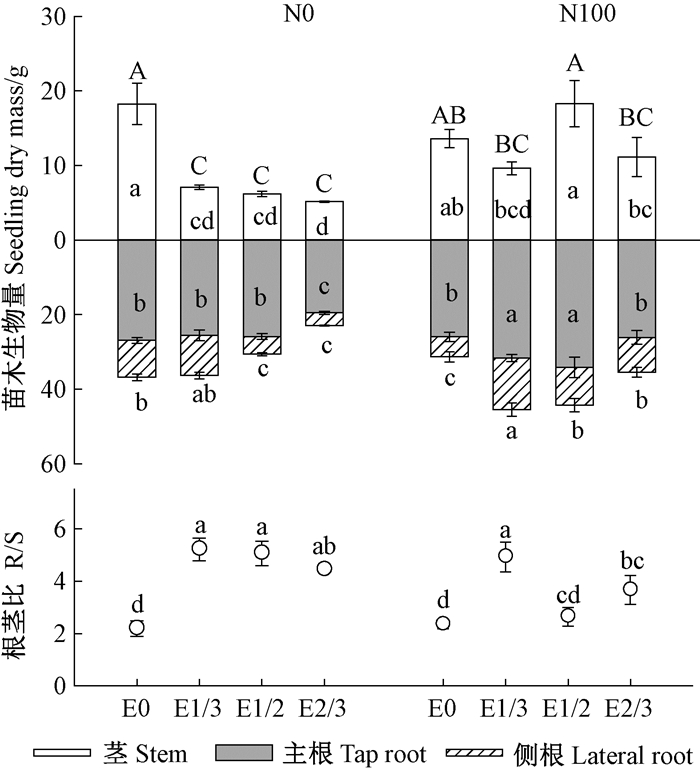
子叶切除和苗圃施肥共同影响造林苗木生物量和根茎比。苗圃不施肥(N0)条件下, 子叶切除导致造林季末苗木茎生物量较不切除处理(E0)减小61.3%~71.3%, 单株生物量减小21.3%~49.0%, 且E1/2和E2/3处理使得苗木侧根生物量分别减小52.3%和65.9%, E2/3处理甚至减小27.4%主根生物量, 但根茎比均显著增大(图 2)。苗圃施肥(N100)条件下, 与不切除处理(E0)相比, 子叶切除促进造林苗木侧根生物量增加72.6%~157.0%, 且E1/3处理对侧根生物量的促进作用大于E1/2和E2/3;E1/3和E1/2处理还促进苗木主根生物量增加21.9%~31.7%, 且E1/2促使苗木单株生物量显著增加39.3%;子叶切除对造林苗木根茎比的影响与苗木生物量基本相反, E1/2处理对造林苗木茎生长的促进作用大于对根的促进作用。
|
图 2 子叶切除与苗圃施肥对造林苗木生物量和根茎比的交互影响 Figure 2 Interaction between cotyledon excision and nursery fertilization on Q.variabilis seedling stem biomass, tap root biomass, lateral root biomass, total biomass and R/S at the end of the outplanting season 图中数值为平均值±标准误。不同大写字母表示苗木单株生物量F检验结果, 不同小写字母表示苗木茎与主、侧根及根茎比F检验结果, 字母不同表示差异显著(P< 0.05)。 Values are means± standard error.Different uppercase letters indicate statistically significant difference of seedling total dry mass at 0.05 level according to F test, and the lowercase letters indicate significant difference of stem, tap root, lateral root and R/S. |
除主根磷含量外, 子叶切除和苗圃施肥的交互效应对造林苗木根和茎的氮、磷、钾养分含量均有显著影响(表 4)。苗圃不施肥(N0)条件下, 与不切除处理(E0)相比, E1/3、E1/2或E2/3处理均显著减小造林苗木茎氮、磷、钾养分含量, 而根系养分含量受子叶切除的影响程度因养分元素不同而异, 但总体来看, 除主根钾含量外, E1/2或E2/3处理均会一定程度减小根系养分含量(图 3)。苗圃施肥(N100)条件下, 除主根磷含量外, E1/2处理显著提高茎、主根、侧根的氮、磷、钾含量, E1/3处理显著增大造林苗木侧根氮、磷、钾含量但降低茎钾含量, E2/3处理增大侧根磷含量, 但同样降低茎钾含量。
|
|

|
图 3 子叶切除与苗圃施肥对造林苗养分含量的交互影响 Figure 3 Interaction between cotyledon excision and nursery fertilization on Q.variabilis seedling nutrient content (stem N, P, and K; tap root N and K; lateral root N, P, and K) at the end of the outplanting season 图中数值为平均值±标准误。不同大写字母表示苗木单株养分含量F检验结果, 不同小写字母表示苗木茎与主、侧根养分含量F检验结果, 字母不同表示差异显著(P< 0.05)。未标字母表示交互效应不显著。下同。 Values are means± standard error.Different uppercase letters indicate statistically significant difference of seedling total N, P and K content at 0.05 level according to F test, and the lowercase letters indicate significante difference of N, P, and K content of stem, tap root and lateral root.Bars with no letters indicate no significant interaction between CE and NF on the indicator.The same below. |
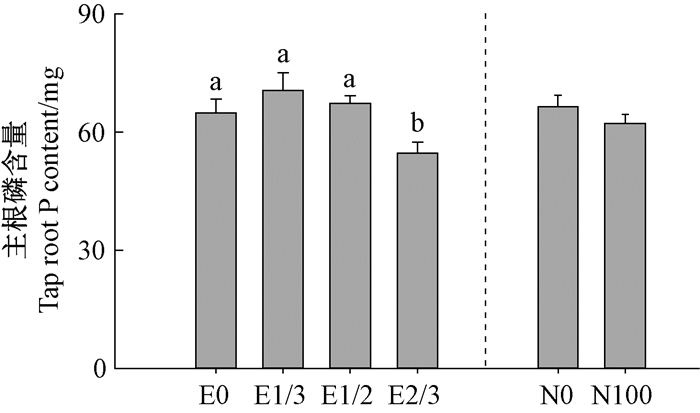
子叶切除主效应对主根磷含量的影响如图 4所示, 与不切除处理组(E0)相比, E1/3或E1/2处理均无显著影响, 但E2/3处理组造林苗木主根磷含量显著减小15.8%。
|
图 4 子叶切除与苗圃施肥主效应对柱皮栎造林苗主根磷含量的影响 Figure 4 Main effects of cotyledon excision and nursery fertilization on Q.variabilis seedling tap root P content at the end of the outplanting season |
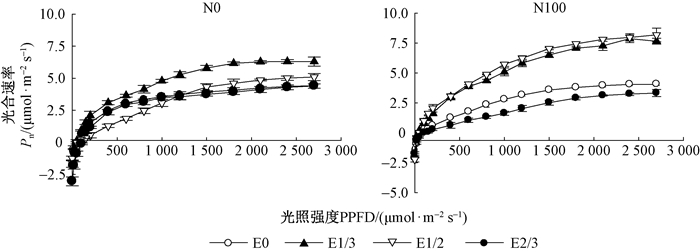
非直角双曲线模型对2种施肥条件下不同子叶切除强度处理造林苗木光响应曲线进行拟合, 决定系数(R2)的变化范围为0.964~0.997(表 6), 拟合效果较好。苗圃不施肥(N0)条件下, E1/3处理组净光合速率(Pn)对光强的响应值最大, 其次为E1/2处理, E2/3处理最小, 而苗圃施肥(N100)条件下, E1/3和E1/2处理的净光合速率(Pn)对各光强的响应值明显高于其他处理(图 5)。
|
|
|
图 5 2种苗圃施肥条件下不同子叶切除处理栓皮栎造林苗木光响应曲线(8月) Figure 5 Photo response curve of Q.variabilis seedlings for different cotyledon excision treatments under two contrasting nursery fertilization conditions(August) |
由表 5、表 6可知, 子叶切除和苗圃施肥的交互效应显著影响造林苗木叶片净光合速率对光强的响应曲线特征值。2种施肥条件下, 与不切除处理(EO)相比, E1/3和E1/2处理造林苗木最大光合速率(Pmax)、表观量子产量(AQY)、暗呼吸速率(Rday)和光饱和点(LSP)均显著提高, 光补偿点(LCP)显著下降。E1/2-N100处理组合Pmax最大, 为11.302 μmol ·m-2 s-1, LCP最小且LSP最大, 表明苗圃施肥并切除1/2子叶处理的造林苗木对光强的利用范围最大, 叶片转化光能效率最高。根据Rday将2种施肥条件下各切除处理造林苗木按照暗时消耗能力大小排序为:不施肥(N0)条件下, E2/3>E1/2, E1/3>E0;施肥(N100)条件下, E2/3>E0>E1/3>E1/2。综合来看, E1/2-N100处理组的Pmax、AQY和LSP最高, LCP最低, Rday也相对较小, 因此其积累有机物质的能力优于其他处理组合。
|
|
子叶切除对苗圃阶段苗木生长的抑制作用主要源于苗木发育初期子叶养分的丢失, 导致苗木根系发育延缓, 吸收外界养分能力下降, 进而减缓苗木生长(Kennedy et al., 2004), 这也解释了无论苗圃肥力高低, 子叶切除均会影响苗圃阶段栓皮栎容器苗生长。但本研究发现, 造林后仅强度子叶切除对造林苗木生长产生抑制作用, 轻度和中度子叶切除在一定条件下还促进造林苗木生长。这可能是由于轻度或中度切除子叶后, 种子养分供应量减少的同时其内含多酚等生长抑制性物质向苗木的转移量同样有所减少(刘艳等, 2013), 从而使得苗木体内生长促进性物质和抑制性物质获得相对平衡, 且经过苗圃阶段幼苗养分亏缺逆境生长的苗木适应造林地环境和抗逆性能力增强(Nathan et al., 2012)。此外, 苗木造林效果还受立地条件等多种环境因素制约(Cuesta et al., 2010; Villar-Salvador et al., 2012), 进而不同程度影响子叶切除效应。由此可见, 从造林效果评价子叶切除强度尤为必要, 苗圃和造林2个阶段相结合评价子叶切除效应更为可靠, 且轻度和中度子叶切除对造林苗木生长的促进机制仍需进一步研究。
强度子叶切除使得种子氮、磷、钾养分分别丢失15.8、2.1和19.2 mg, 而苗圃施肥补充100 mg N、26.0 mg P和33 mg K后, 苗木生长和造林效果受到严重影响, 这表明种子自身养分在苗木建成与发育过程中扮演着至关重要的角色。Jacobs等(2009)研究表明, 阔叶树种的种子播种、萌发直至出现第1轮真叶代表着建成期的完成, 栎属苗木在建成期根系尚不能从周围介质中获取养分, 苗木发育所需养分主要依靠子叶供应, 子叶过度丢失必然导致苗木建成期养分亏缺, 抑制根系发育, 幼苗先天性发育不足, 即使后期补充充足肥料也无法弥补, 苗木质量会受到严重影响(Suszka, 2006; Johnson et al., 2009)。本研究同时发现, 在轻度和中度子叶切除情况下, 苗圃施肥可显著提高栓皮栎容器苗造林后的生物量、养分含量和光合特性, 这表明适度子叶切除可能不会对苗木根系发育产生抑制作用。本研究发现子叶自身养分对苗木发育具有决定作用, 苗圃施肥效果有赖于子叶丢失程度, 但由于没有观测建成期根系发育状况, 尚未建立子叶养分供给与根系发育的动态数量关系, 因此子叶丢失影响栓皮栎苗木质量的作用机制还有待进一步研究。
在自然条件下, 子叶轻度丢失有利于苗高增长, 苗木更新效果最好(Suszka et al., 2000; Branco et al., 2002; Giertych et al., 2010; 2011)。本研究发现, 在苗圃肥力充足的条件下, 播种前轻度子叶切除对所形成苗木的造林效果也有一定促进作用, 但中度子叶切除所形成苗木的造林效果最优, 苗木主/侧根生物量、养分含量以及苗木光合特性均有提高。仅从种子养分丢失数量角度尚无法解释这一现象。本研究发现中度子叶切除的苗木能抑制生物量向地上部分分配, 根茎比有一定程度提高。根茎比反映的是苗木根系对土壤水分吸收和地上部分蒸腾散失间的平衡能力(Grossnickle, 2005; 2012), 根茎比大的苗木造林后能尽快克服水分胁迫, 缩短缓苗期, 造林效果因此有一定程度提高。但为何中度子叶切除能提高苗木根茎比进而提升造林效果, 轻度子叶切除反而没有这种效应, 也印证了仅从子叶养分丢失数量角度难以充分解释这一观点。子叶丢失除了养分损失外, 可能还涉及内源激素数量和比例的改变, 因此子叶丢失还可能是一种质量性状。
本研究还发现, 通过测试光响应曲线获得造林苗木光合特征值可有效反映子叶切除效果。造林苗木生物量和养分含量越大, 其最大光合速率、表观量子产量和光饱合点则越高, 而光补偿点和暗呼吸速率越小, 从而促进光能转化并提高光能利用范围, 有利于造林苗木生长。苗木光合特征值反映苗木光合碳同化效率, 其变化规律与苗木生物量直接相关(Walting et al., 2000; Richardson et al., 2002;焦娟玉等, 2011; 杨腾等, 2014), 而苗木内含养分影响叶绿素合成、暗反应所需主要酶的含量与活性以及光呼吸速率等, 对光合特性起到决定性作用(曹翠玲等, 1999; Maxwell et al.1999, 2000;Boussadia et al., 2010)。可见, 造林苗木光合特征值与苗木生物量、养分含量等指标可同等反映苗木生长状况。需要指出的是, 光合参数可即时测定, 免除苗木破坏取样的繁琐工序, 减少人力物力投入, 仪器携带方便, 在特定条件下(如不利于破坏取样的试验)可代替生物量和养分含量指标进行苗木造林效果的评价。
4 结论本研究分析了2种苗圃施肥条件下, 不同子叶切除强度对栓皮栎苗木生长与造林苗木生长、养分积累和光合特性等影响, 结果发现: 1)造林苗木的野外表现是评价子叶切除强度必不可少的环节, 苗圃和造林2个阶段相结合尤为重要; 2)苗圃施肥对造林效果的促进作用有赖于子叶切除强度, 对于轻度和中度子叶切除的种子, 苗圃施肥促进造林效果, 而对于强度子叶切除的种子, 即使进行苗圃施肥造林效果仍旧受到影响, 反映子叶初始养分对于苗木发育发挥着不可替代的作用; 3)造林苗木光合特性与生物量和养分含量变化趋势相同, 且测定更便捷, 可作为一种有效指标评价造林苗木生长对子叶切除强度的响应情况; 4) E1/2-N100处理组合, 即将远胚轴的子叶切除一半, 然后播种于基质中, 生长季累计施入100 mg氮、26 mg磷、33 mg钾, 最有利于提高栓皮栎容器苗造林效果。
曹翠玲, 李生秀, 苗芳. 1999. 氮素对植物某些生理生化过程影响的研究进展[J]. 西北农业大学学报, 27(4): 96-101. (Cao C L, Li S X, Miao F. 1999. A review on the effects of nitrogen on the physiological and biochemical processes of plants[J]. Acta University Agricalture Boreadi-Occidentalis, 27(4): 96-101. [in Chinese]) |
陈闯, 刘勇, 李国雷, 等. 2015. 底部渗灌灌水梯度对栓皮栎容器苗生长和养分状况的影响[J]. 林业科学, 51(7): 21-27. (Chen C, Liu Y, Li G L, et al. 2015. Effects of sub-irrigation gradients on growth and nutrient status of containerized seedlings of Quercus variabilis[J]. Scientia Silvae Sinicae, 51(7): 21-27. [in Chinese]) |
焦娟玉, 尹春英, 陈珂. 2011. 土壤水、氮供应对麻疯树幼苗光合特性的影响[J]. 植物生态学报, 35(1): 91-99. (Jiao J Y, Yin C Y, Chen K. 2011. Effects of soil water and nitrogen supply on the photosynthetic characteristics of Jatropha curcas seedlings[J]. Chinese Journal of Plant Ecology, 35(1): 91-99. [in Chinese]) |
李国雷, 刘勇, 祝燕. 2011. 苗木切根技术研究进展[J]. 林业科学, 47(9): 140-147. (Li G L, Liu Y, Zhu Y. 2011. A review on advances of root pruning technology of tree seedlings[J]. Scientia Silvae Sinicae, 47(9): 140-147. DOI:10.11707/j.1001-7488.20110924 [in Chinese]) |
李国雷, 刘勇, 祝燕, 等. 2012. 国外容器苗质量调控技术研究进展[J]. 林业科学, 48(8): 136-142. (Li G L, Liu Y, Zhu Y, et al. 2012. A review on the abroad studies of techniques in regulating quality of container seedling[J]. Scientia Silvae Sinicae, 48(8): 136-142. [in Chinese]) |
刘艳, 李庆梅, 刘勇, 等. 2013. 机械处理对房山栎和夏栎种子萌发和生长的影响[J]. 林业科学, 49(4): 39-46. (Liu Y, Li Q M, Liu Y, et al. 2013. Effects of mechanical treatments on germination and growth of Quercus ×fangshanensis and Q.robur seeds[J]. Scientia Silvae Sinicae, 49(4): 39-5. DOI:10.11707/j.1001-7488.20130406 [in Chinese]) |
罗伟祥, 张文辉, 黄一钊, 等. 2009. 中国栓皮栎[M]. 北京: 中国林业出版社. (Luo W X, Zhang W H, Huang Y Z, et al. 2009. Quercus variabilis in China[M]. Beijing: China Forestry Publishing House. [in Chinese]) |
武高林, 杜国祯, 尚占环. 2006. 种子大小及其命运对植被更新贡献研究进展[J]. 应用生态学报, 17(10): 1969-1972. (Wu G L, Du G Z, Shang Z H. 2006. Contribution of seed size and its fate to vegetation renewal A review[J]. Chinese Journal of Applied Ecology, 17(10): 1969-1972. DOI:10.3321/j.issn:1001-9332.2006.10.037 [in Chinese]) |
杨腾, 马履一, 段劼, 等. 2014. 氮处理对文冠果幼苗光合、干物质积累和根系生长的影响[J]. 林业科学, 50(6): 82-89. (Yang T, Ma L Y, Duan J, et al. 2014. Effect of N application on photosynthesis, dry matter accumulation and root growth of Xanthoceras sorbifolia seedlings[J]. Scientia Silvae Sinicae, 50(6): 82-89. [in Chinese]) |
赵雪峰, 路纪琪, 乔王铁, 等. 2009. 生境类型对啮齿动物扩散和贮藏栓皮栎坚果的影响[J]. 兽类学报, 29(2): 160-166. (Zhao X F, Lu J Q, Qiao W T, et al. 2009. Dispersal and hoarding on acorns of Quercus variabilis by rodents in different habitats[J]. Theriologica Sinica, 29(2): 160-166. [in Chinese]) |
Boussadia O, Steppe K, Zgallai H, et al. 2010. Effects of nitrogen deficiency on leaf photosynthesis, carbohydrate status and biomass production in two olive cultivars 'Meski' and 'Koroneiki'[J]. Scientia Horticulturae, 123(3): 336-342. DOI:10.1016/j.scienta.2009.09.023 |
Branco M, Branco C, Merouani H, et al. 2002. Germination success, survival and seedling vigour of Quercus suber acorns in relation to insect damage[J]. Forest Ecology and Management, 166(1/3): 159-164. |
Cuesta B, Villar-Salvadora P, Puértolasb J, et al. 2010. Why do large, nitrogen rich seedlings better resist stressful transplanting conditions? A physiological analysis in two functionally contrasting Mediterranean forest species[J]. Forest Ecology and Management, 260(1): 71-78. DOI:10.1016/j.foreco.2010.04.002 |
Finch-Savage W E, Clay H A. 1994. Water relations of germination in the recalcitrant seeds of Quercus robur L[J]. Seed Science Research, 4(3): 315-322. |
Giertych M J, Suszka J. 2011. Consequences of cutting off distal ends of cotyledons of Quercus robur acorns before sowing[J]. Annals of Forest Science, 68(2): 433-442. DOI:10.1007/s13595-011-0038-6 |
Giertych M, Suszka J. 2010. Influence of cutting off distal ends of Quercus robur acorns on seedling growth and their infection by the fungus Erysiphe alphitoides in different light conditions[J]. Dendrobiology, 64: 73-77. |
Grossman B C, Gold M A, Dey D C. 2003. Restoration of hard mast species for wildlife in Missouri using precocious flowering oak in the Missouri River floodplain, USA[J]. Agroforestry Systems, 59(1): 3-10. DOI:10.1023/A:1026124717097 |
Grossnickle S C. 2005. Importance of root growth in overcoming planting stress[J]. New Forests, 30(2): 273-294. |
Grossnickle S C. 2012. Why seedlings survive:influence of plant attributes[J]. New Forests, 43(5): 711-738. |
Howe H F, Richter W M. 1982. Effects of seed size on seedling size in Virola surinamensis; a within and between tree analysis[J]. Oecologia (Berl), 53(3): 347-351. DOI:10.1007/BF00389011 |
Jacobs D F, Wilkinson K M. 2009. Planning crops and developing propagation protocols-tables and appendices.//Dumroese R K, Luna T, Landis T D.Nursery manual for native plants:a guide for tribal nurseries-Volume 1:Nursery management.Agriculture Handbook 730[J]. Washington D C:U.S.Department of Agriculture, Forest Service, 217. |
Johnson P S, Shifley S R, Rogers R. 2009. The ecology and silviculture of oaks [M]. 2nd Edition. Bodmin, UK: MPG Books Group: 92-102.
|
Kennedy P G, Hausmann N J, Wenk E H, et al. 2004. The importance of seed reserves for seedling performance:an integrated approach using morphological, physiological, and stable isotope techniques[J]. Oecologia, 141(4): 547-554. DOI:10.1007/s00442-004-1686-0 |
Landis T D. 1989. Seedling Nutrition and Irrigation//Landis T D, Tinus R W, McDonald S E, et al.The container tree nursery manual.Volume 4[J]. Agriculture Handbook 674.Washington D C Department of Agriculture, Forest Service: 5-31. |
Li G, Zhu Y, Liu Y, et al. 2014. Combined effects of prehardening and fall fertilization on nitrogen translocation and storage in Quercus variabilis seedlings[J]. European Journal of Forest Research, 133(6): 983-992. DOI:10.1007/s10342-014-0816-4 |
Mancilla-Leytón J M, Cambrollé J, Figueroa M E, et al. 2013. Growth and survival of cork oak (Quercus suber) seedlings after simulated partial cotyledon consumption under different soil nutrient contents[J]. Plant and Soil, 370(1): 381-392. |
Maxwell K, Johnson G N. 2000. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany, 51(345): 659-668. DOI:10.1093/jexbot/51.345.659 |
Milberg P, Lamont B B. 2008. Seed/cotyledon size and nutrient content play a major role in early performance of species on nutrient-poor soils[J]. New Phytologist, 137(4): 665-672. |
Nathan M K, Daniel A H. 2012. Nutrient and water availability alter belowground patterns of biomass allocation, carbon partitioning, and ectomycorrhizal abundance in Betula nigra[J]. Trees, 26(2): 525-533. DOI:10.1007/s00468-011-0613-3 |
Prewein C, Endemann M, Reinohl V, et al. 2006. Physiological and morphological characteristics during development of pedunculate oak (Quercus robur L.) zygotic embryos.[J]. Trees, 20(1): 53-60. DOI:10.1007/s00468-005-0012-8 |
Richardson A D, Berlyn G P. 2002. Spectral reflectance and photosynthetic properties of Betula papyrifera (Betulaceae) leaves along an elevational gradient on Mt[J]. Mansfield, Vermont, USA.American Journal of Botany, 89(1): 88-94. |
Steele M A, Knowles T, Bridle K, et al. 1993. Tannins and partial consumption of acorns implications for dispersal of oaks by seed predators[J]. American Midland Naturalist, 130(2): 229-238. DOI:10.2307/2426123 |
Suszka B, Muller C, Bonnet-Masimbert M. 2000. Nasiona le Ds' nych drzew li Ds' ciastych:od zbioru do siewu[J]. PWN, Warszawa-Poznań, 307. |
Suszka B. 2006. Generative propagation//Bugała W.Dęby (Quercus robur L.; Q.petraea (Matt.) Liebl.) -Nasze drzewa le Ds' ne[J]. Bogucki Wydawnictwo Naukowe, Poznań: 305-388. |
Thomley J H M. 1998. Dynamic model of leaf photosynthesis with acclimation to light and nitrogen[J]. Annals of Botany, 81(3): 421-430. DOI:10.1006/anbo.1997.0575 |
Tinus R W. 1982. Environmental control of seedling physiology//Scarratt J B, Glerum C, Plexman C A.Proceedlings, Canadian Containerized Tree Seedling Symposium[J]. Proceedlings, Canadian Containerized Tree Seedling Symposium.Canadian Forest Service, Environment Canada, Toronto: 73-82. |
Villar-Salvador P, Puértolas J, Cuesta B, et al. 2012. Increase in size and nitrogen concentration enhances seedling survival in Mediterranean plantations[J]. Insights from an ecophysiological conceptual model of plant survival.New Forests, 43(5): 755-770. |
Walting J R, Press M C, Quick W P. 2000. Elevated CO2 induces biochemical and ultrastructural changes in leaves of the C4 cereal sorghum[J]. Plant Physiology, 123(3): 1143-1152. DOI:10.1104/pp.123.3.1143 |
Yang Y, Yi X. 2012. Partial acorn consumption by small rodents:implication for regeneration of white oak, Quercus mongolica[J]. Plant Ecology, 213(2): 197-205. DOI:10.1007/s11258-011-0016-y |
Yi X, Wang Z. 2016. The Importance of cotyledons for early-stage oak seedlings under different nutrient levels:a multi-species study[J]. Journal of Plant Growth Regulation, 35(1): 183-189. DOI:10.1007/s00344-015-9516-7 |
Zhang Z, Wang Z, Chang G, et al. 2016. Trade-off between seed defensive traits and impacts on interaction patterns between seeds and rodents in forest ecosystems[J]. Plant Ecology, 217(3): 253-265. DOI:10.1007/s11258-016-0566-0 |
 2018, Vol. 54
2018, Vol. 54

