文章信息
- 陈模舜, 金则新, 柯世省
- Chen Moshun, Jin Zexin, Ke Shisheng
- 不同光环境下天台鹅耳枥叶形变化的测定与分析
- Measurement and Analysis of Leaf Shape Variation of Carpinus tientaiensis in Different Light Environment
- 林业科学, 2018, 54(1): 54-63.
- Scientia Silvae Sinicae, 2018, 54(1): 54-63.
- DOI: 10.11707/j.1001-7488.20180106
-
文章历史
- 收稿日期:2017-01-03
- 修回日期:2017-04-18
-
作者相关文章
天台鹅耳枥(Carpinus tientaiensis)系桦木科(Betulaceae)鹅耳枥属(Carpinus)植物, 为我国特有的地方种, 只分布在浙江省天台县和磐安县, 仅存13株母株, 数量低于野外种群稳定存活界限。天台鹅耳枥种群呈单株散生的间断分布, 林下幼苗少见, 种群呈衰退趋势, 被列为国家二级重点保护野生植物(章绍尧等, 1993)。天台鹅耳枥对于植物地理、植物区系和生物多样性等方面的研究均有较高的科研价值。目前, 生境的严重破碎化直接影响到天台鹅耳枥的生存, 加之近年来分布区内开发旅游资源, 使其生境受到严重威胁, 已经处于濒危状态, 亟待保护。
叶形态的变异对植物获取资源具有重要作用, 受温度、光照、湿度和土壤等条件的影响, 叶的形态结构与功能会产生适应性的变化。植物叶的形状因叶尖、叶基、叶缘的不同形态特点和叶脉的分布状况而表现出形态上的多样性, 可作为植物种类的识别特征。由于叶的尺寸效应, 根据叶的特征利用传统的长度测量很难区分物种(Kremer et al., 2002)。几何学形态测定(geometric morphometric, GM)是二维生物形状定量比较最合适的方法。GM利用地标和外形标记在分类学研究上已被证明是成功的, 近年来国外已有学者使用GM分析方法研究植物生长进化及其生态适应问题, 如美国红枫(Acer rubrum)和银槭(A.saccharinum)及其杂交种叶的形态分析(Jensen et al., 2002); 在干旱与湿地生活的Quercus petraea [HJ60x]种群形态变异趋势, 是由于气候和岩性的因素(Viscosi et al., 2009)等。目前国内有关植物叶的几何学形态测定方面仅慈姑属(Sagittaria)植物叶型的多样性(Huang et al., 2014)等少量文章发表。叶片的形态建成是多种环境因子综合作用的结果, 而环境因子影响树木叶片变异的主导因子尚不明确。由于个体、群落和树种间叶形的表型高度变化, 加之对许多树种叶片间的异速生长关系缺乏了解, 使得评价树木叶片的动态特征具有重要意义(彭耀强等, 2011)。
濒危和灭绝的生物在进化过程中存在某种脆弱环节, 如某些物种生物生态学特性的特化而依赖于单一或特殊的环境、生境。天台鹅耳枥主要分布于天台县华顶山, 生长于溪谷两侧和山区林中, 分布在海拔860~920 m处, 年降水量1 700 mm, 平均相对湿度85%以上, 年平均气温13 ℃, 无霜期230天, 属中亚热带气候, 温暖潮湿。山地土壤系水成岩和火成的花岗岩母质上发育的山地黄壤土。天台县与磐安县山脉相连, 天台山植物区系属于泛北极区, 由于没有受到冰川的严重影响, 植物一直在比较温暖湿润的气候条件下生存发展, 在这里可见到一些古老的孑遗植物。本区特有种天台鹅耳枥、华顶杜鹃(Rhododendron huadingense)、七子花(Heptacodium miconioides)等物种在浙江范围内以此为主要分布区。这些特有种多数是小种群物种, 分布范围极窄, 个体数量极少, 表明这些物种对生存环境要求严格, 自身对环境适应能力脆弱(胡绍庆等, 2002; 陈之端, 1994)。天台鹅耳枥扩大繁殖要求合适的生长环境, 不同光环境对天台鹅耳枥叶的形态结构影响尚不明确。鉴于此, 本文运用几何学形态测定方法, 分析研究天台鹅耳枥叶的形状变化与环境因素之间的关系, 以便发现叶形态的异速生长模式, 以期为天台鹅耳枥播种、育苗及扩大种群等方面的研究提供参考资料, 并为探讨其自然条件下幼苗稀少的原因提供理论依据。
1 材料与方法 1.1 材料与处理对天台鹅耳枥6个分布点优异种质选育收集, 进行对比和筛选, 选用天台县华顶山同一母株种子进行繁殖。2013年2月利用天台鹅耳枥种子进行人工育苗, 带土移栽天台鹅耳枥幼树, 种植在台州学院椒江校区(28°23′N, 121°55′E)。试验地海拔12 m, 年平均温度17 ℃, 最热月平均温度28 ℃, 最冷月平均温度6 ℃, 年降水量1 500 mm, 年日照时数1 900 h, 属亚热带季风性湿润气候, 四季分明, 没有严冬和酷暑的干扰。
2015年3月中旬在天台鹅耳枥的叶未完全展开时, 将天台鹅耳枥分别置于覆盖不同层数黑色防晒网的遮阳棚内生长, 设置3种不同生长光强:全光照(FI, 空旷地, 3月中旬晴天正午的光合有效辐射PAR约为1 250 μmol ·m-2 s-1)、中等光强(MI, 覆盖1层黑色防晒网, PAR约为全光照的41%, 与林窗光强相近)和低光强(LI, 覆盖2层黑色防晒网, PAR约为全光照的7%, 与林下光强相近), 在3种光环境下分别放置5盆天台鹅耳枥(共15盆, 每盆种植天台鹅耳枥1株), 常规管理, 定时浇水。2015年7月下旬从成熟枝上收集叶片(距枝端3-5叶), 每种光环境下每株采集10~15个叶片, 形成150片叶的一个整体样本, 每种光照强度下随机选取30份天台鹅耳枥叶的标本。
1.2 测定方法 1.2.1 环境因子观测选择2015年7月20—25日的晴天, 用地温计和温湿度计测定地表温度(Ts)、大气温度(Ta)和相对湿度(RH)。利用Li-1400照度计(美国Li-Cor公司)测定光合有效辐射(PAR)。上述环境因子测量在8:00—18:00之间进行, 2 h观测1次, 重复测量3次, 连续观测3天。
1.2.2 叶的形态指标测定选取3种光照梯度下天台鹅耳枥叶片标本(每种光照梯度30个叶片), 利用LI-COR 3000A叶面积测定仪测定叶的长度、宽度和叶柄长度, 分辨二级叶脉数目。
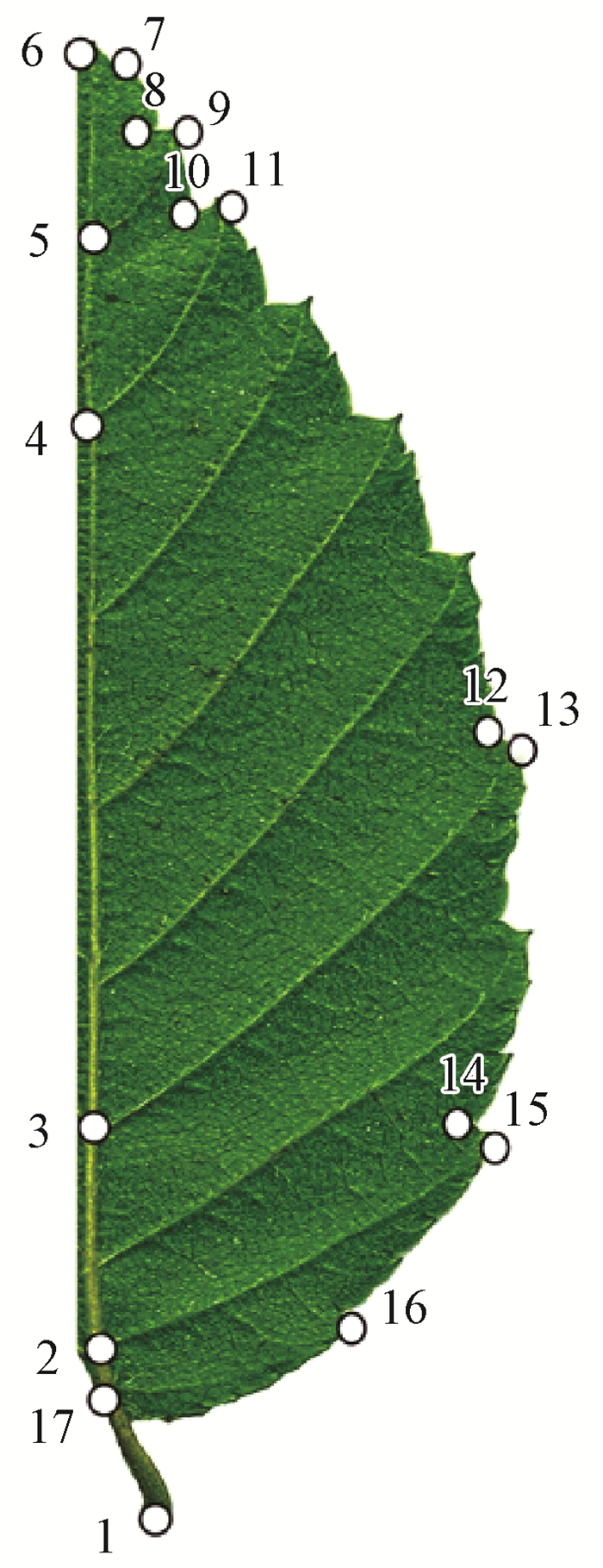
1.2.3 标本数据采集和图像获取叶片经加压、干燥后, 利用Epson perfection 1670扫描仪在300 dpi下进行扫描处理, 叶片远轴面向上, 以便获得清晰的二级叶脉。扫描图像习惯记录叶右边的一半17个标记点, 选择匀称的点避免多余(图 1、表 1)。有关轮廓分析重新得到整体叶形的信息, 选定地标推定同源点, 建议每个物种按照不同的程序嵌入鉴别特征(Jensen et al., 1993; Gonzales-Rodriguez et al., 2004)。
|
图 1 每个叶的轮廓地标点记录 Figure 1 Landmark configuration recorded on each leaf |
|
|
17个地标点是基于叶片边缘上一级和二级叶脉的相关位置被选择出来的(图 1、表 1)。地标点1、2、3、4、5、6和17有着完全的同源性(Gunz et al., 2013), 其分别在第1、第2基底叶脉、叶片最大宽度叶脉和第1、第2先端叶脉与一级叶脉交叉处, 以及叶柄和一级叶脉的最顶端。二级叶脉有1个环结脉的模式(Ellis et al., 2009), 在叶缘通过顶端分叉形成了1个环状的缘下脉络, 7、9、11、13、15、16轮廓地标点被确定为叶齿, 是二级叶脉远端分叉点边缘的延伸, 叶齿是叶缘的突起和与之关联的维管结构, 8、10、12、14轮廓地标点为近相邻两侧叶齿处叶缘凹缺, 设置凹缺点增加叶缘鉴别特征。
1.2.4 数字的标准化处理将3种光照梯度下天台鹅耳枥叶片扫描的图像输入到Tpsdig 2程序中, 用于地标点的数字化, 制作出每一片叶的17个x、y的34个坐标图。使用普氏分析法将标志点轮廓叠加, 获得每个梯度种群的平均轮廓。用IMP系列软件中的Coordgen软件计算每个梯度种群的标准轮廓坐标数据, 然后使用薄片样条曲线图解析标志点差异, 以可视化图例的方式展示各梯度种群在脉型和叶脉形状方面的差异。
1.2.5 统计分析运用PSAT 3.14软件对天台鹅耳枥叶片的脉型和叶形做相对形态变异分析, 显示不同光环境下叶形和叶脉变异规律。叶片用17个地标点分别解释叶的形态变异, 将由所有地标点构成的全部形态变异转换为较少数量、彼此不相关的主成分变异指标(PC), 由前几个主成分代表主要的形态变异信息。应用PAST软件可得到叶的形状主要扭曲及相对扭曲等特征值, 通过各个光照梯度叶的形状相对扭曲的前2个特征值, 判断形状空间内的变异程度(Rohlf et al., 1990)。结合PAST软件获得叶形平均值主成分指标(PC), 由Morpho J软件得到PC数据集。通过SPSS 11.5软件对叶的形态结构参数和环境因子数据进行方差分析(ANOVA), 差异显著性(P < 0.05)运用Duncan’s检验进行多重比较。环境因子对叶结构性状的影响采用相关分析, 建立叶片形状变化与环境因素的关系。
2 结果与分析 2.1 不同光环境下生态因子对天台鹅耳枥叶生长的影响不同光环境下光合有效辐射(PAR)、大气温度(Ta)、地表温度(Ts)和相对湿度(RH)不同(表 2), 3种光环境下的PAR差异最显著, 其次为Ta、Ts和RH。FI(全光照)与MI(中等光强)、LI(低光强)的日平均Ta的差异相对较小, LI仅比FI平均降低2.4 ℃; 与MI、LI相比, FI的Ts日平均值比MI高1.6 ℃, 比LI高2.7 ℃, 差异显著; FI的RH日平均值相当于MI的71%、LI的65%, 差异显著。MI与LI的Ta、Ts和RH相比较差异不显著。
|
|
由表 3可知, 不同光环境下天台鹅耳枥叶形发生了明显变化。天台鹅耳枥叶的长度和宽度在FI与MI、LI之间存在着显著性差异, 在LI下叶的长度和宽度明显大于MI和FI。从叶片叶脉数量来看, LI下叶的二级叶脉数与MI的差异不显著, 但与FI存在显著差异。天台鹅耳枥叶柄的长度在FI、MI和LI之间存在着显著性差异, 在FI和LI下叶柄长度明显大于MI。
|
|
通过Coordgen软件中普氏叠加法(Procrustes superimposition)重叠地标点分析, 表明不同环境因子对叶形状的影响(图 2)。普氏叠加法通过地标点轮廓叠加, 并使地标点离差最小化。在同一个坐标体系中, 剔除形态信息分析中非形态因素的影响, 从而获得每个梯度种群的平均轮廓(Johansson et al., 2009)。从叶形态上看, 3种光环境下天台鹅耳枥叶片形态大致相近, 为椭圆形, 但叶形存在差异, 在LI下叶形较宽, 叶片较长; 在MI下叶片椭圆形较为饱满; 在FI下叶片整体形状相对圆润不偏细长。天台鹅耳枥叶形的叠加分析说明所有地标点的选择合理, 具有同源性; 在不同光环境下叶形存在异速生长, 叶形间差异较大。

|
图 2 低光强LI(A)、中等光强MI(B)和全光照FI(C)下天台鹅耳枥叶片地标点普氏叠加分析 Figure 2 Analysis for Procrustes superimposition of landmark of Carpinus tientaiensis leaves in low irradiance(A), moderate irradiance(B) and full irradiance(C) 图中X, Y为地标点坐标经普氏叠加分析所得的坐标数据。 The X, Y are coordinate data from the Procrustes superimposition analyzed landmark data. |
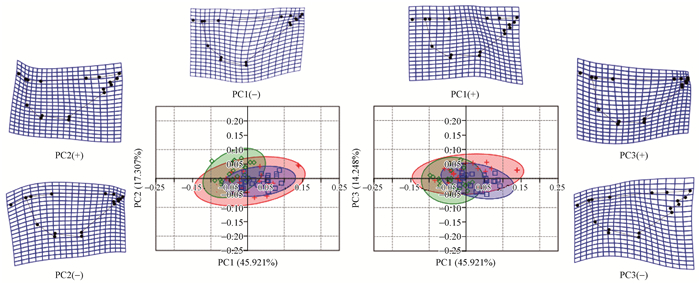
由不同光环境下天台鹅耳枥叶片的主成分分析(PCA) (表 4)可知, 前10个叶片主成分PC特征值表达占总变异的95%以上。其中叶片PC1的特征值为0.002 604 690, 占总变异的45.921 0%;PC2的特征值为0.000 981 685, 占总变异的17.307 0%; PC3特征值为0.000 808 177, 占总变异的14.248 0%。根据Broken-stick模型, 前3个主成分的特征值占总变异的77.476%, 能够说明3种光环境下叶片的主要变异规律。
|
|
整个矩阵的主成分分析(PCA)被用来研究地标点基阵的总体变化和识别叶形的最重要趋势。利用获得的数据对天台鹅耳枥叶形状第1、第2和第3主成分作散点图。PCA散点图代表一个明显的形态变量及趋势, 在2个数据集之间, 3种光环境下天台鹅耳枥叶形状有很大重叠, 说明FI和MI、LI之间叶形状存在一定相似性(图 3)。
|
图 3 不同光环境下PC1、PC2和PC3轴上天台鹅耳枥叶形扭曲分析 Figure 3 Distortion analysis of PC1, PC2 and PC3 axis of leaf shape to Carpinus tientaiensis under different light environments +:LI ◇:MI □:FI 主成分(PC)图采用Procrustes-aligned地标点坐标矩阵, 椭圆为95%置信区间。薄片样条分析图显示叶的形状在PC1、PC2和PC3轴的正负方向极端扭曲状态。 Plot of principal components(PC), using a matrix of Procrustes-aligned landmark coordinates, showing 95% confidence ellipses.Thin-plate spline analysis shows the leaf shape extremely distorted in the positive and negative directions of the PC1, PC2 and PC3 axes. |
根据叶形状的主成分数据, 利用PAST软件绘制相对扭曲图, 建立叶形的变异趋势, PC轴极端值代表了叶形之间叶片的最大差异, 用高分值(high score values)和低分值(low score values)来表示叶形之间的差异, 高分值即PC值在正方向最大值, 低分值即PC值在负方向最小值(Vieira et al., 2014)。图 3结果显示, 在PC1轴上, 天台鹅耳枥低分值上扭曲主要发生在叶基和叶尖, 高分值上扭曲主要发生在叶中部; 在PC2轴上, 叶片在正、负轴叶形进行相对扭曲, 低分值上扭曲主要发生在叶柄向上偏转, 叶尖向下偏转, 高分值上扭曲主要发生在叶柄向下偏转, 叶尖向上偏转; 在PC3轴上, 低分值上扭曲主要发生在叶柄和叶尖向上偏转, 高分值上扭曲主要发生在叶柄和叶尖向下偏转。
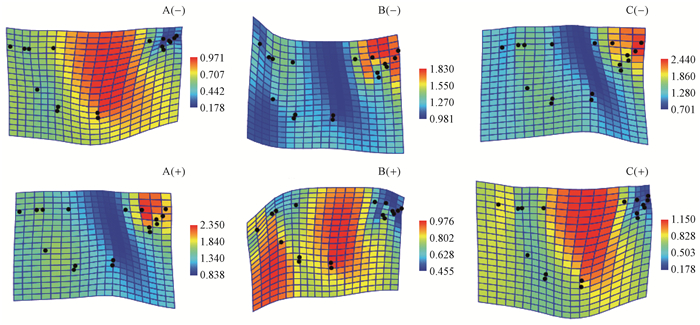
2.4 不同光环境下天台鹅耳枥叶的异速生长不同光环境下, 受PAR、Ta、Ts和RH等因素影响, 沿着前3个PC轴的分值, 观察到天台鹅耳枥叶形之间的差异, 高分值和低分值分别代表PC值在正、负轴的极端值。PC1中涉及叶片中部和叶尖扩张或收缩(图 4)。天台鹅耳枥在低分值上, LI下的叶片中部(地标点3、4和11、13)膨大、叶尖(地标点5、6和9、11)呈现收缩, MI和FI下的叶片中部呈现收缩、叶尖膨大; 高分值上, LI下的叶片中部收缩、叶尖呈现膨大, MI和FI下的叶片中部呈现膨大、叶尖收缩。
|
图 4 PC1轴上LI(A)、MI(B)和FI(C)天台鹅耳枥叶形的典型变量分析 Figure 4 Canonical variates analysis of the leaf shape by the PC1 axis of Carpinus tientaiensis in LI(A), MI(B) and FI(C) 上图显示了PC1低分值的叶形, 下图是高分值的叶形。颜色代码Jacobian膨胀系数用来衡量网格的局部扩张或收缩, 蓝色系数小于1表明压缩, 黄色至橙红色系数大于1表明膨胀。由PAST 3.14计算所得。 The figures above show the leaf shape corresponding to low score values of the PC1, and the figures below to high score values.The colour coded Jacobian expansion factors are used to measure the degree of local expansion or contraction of the grid, yellow to orange red for factors>1, indicating expansions; light to dark blue for factors < 1, indicating contractions.Computed in PAST 3.14. |
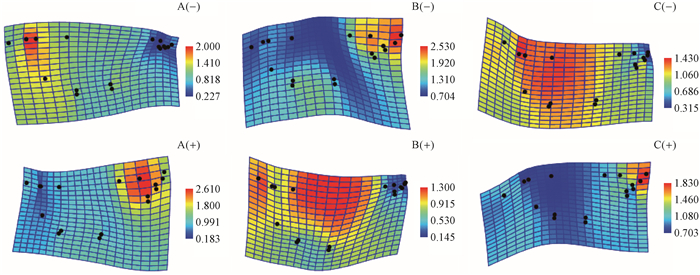
PC2中变异聚焦于叶柄和叶尖交替的伸缩率(图 5)。天台鹅耳枥在低分值上, LI下叶柄(地标点1、17)膨大、叶尖收缩, MI下叶柄收缩、叶尖膨大, FI下叶基(地标点2、17和16、17)和叶片中部(地标点2、4和12、16)膨大、叶尖收缩; 高分值上, 在LI下叶柄收缩、叶尖膨大, MI下叶柄膨大、叶尖收缩, FI下叶基和叶片中部收缩、叶尖膨大。
|
图 5 PC2轴上LI(A)、MI(B)和FI(C)天台鹅耳枥叶形的典型变量分析 Figure 5 Canonical variates analysis of the leaf shape by the PC2 axis of Carpinus tientaiensis in LI(A), MI(B) and FI(C) 上图显示了PC2低分值的叶形, 下图是高分值的叶形。 The figures above show the leaf shape corresponding to low score values of the PC2, and the figures below to high score values. |
PC3中涉及叶片的伸缩率(图 6)。天台鹅耳枥在低分值上, LI条件下叶柄收缩, 叶片下半部叶基第1叶脉(地标点17、16)到叶片中部(地标点3、13)形状改变轻微, 叶片上半部第2先端叶脉(地标点4、11)到叶片中部收缩, 而叶尖膨大; MI和FI条件下叶柄收缩, 叶基和叶片下半部挤压, 叶尖膨大。高分值上, 在LI条件下叶柄膨大, 叶片上半部膨大, 而叶尖收缩; 在MI和FI条件下叶柄膨大, 叶基和叶片下半部膨大, 叶尖收缩。
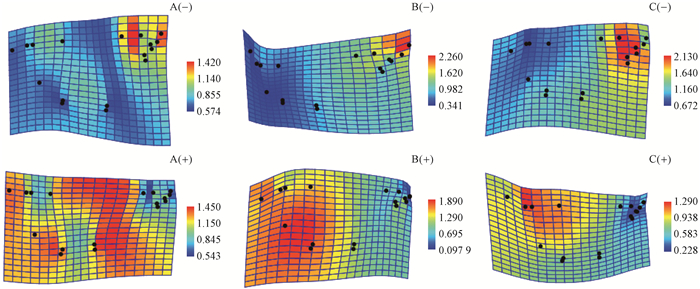
|
图 6 PC3轴上LI(A)、MI(B)和FI(C)天台鹅耳枥叶形的典型变量分析 Figure 6 Canonical variates analysis of the leaf shape by the PC3 axis of Carpinus tientaiensis in LI(A), MI(B) and FI(C) 上图显示了PC3低分值的叶形, 下图是高分值的叶形。 The figures above show the leaf shape corresponding to low score values of the PC3, and the figures below to high score values. |
天台鹅耳枥叶形和环境条件之间有显著的相关性(表 5)。PC1主要受PAR、Ts、Ta和RH的影响, 相关系数分别为0.912(P=0.000)、0.958(P=0.000)、0.972(P=0.000)和-0.831(P=0.003), 具有极显著相关性; 叶形变化主要发生在叶片最大宽度和叶尖位置(图 4)。PC2与PAR、Ts、Ta和RH具有极显著相关性, 相关系数分别为-0.904(P=0.000)、-0.898(P=0.001)、-0.907(P=0.000)和0.782(P=0.006);叶形变化主要发生在叶柄和叶尖位置(图 5)。PC3与Ts和Ta的相关系数分别为0.806(P=0.004)和0.754(P=0.010), 具有极显著相关性, 与PAR相关系数为0.680(P=0.022), 有显著相关性, 与RH相关系数为-0.469(P=0.102), 相关性不显著; 叶形变化涉及叶片的伸缩率, 主要反映在叶片上半部、下半部扩张或收缩(图 6)。
|
|
生态环境因素是导致物种稀有和濒危的重要原因。天台鹅耳枥在自然状态下对光的要求较为独特, 种群呈单株散生间断分布, 依赖于特殊的生境(胡绍庆等, 2002)。在不同环境因素的压力下即使是同一类型, 叶片也可能出现不同的模式, 形成各种适应类型(Xia et al., 2002)。通过叶的几何学形态测定分析, 表明不同光环境下天台鹅耳枥叶形存在异速生长。这种异速生长表现在叶形的扩张或收缩上, 生长于弱光环境中, 叶片出现最大宽度, 叶尖收缩尖锐, 有长的叶柄; 在中等光强下, 叶形较为饱满, 叶柄较短; 在强光环境下, 叶片顶点钝尖, 叶椭圆形收缩。
叶的几何学形态测定目前应用于叶的形状与营养变量、环境变量及叶形状变量之间的研究(Navarro et al., 2004; Adams et al., 2000)。在检验非正常值之后, 计算每株植物叶形平均值, 数据适合于分析个体内部变异的影响(Xia et al., 2002)。本研究相关性分析表明天台鹅耳枥叶形变异趋势与环境因素之间显著相关, 在空旷地与林窗、林下的相近光强下叶的形态差异, 归于有效光合辐射(PAR)、地表温度(Ts)、大气温度(Ta)和相对湿度(RH)的影响。当叶形变化与PAR、Ts和Ta显著正相关、与RH显著负相关时, 叶形变化在叶片中部和叶尖方面, 叶片出现中部的扩张或收缩, 变异聚焦于叶基和叶尖交替的伸缩率; 生长于弱光环境下, 天台鹅耳枥叶片中部出现扩展、叶尖压缩; 在强光和中等光强环境下, 叶片中部挤压、叶尖膨大。当叶形变化与PAR、Ts和Ta呈显著负相关、与RH显著正相关时, 叶形变化涉及叶柄长度和叶尖伸缩率; 在强光和弱光环境下, 天台鹅耳枥叶柄伸长、叶尖收缩; 在中等光强下, 叶柄收缩、叶尖膨大。当叶形仅与PAR、Ts和Ta显著正相关时, 叶的性状对温度的响应明显强于对降水的响应, 在中等光强环境下, 涉及叶片的伸缩率, 叶柄收缩, 叶基和叶片上半部收缩, 叶尖膨大。不同光环境影响叶片形状大小和厚度改变, 可增强叶片细胞对光的捕获能力(李芳兰等, 2005)。叶形的相对扭曲图表明受光环境的影响, 天台鹅耳枥叶柄和叶尖出现上、下扭曲。由于植物的趋光性, 叶柄通过本身的长短和扭曲处于光合作用的最佳位置。
植物采用增加叶厚度及较小的叶面积和较高的叶组织密度适应强光环境。长期生长于弱光环境中的植物叶面积大、叶片较薄, 比叶质量较低, 叶柄较长(薛立等, 2010)。天台鹅耳枥随光照增强, 叶肉组织细胞数量增加, 叶片厚度增加, 其最大净光合速率(Pn max)亦增大; 在弱光下叶肉组织细胞排列疏松, 叶片变薄, 比叶质量小; 在3种光环境下, 天台鹅耳枥全光照(FI)下叶片的光饱和光合速率最大但其叶绿素含量并不是最高, 最大光合速率取决于阳生叶具有阳性叶绿体, 能进行更高效率的光能转化; 在光照较强的林窗环境中, 天台鹅耳枥叶的主脉维管束较发达, 较短的叶柄能有效地传导水分和养料(陈模舜等, 2010;2013)。
天台鹅耳枥叶类型在萌芽阶段取决于叶原基, 叶形态可塑性是对环境条件的响应。几何学形态测定方法在研究叶形特征上强调地标点的同源性, 同源结构一般具有相同的遗传基础。在经历环境胁迫时, 同源结构的变异能够被有效测定并进行量化分析(Klingenberg, 2008; Klingenberg et al., 2010)。存在于种群间的基因与叶形态特征的关系是复杂的, 需要对表型特征和遗传特征做进一步研究。今后通过与分子系统发育分析相结合, 将有助于进一步改进天台鹅耳枥的形态学推论和对种群地理格局的了解。
4 结论本研究所获得的描述性和定量结果表明, 在天台鹅耳枥的叶形变化中, 几何学形态测定方法能较好地区分种内差异。不同光环境下, 随着光照增强天台鹅耳枥通过改变叶的结构增加光合能力。生长于弱光环境下, 天台鹅耳枥叶片较宽, 中部出现扩展、叶尖压缩, 叶柄较长, 基部心形, 二级叶脉数量也相应增加; 在强光环境中, 叶片中部挤压、叶尖膨大, 叶椭圆形较为收缩。不同光环境下天台鹅耳枥叶形变化相关分析显示, 与中等光强的林窗环境相适应, 天台鹅耳枥叶基和叶片下半部收缩、叶尖膨大, 叶片椭圆形较为饱满, 较短的叶柄能更有效地传导水分和养料。在自然状态下依赖于特殊生境进行天台鹅耳枥生物多样性的迁地保护中, 选择光照较强的林窗环境, 注重其输水器官的保护, 可有效地恢复和扩大天台鹅耳枥种群。
陈模舜, 柯世省. 2013. 天台鹅耳枥叶片的解剖结构和光合特性对光照的适应[J]. 林业科学, 49(2): 46-53. (Chen M S, Ke S S. 2013. Acclimation of anatomical structure and photosynthesis characteristics in leaves of Carpinus tientaiensis to irradiance[J]. Scientia Silvae Sinicae, 49(2): 46-53. DOI:10.11707/j.1001-7488.20130208 [in Chinese]) |
陈模舜, 柯世省, 杨勇宇, 等. 2010. 珍稀濒危植物天台鹅耳枥营养器官的解剖学研究[J]. 浙江林业科技, 30(5): 14-19. (Chen M S, Ke S S, Yang Y Y, et al. 2010. Anatomical study on vegetative organs of Carpinus tientaiensis[J]. Journal of Zhejiang Forestry Science and Technology, 30(5): 14-19. [in Chinese]) |
陈之端. 1994. 桦木科植物的系统发育和地理分布[J]. 植物分类学报, 32(1): 1-31. (Chen Z D. 1994. Phylogeny and phytogeography of the Betulaceae[J]. Acta Phytotaxonomica Sinica, 32(1): 1-31. [in Chinese]) |
胡绍庆, 丁炳扬, 陈征海. 2002. 浙江省珍稀濒危植物物种多样性保护的关键区域[J]. 生物多样性, 10(1): 15-23. (Hu S Q, Ding B Y, Chen Z H. 2002. The critical regions for conservation of rare and endangered plant species diversity in Zhejiang Province[J]. Biodiversity Science, 10(1): 15-23. [in Chinese]) |
李芳兰, 包维楷. 2005. 植物叶片形态解剖结构对环境变化的响应与适应[J]. 植物学通报, 22(增刊): 118-127. (Li F L, Bao W K. 2005. Responses of the morphological and anatomical structure of the plant leaf to environmental change[J]. Chinese Bulletin of Botany, 22(S1): 118-127. [in Chinese]) |
彭耀强, 薛立, 潘澜, 等. 2011. 3种阔叶幼苗叶片形态特征的季节变化[J]. 中国农学通报, 27(13): 31-36. (Peng Y Q, Xue L, Pan L, et al. 2011. Seasonal change of leaf trait of three broadleaf seedlings[J]. Chinese Agricultural Science Bulletin, 27(13): 31-36. [in Chinese]) |
薛立, 曹鹤. 2010. 逆境下植物叶性状变化的研究进展[J]. 生态环境学报, 19(8): 2004-2009. (Xue L, Cao H. 2010. Changes of leaf traits of plants under stress resistance[J]. Ecology and Environmental Sciences, 19(8): 2004-2009. [in Chinese]) |
章绍尧, 丁炳扬. 1993. 浙江植物志:总论卷[M]. 杭州: 浙江科学技术出版社. (Zhang S R, Ding B Y. 1993. Flora of Zhejiang:Volume General[M]. Hangzhou: Zhejiang Science and Technology Press. [in Chinese]) |
Adams D C, Rohlf F J. 2000. Ecological character displacement in Plethodon:Biomechanical differences found from a geometric morphometric study[J]. Proceedings of the National Academy of Sciences USA, 97(8): 4106-4111. DOI:10.1073/pnas.97.8.4106 |
Ellis B, Daly D C, Hickey L J, et al. 2009. Manual of leaf architecture[M]. Ithaca & New York: Cornell University Press: 1-190.
|
Gonzales-Rodriguez A, Arias D M, Oyama K. 2004. Morphological and RAPD analysis of hybridization between Quercus affinis and Q.laurina (Fagaceae), two Mexican red oaks[J]. American Journal of Botany, 91(3): 499-509. DOI:10.3732/ajb.91.3.499 |
Gunz P, Mitteroecker P. 2013. Semilandmarks:a method for quantifying curves and surfaces[J]. Hystrix-Italian Journal of Mammalogy, 24(1): 103-109. |
Huang L J, Cheng Y. 2014. Understanding diversity in leaf shape of Chinese Sagittaria (Alismataceae) by geometric tools[J]. Pakistan Journal of Botany, 46(6): 1927-1934. |
Jensen R J, Ciofani K M, Miramontes L C. 2002. Lines, outlines, and landmarks:Morphometric analyses of leaves of Acer rubrum, Acer saccharinum (Aceraceae) and their hybrid[J]. Taxon, 51(3): 475-492. DOI:10.2307/1554860 |
Jensen R J, Hokanson S C, Isebrands J G, et al. 1993. Morphometric variation in oaks of the Apostle Islands in Wisconsin:Evidence of hybridization between Quercus rubra and Q.ellipsoidalis[J]. ellipsoidalis (Fagaceae).Jensen American Journal of Botany, 80(11): 1358-1366. DOI:10.1002/ajb2.1993.80.issue-11 |
Johansson F, Scderquist M, Bokma F. 2009. Insect wing shape evolution:independent effects of migratory and mate guarding flight on dragonfly wings[J]. Biological Journal of the Linnean Society, 97(2): 362-372. DOI:10.1111/j.1095-8312.2009.01211.x |
Klingenberg C P. 2008. Novelty and "homology-free" morphometrics:what's in a name?[J]. Evolutionary Biology, 35(3): 186-190. DOI:10.1007/s11692-008-9029-4 |
Klingenberg C P, Gidaszewski N A. 2010. Testing and quantifying phylogenetic signals and homoplasy in morphometric data[J]. Systematic Biology, 59(3): 245-261. DOI:10.1093/sysbio/syp106 |
Kremer A, Dupouey J L, Deans J D, et al. 2002. Leaf morphological differentiation between Quercus robur and Quercus petraea is stable across western European mixed oak stands[J]. Ann Forest Sci, 59(7): 777-787. DOI:10.1051/forest:2002065 |
Navarro N, Zatarain X, Montuire S. 2004. Effects of morphometric descriptor changes on statistical classification and morphospaces[J]. Biological Journal of the Linnean Society, 83(2): 243-260. DOI:10.1111/j.1095-8312.2004.00385.x |
Rohlf F J, Slice D. 1990. Extensions of the Procrustes method for the optimal superimposition of landmarks[J]. Systematic Zoology, 39(1): 40-59. DOI:10.2307/2992207 |
Terashima I, Hanba Y T, Tholen D, et al. 2011. Leaf functional anatomy in relation to photosynthesis[J]. Plant Physiology, 155(1): 108-116. DOI:10.1104/pp.110.165472 |
Vieira M, Mayo S J, Andrade I M D. 2014. Geometric morphometrics of leaves of Anacardium microcarpum Ducke and A.occidentale L.(Anacardiaceae) from the coastal region of Piaui, Brazil[J]. Brazilian Journal of Botany, 37(3): 315-327. DOI:10.1007/s40415-014-0072-3 |
Viscosi V, Fortini P, Slice D E, et al. 2009. Geometric morphometric analyses of leaf variation in four oak species of the subgenus Quercus (Fagaceae)[J]. Plant Biosyst, 143(3): 575-587. DOI:10.1080/11263500902775277 |
Xia Y, Tong H, Li W K, et al. 2002. An adaptive estimation of dimension reduction space[J]. Journal of the Royal Statistical Society, 64(3): 363-410. |
 2018, Vol. 54
2018, Vol. 54
