文章信息
- 谷战英, 杨若楠, 陈昊
- Gu Zhanying, Yang Ruonan, Chen Hao
- 油桐叶肉细胞原生质体分离及瞬时转化体系的建立
- The Establishment of Isolation and Transient Transformation Methods of Protoplasts of Vernicia fordii Mesophyll Cells
- 林业科学, 2018, 54(1): 46-53.
- Scientia Silvae Sinicae, 2018, 54(1): 46-53.
- DOI: 10.11707/j.1001-7488.20180105
-
文章历史
- 收稿日期:2017-04-10
- 修回日期:2017-05-15
-
作者相关文章
油桐(Vernicia fordii)是我国重要的木本油料植物, 然而到目前为止, 尽管通过高通量测序手段找到了一些可能位于桐油形成通路中的基因, 但这些基因在油桐体内行使的具体功能还未见研究(陈昊等, 2015), 严重阻碍了油桐产业的发展。解析与桐油合成相关基因的功能, 不仅具有重要的理论意义, 也可为油桐的遗传改良提供有效的基因资源。基因功能的解析需要相应技术体系的支撑, 因此, 本研究建立的油桐叶肉细胞原生质体分离及瞬时转化体系为在油桐自身细胞中研究其基因功能创造了条件, 将极大地促进油桐分子理论研究的进展。
基因编码蛋白的亚细胞定位与基因的功能密切相关, 蛋白的亚细胞定位可为其基因功能的揭示提供重要的线索和依据(周丹丹等, 2013)。目前, 常用于蛋白亚细胞定位的植物受体细胞主要有表皮细胞(Chen et al., 2012)、愈伤组织细胞(夏玉凤, 2006)、叶肉细胞(Yang et al., 2000)和原生质体细胞(Sheen, 2001; Liu et al., 2007)。相较于其他几种细胞受体系统, 原生质体在亚细胞定位研究中更具优势:原生质体细胞去除了细胞壁, 质膜和细胞器清晰可见, 更有利于观察蛋白亚细胞定位情况; 由于原生质体的分离周期一致, 外源基因在细胞中的起始表达时期较均一; 无需昂贵的设备和繁琐的组织培养, 整个实验流程仅需2天时间。随着GUS(Jefferson et al., 1987)、LUC(Luehrsen et al., 1992)和GFP(Chiu et al., 1996)等报告基因的引入, 原生质体已被广泛应用于植物学基础研究中(Hansen et al., 2016; Poot-Poot et al., 2016; Zhang et al., 2016)。
Cocking(1960)报道了番茄(Solanum lycopersicum)根尖细胞原生质体的分离, 这也是植物细胞原生质体的首次成功分离。目前, 模式植物的原生质体制备技术体系较为完备, 例如, 通过优化实验条件, 1 g拟南芥(Arabidopsis thaliana)叶片组织可产生107个原生质体细胞(Yoo et al., 2007)。尽管如此, 大多数有经济利用价值的木本植物的原生质体分离体系尚未建立, 这在一定程度上制约了植物基础研究的发展。油桐种子含油率高, 从中榨出的桐油经济利用价值极高(谭晓风等, 2011)。同时, 油桐也是研究植物α-桐酸(α-eleostearic acid)形成机理的模式植物, 桐油中α-桐酸含量占脂肪酸总量的70%(W/W)以上, 远超其他植物(傅伟昌等, 2008; 刘金龙等, 2011)。对油桐α-桐酸形成通路的解析, 关键在于揭示通路中关键酶基因的功能。基因功能研究离不开遗传转化的受体系统, 目前油桐基因功能研究大多是将其导入到拟南芥中进行, 但这并不能完全真实地反映油桐基因在其自身体内的功能。因此, 油桐的基础研究迫切需要建立一套油桐细胞原生质体分离和遗传转化体系, 使在油桐体内研究自身基因功能成为可能。
本研究在分离油桐叶肉细胞原生质体的基础上, 以获得的原生质体细胞为受体, 用已知亚细胞定位位置的标记基因对建立的瞬时转化方法进行验证, 试验结果证实了本研究建立的油桐叶肉细胞原生质体分离和瞬时转化体系的可靠性, 这将极大地促进油桐基础研究的发展。此外, 由于原生质体融合技术打破了物种的界限, 其作为一种重要的种质创新手段, 在植物育种中被广泛应用(蔡兴奎等, 2004; 吴紫云等, 2007; 于晓玲等, 2009; 解凯东等, 2014)。因此, 本研究建立的油桐原生质体分离和遗传转化体系不仅可促进油桐理论研究的发展, 而且在通过细胞融合和基因工程手段进行油桐种质创新研究方面也具有重要意义。
1 材料与方法 1.1 材料油桐幼叶取自油桐组培苗, 成熟叶片于6月份取自自然环境下生长的油桐植株。基因表达模式分析和油脂提取所用株系为本实验室选育的油桐自交系。
1.2 试验设计为了获得制备油桐叶肉细胞原生质体的最佳实验条件, 根据前人研究(Prasad et al., 2000; Wu et al., 2009; Lung et al., 2011), 设计了4因素3水平正交试验方案。4个因素分别为酶解液中纤维素酶R-10浓度、离析酶R-10浓度、甘露醇浓度和酶解时间, 其中纤维素酶和离析酶浓度(质量体积比)的3水平为1%、1.5%、2%, 甘露醇浓度的3水平为0.5、0.6、0.7 mol ·L-1, 酶解时间的3水平为3、6、12 h。通过对上述4因素3水平正交试验进行极差分析, 确定对原生质体产量和活力影响最大的因素。
1.3 油桐叶肉细胞原生质体的制备将采集的油桐叶片用质量分数为3%的次氯酸钠灭菌。灭菌后取适量经无菌解剖刀切割为宽度1 mm的条状叶片碎块, 置于3 mL酶解液(表 1)中, 黑暗条件下静置酶解一定时间(3、6、12 h), 随后用45 μm孔径不锈钢滤网过滤酶解液。将滤液置于15 mL离心管中, 在100×g转速下离心5 min后收集原生质体。弃上清后用1 mL CPW13溶液(表 1)重悬原生质体, 随后加入3 mL CPW26溶液(表 1)。重悬液在100×g转速下离心2 min, 收集液面分界处的原生质体细胞。原生质体产量和活性的测定按照舒小娟等(2015)方法进行。
|
|
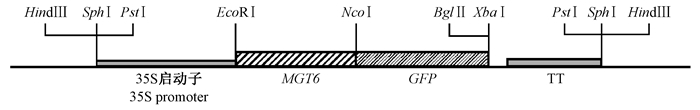
采用Qiagen公司的总RNA提取试剂盒进行油桐叶片总RNA的提取, 获得的总RNA需经质量检测, 满足相应条件后方可用于后续实验(陈昊等, 2015)。根据MGT6基因(TAIR登录号:At3g58970)的CDS(coding sequence)序列设计引物(正向引物:5′-GCCGAATTCATGGGGAAGGGCCC-3′; 反向引物:5′-CGGCCATGGATATGAGCCT AGCAG-3′), 扩增MGT6基因不包含终止密码子的CDS序列。利用正向引物序列上的EcoRⅠ和反向引物序列上的NcoⅠ酶切位点(下划线标出)对扩增出的PCR产物进行双酶切, 酶切后将其插入载体pRTL2-mGFP的EcoRⅠ-NcoⅠ位点(von Arnim et al., 1998), 构建35S∷MGT6-GFP瞬时表达载体。
1.5 原生质体的转化与信号检测将1.3中收集到的原生质体溶液在100×g转速下离心1 min, 弃掉上清, 用冰上预冷的W5溶液(表 1)重悬原生质体细胞, 冰上静置30 min后100×g离心1 min。弃去上清液, 用1 mL MMg溶液(表 1)重悬细胞。分别将15 μg空载体(对照)和构建好的35S∷MGT6-GFP瞬时表达载体与100 μL原生质体重悬液于1.5 mL离心管中混匀后, 加入110 μL PEG溶液(表 1), 混匀后静置20 min以完成转化。加入0.44 mL W5溶液并颠倒混匀, 以终止转化反应, 随后100×g离心1 min。弃上清, 用1 mL W5溶液重悬原生质体细胞, 室温孵育18 h后于荧光显微镜下观察GFP蛋白荧光信号。
2 结果与分析 2.1 油桐成熟叶片原生质体的最佳制备条件按照正交试验设计的几种实验条件组合进行油桐成熟叶片原生质体的制备, 所得实验数据见表 2。对实验数据进行极差分析, 结果显示酶解时间的R(极差)最大, 达到了每克(鲜质量)叶片5.90×106个, 这表明实验设定的4个因素中酶解时间对油桐成熟叶片原生质体分离效率的影响最显著(表 2)。除酶解时间外, 纤维素酶浓度的R也较大, 达到了每克(鲜质量)叶片2.70×106个, 这表明纤维素酶也是影响油桐成熟叶片原生质体产量的一个重要因素(表 2)。离析酶浓度和甘露醇浓度的R都不大, 这表明至少在试验设计的3个水平下, 二者对油桐成熟叶片原生质体产量的影响不大(表 2)。通过比较各实验条件组合所得的原生质体产量数据发现, 当纤维素酶浓度为1.5%、离析酶浓度为1%、甘露醇浓度为0.6 mol ·L-1、酶解时间为12 h时, 成熟叶片原生质体的产量最高, 达到了每克(鲜质量)叶片7.21×106个, 显著高于其他实验条件组合(表 2)。
|
|
相较于成熟叶片来说, 油桐幼叶来源于油桐组培苗, 有着取材不受季节影响、转基因原生质体细胞污染较少、有利于后续原生质体培养等优点, 因此, 本研究以油桐组培苗幼叶为实验材料进行原生质体的制备, 以比较成熟叶片和幼叶作为实验材料在分离原生质体效率方面的差异。幼叶正交试验设计同成熟叶片, 按照试验设计的几种实验条件组合进行幼叶原生质体的制备, 所得实验数据见表 3。对实验数据进行极差分析, 结果显示酶解时间的R最大, 达到了每克(鲜质量)叶片7.00×106个, 这表明实验设定的4个因素中酶解时间同样对油桐幼叶原生质体分离效率的影响最显著(表 3), 与以成熟叶片为实验材料的结果一样。同样, 除酶解时间外, 纤维素酶浓度的R也较大, 达到了每克(鲜质量)叶片2.00×106个, 这表明纤维素酶也是影响油桐幼叶原生质体产量的一个重要因素(表 3)。由于R较小, 离析酶浓度和甘露醇浓度同样也不是油桐幼叶原生质体制备的主要影响因素(表 3)。通过比较各实验条件组合所得的原生质体产量数据发现, 当纤维素酶浓度为2%、离析酶浓度为1%、甘露醇浓度为0.7 mol ·L-1、酶解时间为6 h时, 幼叶原生质体的产量最高, 达到了每克(鲜质量)7.08×106个, 显著高于其他实验条件组合(表 3)。
|
|
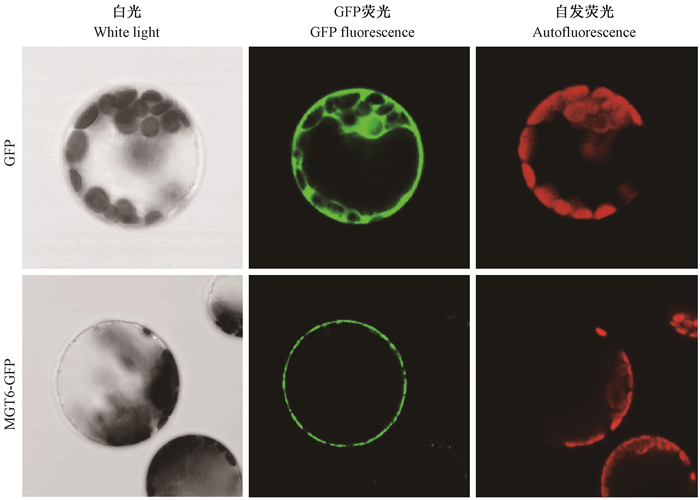
如前所述, 油桐组培苗幼叶相较成熟叶片作为实验材料更具优势, 因此, 本研究以油桐幼叶原生质体细胞为受体进行后续基因的亚细胞定位研究。已有研究表明, 拟南芥MGT6是一个镁离子转运蛋白, 定位于细胞质膜上(Mao et al., 2014), 本研究选用MGT6基因作为标记基因, 通过在油桐原生质体中对其亚细胞定位情况进行分析, 以验证本研究建立的原生质体分离和瞬时转化体系的可靠性。将构建好的35S∷MGT6-GFP瞬时表达载体(图 1)和pRTL2-mGFP空载体(对照)利用PEG介导法导入到原生质体细胞中, 室温孵育18 h后于荧光显微镜下观察GFP蛋白的荧光信号。结果显示, 白光下, 导入35S∷MGT6-GFP瞬时表达载体的原生质体细胞形状规则, 细胞膜没有破损, 当以绿光(545~580 nm)作为激发光时, 能够观察到叶绿体的红色自发荧光, 当以蓝光(460~480 nm)作为激发光时, 能够在导入 MGT6-GFP 融合基因的原生质体细胞膜上观察到很强的GFP蛋白绿色荧光, 而未导入融合基因的原生质体仅发出微弱的本底荧光信号(图 2)。在同样的激发光条件下, 导入pRTL2-mGFP空载体的原生质体细胞中, 红色荧光仅由叶绿体发出, 而绿色荧光则遍布整个细胞(图 2)。以上观察结果表明, 本研究建立的油桐原生质体分离和瞬时转化体系能够很好地应用于功能基因的亚细胞定位研究。
|
图 1 MGT6-GFP瞬时表达载体示意 Figure 1 Schematic diagram of transient expression vector of MGT6-GFP TT:转录终止子序列Transcriptional terminator sequence. |
|
图 2 拟南芥MGT6蛋白在油桐原生质体中的亚细胞定位 Figure 2 Subcellular localization of Arabidopsis thaliana MGT6 protein in Vernicia fordii protoplast |
尽管目前拟南芥、烟草(Nicotiana tabacum)等模式植物原生质体分离和转化体系已很成熟, 但由于遗传背景不同, 在研究油桐基因功能时, 如将油桐基因在这些异源细胞中进行表达, 很可能出现表达异常的现象(Marion et al., 2008)。另外, 相较于植物其他组织细胞的原生质体, 叶肉细胞原生质体中的叶绿体是植物脂肪酸合成的场所之一(Ohlrogge et al., 1995), 能够进行光合作用固定碳源(Edwards et al., 1970), 有鉴于此, 以油桐叶肉细胞原生质体为受体细胞, 在油桐基因尤其是脂肪酸合成相关基因的功能研究方面更具优势。由于原生质体融合打破了物种的界限, 自1972年首次成功获得第1个体细胞杂种以来(Carlson et al., 1972), 原生质体融合作为一种重要的种质创新手段, 在植物育种中被广泛应用(蔡兴奎等, 2004; 吴紫云等, 2007; 于晓玲等, 2009; 解凯东等, 2014), 因此, 本研究建立的油桐原生质体分离体系为创制和筛选具有优良经济性状的油桐体细胞杂种奠定了基础。
相较于成熟叶片, 以油桐组培苗幼叶为材料不受取材季节限制, 获得的原生质体污染率低, 有利于后续原生质体培养, 因此, 本研究分别以油桐成熟叶片和组培苗幼叶为实验材料进行原生质体分离体系的构建, 从而综合比较各因素对原生质体产量和活性的影响。结果表明, 在最适分离条件下, 油桐幼叶和成熟叶片的原生质体产量无明显差异, 但幼叶原生质体活性要高于成熟叶片原生质体, 这很可能与幼叶酶解时间较短有关。综上所述, 如后续实验以原生质体培养为目的, 建议以油桐组培苗幼叶为材料进行原生质体的分离。
纤维素酶、半纤维素酶、果胶酶和离析酶等酶类均可破坏植物细胞壁结构, 其中纤维素酶和离析酶应用较广(Yoo et al., 2007), 因此, 本研究选用纤维素酶和离析酶分离油桐叶肉细胞原生质体。由实验结果可知, 无论是成熟叶片还是组培苗幼叶, 其最适原生质体分离条件中纤维素酶用量均多于离析酶, 酶解幼叶时纤维素酶用量是离析酶的2倍。另外, 由极差分析可知, 纤维素酶对原生质体产量的影响远大于离析酶。以上结果表明, 相对于离析酶, 纤维素酶在油桐叶肉细胞原生质体分离过程中起主要作用。有研究表明, 除酶浓度外, 酶解时间和溶液渗透压也是原生质体分离的影响因素(Marion et al., 2008)。极差分析结果表明, 无论酶解何种油桐叶片, 酶解时间均为影响原生质体产量的决定因素, 其R(极差)远大于其余3因素的R。另外值得注意的是, 本研究结果表明, 随着酶解时间的增加, 原生质体活力呈现下降趋势。尽管在最适分离条件下, 原生质体产量无明显差异, 但成熟叶片酶解12 h后的原生质体活力要低于幼叶酶解6 h的活力。以上分析表明, 酶解时间对原生质体产量和活性的影响很大。这一结论也可解释以幼叶为材料时最适酶解时间为6 h的原因, 因为酶解时间超过6 h, 幼嫩的幼叶组织细胞将受到酶的不可逆伤害。酶解液中渗透压稳定剂的作用是使细胞壁和原生质体发生质壁分离, 保证原生质体在分离过程中不会膨胀破裂, 从而提高原生质体的产量和活性。虽然可用于原生质体分离的渗透压稳定剂不尽相同, 但甘露醇最为常用, 因此, 本研究选用甘露醇作为渗透压稳定剂。研究发现, 尽管成熟叶片和幼叶的最适酶解液中甘露醇浓度分别为0.6, 0.7 mol ·L-1, 但二者甘露醇浓度的R较小, 这表明在油桐叶片原生质体的分离中, 甘露醇浓度对产量的影响较小。
为了验证油桐原生质体细胞转化方法的可靠性, 本研究以定位于细胞膜的拟南芥MGT6基因为标记基因进行原生质体细胞的转化。观察发现, MGT6-GFP融合蛋白定位于油桐原生质体细胞的细胞膜上, 与前人的定位结果一致, 这表明本研究建立的原生质体分离和转化方法完全可用于油桐的基础研究。另外, 通过原生质体融合技术和转基因原生质体的培养, 本研究成果在种质创新方面也具有重要意义。
4 结论本研究建立的原生质体分离方法可高效地分离油桐成熟叶片和组培苗幼叶的叶肉细胞原生质体, 其中成熟叶片的最适分离条件为纤维素酶浓度1.5%、离析酶浓度1%、甘露醇浓度0.6 mol ·L-1、酶解时间12 h, 幼叶的最适分离条件为纤维素酶浓度2%、离析酶浓度1%、甘露醇浓度0.7 mol ·L-1、酶解时间6 h。考虑到取材的便利性和对后续原生质体培养的影响, 建议以组培苗幼叶为材料分离原生质体。在分离得到油桐叶肉细胞原生质体的基础上, 本研究建立的PEG介导的原生质体遗传转化方法能以油桐叶肉细胞原生质体为受体, 高效地将外源基因导入其中并使外源基因表达。本研究建立的油桐叶肉细胞原生质体分离和遗传转化方法使在油桐体内研究自身基因功能成为可能, 这对油桐的基础研究和种质创新研究具有重要意义。
蔡兴奎, 柳俊, 谢从华. 2004. 马铃薯栽培种与野生种叶肉细胞融合及体细胞杂种鉴定[J]. 园艺学报, 34(5): 623-626. (Cai X K, Liu J, Xie C H. 2004. Mesophyll protoplast fusion of Solanum tuberosum and Solanum chacoense and their somatic hybrid analysis[J]. Acta Horticulturae Sinica, 34(5): 623-626. [in Chinese]) |
陈昊, 谭晓风. 2015. 基于油脂合成期油桐种仁转录组数据的α-亚麻酸代谢途径解析[J]. 林业科学, 51(3): 41-48. (Chen H, Tan X F. 2015. Identification of α-linolenic acid metabolism pathway based on transcriptome data of Vernicia fordii kernels during tung oil synthesis stage[J]. Scientia Silvae Sinicae, 51(3): 41-48. [in Chinese]) |
傅伟昌, 顾小红, 陶冠军, 等. 2008. 桐油脂肪酸组成分析和甘三酯结构判定[J]. 天然产物研究与开发, 20(6): 964-968. (Fu W C, Gu X H, Tao G J, et al. 2008. Analysis of fatty acids and the structure identification of triacylglycerols in tung oil[J]. Natural Product Research and Development, 20(6): 964-968. [in Chinese]) |
刘金龙, 郑小江, 郑威, 等. 2011. 油桐品种五爪桐含油量及桐油质量研究[J]. 湖北农业科学, 50(10): 2031-2035. (Liu J L, Zheng X J, Zheng W, et al. 2011. Study on the oil content and quality of Vernicia fordii cv[J]. five fingernail tung.Hubei Agricultural Sciences, 50(10): 2031-2035. DOI:10.3969/j.issn.0439-8114.2011.10.027 [in Chinese]) |
舒小娟, 温腾建, 邢佳毅, 等. 2015. 葡萄原生质体分离及瞬时转化体系的建立[J]. 西北植物学报, 35(6): 1262-1268. (Shu X J, Wen T J, Xing J Y, et al. 2015. Isolation of protoplast and establishment of transient expression system in grapevine(Vitis vinifera L[J]. ).Acta Botanica Boreali-Occidentalia Sinica, 35(6): 1262-1268. [in Chinese]) |
谭晓风, 蒋桂雄, 谭方友, 等. 2011. 我国油桐产业化发展战略调查研究报告[J]. 经济林研究, 29(3): 1-7. (Tan X F, Jiang G X, Tan F Y, et al. 2011. Research report on industrialization development strategy of Vernicia fordii in Chinese[J]. Nonwood Forest Research, 29(3): 1-7. [in Chinese]) |
吴紫云, 华玉伟, 黄华孙. 2007. 植物微原生质体的融合[J]. 植物生理学报, 43(6): 1182-1188. (Wu Z Y, Hua Y W, Huang H S. 2007. Plant microprotoplast fusion[J]. Plant Physiology Communications, 43(6): 1182-1188. [in Chinese]) |
夏玉凤. 2006. 用于蛋白亚细胞定位研究的烟草愈伤组织培养条件优化[J]. 河北师范大学学报, 30(3): 343-345. (Xia Y F. 2006. Optimizing the tobacco callulas culture condition to study protein subcellular localization[J]. Journal of Hebei Normal University, 30(3): 343-345. [in Chinese]) |
解凯东, 王晓培, 王惠芹, 等. 2014. 以柑橘多胚性二倍体母本倍性杂交培育三倍体[J]. 园艺学报, 41(4): 613-620. (Xie K D, Wang X P, Wang H Q, et al. 2014. High efficient and extensive production of triploid citrus plants by crossing polyembryonic diploids with tetraploids[J]. Acta Horticulturae Sinica, 41(4): 613-620. [in Chinese]) |
于晓玲, 李春强, 彭明. 2009. 植物原生质体技术及其应用[J]. 中国农学通报, 25(8): 22-26. (Yu X L, Li C Q, Peng M. 2009. Advances on the research of protoplast technology[J]. Chinese Agricultural Science Bulletin, 25(8): 22-26. [in Chinese]) |
周丹丹, 俞嘉宁. 2013. 植物细胞中瞬时表达系统的建立及研究进展[J]. 中国农学通报, 29(24): 151-156. (Zhou D D, Yu J N. 2013. The progress of establishing transient expression system in plant cell[J]. Chinese Agricultural Science Bulletin, 29(24): 151-156. [in Chinese]) |
Carlson P S, Smith H H, Dearing R D. 1972. Parasexual interspecific plant hybridization[J]. Proceedings of the National Academy of Sciences of the United States of America, 69(8): 2292-2294. DOI:10.1073/pnas.69.8.2292 |
Chen H, Chen W, Zhou J, et al. 2012. Basic leucine zipper transcription factor OsbZIP16 positively regulates drought resistance in rice[J]. Plant Science, 193/194: 8-17. DOI:10.1016/j.plantsci.2012.05.003 |
Chiu W, Niwa Y, Zeng W, et al. 1996. Engineered GFP as a vital reporter in plants[J]. Current Biology, 6(3): 325-330. DOI:10.1016/S0960-9822(02)00483-9 |
Cocking E C. 1960. A method for the isolation of plant protoplasts and vacuoles[J]. Nature, 187: 962-963. DOI:10.1038/187962a0 |
Edwards G E, Lee S S, Chen T M, et al. 1970. Carboxylation reactions and photosynthesis of carbon compounds in isolated mesophyll and bundle sheath cells of Digitaria sanguinalis(L.) Scop[J]. Biochemical and Biophysical Research Communications, 39(3): 389-395. DOI:10.1016/0006-291X(70)90589-9 |
Hansen L L, van Ooijen G. 2016. Rapid analysis of circadian phenotypes in Arabidopsis protoplasts transfected with a luminescent clock reporter[J]. Journal of Visualized Experiments, (115): 54586. |
Jefferson R A, Bevan M, Kavanagh T. 1987. The use of the Escherichia coli β-glucuronidase as a gene fusion marker for studies of gene expression in higher plants[J]. Biochemical Society Transactions, 15(1): 17-18. DOI:10.1042/bst0150017 |
Liu H, Wei C, Zhong Y, et al. 2007. Rice black-streaked dwarf virus minor core protein P8 is a nuclear dimeric protein and represses transcription in tobacco protoplasts[J]. Febs Letters, 581(13): 2534-2540. DOI:10.1016/j.febslet.2007.04.071 |
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
Luehrsen K R, de Wet J R, Walbot V. 1992. Transient expression analysis in plants using firefly luciferase reporter gene[J]. Methods in Enzymology, 216(1): 397-414. |
Lung S C, Yanagisawa M, Chuong S D. 2011. Protoplast isolation and transient gene expression in the single-cell C4 species, Bienertia sinuspersici[J]. Plant Cell Reports, 30(4): 473-484. DOI:10.1007/s00299-010-0953-2 |
Mao D, Chen J, Tian L, et al. 2014. Arabidopsis transporter MGT6 mediates magnesium uptake and is required for growth under magnesium limitation[J]. Plant Cell, 26(5): 2234-2248. DOI:10.1105/tpc.114.124628 |
Marion J, Bach L, Bellec Y, et al. 2008. Systematic analysis of protein subcellular localization and interaction using high-throughput transient transformation of Arabidopsis seedlings[J]. Plant Journal, 56(1): 169-179. DOI:10.1111/tpj.2008.56.issue-1 |
Ohlrogge J, Browse J. 1995. Lipid biosynthesis[J]. Plant Cell, 7(7): 957-970. DOI:10.1105/tpc.7.7.957 |
Poot-Poot W, Rodas-Junco B A, Muñoz-Sánchez J A, et al. 2016. Protoplasts:a friendly tool to study aluminum toxicity and coffee cell viability[J]. SpringerPlus, 5(1): 1452. DOI:10.1186/s40064-016-3140-2 |
Prasad V V, Naik G R. 2000. Plant protoplast isolation-a practical approach[J]. Biochemical Education, 28(1): 39-40. |
Sheen J. 2001. Signal transduction in maize and Arabidopsis mesophyll protoplasts[J]. Plant Physiology, 127(4): 1466-1475. DOI:10.1104/pp.010820 |
von Arnim A G, Deng X W, Stacey M G. 1998. Cloning vectors for the expression of green fluorescent protein fusion proteins in transgenic plants[J]. Gene, 221(1): 35-43. DOI:10.1016/S0378-1119(98)00433-8 |
Wu F H, Shen S C, Lee L Y, et al. 2009. Tape-Arabidopsis Sandwich-a simpler Arabidopsis protoplast isolation method[J]. Plant Methods, 5: 16. DOI:10.1186/1746-4811-5-16 |
Yang Y, Li R, Qi M. 2000. In vivo analysis of plant promoters and transcription factors by agroinfiltration of tobacco leaves[J]. Plant Journal, 22(6): 543-551. DOI:10.1046/j.1365-313x.2000.00760.x |
Yoo S D, Cho Y H, Sheen J. 2007. Arabidopsis mesophyll protoplasts:a versatile cell system for transient gene expression analysis[J]. Nature Protocols, 2(7): 1565-1572. DOI:10.1038/nprot.2007.199 |
Zhang Z, Boonen K, Ferrari P, et al. 2016. UV crosslinked mRNA-binding proteins captured from leaf mesophyll protoplasts[J]. Plant Methods, 12: 42. DOI:10.1186/s13007-016-0142-6 |
 2018, Vol. 54
2018, Vol. 54

