文章信息
- 王家鸣, 许涵, 李意德, 林明献, 周璋, 骆土寿, 陈德祥
- Wang Jiaming, Xu Han, Li Yide, Lin Mingxian, Zhou Zhang, Luo Tushou, Chen Dexiang
- 地形异质性对尖峰岭热带山地雨林木本植物群落结构及多样性的影响
- Effects of Topographic Heterogeneity on Community Structure and Diversity of Woody Plants in Jianfengling Tropical Montane Rainforest
- 林业科学, 2018, 54(1): 1-11.
- Scientia Silvae Sinicae, 2018, 54(1): 1-11.
- DOI: 10.11707/j.1001-7488.20180101
-
文章历史
- 收稿日期:2016-07-07
- 修回日期:2017-11-24
-
作者相关文章
2. 中国林业科学研究院热带林业研究所试验站 乐东 572542
2. Experimental Station of Research Institute of Tropical Forestry, CAF Ledong 572542
植物群落中不同物种的共存机制是植物群落生态学的核心内容之一(侯继华等, 2002; Chave, 2004; Shea et al., 2004), 也是生物多样性维持的重要研究内容(叶万辉, 2000)。生态学家提出各种各样的理论和假说来解释物种多样性维持机制, 其中中性理论和生态位理论最引人注目。生态位理论认为, 不同物种通过与环境的相互作用, 适应于环境, 受环境因子限制, 通过占有不同资源、时间、空间来实现共存。经纬度、海拔梯度变化及其组合在空间上引发的温度、降水、光照和土壤等众多因素共同影响物种及其多样性的空间分布格局(Ausirheim, 2002; Grytnes et al., 2006)。在某气候区内, 地形导致的环境条件异质性是影响植物空间分布格局的最重要因素(Palmer et al., 1990), 而且森林大样地的研究, 进一步证实了地形对植物空间分布与森林群落结构的影响(Harms et al., 2001; Gunatilleke et al., 2006; Queenborough et al., 2007; Lai et al., 2009; Wang et al., 2009); 基于此平台, 不同学者评估了地形或生境对物种分布与共存的重要性(Chen et al., 2010; Lan et al., 2011)。
景观或群落尺度上, 地形因子是主导植被格局的非地带性环境因子之一(Woodward et al., 1991)。在山区, 地形往往是局部生境温湿度的良好指示, 影响光照、水分和土壤发育, 进而影响不同地形部位地貌和群落的物种构成、结构和动态(Swanson, 1988; Mujuru et al., 2007; Puchi-Manage et al., 2013)。沟谷地形的丰富资源是影响物种多样性的一个重要因素(Gunatilleke et al., 2006; 赖江山, 2008), 这导致一些树种偏好沟谷地形; 光照同样是影响样地内植物分布的主要非生物因子之一(王伟等, 2011), 这导致另外一些树种偏好山脊地形。此外, 喀斯特生境的独特地形地貌导致其优势种大部分为岩溶地区特有树种(王斌等, 2014)。可见, 不同地形条件下植物空间分布及森林群落结构具有明显差异。
尖峰岭是我国保存最为完整的热带原始森林林区之一(李意德, 2012), 属热带北缘类型, 区位条件独特, 是生物多样性研究热点地区, 在该地区已经开展了大量植物群落和生物多样性研究工作(李意德, 1997; 李意德等, 2002; 2006;方精云等, 2004; 许涵等, 2009; 2015a;吴裕鹏等, 2014; Xu et al., 2015)。研究指出, 依据最小取样面积建立的森林植被样地并不能全面反映热带山地雨林的群落结构特征(李意德, 1997), 基于更大面积的长期森林动态监测样地探讨热带山地雨林的群落结构特征、物种空间分布和物种多样性共存机制具有重要意义(Condit et al., 2006)。许涵等(2015a)对尖峰岭热带山地雨林60 hm2动态监测样地的群落结构特征进行了探讨, 为本研究提供了背景资料。本研究基于尖峰岭热带山地雨林60 hm2大样地, 探讨不同地形生境类型下的群落结构特征差异, 评估尖峰岭60 hm2大样地中物种与地形的关联性及其对物种共存的影响, 以期为进一步揭示热带森林物种的分布与共存规律提供科学依据并指导生产实践。
1 研究区概况尖峰岭位于海南岛西南部, 总面积约640 km2, 包括尖峰岭林区及其周边地区。尖峰岭林区内的热带山地雨林是我国现有面积较大、保存较完整的热带原始森林。本研究所在区域位于尖峰岭林区的尖峰岭国家级自然保护区内(108°44′—109°02′E, 18°23′—18°52′N)。距离大样地约4 km处的自动气象观测站26年观测数据显示(站区海拔820 m), 尖峰岭热带山地雨林年均气温19.8 ℃, 年均降水量2 449.0 mm, 年均空气相对湿度88.67%(周璋等, 2009), 干湿两季明显。尖峰岭国家级自然保护区内保存有大量未经破坏的原始热带雨林, 其中热带山地雨林分布于海拔600~1 200 m的山地丘陵, 其生境异质性较高, 物种组成丰富, 结构复杂, 板根现象普遍, 寄生和附生植物较多(吴裕鹏等, 2014)。土壤类型为砖黄壤和黄壤, 土壤水分和腐殖质含量高(蒋有绪等, 1991; 李意德等, 2002)。
2 研究方法 2.1 样地设置及调查尖峰岭热带山地雨林60 hm2大样地按照美国史密森热带研究所热带森林研究中心(Center for Tropical Forest Science, CTFS)的调查技术规范建设, 样地东西长1 000 m, 南北宽600 m, 将整个样地划分为1 500块20 m×20 m样地。大样地分布于海拔866.3~1 016.7 m处, 大样地西南角较平缓, 整体地势为向东北角陡峭的山脊逐渐过渡抬升。对每块20 m × 20 m样地内胸径≥1.0 cm的乔灌木逐一挂标签, 记录该植株的坐标、名称、胸径、树高和生存状态; 首次植物本底调查于2010年年底开始, 2012年底完成。调查结果表明, 样地内共记录到439 676株胸径≥1.0 cm的存活乔灌木植株, 其中除61个植株未确定种名外, 其他植株分属于62科155属290种(许涵等, 2015a)。
2.2 数据处理样地平均海拔是样地4个顶点海拔的平均值; 从样地4个顶点取3个顶点组成一个平面, 可以组成4个不同的平面, 这4个平面与样地投影面夹角的平均值就是样地的坡度; 样地的凹凸度为样地平均海拔减去与该样地相邻的8块样地平均海拔的平均值, 处于大样地边缘的样地凹凸度为样地中心的海拔减去4个顶点海拔的平均值(Harms et al., 2001; Debski et al., 2002)。通过对大样地的平均海拔、坡度和凹凸度进行C-均值模糊聚类(fuzzy C-mean clustering)分析(宫贵权等, 2007; Bezdek, 1981), 划分大样地不同的地形生境类型。
以大样地内调查到的290种439 615株存活的胸径≥1.0 cm的乔灌木植株为研究对象, 比较分析不同生境中群落的物种组成、物种丰富度和植株密度等(Gunatilleke et al., 2006; 赖江山, 2008)。
利用目前常用的检验物种与生境关联的方法—Torus转换检验法(Harms et al., 2001; Gunatilleke et al., 2006;Lai et al., 2009; 王伟等, 2011; 郭屹立等, 2015)对大样地内胸径≥1.0 cm的独立植株(不计算萌生植株)且种群个体数量大于60的230种常见木本植物进行物种与地形关联性分析。
Torus转换检验法与常规方法(如卡方检验)不同, 其优点在于能够排除生境和物种分布的空间自相关, 从而使检验更加敏感(Harms et al., 2001)。该方法主要通过比较实际生境图和模拟生境图上物种在各类生境中的相对多度来确定物种与生境的关联程度。物种在模拟生境图上相对多度的获取方法是保持生境不变, 将叠加于生境图上的物种作平移。这些相对多度值从小到大组成一个排序轴, 若某物种在某生境中的实际相对多度处于最大的2.5%区间内, 则认为该物种与这类生境正相关; 反之, 若实际相对多度处于最小的2.5%区间内, 则认为物种与生境负相关。本研究选用Comita等(2007)改进的Torus转换检验法检测每个物种与生境的相关性。
用与地形负相关的物种平均数占被检测物种总数比例表示地形异质性贡献率(Harms et al., 2001; 赖江山, 2008), 以评估地形对物种分布与共存的贡献。
所有统计分析均在Excel 2010、R 2.15.3软件中进行, 辅以ArcMap 10.2软件作图。
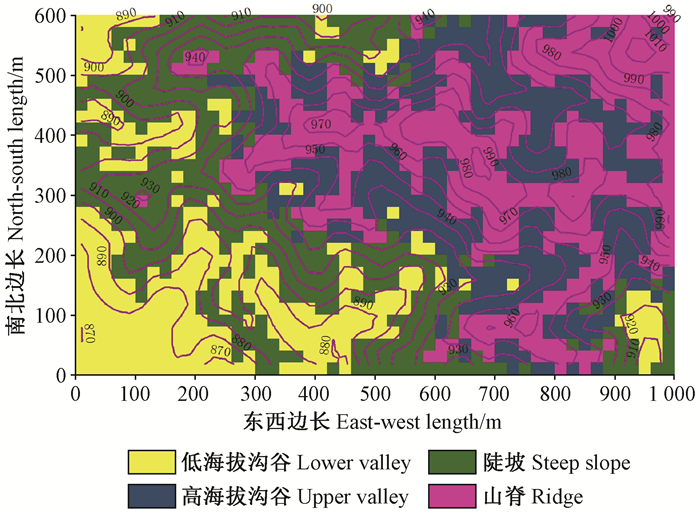
3 结果与分析 3.1 4类地形物种组成和群落结构差异本研究中, 将整个样地划分为低海拔沟谷、陡坡、高海拔沟谷、山脊4类地形(图 1), 4类地形特征及样地数见表 1。
|
图 1 60 hm2大样地等高线与生境 Figure 1 Contour map with 10 m intervals and topography groups of the 60 hm2 big sample plot |
|
|
4类地形中低海拔沟谷面积最小为12.6 hm2, 但其物种丰富度最高, 为274;陡坡面积最大, 为16.68 hm2, 物种丰富度为269, 位于其次; 高海拔沟谷与山脊面积分别为15.08和15.64 hm2, 物种丰富度分别为264与267(表 2)。
|
|
由表 2可知, 整体植株密度表现为山脊>陡坡>大样地>低海拔沟谷>高海拔沟谷, 分别为8 734, 7 721, 7 327, 6 551和6 079株·hm-2; 山脊各径级植株密度都最大, 陡坡次之; 胸径≤10 cm时, 高海拔沟谷植株密度小于低海拔沟谷; 胸径≥10 cm时, 低海拔沟谷植株密度小于高海拔沟谷。
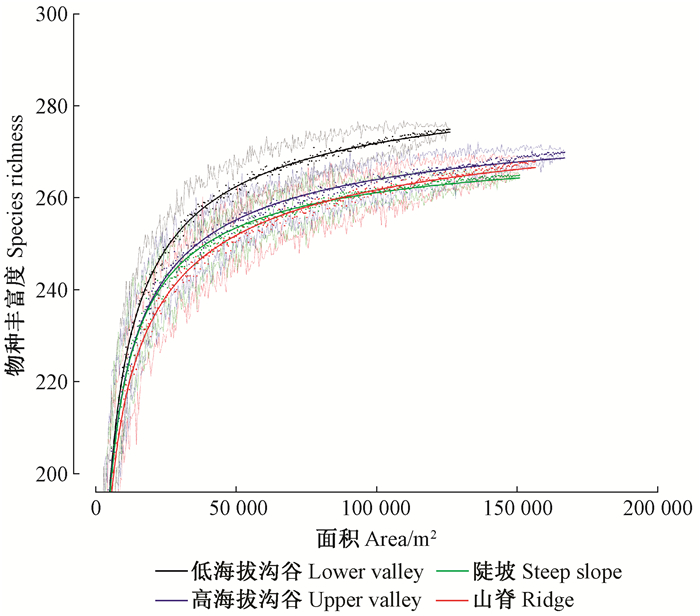
种-面积曲线表明, 随着取样面积增加, 同等面积条件下, 低海拔沟谷的物种丰富度始终最大, 其他3类地形物种丰富度基本处于陡坡类型估计值的±1.96×SE置信区间内, 三者种-面积曲线相差不大(图 2)。
|
图 2 4类地形种-面积曲线(虚线表示估计值在±1.96×SE的变化范围) Figure 2 Cumulative species-area relationships of four topography (the dotted lines indicated the expected values ±1.96×SE) |
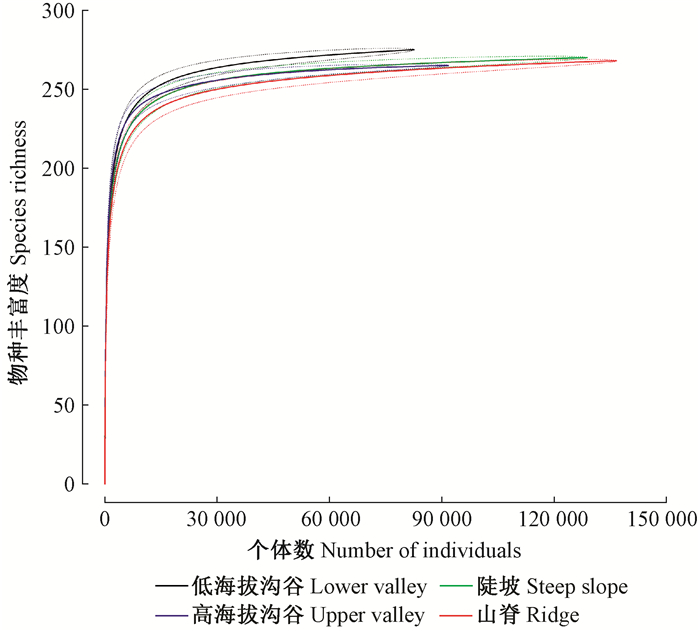
种-个体数累积曲线表明, 随着个体数增加, 低海拔沟谷物种丰富度的累积速率最大, 陡坡和高海拔沟谷的物种丰富度基本处于陡坡类型估计值的±1.96×SE置信区间内, 二者种-个体数累积曲线相差不大, 山脊类型物种丰富度随个体数增加的累积速率最小(图 3)。
|
图 3 4类地形种-个体数累积曲线 Figure 3 Cumulative species-individual relationships of four topography (虚线表示估计值在±1.96×SE的变化范围) (the dotted lines indicated the expected values ±1.96×SE) |
表 3表明, 1~5 cm胸径级植株数占总植株数的比例表现为低海拔沟谷明显大于其他3类地形; 30~40和40~50 cm胸径级植株数占总植株数的比例均表现为高海拔沟谷>陡坡>山脊>低海拔沟谷; ≥50 cm胸径级植株数占总植株数的比例表现为低海拔沟谷>高海拔沟谷>陡坡>山脊。
|
|
表 4表明, 低海拔沟谷中重要值最大的前3个物种为白颜树(Gironniera subaequalis)、柏拉木(Blastus cochinchinesis)和大叶蒲葵(Livistona saribus), 尤其是柏拉木重要值排在第2位, 相对密度排在第1位。其他3类地形中重要值最大的前3个物种均为大叶蒲葵、白颜树和厚壳桂(Cryptocarya chinensis)。低海拔沟谷与高海拔沟谷中重要值最大的前10个物种有9个相同, 说明2类沟谷地形群落结构较为一致; 陡坡与山脊中重要值最大的前10个物种有9个相同, 说明陡坡与山脊群落结构较为一致。
|
|
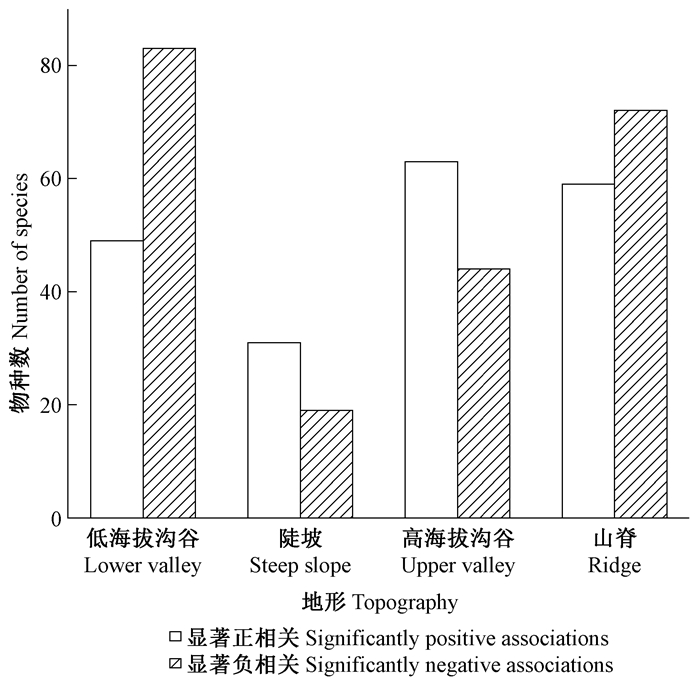
Torus转换检验结果表明, 230个常见物种(独立植株数目>60)在4类地形中共产生920个相关关系。这些相关关系中, 有203个物种发生了420个显著相关关系(P < 0.05), 其中显著正相关202个, 显著负相关218个。换言之, 203个物种至少与1类地形存在显著相关(P < 0.05), 剩下的27个物种并未与4类地形中的任何一类显著相关。而在这27个物种中, 厚壳桂独立植株数量最多, 为12 238株; 九节其次, 为12 024株; 长柄山龙眼(Helicia longipetiolata)的数量为2 500株, 居于第3位。检验结果也表明, 与4类地形显著相关的物种数明显不同。在正相关的检测结果中, 高海拔沟谷>陡坡>山脊>低海拔沟谷; 在负相关的检测结果中, 陡坡>山脊>高海拔沟谷>低海拔沟谷(图 4)。另外, 与某类地形正相关的物种并不完全与其他地形负相关, 大部分物种对其他地型相关性表现为中性, 并非完全排斥其他3类地形。
|
图 4 与4类地形显著相关的物种数 Figure 4 Number of species significantly associated with each of four topographies |
4类地形中重要值前10的物种共有15种, 其与地形的相关性见表 5。厚壳桂、海南蕈树和九节与4类地形中任何一类均无显著相关(P>0.05), 变色山槟榔与低海拔沟谷、高海拔沟谷2种地形显著正相关(P < 0.05), 其他物种均仅与1类地形显著正相关(P < 0.05)。
|
|
尖峰岭60 hm2大样地中与低海拔沟谷、陡坡、高海拔沟谷和山脊负相关的物种数分别为83、19、44和72。以与4类地形负相关的物种平均数占被检测物种总数的比例表示地形异质性贡献率, 发现60 hm2大样地中地形异质性对物种分布与共存的贡献率为23.7%。
4 讨论 4.1 不同地形间群落结构和物种组成差异低海拔沟谷面积最小, 物种丰富度最高, 是由于该地形条件下环境异质性强, 拥有足够多的种源, 能为更多的物种提供定居的生态位(卜文圣, 2013), 但与该生境负相关的物种数最多, 表明适宜生存的物种数最少, 且低海拔沟谷植株密度较小, 这是由于:1)低海拔沟谷地势低洼, 大量降雨容易形成溪流和沟壑, 减少了部分不耐水湿条件植物的生长空间(Daws et al., 2002; Punchi-Manage et al., 2013); 2)土壤透气性差, 抑制了植物生长(郭屹立等, 2016); 3)光照条件较弱, 植物群落接受光合有效辐射的时间可能短于其他地形(Körner, 2007; 黄甫昭等, 2014; 2016)。低海拔沟谷更大比例超大径级植株(DBH≥50 cm)的遮挡, 导致群落中下层光照资源更为缺乏, 荫生小径级物种由于耐荫性, 在该生境中重要值和植株数比例比其他生境大, 因而植株平均胸径在4类地形中最小。
高海拔沟谷内植株平均胸径最大, 可能原因是该地形内水热条件较好, 且沟壑数量少于低海拔沟谷, 而光照条件优于低海拔沟谷(Körner, 2007; 黄甫昭等, 2014), 土壤N, P, K含量较高(许涵等, 2015b)。整体植株密度最小, 原因是大径级植株比例大, 群落上层郁闭度高, 小型植物生长困难。这也说明光照、土壤、水热资源共同发挥着作用。
在海南热带山地雨林气候区, 水分等限制性资源在非沟谷地形内并不是主要的限制因子(王伟等, 2011)。山脊植株密度各径级都最大, 原因是该地形内光照条件充足, 且该地形凹凸度较大, 从而加大了植株生存的表面积。
陡坡各径级植株密度也明显大于2类沟谷地形, 山脊陡坡阳生树种更丰富(Hoover et al., 2012; Lin et al., 2012), 说明在尖峰岭60 hm2大样地中光照可能是影响植物分布的另一个关键环境因子。
种-面积曲线显示山脊物种丰富度低, 可能原因是其内部环境异质性较弱, 生境限制性高; 流水或风力作用导致植物种子迁移至沟谷或山下, 山顶种源较少(Jiao et al., 2009; 沈泽昊等, 2004)。而高海拔沟谷物种数目少, 说明该地形内影响群落物种丰富度的环境因子较为复杂。
许涵等(2015b)在该大样地中的研究发现, 有些物种的空间分布与土壤有效氮的养分供给紧密相关, 另外一些物种(如海南蕈树)的空间分布似乎受其他因素影响。这表明尖峰岭60 hm2大样地中光照可能是影响其植物分布的限制性环境因子之一, 水热资源、土壤等多种环境因子共同发挥了作用。
4.2 样地木本植物与地形生境的关联性在地形比较平坦的巴拿马BCI 50 hm2大样地(海拔高差38 m)中, Harms等(2001)利用Torus转换检验, 发现64%的常见种至少与1类地形存在显著相关。在海拔高差达151 m的斯里兰卡25 hm2 Sinharaja样地, 同样通过Torus转换检验, 发现79%的物种与至少1类地形存在显著相关。在地形复杂的古田山24 hm2样地(海拔高差达268 m), 赖江山(2008)利用Torus转换检验, 发现83.3%的常见种与地形存在显著相关。王伟等(2011)发现百山祖5 hm2样地(海拔高差123 m)中, 39%的物种与地形存在显著相关。比较这些样地的地形条件, 可以发现地形越复杂, 物种与地形关联比例越大; 同时样地面积也可能会影响物种生境关联的研究。
本研究应用Torus转换检验法对尖峰岭60 hm2样地中胸径≥1 cm的独立植株且个体数量大于60的物种与地形的相关性进行检验, 发现被检验的230个物种中, 与地形相关的物种有203种, 即高达88.3%的物种与至少1类地形存在显著相关。尽管尖峰岭样地的海拔高差比古田山样地小, 与Sinharaja、Lambir样地相当, 并非地形条件最复杂的样地, 但物种与地形相关比例却大于其他样地, 主要原因可能是尖峰岭样地具有更大的面积, 因而具有更为复杂的地形。植被群落属于原始林, 与次生林相比, 物种经过更长时间的环境适应, 生态位分化更加明显(Letcher et al., 2012; Jiao et al., 2012), 不同物种更多地生存于各自有利的地形条件中, 这导致物种与地形具有更高的相关性。
Torus转换检验是较为保守的物种生境关联性检验方法, 可以推断大部分尖峰岭热带山地雨林中的常见树种, 具有明显的生境生态位分化特征。
4.3 物种地形关联与物种共存Harms等(2001)认为如果某物种与某类生境负相关, 代表该物种不能在该生境中长期生存, 正相关或中性则代表物种能在该生境中长期生存。基于此, Harms认为BCI样地中与沼泽(swamp)生境负相关的物种数虽然最多, 但若BCI样地仅由沼泽(swamp)生境组成, 其群落物种减少数占被检测物种总数的比例却很小, 因此生境异质性对BCI样地物种多样性维持的贡献率很小。赖江山(2008)据此采用与生境负相关的平均物种数占被检测物种总数的比例评估了古田山样地内物种生境关联对物种共存的贡献, 认为古田山24 hm2样地中地形导致的生境异质性对物种共存的贡献率为19.6%。
本研究采用同样方法, 发现尖峰岭60 hm2大样地中地形导致的生境异质性对物种分布与共存贡献率为23.7%, 说明尖峰岭大样地中地形是影响植物分布的一个重要因素。梁爽(2014)研究该大样地3个主要优势种的空间分布, 也发现了相同规律。本研究结果同样具有应用价值, 如在恢复热带山地雨林植被、改造或营建混交林时, 可以根据不同物种对地形的关联性, 在不同的地形条件下选择不同的物种组合。
但是由于本研究在分析中只考虑了地形因素对物种分布的影响, 可能低估了生境异质性在热带雨林中的作用。如果考虑光照、土壤、水分等其他环境因子, 生态位理论或许能更好地解释物种的共存机制。因此, 下一步研究可以继续探索光照、水分、土壤等其他环境因子对群落物种空间分布的影响。
5 结论本研究以地形因素为主线, 对热带山地雨林木本植物物种多样性的维持机制进行研究, 发现尖峰岭60 hm2大样地中不同地形条件下木本植物群落结构及其多样性具有较大差异, 4类地形显著相关的物种数明显不同。地形是影响该大样地中植物分布的一个重要因素, 其生境异质性对物种分布与共存的贡献率为23.7%, 与其他影响因素如光照、水分、土壤等多种环境因子共同发挥作用。大部分热带山地雨林森林群落具有生境特化的特性, 本研究结果同样具有其应用价值, 如在恢复热带山地雨林植被、改造或营建混交林时, 可以根据物种与地形的关联性, 在不同的地形条件下选择不同的物种组合, 更好地进行群落配置, 以达到更大的生态效益和经济效益。
卜文圣. 2013. 海南岛热带天然林生物多样性与生态系统功能关系的研究. 北京: 中国林业科学研究院博士学位论文. (Bu W S. 2013. The relationships between biodiversity and ecosystem functioning in natural tropical forests of Hainan Island, China. Beijing: PhD thesis of Chinese Academy of forestry. [in Chinese]) |
方精云, 李意德, 朱彪, 等. 2004. 海南岛尖峰岭山地雨林的群落结构, 物种多样性以及在世界雨林中的地位[J]. 生物多样性, 12(1): 29-43. (Fang J Y, Li Y D, Zhu B, et al. 2004. Community structures and species richness in the montane rain forest of Jianfengling, Hainan Island, China[J]. Biodiversity Science, 12(1): 29-43. [in Chinese]) |
宫贵权, 程积民, 米湘成, 等. 2007. 古田山常绿阔叶林木本植物与生境的相关性[J]. 中国水土保持科学, 5(3): 79-83. (Gong G Q, Cheng J M, Mi X C, et al. 2007. Habitat associations of wood species in the Gutianshan subtropical broad-leaved evergreen forest[J]. Science of Soil and Water Conservation, 5(3): 79-83. [in Chinese]) |
郭屹立, 王斌, 向悟生, 等. 2016. 喀斯特季节性雨林木本植物胸高断面积分布格局及其对地形因子的响应[J]. 生物多样性, 24(1): 30-39. (Guo Y L, Wang B, Xiang W S, et al. 2016. Responses of spatial pattern of woody plants' basal area to topographic factors in a tropical karst seasonal rainforest in Nonggang, Guangxi, southern China[J]. Biodiversity Science, 24(1): 30-39. DOI:10.17520/biods.2015207 [in Chinese]) |
郭屹立, 王斌, 向悟生, 等. 2015. 弄岗北热带喀斯特季节性雨林15 hm2样地木本植物萌生特征[J]. 生态学杂志, 34(4): 955-961. (Guo Y L, Wang B, Xiang W S, et al. 2015. Sprouting characteristics of tree species in the 15-hm2 plot of northern tropical seasonal rain forest in Nonggang, Guangxi, Southern China[J]. Chinese Journal of Ecology, 34(4): 955-961. [in Chinese]) |
侯继华, 马克平. 2002. 植物群落物种共存机制的研究进展[J]. 植物生态学报, 26(增刊): 1-8. (Hou J H, Ma K P. 2002. On mechanisms of species coexistence in plant communities[J]. Acta Phytoecological Sinica, 26(Suppl): 1-8. [in Chinese]) |
黄甫昭, 丁涛, 李先琨, 等. 2016. 弄岗喀斯特季节性雨林不同群丛物种多样性随海拔的变化[J]. 生态学报, 36(14): 1-9. (Huang F Z, Ding T, Li X K, et al. 2016. Species diversity for various associations along an altitudinal gradient in the Karst seasonal rainforest in Nonggang[J]. Acta Ecologica Sinica, 36(14): 1-9. [in Chinese]) |
黄甫昭, 王斌, 丁涛, 等. 2014. 弄岗北热带喀斯特季节性雨林群丛数量分类及与环境的关系[J]. 生物多样性, 22(2): 157-166. (Huang F Z, Wang B, Ding T, et al. 2014. Numerical classification of associations in a northern tropical karst seasonal rain forest and the relationships of these associations with environmental factors[J]. Biodiversity Science, 22(2): 157-166. [in Chinese]) |
蒋有绪, 卢俊培. 1991. 中国海南岛尖峰岭热带林生态系统[M]. 北京: 科学出版社: 18-199. (Jiang Y X, Lu J P. 1991. Forest Ecosystem of Tropical Forest of Jianfengling Mountain, Hainan Island[M]. Beijing: Science Press: 18-199. [in Chinese]) |
赖江山. 2008. 古田山常绿阔叶林物种生境关联及其对物种共存的贡献. 北京: 中国科学研究院博士学位论文. (Lai J S. 2008. Species habitat associations and species coexistence on evergreen broadleaved forest in Gutianshan, Zhejiang. Beijing: PhD thesis of the Chinese Academy of Sciences. [in Chinese]) |
李意德. 1997. 海南岛尖峰岭热带山地雨林的群落结构特征[J]. 热带亚热带植物学报, 5(1): 18-26. (Li Y D. 1997. Community characteristics of tropical mountain rain forest in Jianfengling, Hainan Island[J]. Journal of Tropical and Subtropical Botany, 5(1): 18-26. [in Chinese]) |
李意德, 陈步峰, 周光益. 2002. 中国海南岛热带森林及其生物多样性保护研究[M]. 中国林业出版社: 37-95. (Li Y D, Chen B F, Zhou G Y, et al. 2002. Research and conservation of tropical forest and the biodiversity:a special reference to Hainan Island, China[M]. China Forestry Publishing House: 37-95. [in Chinese]) |
李意德, 方洪, 罗文, 等. 2006. 海南尖峰岭国家级保护区青皮林资源与乔木层群落学特征[J]. 林业科学, 42(1): 1-6. (Li Y D, Fang H, Luo W, et al. 2006. The resource and community characteristics of Vatica mangachapoi forest in Jianfengling National Nature Reserve, Hainan Island[J]. Scientia Slivae Sinicae, 42(1): 1-6. [in Chinese]) |
李意德, 许涵, 罗土寿, 等. 2012. 海南尖峰岭站生物物种数据集//中国生态系统定位观测与研究数据集.森林生态系统卷[M]. 北京: 中国农业出版社: 330-347. (Li Y D, Xu H, Luo T S, et al. 2012. Permanent monitoring and research dataset of Chinese ecosystem:forest ecosystem. Jianfengling Station.Bio-species checklist[M]. Beijing: Chinese Agriculture Press: 330-347. [in Chinese]) |
梁爽. 2014. 海南尖峰岭热带山地雨林主要优势种空间分布格局研究. 广州: 华南农业大学硕士学位论文. (Liang S. 2014. The spatial pattern distribution of main dominant species in tropical montane rainforest of Jianfengling, Hainan Island, China. Guangzhou: MS thesis of South China Agriculture University. [in Chinese]) |
沈泽昊, 吕楠, 赵俊. 2004. 山地常绿落叶阔叶混交林种子雨的地形格局[J]. 生态学报, 24(9): 1981-1987. (Shen Z H, Lü N, Zhao J. 2004. The topographic pattern of seed rain of a mountain mixed evergreen and deciduous forest community[J]. Acta Ecologica Sinica, 24(9): 1981-1987. [in Chinese]) |
王斌, 黄俞淞, 李先琨, 等. 2014. 弄岗北热带喀斯特季节性雨林15 ha监测样地的树种组成与空间分布[J]. 生物多样性, 22(2): 141-156. (Wang B, Huang Y S, Li X K., et al. 2014. Species composition and spatial distribution of a 15 ha northern tropical karst seasonal rain forest dynamics study plot in Nonggang, Guangxi, southern China[J]. Biodiversity Science, 22(2): 141-156. [in Chinese]) |
王伟, 骆争荣, 周荣飞, 等. 2011. 百山祖常绿阔叶林木本植物的生境相关性分析[J]. 生物多样性, 19(2): 134-142. (Wang W, Luo Z R, Zhou R F, et al. 2011. Habitat associations of woody plant species in Baishanzu subtropical broad-leaved evergreen forest[J]. Biodiversity Science, 19(2): 134-142. [in Chinese]) |
吴裕鹏, 许涵, 李意德, 等. 2014. 海南尖峰岭热带山地雨林不同空间尺度和径级水平的物种丰富度与个体密度关联[J]. 植物生态学报, 38(4): 325-333. (Wu Y P, Xu H, Li Y D, et al. 2014. Associations between species richness and individual densities of varying spatial scales and diameter classifications in tropical montane rainforest in Jianfengling, Hainan Island, China[J]. Chinese Journal of Plant Ecology, 38(4): 325-333. [in Chinese]) |
许涵, 李意德, 林明献, 等. 2015a. 海南尖峰岭热带山地雨林60 ha动态监测样地群落结构特征[J]. 生物多样性, 23(2): 192-201. (Xu H, Li Y D, Lin M X, et al. 2015a. Community characteristics of a 60 ha dynamics in the tropical montane forest in Jianfengling, Hainan Island[J]. Biodiversity Science, 23(2): 192-201. [in Chinese]) |
许涵, 李意德, 骆土寿, 等. 2015b. 海南尖峰岭热带山地雨林-群落特征、树种及其分布格局[M]. 北京: 中国林业出版社: 15-48. (Xu H, Li Y D, Luo T S, et al. 2015b. Jianfengling tropical mountain rain forest dynamic plot:community characteristics, tree species and their distribution patterns[M]. Beijing: China Forestry Publishing House: 15-48. [in Chinese]) |
许涵, 李意德, 骆土寿, 等. 2009. 尖峰岭热带山地雨林不同更新林的群落特征[J]. 林业科学, 45(1): 14-20. (Xu H, Li Y D, Luo T S, et al. 2009. Community structure characteristics of tropical montane rain forests with different regeneration types in Jianfengling[J]. Scientia Slivae Sinicae, 45(1): 14-20. DOI:10.11707/j.1001-7488.20090103 [in Chinese]) |
叶万辉. 2000. 物种多样性与植物群落的维持机制[J]. 生物多样性, 8(1): 17-24. (Ye W H. 2000. The maintenance of plant community and its species diversity[J]. Chinese Biodiversity, 8(1): 17-24. [in Chinese]) |
周璋, 李意德, 林明献, 等. 2009. 海南岛尖峰岭热带山地雨林区26年的气候变化特征-光、水和风因子[J]. 生态学报, 29(3): 1112-1120. (Zhou Z, Li Y D, Lin M X, et al. 2009. Climate changes characteristics over tropical mountain rainforest in Jianfengling during the recent 26 years:radiation, moisture, and wind factors[J]. Acta Ecologica Sinica, 29(3): 1112-1120. [in Chinese]) |
Austrheim G. 2002. Plant diversity patterns in semi-natural grasslands along an elevational gradient in southern Norway[J]. Plant Ecology, 161(2): 193-205. DOI:10.1023/A:1020315718720 |
Bezdek J C. 1981. Pattern recognition with fuzzy objective function algorithms[M]. New York: Plenum Press: 15-235.
|
Chave J. 2004. Neutral theory and community ecology[J]. Ecology Letters, 7(3): 241-253. DOI:10.1111/ele.2004.7.issue-3 |
Chen L, M X C, Comita L S, et al. 2010. Community-level consequences of density dependence and habitat association in a subtropical broad-leaved forest[J]. Ecology Letters, 13(6): 695-704. DOI:10.1111/j.1461-0248.2010.01468.x |
Comita L S, Condit R, Hubbell S P. 2007. Developmental changes in habitat associations of tropical trees[J]. Journal of Ecology, 95(3): 482-492. DOI:10.1111/jec.2007.95.issue-3 |
Condit R, Ashton P, Bunyavejchewin S, et al. 2006. The importance of demographic niches to tree diversity[J]. Science, 313(5783): 98-101. DOI:10.1126/science.1124712 |
Daws M I, Mullins C E, Burslem D F R P, et al. 2002. Topographic position affects the water regime in a semideciduous tropical forest in Panama[J]. Plant and Soil, 238(1): 79-89. DOI:10.1023/A:1014289930621 |
Debski I, Burslem D F R P, Palmiotto P A, et al. 2002. Habitat preferences of Aporosa in two Malaysian forests:implications for abundance and coexistence[J]. Ecology, 83(7): 2005-2018. DOI:10.1890/0012-9658(2002)083[2005:HPOAIT]2.0.CO;2 |
Grytnes J A, Heegaard E, Ihlen P G. 2006. Species richness of vascular plants, bryophytes, and lichens along an altitudinal gradient in western Norway[J]. Acta Oecologica, 29(3): 241-246. DOI:10.1016/j.actao.2005.10.007 |
Gunatilleke C V S, Gunatilleke I, Esufali S, et al. 2006. Species-habitat associations in a Sri Lankan Dipterocarp forest[J]. Journal of Tropical Ecology, 22(4): 371-384. DOI:10.1017/S0266467406003282 |
Harms K E, Condit R, Hubbell S P, et al. 2001. Habitat associations of trees and shrubs in a 50-ha Neotropical forest plot[J]. Journal of Ecology, 89(6): 947-959. DOI:10.1111/jec.2001.89.issue-6 |
Hoover C M, Leak W B, Keel B G. 2012. Benchmark carbon stocks from old-growth forests in northern New England, USA[J]. Forest Ecology and Management, 266: 108-114. DOI:10.1016/j.foreco.2011.11.010 |
Jiao J, Zhang Z, Bai W, et al. 2012. Assessing the ecological success of restoration by afforestation on the Chinese Loess Plateau[J]. Restoration Ecology, 20(2): 240-249. DOI:10.1111/rec.2012.20.issue-2 |
Jiao J, Zou H, Jia Y, et al. 2009. Research progress on the effects of soil erosion on vegetation[J]. Acta Ecologica Sinica, 29(2): 85-91. DOI:10.1016/j.chnaes.2009.05.001 |
Körner C. 2007. The use of 'altitude' in ecological research[J]. Trends in Ecology and Evolution, 22(11): 569-574. DOI:10.1016/j.tree.2007.09.006 |
Lai J, Mi X, Ren H, et al. 2009. Species-habitat associations change in a subtropical forest of China[J]. Journal of Vegetation Science, 20(3): 415-423. DOI:10.1111/jvs.2009.20.issue-3 |
Lan G, Hu Y, Cao M, et al. 2011. Topography related spatial distribution of dominant tree species in a tropical seasonal rain forest in China[J]. Forest Ecology and Management, 262(8): 1507-1513. DOI:10.1016/j.foreco.2011.06.052 |
Letcher S G, Chazdon R L, Andrade A C S, et al. 2012. Phylogenetic community structure during succession:evidence from three Neotropical forest sites[J]. Perspectives in Plant Ecology, Evolution and Systematics, 14(2): 79-87. DOI:10.1016/j.ppees.2011.09.005 |
Lin D, Lai J, Muller-Landau H C, et al. 2012. Topographic variation in aboveground biomass in a subtropical evergreen broad-leaved forest in China[J]. Plos One, 7(10): e48244. DOI:10.1371/journal.pone.0048244 |
Mujuru L, Kundhlande A. 2007. Small-scale vegetation structure and composition of chirinda forest, southeast Zimbabwe[J]. African Journal of Ecology, 45(4): 624-632. DOI:10.1111/aje.2007.45.issue-4 |
Palmer M W, Dixon P M. 1990. Small-scale environmental heterogeneity and the analysis of species distributions along gradients[J]. Journal of Vegetation Science, 1(1): 57-65. DOI:10.2307/3236053 |
Punchi-Manage R, Getzin S, Wiegand T, et al. 2013. Effects of topography on structuring local species assemblages in a Sri Lankan mixed dipterocarp forest[J]. Journal of Ecology, 101(1): 149-160. DOI:10.1111/jec.2012.101.issue-1 |
Queenborough S A, Burslem D F R P, Garwood N C, et al. 2007. Habitat niche partitioning by 16 species of Myristicaceae in Amazonian Ecuador[J]. Plant Ecology, 192(2): 193-207. DOI:10.1007/s11258-007-9328-3 |
Shea K, Roxburgh S H, Rauschert E S J. 2004. Moving from pattern to process:coexistence mechanisms under intermediate disturbance regimes[J]. Ecology Letters, 7(6): 491-508. DOI:10.1111/ele.2004.7.issue-6 |
Swanson F J, Kratz T K, Caine N, et al. 1988. Landform effects on ecosystem patterns and processes[J]. Bioscience, 38(2): 92-98. DOI:10.2307/1310614 |
Wang Z, Ye W, Cao H, et al. 2009. Species-topography association in a species-rich subtropical forest of China[J]. Basic and Applied Ecology, 10(7): 648-655. DOI:10.1016/j.baae.2009.03.002 |
Woodward F I, McKee I F. 1991. Vegetation and climate[J]. Environment International, 17(6): 535-546. DOI:10.1016/0160-4120(91)90166-N |
Xu H, Detto M, Fang S, et al. 2015. Habitat hotspots of common and rare tropical species along climatic and edaphic gradients[J]. Journal of Ecology, 103(5): 1325-1333. DOI:10.1111/1365-2745.12442 |
 2018, Vol. 54
2018, Vol. 54

