文章信息
- 陈倩, 陈京环, 王堃, 蒋建新, 孙润仓
- Chen Qian, Chen Jinghuan, Wang Kun, Jiang Jianxin, Sun Runcang
- 热水预处理生物质原料及其生物转化研究进展
- Research Progress on the Hydrothermal Pretreatment of Lignocellulosic Biomass and Its Bioconversion
- 林业科学, 2017, 53(9): 97-104.
- Scientia Silvae Sinicae, 2017, 53(9): 97-104.
- DOI: 10.11707/j.1001-7488.20170912
-
文章历史
- 收稿日期:2016-04-05
- 修回日期:2016-06-20
-
作者相关文章
2. 中国制浆造纸研究院 北京 100102
2. China National Pulp and Paper Research Institute Beijing 100102
化石能源使人们生活发生了翻天覆地的变化,人们对能源的消耗也越来越多,交通运输、制造业、电力等部门都在消耗大量能源。对化石能源的高度依赖,不仅使能源逐渐短缺,而且对环境造成了负面影响。随着化石能源的枯竭以及面临的全球变暖问题,人们开始寻求新型环保能源,其中使用生物质转化为乙醇是目前最受人们关注的生产液体燃料的方法。基于木质纤维生物质来源广、成本低等特点,使用这类原料制备生物乙醇的研究已经取得了很大进展(李文等,2009);然而,目前乙醇的生产技术还不能满足市场要求,大规模地生产乙醇燃料需要新的思路。
木质生物质转化为乙醇主要包括4个步骤:1) 木质生物质的预处理;2) 纤维素经酶水解转化为葡萄糖;3) 将葡萄糖发酵转化为乙醇;4) 乙醇的分离和脱水(Mosier et al., 2005a)。其中,木质生物质的预处理是十分关键的一步,其原因在于木质生物质结构的复杂性。木质生物质主要由纤维素(30%~45%)、半纤维素(20%~35%)和木质素(10%~30%)3种高分子聚合物组成,在分子水平上纤维素、半纤维素和木质素分子间存在不同的结合力。木质素为不定形、非均一、非线性的三维立体高聚物,除分子间的化学连接外,还同时以共价键和半纤维素结合,而纤维素线性分子间和分子内氢键形成的结晶结构,使其难溶于水,导致纤维素在自然条件下水解速率极低。典型的物理化学预处理方式,如蒸汽爆破、有机溶剂、硫酸和热碱等,对反应设备要求严格,耗费大量的能源(Sun et al., 2002;Silverstein et al., 2007;Datar et al., 2007),并且产生对后续酶水解有抑制作用的物质,生产成本高昂且污染环境;生物预处理作为一种环境友好和低成本的预处理技术,也存在着效率低、作用周期长和碳水化合物严重损失的缺点(Keller et al., 2003;Hwang et al., 2008;Zhang et al., 2007;Shi et al., 2008;2009)。热水预处理通过高温高压来处理木质纤维素,能部分水解半纤维素并破坏木质素及纤维素的结构,增加生物转化底物的酶可及面积(Mosier et al., 2005a),被认为是成本效益最优的木质生物质预处理方式(Yu et al., 2010a)。在120~230 ℃的温度条件下热水预处理生物质原料245 min,会有40%~60%的物料损失,其中包括4%~22%的纤维素、35%~60%的木质素和几乎全部的半纤维素组分(Mosier et al., 2005a),该预处理方法具有腐蚀性小、无沉淀产生且操作成本低等特点(Liu et al., 2010)。
1 热水预处理对木质纤维生物质结构化学成分的影响木质生物质具有复杂、精细的细胞壁结构,了解预处理过程中纤维素、半纤维素、木质素的化学转化和预处理后的结构特点对于消除生物质抗降解屏障十分有帮助(Cao et al., 2012)。热水预处理过程对细胞壁的作用可以归结为以下3方面:1) 木素-碳水化合物复合体(LCC)连接键断裂并除去部分半纤维素;2) 木质素性质改变和再分配;3) 纤维素的消晶化(Chundawat et al., 2011)。
1.1 热水预处理过程木质素理化性质变化木质素主要存在于细胞壁的次生壁S2层中,其主要结构单元为对羟苯基丙烷(H)、愈创木基丙烷(G)和紫丁香基丙烷(S),主要通过C—C键和醚键进行连接,其中以β—O—4芳基醚键连接键最多,主要功能基团为甲氧基、羟基(酚羟基和醇羟基)和羰基。诸多因素(物种、科属、生长环境等)会造成植物间木质素含量和组成的不同,阔叶木中木质素含有大量紫丁香基结构,其次为愈创木基结构,针叶木中以愈创木基为主,而禾本科(Gramineae)中3种结构单元均有一定分布(郑大峰等,2005)。图 1为不同反应条件下样品预处理前后的扫描电镜(SEM)图像,试验将高压反应釜内进行热水预处理后的样品与较为温和的处理方法——索氏提取和回流(以水为溶剂)处理后的样品进行对比,可以观察到后者处理的样品其表面形态与原料相似,而在高温水热处理时,原料破损严重,颜色变深,并且表面有液滴状颗粒(Nitsos et al., 2013)。热水预处理可以除去一小部分木质素(溶于酸的部分),但在处理过程中木质素熔融、固化并在纤维表面再聚合,同时也使部分木质素与碳水化合物之间的连接断裂,改变了木质素的化学结构和分布状况(Aita et al., 2010)。一些研究表明,酸不溶木素经过酸性条件处理后会比处理前的含量更高,这种现象被认为是多糖降解产物(如糠醛)重新聚合或者多糖与木素聚合形成的木素类化合物,被称为“假木素”(Jung et al., 2010;Mao et al., 2010;Li et al., 2005)。“假木素”中含有羧基、羰基、脂肪族和芳香族结构,并且在不同预处理条件下分子质量变化不大(Mn~ 1 000 g·mol-1; Mw~5 000 g·mol-1)(Hu et al., 2012)。与此同时,木质素在高温水解离的H离子的作用下会形成苄醇结构中间体,醚键不稳定容易发生断裂,断裂后的木素碎片与相邻芳香环中的正碳离子形成C—C连接。在较为剧烈的条件下,木质素再缩合阻碍了热水预处理过程中的解聚作用和木质素的脱除,虽然醚键断开,但是β—O—4′键脱除的速率接近于0(Li et al., 2007)。

|
图 1 原料和不同温度热水预处理后样品的扫描电镜(SEM)图像(Nitsos et al., 2013) Fig.1 SEM images of the parent and representative hydrothermally treated biomass samples at increasing temperature and constant reaction time (15 min) (Nitsos et al., 2013) |
经热水预处理后,固体残渣中纤维素含量随预处理强度的增加而减少,同时,水解液中葡萄糖、纤维二糖、纤维素低聚物等纤维素降解产物的含量相应增加(Petersen et al., 2009;Liu et al., 2003)。在不同热水预处理温度下,进一步分析处理液中的产物发现,纤维素无定形结构中的一些短链仍与结晶纤维素通过氢键等连接在一起(Yu et al., 2010b)。在较低的预处理温度(100 ℃)下,无定形区内的短分子链会生成C4-C13的低聚物,而完全断裂糖苷键形成葡萄糖单体的最低温度为150 ℃左右,纤维素结晶区开始水解为葡萄糖单体的温度为180 ℃左右,这是由于纤维素结晶区分子内和分子间的氢键作用,极大削弱了H离子对糖苷键的作用效果。纤维素无定形区与结晶区之间的氢键和链长也存在差异,这些差异会在很大程度上影响热水预处理水解液中葡萄糖低聚物的分布。通常,在相同水解温度下,无定形纤维素相对于结晶部分在主要降解物中会生成更多葡萄糖及其低聚物,但生成低聚物的选择性并不随纤维素聚合度的降低而增加(Yu et al., 2010b)。徐绍华等(2013)利用X射线衍射法研究经高温热水预处理后的桉木(Eucalyptus)发现,纤维素的结晶度在高温热水预处理前后变化很小,但在微观形态(图 2)上,处理后的桉木比原料纤维长度明显变短,碎片化现象显著,纤维之间的结合变得松弛,可以清晰观察到纤维的断裂。Saha等(2013)以麦草杆为原料在200 ℃下进行热水预处理,处理时间小于25 min时,随着时间增加,越来越多的纤维素被水解,但是处理时间超过25 min直至60 min,纤维素的水解量缓慢降低。
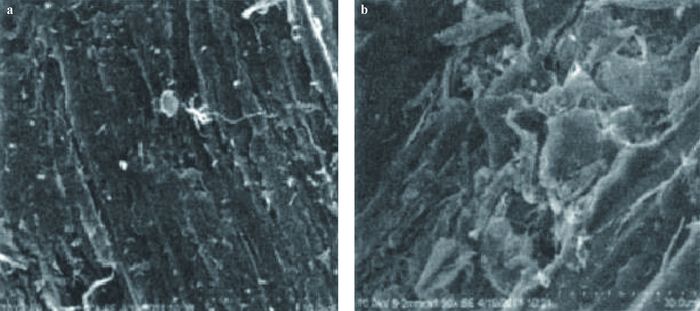
|
图 2 桉木高温热水预处理前后及酶解残渣的扫描电镜(SEM)图像(徐绍华等,2013) Fig.2 SEM images of Eucalyptus before and after hot water pretreatment and enzymolysis (Xu et al., 2013) a.桉木原料Eucalyptus materials; b.预处理后Materials after pretreatment. |
与纤维素不同,半纤维素的组成与细胞组织、植物种类、糖苷键类型、侧链组成和聚合度有关(Fengel et al., 1984;Jeffries, 1994)。聚木糖的水解机制通常采用拟均相反应动力学模型和预处理强度参数来表达,但是聚木糖的动力学研究非常困难,不仅反应步骤复杂,而且还受很多因素影响(马静,2015)。Conner等(1986)提出,木聚糖水解为低分子质量的木寡糖为第1阶段,第2阶段的主要产物为木糖。在热水预处理过程中,木质生物质中的碳水化合物会发生降解反应或者溶解在水溶液中,尤其是半纤维素主要分解为可溶性低聚物和单糖。随着预处理温度和时间增加,更多的木聚糖被降解,在糖苷键断裂的同时,从半纤维素上脱离下来的乙酰基在水溶液中形成乙酸,己糖降解产生5-羟甲基糠醛而戊糖降解为糠醛,并可进一步降解生成甲酸(Klinke et al., 2003;Larsson et al., 1999;Lu et al., 2009)。反应过程中生成的乙酸可以促进水解,乙酸中的水合氢离子比水中产生的水合氢离子对水解过程的作用更大(Garrote et al., 1999)。Yu等(2013)在热水预处理过程中根据木糖和降解产物的变化,得出在较高的预处理温度和压强下,体系中的木糖分解得更多更快。李海龙等(2012)用热水对相思木(Acacia)进行预处理发现,处理液pH随着预处理时间增加逐渐下降,水解结束时pH最低可达到3.0,期间处理液中的糖含量呈现先增加后降低的趋势。当处理液pH达到3.2左右时,糖的含量达到最大值,然后随着pH下降,糖含量以较快的速度下降。
2 热水预处理对抑制物的影响热水预处理过程中会生成许多化学中间体和副产物,对水解酶(包括纤维素酶、木聚糖酶、β-葡萄糖苷酶等)和发酵微生物产生抑制作用,从而使水解和发酵速率减慢。Kont等(2013)通过高效液相色谱和质谱分析证实热水预处理过程中会生成抑制纤维素酶活性的低聚糖(聚合度7~10),主要由半纤维素断裂形成并溶解在处理液中(Pu et al., 2013; Holopainen-Mantila et al., 2013)。在乙醇发酵过程中,抑制物主要包括3类:弱酸(甲酸、乙酸、葡萄糖醛酸、乙酰丙酸、阿魏酸和对香豆酸)、呋喃醛类(糠醛、羟甲基糠醛)和酚类(对苯二酚),其中弱酸会使细胞内环境酸化,是抑制细胞生长的主要原因,呋喃醛类化合物对酿酒酵母的影响主要是抑制酵母生长,而酚类化合物对发酵具有最强的抑制作用,并且低分子质量酚类化合物毒性更强(李洪兴等,2009;李志强等,2015;肖领平,2014)。在热水预处理的初始阶段,基本没有糠醛生成,当预处理温度从25 ℃升至170 ℃、升温速率为1.2 ℃·min-1、保温时间为120 min的条件下,反应时间和H-因子(不同温度下相对反应速率常数与其时间的函数的积分面积)分别达到150 min和450时,生成的糠醛含量随着反应时间和H-因子增加呈直线增加;在热水预处理温度140~160 ℃时得到的糠醛[(0.31±0.00) mg·g-1)]和5-羟甲基糠醛[(0.11±0.01) mg·g-1]含量较低,在180 ℃糠醛含量增加到(0.63± 0.02) mg·g-1,5-羟甲基糠醛含量依然为(0.11±0.01) mg·g-1,在200 ℃时二者生成含量分别为(12.00±2.00) mg·g-1和(1.00±0.10) mg·g-1 (李海龙等,2012)。乙酸在热水解过程中的含量与糠醛和5-羟甲基糠醛类似,200 ℃时每克原料可以生成(32±0.0) mg乙酸(Saha et al., 2013)。Min等(2015)将热水预处理分2步进行,证明当第1步热水预处理低温、较长时间进行,第2步热水预处理高温、较短时间进行,相比单一的在较高或较低热水预处理强度下,可以更有效地减少抑制物含量从而提高糖的生物转化效率。
3 热水预处理对酶水解的影响通过酶水解和微生物降解从植物细胞中获得较高得率的葡萄糖,预处理是十分关键的一步。植物细胞中的木质素和半纤维素对纤维素具有保护作用,预处理过程可以破坏或除去木质素和半纤维素,使酶更容易接触到纤维素从而促进酶解效率(Kumar et al., 2009;Mosier et al., 2005a)。在热水预处理过程中,木质素从木材细胞中转移到纤维素表面,可降低酶的可及度,减慢酶水解速率,但是这种抑制作用随着水解时间增加会有所减弱,在纤维素转化率较高的情况下几乎消除。研究表明,生物酶制剂与木质素液滴之间的结合并不是抑制作用的主要原因,纤维素表面的木质素液滴形成的阻碍作用才是抑制酶水解的重要因素,其作用大小主要取决于木质素聚合物分子的化学性质和粒径大小(Li et al., 2014)。Jeoh等(2007)认为,预处理强度会影响酶解过程中酶与底物的反应程度。热水预处理后的酶水解效率主要取决于预处理温度和时间,较长的预处理时间不利于半纤维素的回收,但是随着预处理时间增加纤维素的水解是先增加后降低的。热水预处理温度对于酶水解过程十分重要,在预处理温度达到160 ℃之前,随着预处理温度升高,酶解糖含量缓慢增加,但是在温度达到180 ℃时得到的酶解糖比160 ℃时增加了55%,预处理温度200 ℃又比180 ℃时增加了43.5%(Saha et al., 2013)。Dien等(2006)通过对比经热水预处理和未经预处理的无淀粉玉米纤维,发现在经热水预处理原料上培育的真菌产生的酶活性更强,并且当预处理时间从20 min增加到30 min时,木糖的得率增加了14%,延长预处理时间可以除去更多非碳水化合物的侧链基团或者更进一步使细胞结构打开从而增加木糖的可消化性。Mosier等(2005b)对比研究了190 ℃、15 min和200 ℃、5 min 2种热水预处理强度后发现,二者的固体损失分别为35%和30%,而前者最终经酶水解后的总糖得率较高,说明对于总碳水化合物利用的生物转化效率与热水预处理过程中的物料损失有关,其中主要是半纤维素过度降解。Park等(2010)通过X射线衍射和核磁共振等方法测定纤维素结晶度对酶解效率的影响,结果发现结晶度对酶解效率的影响并不清晰,除了结晶度外,木质素/半纤维素含量和分布、孔隙率和颗粒大小也会产生影响。一些研究甚至认为结晶度指数在酶水解过程中是增加的,但是增加量很少(Cao et al., 2005;Chen et al., 2007;Wang et al., 2006)。
4 热水预处理对乙醇浓度的影响Negro等(2003)对经热水处理后的黑杨(Populus nigra)进行同步糖化发酵发现,随着预处理温度升高,糖化发酵得率升高,最大得率达到理论值的60%(理论值为原料中含有的葡萄糖成分全部进行糖化发酵,每克葡萄糖可以生成0.51 g乙醇)。Díaz等(2010)研究表明,油菜(Brassica campestris)籽经217.7 ℃、42.2 min热水预处理和酶水解处理后,得到了原料中葡萄糖含量的70%,相应地,同步糖化发酵也会得到了较高的得率;但是如果预处理强度过于剧烈,会造成部分纤维素降解,使生物乙醇得率降低。Romaní等(2010) 用桉木在195~250 ℃下进行预处理,经酶解糖化发酵后发现,当预处理温度达到210 ℃时,全部纤维素已为葡萄糖,当预处理温度超过230 ℃时,部分纤维素降解损失,导致乙醇得率降低。Da Cruz等(2012)以甘蔗(Saccharum officinarum)作为原料优化热水预处理条件,当处理条件为190 ℃、17.2 min时,用重组啤酒酵母进行发酵乙醇得率最高(理论最高产量的50.1%),并且热水预处理后的酶水解产物无需进行脱毒操作即可直接进行发酵操作(Saha et al., 2013)。
5 问题与展望在能源问题日益紧张的时局下,寻求可再生清洁能源是亟待解决的关键问题,而乙醇燃料无疑是化石能源的最佳替代者。基于木质纤维生物质来源广、成本低等特点,使用这类原料制备生物乙醇的研究取得了很大进展。作为地球上储量最丰富的生物有机质,木质纤维素每年通过光合作用固定的太阳能达4×1021J,但是其利用率仅为0.27%(Márquez et al., 2007),如何合理利用这一巨大的生物质资源已成为该领域研究的重点和热点。木质生物质细胞壁结构复杂,导致纤维素在自然条件下水解速率极低,预处理是生产乙醇燃料十分关键的一步。热水预处理是成本效益最优的木质生物质预处理方式之一,且对环境友好,虽然通常要在高温下进行,需要配备耐高压的反应容器,但是反应过程中不需要添加其他化学试剂,反应时间较短,在尽量保留天然大分子原位结构的基础上一定程度地破坏了植物细胞壁的致密结构。木质生物质复杂的理化组成和多级结构的不均一性,是阻碍其经济高效水解产糖的另一关键问题,尽管辅助一些经济有效的预处理手段,但添加单一纤维素酶实现木质纤维素-糖转化依然难以跨越酶解成本过高的障碍,常常需要由纤维素酶和辅助酶(其他水解酶)构成的组合酶(催化水解同一底物但不同来源和特性的2种或2种以上酶配合而成的酶制剂,这些酶之间具有互补性)、复合酶(催化水解不同底物的多种酶混合而成的酶制剂,这些酶的来源相同或不同)或组合型复合酶等混合酶共同作用,才能实现预期目标(冯定远等,2008)。热水预处理过程中生成的副产物可以通过进一步处理生成更有价值的产品,其中糠醛用途广泛,可以应用在医药、塑料、橡胶等领域,5-羟甲基糠醛的化学性质也较为活泼,可以应用在化工领域,甲酸和乙酸在诸多领域中均有良好应用,乙酸还可以作为催化剂促进生物质原料中化学键的断裂。热水预处理作为一种预处理方式具有很多优势,相信经过不断努力和发展,可以得到更广泛的应用,为实现生物质能源工业化生产带来更多契机。
| [] |
冯定远, 黄燕华, 于旭华. 2008. 饲料酶制剂理论与实践的新思路——新型高效饲料组合酶的原理和应用. 中国饲料(13): 24–28.
( Feng D Y, Huang Y H, Yu X H. 2008. The new idea of feed enzymes theory:principle and application of new high-efficient feed combination enzymes. China Feed(13): 24–28. DOI:10.3969/j.issn.1004-3314.2008.13.009 [in Chinese] ) |
| [] |
李海龙, 詹怀宇. 2012. 热水预处理相思木过程中糖类物质溶出及糠醛形成规律的研究. 中国造纸学会第十五届学术年会论文集. ( Li H L, Zhan H Y. 2012. The study of formation rules of carbohydrates and furfural duringhot-water pre-extraction acacia processes.The 15th Academic Conference Collected Paper of China Technical Association of Paper Industry.[in Chinese]) http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGVO201205001045.htm |
| [] |
李洪兴, 张笑然, 沈煜, 等. 2009. 纤维素乙醇生物加工过程中的抑制物对酿酒酵母的影响及应对措施. 生物工程学报, 25(9): 1321–1328.
( Li H X, Zhan X R, Shen Y, et al. 2009. Inhibitors and their effects on Saccharomyces cerevisiae and relevant countermeasures in bioprocess of ethanol production from lignocellulose-a review. Chinese Journal of Biotechnology, 25(9): 1321–1328. [in Chinese] ) |
| [] |
李文, 潘家祯, 许洪朋. 2009. 木质纤维素类生物质转化生物乙醇预处理B2B工艺的发展研究. 安徽农业科学, 37(7): 2911–2916.
( Li W, Pan J Z, Xu H P. 2009. Study on the pretreatment technology development of transforming B2B-lignocellulosic biomass to bio-ethanol. Anhui Agricultural University, 37(7): 2911–2916. [in Chinese] ) |
| [] |
李志强, 费本华, 江泽慧. 2015. 发酵抑制物对葡萄糖发酵产乙醇的影响. 化工进展, 34(A01): 80–84.
( Li Z Q, Fei B H, Jiang Z H. 2015. Effects of fermentation inhibitors on ethanol production of glucose fermentation. Chemical Industry and Engineering Progress, 34(A01): 80–84. [in Chinese] ) |
| [] |
马静. 2015. 热水预处理杨木半纤维素的局部化学溶解机理. 北京: 北京林业大学博士学位论文. ( Ma J. 2015. The mechanism of topochemical dissolving of hemicellulose during hydrothermal pretreatment of poplar. Beijing:PhD thesis of Beijing Forestry University.[in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10022-1015319523.htm |
| [] |
肖领平. 2014. 木质生物质水热资源化利用过程机理研究. 北京: 北京林业大学博士学位论文. ( Xiao L P. 2014. Mechanism research on hydrothermal utilization process of lignocellulosic biomass. Beijing:PhD thesis of Beijing Forestry University.[in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10022-1014319144.htm |
| [] |
徐绍华, 武书彬, 尉慰奇. 2013. 桉木三组分在高温热水预处理及酶解糖化中的规律研究. 林产化学与工业, 33(1): 21–26.
( Xu S H, Wu S B, Wei W Q. 2013. The changes ofthree-components in Eucalyptus during processes of pre-processing in high temperature liquid water and enzymolysis. Chemistry and Industry of Forest Products, 33(1): 21–26. [in Chinese] ) |
| [] |
郑大锋, 邱学青, 楼宏铭. 2005. 木质素的结构及其化学改性进展. 精细化工, 33(1): 21–26.
( Zheng D F, Qiu X Q, Lou H M. 2005. The structure of lignin and its chemical modification. Fine Chemical, 33(1): 21–26. [in Chinese] ) |
| [] | Aita G, Kim M. 2010. Pretreatment technologies for the conversion of lignocellulosic materials to bioethanol. Oxford University Press: 117-145. |
| [] | Cao S, Pu Y, Studer M, et al. 2012. Chemical transformations of Populus trichocarpa during dilute acid pretreatment. RSC Advances, 2(29): 10925–10936. DOI:10.1039/c2ra22045h |
| [] | Cao Y, Tan H. 2005. Study on crystal structures ofenzyme-hydrolyzed cellulosic materials by X-ray diffraction. Enzyme and Microbial Technology, 36(2): 314–317. |
| [] | Chen Y, Stipanovic A J, Winter W T, et al. 2007. Effect of digestion by pure cellulases on crystallinity and average chain length for bacterial and microcrystalline celluloses. Cellulose, 14(4): 283–293. DOI:10.1007/s10570-007-9115-2 |
| [] | Chundawat S P S, Beckham G T, Himmel M E, et al. 2011. Deconstruction of lignocellulosic biomass to fuels and chemicals. Annual Review of Chemical and Biomolecular Engineering, 2: 121–145. DOI:10.1146/annurev-chembioeng-061010-114205 |
| [] | Conner A H, Lorenz L F. 1986. Kinetic modeling of hardwood prehydrolysis. Part Ⅲ. Water and dilute acetic acid prehydrolysis of southern red oak. Woodand Fiber Science, 18(2): 248–263. |
| [] | Da Cruz S H, Dien B S, Nichols N N, et al. 2012. Hydrothermal pretreatment of sugarcane bagasse using response surface methodology improves digestibility and ethanol production by SSF. Journal of Industrial Microbiology & Biotechnology, 39(3): 439–447. |
| [] | Datar R, Huang J, Maness P C, et al. 2007. Hydrogen production from the fermentation of corn stover biomass pretreated with a steam-explosion process. International Journal of Hydrogen Energy, 32(8): 932–939. DOI:10.1016/j.ijhydene.2006.09.027 |
| [] | Díaz M J, Cara C, Ruiz E, et al. 2010. Hydrothermal pre-treatment of rapeseed straw. Bioresource Technology, 101(7): 2428–2435. DOI:10.1016/j.biortech.2009.10.085 |
| [] | Dien B S, Li X L, Iten L B, et al. 2006. Enzymatic saccharification of hot-water pretreated corn fiber for production of monosaccharides. Enzyme and Microbial Technology, 39(5): 1137–1144. DOI:10.1016/j.enzmictec.2006.02.022 |
| [] | Fengel D, Wegener G. 1984. Wood:chemistry, ultrastructure, reactions. Walter de Gruyter, 613: 1960–1982. |
| [] | Garrote G, Dominguez H, Parajo J C. 1999. Hydrothermal processing of lignocellulosic materials. European Journal of Wood and Wood Products, 57(3): 191–202. DOI:10.1007/s001070050039 |
| [] | Holopainen-Mantila U, Marjamaa K, Merali Z, et al. 2013. Impact of hydrothermal pre-treatment to chemical composition, enzymatic digestibility and spatial distribution of cell wall polymers. Bioresource Technology, 138: 156–162. DOI:10.1016/j.biortech.2013.03.152 |
| [] | Hu F, Jung S, Ragauskas A. 2012. Pseudo-lignin formation and its impact on enzymatic hydrolysis. Bioresource Technology, 117: 7–12. DOI:10.1016/j.biortech.2012.04.037 |
| [] | Hwang S S, Lee S J, Kim H K, et al. 2008. Biodegradation and saccharification of wood chips of Pinus strobes and Liriodendron tulipifera by white rot fungi. Journal of Microbiology and Biotechnology, 18(11): 1819–1826. |
| [] | Jeffries T W. 1994. Biodegradation of lignin and hemicelluloses//Biochemistry of microbial degradation. Springer Netherlands, 233-277. |
| [] | Jeoh T, Ishizawa C I, Davis M F, et al. 2007. Cellulase digestibility of pretreated biomass is limited by cellulose accessibility. Biotechnology and Bioengineering, 98(1): 112–122. DOI:10.1002/(ISSN)1097-0290 |
| [] | Jung S, Foston M, Sullards M C, et al. 2010. Surface characterization of dilute acid pretreated Populus deltoides by ToF-SIMS. Energy and Fuels, 24(2): 1347–1357. DOI:10.1021/ef901062p |
| [] | Keller F A, Hamilton J E, Nguyen Q A. 2003. Microbial pretreatment of biomass. Applied Biochemistry and Biotechnology, 105(1/3): 27–41. |
| [] | Klinke H B, Olsson L, Thomsen A B, et al. 2003. Potential inhibitors from wet oxidation of wheat straw and their effect on ethanol production of Saccharomyces cerevisiae:wet oxidation and fermentation by yeast. Biotechnology and Bioengineering, 81(6): 738–747. DOI:10.1002/(ISSN)1097-0290 |
| [] | Kont R, Kurašin M, Teugjas H, et al. 2013. Strong cellulase inhibitors from the hydrothermal pretreatment of wheat straw. Biotechnology for Biofuels, 6(1): 135. DOI:10.1186/1754-6834-6-135 |
| [] | Kumar R, Wyman C E. 2009. Access of cellulase to cellulose and lignin for poplar solids produced by leading pretreatment technologies. Biotechnology Progress, 25(3): 807–819. DOI:10.1002/btpr.v25:3 |
| [] | Larsson S, Palmqvist E, Hahn-Hägerdal B, et al. 1999. The generation of fermentation inhibitors during dilute acid hydrolysis of softwood. Enzyme and Microbial Technology, 24(3): 151–159. |
| [] | Li H, Pu Y, Kumar R, et al. 2014. Investigation of lignin deposition on cellulose during hydrothermal pretreatment, its effect on cellulose hydrolysis, and underlying mechanisms. Biotechnology and Bioengineering, 111(3): 485–492. DOI:10.1002/bit.25108 |
| [] | Li J, Henriksson G, Gellerstedt G. 2005. Carbohydrate reactions duringhigh-temperature steam treatment of aspen wood. Applied Biochemistry and Biotechnology, 125(3): 175–188. DOI:10.1385/ABAB:125:3 |
| [] | Li J, Henriksson G, Gellerstedt G. 2007. Lignin depolymerization/repolymerization and its critical role for delignification of aspen wood by steam explosion. Bioresource Technology, 98(16): 3061–3068. DOI:10.1016/j.biortech.2006.10.018 |
| [] | Liu C, Wyman C E. 2003. The effect of flow rate of compressed hot water on xylan, lignin, and total mass removal from corn stover. Industrial and Engineering Chemistry Research, 42(21): 5409–5416. DOI:10.1021/ie030458k |
| [] | Liu S J. 2010. Woody biomass:niche position as a source of sustainable renewable chemicals and energy and kinetics ofhot-water extraction/hydrolysis. Biotechnology Advances, 28(5): 563–582. DOI:10.1016/j.biotechadv.2010.05.006 |
| [] | Lu X, Yamauchi K, Phaiboonsilpa N, et al. 2009. Two-step hydrolysis of Japanese beech as treated by semi-flow hot-compressed water. Journal of Wood Science, 55(5): 367–375. DOI:10.1007/s10086-009-1040-6 |
| [] | Márquez A G C, Rodríguez L M T, Rojas A M. 2007. Synthesis of fully and partially sulfonated polyanilines derived from ortanilic acid:An electrochemical and electromicrogravimetric study. Electrochimica Acta, 52(16): 5294–5303. DOI:10.1016/j.electacta.2007.02.048 |
| [] | Mao J D, Holtman K M, Franqui-Villanueva D. 2010. Chemical structures of corn stover and its residue after dilute acid prehydrolysis and enzymatic hydrolysis:insight into factors limiting enzymatic hydrolysis. Journal of Agricultural and Food Chemistry, 58(22): 11680–11687. DOI:10.1021/jf102514r |
| [] | Min D, Xu R, Hou Z, et al. 2015. Minimizing inhibitors during pretreatment while maximizing sugar production in enzymatic hydrolysis through a two-stage hydrothermal pretreatment. Cellulose, 22(2): 1253–1261. DOI:10.1007/s10570-015-0552-z |
| [] | Mosier N, Wyman C, Dale B, et al. 2005a. Features of promising technologies for pretreatment of lignocellulosic biomass. Bioresource Technology, 96(6): 673–686. DOI:10.1016/j.biortech.2004.06.025 |
| [] | Mosier N, Hendrickson R, Ho N, et al. 2005b. Optimization of pH controlled liquid hot water pretreatment of corn stover. Bioresource Technology, 96(18): 1986–1993. DOI:10.1016/j.biortech.2005.01.013 |
| [] | Negro M J, Manzanares P, Ballesteros I, et al. 2003. Hydrothermal pretreatment conditions to enhance ethanol production from poplar biomass. Applied Biochemistry and Biotechnology, 105(1/3): 87–100. |
| [] | Nitsos C K, Matis K A, Triantafyllidis K S. 2013. Optimization of hydrothermal pretreatment of lignocellulosic biomass in the bioethanol production process. Chemsuschem, 6(1): 110–122. DOI:10.1002/cssc.201200546 |
| [] | Park S, Baker J O, Himmel M E, et al. 2010. Cellulose crystallinity index:measurement techniques and their impact on interpreting cellulase performance. Biotechnology for Biofuels, 3(1): 10. DOI:10.1186/1754-6834-3-10 |
| [] | Petersen M Ø, Larsen J, Thomsen M H. 2009. Optimization of hydrothermal pretreatment of wheat straw for production of bioethanol at low water consumption without addition of chemicals. Biomass and Bioenergy, 33(5): 834–840. DOI:10.1016/j.biombioe.2009.01.004 |
| [] | Pu Y, Hu F, Huang F, et al. 2013. Assessing the molecular structure basis for biomass recalcitrance during dilute acid and hydrothermal pretreatments. Biotechnology for Biofuels, 6(1): 1–13. DOI:10.1186/1754-6834-6-1 |
| [] | Romaní A, Garrote G, Alonso J L, et al. 2010. Bioethanol production from hydrothermally pretreated Eucalyptus globulus wood. Bioresource Technology, 101(22): 8706–8712. DOI:10.1016/j.biortech.2010.06.093 |
| [] | Saha B C, Yoshida T, Cotta M A, et al. 2013. Hydrothermal pretreatment and enzymatic saccharification of corn stover for efficient ethanol production. Industrial Crops and Products, 44: 367–372. DOI:10.1016/j.indcrop.2012.11.025 |
| [] | Shi J, Chinn M S, Sharma-shivappa R R. 2008. Microbial pretreatment of cotton stalks by solid state cultivation of Phanerochaete chrysosporium. Bioresource Technology, 99(14): 6556–6564. DOI:10.1016/j.biortech.2007.11.069 |
| [] | Shi J, Sharma-shivappa R R, Chinn M, et al. 2009. Effect of microbial pretreatment on enzymatic hydrolysis and fermentation of cotton stalks for ethanol production. Biomass and Bioenergy, 33(1): 88–96. DOI:10.1016/j.biombioe.2008.04.016 |
| [] | Silverstein R A, Chen Y, Sharma-Shivappa R R, et al. 2007. A comparison of chemical pretreatment methods for improving saccharification of cotton stalks. Bioresource Technology, 98(16): 3000–3011. DOI:10.1016/j.biortech.2006.10.022 |
| [] | Sun Y, Cheng J Y. 2002. Hydrolysis of lignocellulosic materials for ethanol production:a review. Bioresource Technology, 83(1): 1–11. DOI:10.1016/S0960-8524(01)00212-7 |
| [] | Wang L, Zhang Y, Gao P, et al. 2006. Changes in the structural properties and rate of hydrolysis of cotton fibers during extended enzymatic hydrolysis. Biotechnology and Bioengineering, 93(3): 443–456. DOI:10.1002/(ISSN)1097-0290 |
| [] | Yu G, Yano S, Inoue H, et al. 2010a. Pretreatment of rice straw by a hot-compressed water process for enzymatic hydrolysis. Applied Biochemistry and Biotechnology, 160(2): 539–551. DOI:10.1007/s12010-008-8420-z |
| [] | Yu Y, Wu H. 2010b. Significant differences in the hydrolysis behavior of amorphous and crystalline portions within microcrystalline cellulose in hot-compressed water. Industrial & Engineering Chemistry Research, 49(8): 3902–3909. |
| [] | Yu Q, Zhuang X, Lü S, et al. 2013. Liquid hot water pretreatment of sugarcane bagasse and its comparison with chemical pretreatment methods for the sugar recovery and structural changes. Bioresource Technology, 129: 592–598. DOI:10.1016/j.biortech.2012.11.099 |
| [] | Zhang X Y, Xu C Y, Wang H X. 2007. Pretreatment of bamboo residues with Coriolus versicolor for enzymatic hydrolysis. Journal of Bioscience and Bioengineering, 104(2): 149–151. DOI:10.1263/jbb.104.149 |
 2017, Vol. 53
2017, Vol. 53

