文章信息
- 陈媛, 尚丽丽, 杨锦玲, 李改云, 殷亚方, 戴好富
- Chen Yuan, Shang Lili, Yang Jinling, Li Gaiyun, Yin Yafang, Dai Haofu
- 野生沉香的鉴别方法
- The Exploration of Identification Method of Wild Agarwood
- 林业科学, 2017, 53(9): 90-96.
- Scientia Silvae Sinicae, 2017, 53(9): 90-96.
- DOI: 10.11707/j.1001-7488.20170911
-
文章历史
- 收稿日期:2016-04-14
- 修回日期:2016-05-31
-
作者相关文章
2. 中国林业科学研究院木材工业研究所 北京 100091;
3. 中国热带农业科学院热带生物技术研究所 海口 571101
2. Research Institute of Wood Industry, CAF Beijing 100091;
3. Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences Haikou 571101
沉香是瑞香科(Thymelaeaceae)白木香属(Aquilaria)树木在自然生长过程中形成的由木质部组织及其分泌物共同组成的混合物质(殷亚方,2014)。在我国,白木香又名沉香树、土沉香,主要分布在广东、广西、海南、云南、台湾等地,其产生的树脂被称为国产沉香。沉香既是一种珍贵的香料,位列“沉檀龙麝”四大香料之首,又是一种名贵的中药,具有悠久的入药历史。而且,沉香还用于工艺品和文化收藏等多个领域,其作为一种珍贵的林产品(傅立国,1992),得到了林业行业、香料行业、医药行业和文化收藏界的普遍重视。
沉香的形成具有特殊性,白木香树只有在受到火烧、雷劈、虫蛀、刀砍等损害后才能分泌树脂(李戈等,2009),并沉积于木质中,树龄越长,树脂沉积越久,沉香的品质越高(田耀华等,2009)。目前市场上主要有人工沉香和野生沉香2大类:野生沉香是指在生长过程中没有受到人为干预且经较长时间自然形成的沉香;人工沉香是采用物理法、化学法和生物法等结香方式使白木香树木在较短时间内形成的沉香(黄俊卿等,2013;梅文莉等,2013a)。随着人们对天然沉香的大量采挖,野生沉香资源逐渐枯竭,使得供求矛盾更加突出,野生沉香价格高涨。为满足人们对沉香的需求,大量的人工沉香出现。然而,人工沉香结香时间较短,多为9~12个月,其品质远低于野生沉香,市场价格也与野生沉香有巨大差距。在野生沉香价格利益的驱使下,市场上出现了很多假冒伪劣的野生沉香,利用人工沉香以次充好的现象愈加严重。因此,采用科学的方法鉴别野生沉香,对于沉香行业的健康发展具有重要意义。
目前,国内还没有关于沉香的质量控制标准,而作为药用沉香的质量标准主要是《中华人民共和国药典》 (2015年版)(以下简称《药典》)。该标准从外观形状、横切面显微结构、醇溶性浸出物含量、显色反应、薄层色谱以及高效液相色谱等方面对其进行鉴别,其中醇溶性浸出物含量为主要的评价标准。然而,《药典》多用于人工种植沉香的鉴别,对于野生沉香的鉴别并不完全适用。除此之外,还有报道使用光谱法(李凤琴等,1994)、气质连用法(钟建理等,2010;Gao et al., 2014)、近红外光谱法(张妤琳等,2011)等对沉香进行鉴别。部分文献报道通过GC-MS方法鉴别倍半萜及芳香族化合物成分(陈晓颖等,2012;林峰等,2010a; 2010b;梅文莉等,2013b;Wetwitayaklung et al., 2009)来评价沉香的质量品质;还有少量文献报道利用HPLC检测沉香样品中的2-(2-苯乙基)色酮类、四氢色原酮类化合物(陈亚等,2007;杨锦玲等,2014;张倩等,2015;Chen et al., 2012)等。依据以上方法虽可有效地鉴别沉香真伪,但却很少能将野生沉香加以分离鉴定。因此,针对沉香市场供求矛盾突出的现状,科学防范造假沉香和以次充好的现象,完善野生沉香化学成分图谱,建立有效的沉香质量评价体系意义重大。
本文通过对10批次野生沉香的醇溶性浸出物含量、显色反应、薄层色谱和HPLC指纹图谱进行测定,建立野生沉香的HPLC指纹图谱,结合相似度评价和峰面积,得到野生沉香特征图谱和共有特征峰,构建有效、准确、科学的野生沉香鉴别技术,以期为沉香的鉴定和品质评价体系建立提供参考依据。
1 材料与方法 1.1 样品材料对照样品(CK)购自中国食品药品检定研究院。10批次野生沉香(编号为W1-W10) 经中国林业科学研究院木材工业研究所鉴定,均为瑞香科植物白木香。样品取样地包括柬埔寨、越南、印度尼西亚、老挝、菲律宾、马来西亚、中国海南等地,具体产地信息见表 1。
|
|
仪器设备:粉碎机(温岭市林大机械有限公司制造,50 g手提式高速万能粉碎机,DFT-50A型);真空烘箱;筛网(2号筛,筛孔内径850±29 μm);万分之一天平(德国Sartorius公司R2000型);超声波清洗器(南京垒君达超声电子设备有限公司);岛津高效液相色谱仪(包括高压二元泵、DAD检测器、柱温箱、自动进样器、工作站);点样器;薄层色谱扫描仪。试剂:五氧化二磷干燥剂;屈臣氏超纯水;色谱级乙腈(美国Fisher公司);三氯甲烷-丙酮;无水乙醇;盐酸;香草醛;甲酸(分析纯);薄层板。
1.3 样品制备及干燥采集约4 g样品,去除表面腐锈,粉碎至全部通过2号筛。将加入五氧化二磷干燥剂的培养皿放入直径真空烘箱中,粉碎的样品放入称量瓶中,打开瓶盖,放入真空烘箱中,减压至2.67 kPa以下持续24 h,得到干燥后的样品。
1.4 醇溶性浸出物含量、显色反应及薄层色谱测定醇溶性浸出物含量、显色反应以及薄层色谱测定依据《药典》中对沉香的相关规定进行。
1.5 高效液相色谱测定HPLC制样依据《药典》中对沉香的相关规定进行。
HPLC色谱条件:色谱柱为Diamonsil C18(250 mm×4.6 mm×5 μm);乙腈为流动相A,0.1%甲酸溶液为流动相B,进样量为10 μL,柱温为32 ℃,流速为0.7 mL·min-1,检测波长为252 nm,梯度洗脱程序:0~10 min,15%~20%A;10~19 min, 20%~23%A;19~21 min,23%~33%A;21~39 min,33%A;39~40 min,33%~35%A;40~50 min,35%A;50~60 min,95%A。
2 结果与分析 2.1 表观性状如图 1所示,在整体形貌上,野生沉香不同于人工沉香。人工沉香多呈规整的薄木片或块状,有明显的人工受伤痕迹(如火钻、打洞等),木质较多且木纹粗糙;而野生沉香多呈不规则形状,黑褐色树脂较为明显,木质较少,表面多有腐锈,燃烧时香味更加浓郁,具有强烈香气,同时可见黑色油状物渗出。

|
图 1 部分野生沉香样品 Fig.1 Some wild agarwood samples |
如图 2所示,10批次野生沉香(W1-W10) 的醇溶性含量为10.27%~41.93%,平均为24.9%。其中,醇溶性浸出物含量在10%~20%之间的有3批次(W2、W4、W5),20%~30%之间的有5批次(W1、W3、W7、W8、W9),而大于30%的有2批次(W6、W10)。醇溶性浸出物中包括2-(2-苯乙基)色酮类化合物、倍半萜类化合物、芳香族化合物、脂肪酸等,是沉香中主要化学成分的总量,因此,醇溶性浸出物含量是沉香质量的一个重要指标。根据《药典》的检验标准,药用沉香醇溶性浸出物含量不低于10.0%。野生沉香因结香时间较长,通常高于人工沉香的判别标准。然而,野生沉香结香时间差异性较大,表面处理腐朽程度不同,导致醇溶物含量相差较大。

|
图 2 野生沉香醇溶性浸出物含量对比 Fig.2 The alcohol extract content of 10 batches of wild agarwood |
《药典》规定药用沉香的显色反应应呈樱红色或浅樱红色;然而,入药沉香材料多为人工沉香,《药典》规定并没有充分考虑到野生沉香的显色反应颜色。从图 3可以清晰地观察到,除了明显的樱红色或浅樱红色(W1、W2、W4、W8、W9、W10) 外,野生沉香呈现出更多样的颜色,包括紫堇色(W3、W7)、浅红色(W5) 和浅紫色(W6)。

|
图 3 野生沉香的显色反应 Fig.3 Chromogenic reaction of wild agarwood |
由图 4可知,10批次野生沉香的薄层色谱均出现与对照样品(CK)相对应的荧光斑点,在比移值Rf为0.18、0.20、0.27和0.35四处有明显的蓝色或淡蓝色荧光斑点是沉香的薄层色谱特征。由于部分样品溶液浓度较低或色酮类成分含量的差异,导致有些荧光斑点较淡,但依然存在(如W8)。薄层色谱鉴别具有专属性,采用适当的展开剂,可以通过荧光斑点鉴别其色酮类成分,斑点清晰,分离效果好,而且该种鉴别方法节省材料,简单易操作,对于野生沉香的基础鉴别(如真伪鉴定)具有较强的分辨能力。
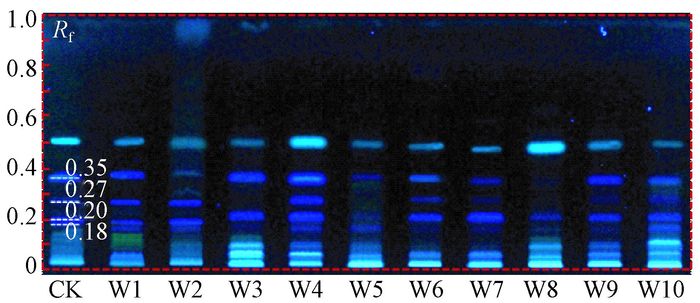
|
图 4 10批次野生沉香的薄层色谱 Fig.4 Thin-layer chromatography of 10 batches of wild agarwood |
野生沉香成分具有多样性,各组分含量受结香时间、树龄、产地等多因素影响,因此,在初步鉴别的基础上,进一步增加化学成分鉴别,有利于更好地鉴别野生沉香。按照HPLC色谱条件进行分析,利用《中药色谱指纹图谱相似度评价系统》(2004A)对所得色谱图进行数据处理。以对照样品为参照图谱,采用中位数法,时间窗为0.1,经多点矫正后,10批次野生沉香的全峰匹配相似度范围为0.350~0.983(W1-W10分别为0.981、0.978、0.947、0.863、0.350、0.973、0.983、0.946、0.975和0.838)。除W5样品相似度较低外,其余样品相似度均大于0.8,说明样品之间品质相差较小。如图 5所示,自动匹配得到特征图谱兼顾了各批次样品特征,出现了11个色谱共有峰(图 5a)。综合分析,选定其中9个共有峰作为特征峰(CPW1-CPW9),如图 5b所示,其对照特征图谱的保留时间分别为19.648、20.301、22.600、23.310、23.870、24.472、34.957、39.304和44.300。根据相关报道(张倩等,2015),确定其中部分特征峰成分为:1) 沉香四醇;2) (5S, 6R, 7S, 8R)-2-[2-(4’-甲氧基-苯乙基)]-5, 6, 7, 8-四氢色酮;3) (5S, 6R, 7S, 8R)-异沉香四醇;4) 沉香色酮B;5) 沉香色酮C;6) 8-氯-2-(2-苯乙基)-5, 6, 7-三羟基-5, 6, 7, 8-四氢色酮。
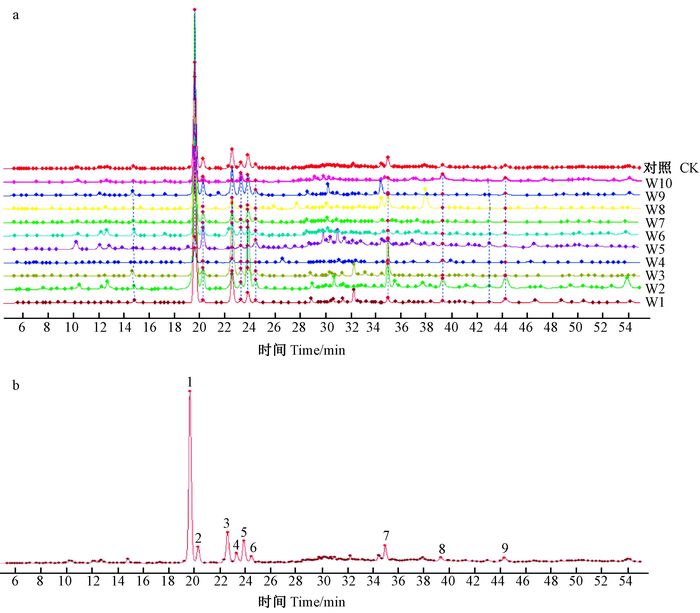
|
图 5 10批次野生沉香特征图谱(a)以及野生沉香对照特征图谱(b) Fig.5 Characteristic chromatograms (a) and reference characteristic chromatogram (b) of 10 batches of wild agarwood |
表 2给出了野生沉香9个共有峰面积在单批次图谱总峰面积中所占比例。由表 2可知,自动匹配选定的9个共有特征峰的峰面积之和占单批次总峰面积的比例很高(φW=S9/STotal),为18.85%~83.42%,平均为53.77%,高于50%的有5批次样品。其中,W5样品CPW1和CPW3特征峰的峰面积所占比例远低于其他样品,导致其共有特征峰面积比例最低,为18.85%,该结果与其醇溶性浸出物含量较低及薄层色谱中的荧光斑点较淡、相似度较低相一致,共同说明W5号样品品质较差。在较多批次野生沉香中,φW均高于50%,进一步说明9个共有特征峰是野生沉香的主要成分,可作为野生沉香的鉴别依据。通过10批次野生沉香9个共有特征峰的φW可以看出,CPW1特征峰的平均峰面积比例为29.75%,成为最重要的野生沉香参照峰,这一特征与《药典》中人工沉香的参照峰相同。
|
|
然而,在特征峰的选择上,野生沉香与《药典》规定的人工沉香存在差异。根据《药典》,人工沉香特征图谱应呈现6个特征峰(图 6),除1号峰所占峰面积比例很高外,在保留时间36~38 min存在很明显的特征峰,在45~47 min存在2个特征峰,峰面积较高,是非常重要的人工沉香鉴别特征。而对于野生沉香,除1号峰外,其余特征峰比例较低,尤其是在以上2段保留时间内(黑色虚线部分),远低于人工沉香峰面积比例,不存在人工沉香的特征峰或峰面积极小而不作为明显特征峰。造成这一现象的原因,可能是由于人工沉香结香时间较短(一般为12个月左右),沉香化学成分在组分上分化较少,而野生沉香结香时间几十年、上百年甚至更长,使植物次生代谢产物增加,原来的成分含量骤减(Chen et al., 2011; Gao et al., 2014; Naef et al., 2011)。

|
图 6 人工沉香对照样品(a)和野生沉香对照特征图谱(b)对比 Fig.6 Comparative fingerprint of characteristic peak in cultivated agarwood and wild agarwood |
从醇溶性浸出物含量结果分析,野生沉香因结香时间较长,通常高于人工沉香的判别标准。10批次野生沉香的醇溶性浸出物含量均高于《药典》的检验标准,最高达41.93%,因此,醇溶性浸出物含量作为野生沉香鉴别指标之一,其含量应不低于10.0%。
从显色反应结果来看,野生沉香的显色反应呈现出更多样的颜色,除人工沉香的樱红色或浅樱红色外,野生沉香的显色反应还包括紫堇色(W3、W7)、浅红色(W5) 和浅紫色(W6)。为了防止野生沉香的鉴定失误,野生沉香的显色反应颜色需扩展为樱红色、紫堇色、浅红色和浅紫色。
从薄层色谱鉴别结果分析,野生沉香的薄层色谱均出现与对照样品相对应的荧光斑点,虽然样品之间含油量的差异可能造成荧光斑点强弱不一,但荧光斑点并未缺失,这使薄层色谱与一般的鉴别方法相比,具有更强的分辨能力。
从HPLC结果分析,野生沉香的峰匹配相似度较高,说明该样品品质差异较小。选定的9个特征峰峰面积较大,全部存在于野生沉香样品中,可作为野生沉香鉴别的特征峰。其中,部分特征峰与人工沉香相同,体现了野生沉香和人工沉香的共性,而在36~47 min保留时间内,野生沉香特征峰明显不同于人工沉香(《药典》),该特征可作为人工沉香和野生沉香的鉴别依据。
4 结论通过对10批次野生沉香的醇溶性浸出物含量测定、显色反应、薄层色谱分析和HPLC方法测定,采用简单、准确、快捷的鉴别方法,达到了鉴别野生沉香的目的。结果表明:1) 野生沉香的醇溶性浸出物含量≥10.0%,是野生沉香基础鉴别的依据之一;2) 《药典》中规定人工沉香显色反应为樱红色,而野生沉香的显色反应则呈现多样性,包括樱红色、紫堇色、浅红色和浅紫色,显色反应成为鉴别野生沉香的重要方法之一;3) 野生沉香样品在薄层色谱分析中,整体上呈现清晰的荧光斑点和较好的分离效果,薄层色谱分析可作为野生沉香基础鉴别方法之一;4) 根据10批次野生沉香的HPLC图谱,建立其特征图谱,通过相似度评价、峰面积比较,确定了野生沉香的9个共有特征峰,通过与人工沉香特征峰对比,可以科学、有效、准确地鉴别野生沉香。
目前,野生沉香的鉴别方法研究较少,本文从繁杂高成本的众多方法中,基于节约原料、降低检测时间、科学准确的原则,提出以显微鉴别、醇溶性浸出物含量、显色反应、薄层色谱作为沉香基础鉴别方法,辅助高效液相色谱进行深入鉴别,最终能够准确、快捷地鉴定野生沉香样品,可为沉香品质评价体系的建立提供参考。
| [] |
陈晓颖, 高英, 李卫民, 等. 2012. 不同结香方法与国产沉香挥发性化学成分的相关性研究. 中国药房, 23(11): 1017–1020.
( Chen X Y, Gao Y, Li W M, et al. 2012. Study on the correlation between the volatile constituents of Aquilaria sinensis and the inducing methods. China Pharmacy, 23(11): 1017–1020. DOI:10.6039/j.issn.1001-0408.2012.11.22 [in Chinese] ) |
| [] |
陈亚, 江滨, 曾元儿. 2007. 高效液相色谱法测定沉香药材中两种活性成分的含量. 时珍国医国药, 18(7): 1697–1698.
( Chen Y, Jiang B, Zeng Y E. 2007. HPLC determination of 2 active components in Aquilaria sinensis (Lour.) Gilg. Lishizhen Medicine and Materia Medica Research, 18(7): 1697–1698. [in Chinese] ) |
| [] |
傅立国. 1992. 中国植物红皮书——珍稀濒危植物. 北京, 中国科技出版社.
( Fu G L. 1992. China plant red data book——rare endangered species. Beijing, China Science Press.[in Chinese]. [in Chinese] ) |
| [] |
黄俊卿, 魏建和, 张争, 等. 2013. 沉香结香方法的历史记载、现代研究及通体结香技术. 中国医药杂志, 38(3): 302–306.
( Huang J Q, Wei J H, Zhang Z, et al. 2013. Historical records of aloes fragrance method, modern research and the sweet technology. China Journal of Chinese Materia Medica, 38(3): 302–306. [in Chinese] ) |
| [] |
李凤琴, 王广林. 1994. 一阶导数光谱法鉴别沉香及非习用进口沉香. 中药材(1): 18.
( Li F Q, Wang G L. 1994. The first derivative spectrometric identification and non conventional imported incense incense. Journal of Chinese Medicinal Materials(1): 18. [in Chinese] ) |
| [] |
李戈, 段立胜, 杨春勇, 等. 2009. 白木香结香技术研究进展. 安徽农业科学, 37(25): 12012–12013.
( Li Y, Duan L S, Yang C Y, et al. 2009. Research progress of technology of Aquilaria sinensis knot incense. Journal of Anhui Agricultural Sciences, 37(25): 12012–12013. DOI:10.3969/j.issn.0517-6611.2009.25.078 [in Chinese] ) |
| [] |
林峰, 梅文莉, 吴娇, 等. 2010a. 人工结香法所产沉香挥发性成分的GC-MS分析. 中药材, 33(2): 222–225.
( Lin F, Mei W L, Wu J, et al. 2010a. GC-MS analysis of volatile constituents from Chinese eaglewood. Journal of Chinese Medicinal Materials, 33(2): 222–225. [in Chinese] ) |
| [] |
林峰, 戴好富, 王辉, 等. 2010b. 两批接菌法所产沉香挥发油化学成分的气相色谱-质谱联用分析. 时珍国医国药, 21(8): 1901–1902.
( Lin F, Dai H F, Wang H, et al. 2010b. Two batches of the inoculation method of aloes volatile oil chemical composition from the GC-MS analysis. Lishizhen Medicine and Materia Medica Research, 21(8): 1901–1902. [in Chinese] ) |
| [] |
梅文莉, 杨德兰, 左文健, 等. 2013a. 沉香的科学思考. 热带林业, 4(Suppl): 40–45.
( Mei W L, Yang D L, Zuo W J, et al. 2013a. The scientific thinking of incense. Tropical Forestry, 4(Suppl): 40–45. [in Chinese] ) |
| [] |
梅文莉, 杨德兰, 左文健, 等. 2013b. 奇楠沉香中2-(2-苯乙基)色酮的GC-MS分析鉴定. 热带作物学报, 34(9): 1819–1824.
( Mei W L, Yang D L, Zuo W J, et al. 2013b. GC-MS Analysis and identification of 2-(2-phenylethyl) chromone derivatives of agarwood 'Qi-Nan'. Chinese Journal of Tropical Crops, 34(9): 1819–1824. [in Chinese] ) |
| [] |
田耀华, 原慧芳, 倪书邦, 等. 2009. 沉香属植物研究进展. 热带亚热带植物学报, 17(1): 98–104.
( Tian Y H, Yuan H F, Ni S B, et al. 2009. Advance in studies on endangered Aquilaria plant. Journal of Tropical and Subtropical Botany, 17(1): 98–104. [in Chinese] ) |
| [] |
钟建理, 饶伟文, 谢黔峰, 等. 2010. 沉香的近红外光谱法鉴别初探. 西北药学杂志(4): 273–275.
( Zhong J L, Rao W W, Xie Q F, et al. 2010. Study on identification method of near infrared spectrum of incense. Northwest Pharmaceutical Journal(4): 273–275. [in Chinese] ) |
| [] |
杨锦玲, 梅文莉, 余海谦, 等. 2014. 国产沉香HPLC指纹图谱研究. 中草药, 45(23): 3456–3461.
( Yang J L, Mei W L, Yu H Q, et al. 2014. HPLC fingerprint of Aquilariae resinatum Lignum in China. Chinese Traditional and Herbal Drugs, 45(23): 3456–3461. DOI:10.7501/j.issn.0253-2670.2014.23.019 [in Chinese] ) |
| [] |
殷亚方. 2014. 白木香属木材的鉴别. 收藏与投资(8): 110–115.
( Yin Y F. 2014. Identification of genus wood of Aquilaria sinensis. Collection and Investment(8): 110–115. [in Chinese] ) |
| [] |
张妤琳, 曹玲, 谭力, 等. 2011. 液质联用技术用于沉香中非法掺入含松香酸类物质的检测. 中成药(5): 844–847.
( Zhang S L, Cao L, Tan L, et al. 2011. Identification of adulterating agalloch with abietic acid by HPLC-MS. Chinese Traditional and Herbal Drugs(5): 844–847. [in Chinese] ) |
| [] |
张倩, 霍会霞, 顾宇凡, 等. 2015. 沉香药材HPLC-DAD特征图谱研究. 中国药学杂志, 50(3): 213–216.
( Zhang Q, Huo H X, Gu Y F, et al. 2015. HPLC-DAD characteristic chromatogram of Chinese eaglewood. Chinese Journal of Pharmaceuticals, 50(3): 213–216. [in Chinese] ) |
| [] | Chen H, Yang Y, Xue J, et al. 2011. Comparison of compositions and antimicrobial activities of essential oils from chemically stimulated agarwood, wild agarwood and healthy Aquilaria sinensis (Lour.) gilgtrees. Molecules, 16(6): 4884–4896. |
| [] | Chen D, Xu Z R, Chai X Y, et al. 2012. Nine 2-(2-phenylethyl) chromone derivatives from the resinous wood of Aquilaria sinensis and their inhibition of LPS-induced no production in RAW 264. 7 cells. Eur J Org Chem, 2012(27): 5389–5397. DOI:10.1002/ejoc.201200725 |
| [] | Gao X X, Xie M R, Liu S F, et al. 2014. Chromatographic fingerprint analysis of metabolites in natural and artificial agarwood using gas chromatograohy-mass spectrometry combined with chemometric methods. Journal of Chromatography B, 967: 264–273. DOI:10.1016/j.jchromb.2014.07.039 |
| [] | Naef R. 2011. The volatile and semi-volatile constituents of agarwood, the infected heartwood of Aquilaria species:a review. Flavour and Fragrance Journal, 26(2): 73–87. DOI:10.1002/ffj.2034 |
| [] | Wetwitayaklung P, Thavanapong N, Charoenteeraboon J. 2009. Chemical constituents andantimicrobial activity of essential oil and extracts of heartwood of Aquilaria crassna obtained from water distillation and supercritical fluid carbon dioxide extraction. Silpakorn U Science & Tech J, 3(1): 25–33. |
 2017, Vol. 53
2017, Vol. 53

