文章信息
- 王立祥, 刘晓博, 任利利, 石娟, 骆有庆
- Wang Lixiang, Liu Xiaobo, Ren Lili, Shi Juan, Luo Youqing
- 松树蜂入侵的混交林中针叶树种内生真菌多样性
- Variety of Endophytic Fungi Associated with Conifers in Mixed Conifer Forests Invaded by Sirex noctilio
- 林业科学, 2017, 53(9): 81-89.
- Scientia Silvae Sinicae, 2017, 53(9): 81-89.
- DOI: 10.11707/j.1001-7488.20170910
-
文章历史
- 收稿日期:2016-07-14
- 修回日期:2016-11-04
-
作者相关文章
许多林业害虫与真菌之间存在着广泛的共生关系,伴生菌能迅速削弱林木的抗病虫能力,加速树木的死亡,在协助昆虫建立种群、协同克服寄主抗性等方面起到重要作用。
松树蜂(Sirex noctilio)属于膜翅目(Hymenoptera)树蜂科(Siricidae)树蜂属(Sirex),原产欧亚大陆和北非,现已传入4大洲9个国家,在入侵地暴发成灾,造成巨大的经济和生态损失(Neumann et al., 1981;Hoebeke et al., 2005; Hurley et al., 2007),是国际重大林业检疫性对象,也是全球范围内最受关注的害虫之一。该害虫寄主广泛,主要危害针叶树,最偏好松属(Pinus)树种(Spradbery et al., 1981; Tribe, 1995)。松树蜂的共生菌是一种白腐真菌,种名为Amylostereum areolatum,属于淀粉韧革菌属(Amylostereum)。松树蜂雌性成虫在体内形成一对专门贮藏共生菌菌丝片段和分节孢子的囊状器官——贮菌囊,该器官位于产卵器基部,与中输卵管相连,产卵时将卵和共生菌一同注入到寄主树木内(Taylor, 1981)。松树蜂幼虫不能直接取食寄主木质部,生长发育必须依赖于共生菌对寄主树种的侵染,反之,松树蜂自身分泌的毒素可以提高共生菌对寄主树木木纤维素的降解能力,加速树势的衰弱,从而建立共生合作关系(Slippers et al., 2002; 2012; Li et al., 2015)。
我国于2013年7月在黑龙江省杜尔伯特蒙古族自治县首次发现松树蜂,截至目前为止,其危害的区域已达到22处:黑龙江省12处,辽宁省3处,吉林省3处,内蒙古自治区4处(Sun et al., 2016)。调查发现松树蜂入侵的混交林多种针叶树中,只有樟子松(Pinus sylvestris var. mongolica)受害。受松树蜂危害的樟子松和未受危害的樟子松内生真菌种类和数量差别较大(王立祥等,2016)。松树蜂入侵后各树种内生真菌的作用尚不明确。Ryan等(2012)研究发现2种松木蓝变菌[(Leptographium wingfieldii)和小长喙霉(Ophiostoma minus)]对松树蜂的产卵选择有影响。Noritoshi(2002)研究认为马尾松(Pinus massoniana)优势内生真菌的种类能够影响天牛羽化时所携带的线虫数量。为此,笔者研究了黑龙江省鹤岗市松树蜂入侵后混交林内樟子松、红松(Pinus koraiensis)、兴安落叶松(Larix gmelinii)和红皮云杉(Picea koraiensis) 4种针叶树不同主干高度(基、中、上部)内生真菌的种类、数量及分布情况,分析不同树种间优势内生真菌的变化规律,以期从微观角度揭示内生真菌的多样性与松树蜂危害的关系,为今后松树蜂的生物防治等提供理论依据。
1 材料与方法 1.1 试验材料采集2015年4月下旬,在黑龙江鹤岗市峻德林场松树蜂发生地的混交林内随机选取樟子松、红松、兴安落叶松、红皮云杉的健康木(未受害)各5株,共计20株;供试树木30~35年生,胸径18~27 cm,树高7.1~9.4 m。受松树蜂危害的樟子松内生真菌和未受松树蜂危害的樟子松内生真菌的优势菌对比见表 1(王立祥等,2016)。每株样木距地面起10 cm处截1个约10 cm厚的圆盘(树木横截面),标记为基部样本,从基部样本处向上2 m处再截1个约10 cm厚的圆盘,标记为中部样本,从中部样本处向上2 m处再截1个约10 cm厚的圆盘,标记为上部样本。用无菌刀去除圆盘树皮,在向内1.5 cm左右的木质部处,取1个约10 cm×10 cm×2 cm的木块,每个圆盘取1个样品,封入无菌真空袋内,带回北京林业大学重点实验室进行分析。
|
|
采用常规组织分离法,每个样品取木质部组织(约4 mm3)各25块,用15%的次氯酸钠消毒30 s,无菌水漂洗3次后植入带有PDA培养基的培养皿中,每皿接种5个组织块,每个样品5个重复。在25 ℃培养箱中暗培养7天,定期观察培养基中菌落的生长情况,并进行纯化培养和菌种保藏。
1.3 真菌种类的鉴定形态鉴定:根据观察的产孢结构特征,以及培养物的菌落颜色、特征等鉴定。
分子鉴定:按照CTAB法提取纯化菌株的DNA,PCR扩增ITS-rDNA序列(引物为ITS1:TCCGTAGGTGAACCTGCGG和ITS4: TCCTCCGCTT ATTGATATGC),用凝胶电泳技术检测,扩增产物由北京擎科生物公司测序,序列经BioEdit等软件进行拼接处理,在NCBI基因库进行同源性比对分析,结合形态特征,采用Kirk等(2008) 分类系统,确定分类地位。
1.4 数据处理真菌检出率(frequency,F):F=内生真菌某属或种的出现次数/组织块数× 100%,它可以衡量某一内生真菌在木质部中的丰富程度以及数量大小。
相对多度(relative abundance):Pi=某一内生真菌的分离株数/总内生真菌的分离株数× 100%。
本文定义优势属或种的方法是,如果某一内生真菌类群在群体中的相对多度Pi >1/S,则该类群为优势菌群,如果Pi <1/S,则该类群为次要类群,S为每个样品的物种总数(Camargo, 1992)。
Shannon diversity index多样性指数(H′)、Pielou均匀度(J)指数和Margalef丰富度指数(R)计算公式如下:
H′= -∑Pi lnPi (i=1, 2,…,n),反映每个样本真菌的物种多样性程度,是丰富度和均匀度的综合指标。
J=H′/lnS,反映每种个体数间的差异。
R=(S-1)/lnN,测定混交林内每个树种的真菌丰富程度。式中Pi和S与上式含义相同,Pi=Ni/N,Ni为第i个物种的个数,N为总体个数。
Jaccard相似性指数Cj=c /(a+b-c),式中a、b分别为2个样本中真菌的种数或属数,c为2个样本中共有的真菌种数或属数,相似性指数是用来比较2个树种之间真菌种类组成的相似程度(王娜等,2012)。
数据处理与分析采用SPSS(18.0) 统计软件进行方差分析和多重比较,利用Excel 2016制图。
2 结果分析 2.1 4种针叶树内生真菌区系组成4种针叶树共分离得到内生真菌22属35种(表 2)。樟子松木质部内共分离到真菌9属13种,基部得到真菌7属9种,检出率为42.4%,优势真菌(相对多度Pi>1/S=1/9) 为绿色木霉、球毛壳菌、青霉,其中绿色木霉的相对多度最高,为28.3%;中部得到真菌6属8种,检出率为55.2%,优势真菌为黑曲霉、松球壳孢菌、链格孢,黑曲霉的相对多度最高,为26.1%;上部得到真菌6属6种,检出率为44%,优势真菌为黑曲霉、球毛壳菌,相对多度都为25.5%。樟子松不同主干高度内生真菌的种类和分离频率差别较大,其中球毛壳菌、链格孢在樟子松的上、中、基部都有分布。
|
|
红松木质部内共分离到真菌7属13种,基部得到真菌6属7种,检出率为34.4%,优势真菌为深绿木霉和球毛壳菌,深绿木霉的相对多度最高,为45.6%;中部得到真菌4属7种,检出率为55.2%,优势真菌为深绿木霉、绿色木霉、小长喙壳,深绿木霉的相对多度最高,为33.3%;上部得到真菌4属8种,检出率为56%,优势真菌为深绿木霉和肉紫胶盘菌,深绿木霉的相对多度最高,为35.7%。其中深绿木霉、绿色木霉、三线镰刀菌在红松的上、中、基部都有分布,深绿木霉的相对多度均最高。
兴安落叶松木质部内共分离到真菌8属17种,基部得到真菌6属9种,检出率为52.8%,优势真菌为深绿木霉、毛霉、青霉和三线镰刀菌,毛霉的相对多度最高,为25.8%;中部得到真菌7属10种,检出率为73.6%,优势真菌为毛霉、三线镰刀菌、金黄壳囊孢,毛霉的相对多度最高,为37%;上部得到真菌5属11种,检出率为78.4%,优势真菌为毛霉、三线镰刀菌和金黄壳囊孢,毛霉的相对多度最高,为40.8%。其中毛霉、金黄壳囊孢、三线镰刀菌、深绿木霉在落叶松的上、中、基部都有分布,且毛霉的相对多度均最高。
红皮云杉木质部内共分离到真菌15属20种,基部得到真菌7属9种,检出率为43.2%,优势真菌为深绿木霉和青霉,深绿木霉的相对多度最高,为24.1%;中部得到真菌4属4种,检出率为44.8%,优势真菌为深绿木霉、松球壳孢菌、Paraconiothyrium sp.,松球壳孢菌的相对多度最高,为41.1%;上部得到真菌9属13种,检出率为73.6%,优势真菌为深绿木霉、松球壳孢菌、多喙茎点霉、三线镰刀菌和链格孢,深绿木霉的相对多度最高,为20.7%。其中三线镰刀菌、深绿木霉在云杉的上、中、基部都有分布。
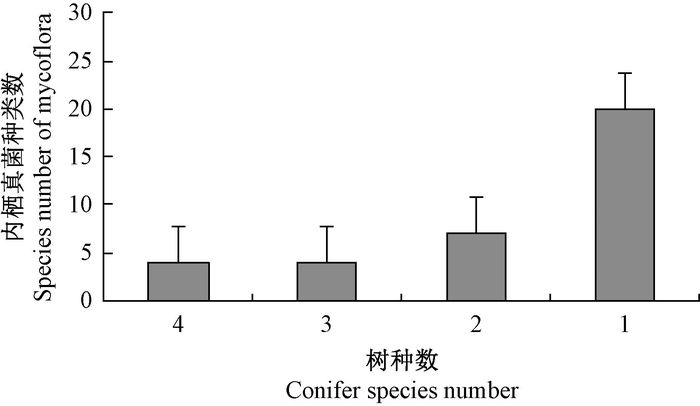
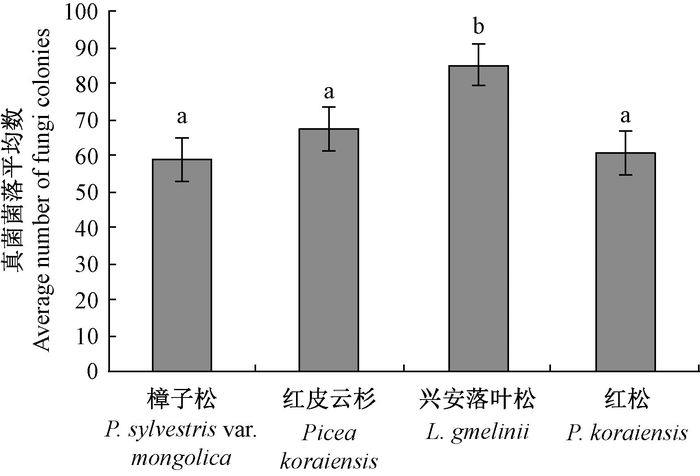
4种针叶树内生真菌种类差别较大,在35种内生真菌中,有4种内生真菌在供试针叶树内分别都存在,4种内生真菌在3种针叶树内都存在,7种内生真菌在2种针叶树内都存在,20种内生真菌在1种针叶树上能分离到(图 1)。总体而言,4种针叶树内生真菌平均菌落数,兴安落叶松最多,樟子松最少,兴安落叶松与其他3种针叶树差异显著(P<0.05)(图 2)。
|
图 1 不同种针叶树共有内生真菌的种类总数 Fig.1 The common fungi species number of different conifer species |
|
图 2 4种针叶树内生真菌菌落平均数 Fig.2 The average number of endophytic fungi colonies in four conifer species |
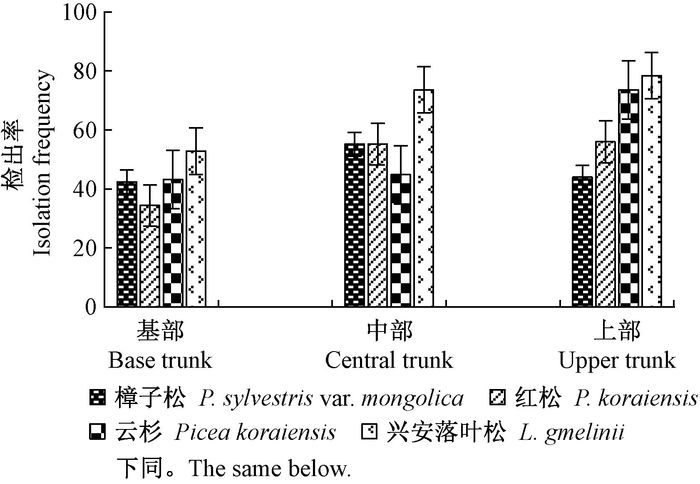
从图 3可知,受松树蜂危害的混交林内4种针叶树内生真菌平均检出率为:兴安落叶松(68.27%) >红皮云杉(53.87%) >红松(48.53%)>樟子松(47.2%),说明4种针叶树的内生真菌数量落叶松最大,樟子松最小。不同主干高度真菌检出率结果为,上部兴安落叶松最大(78.4%),樟子松最小(44%);中部兴安落叶松最大(73.6%),红皮云杉最小(44.8%);基部兴安落叶松最大(52.8%),红松最小(34.4%)。除樟子松外,其他3种针叶树的内生真菌在不同部位的检出率均呈现出规律性:上部﹥中部﹥基部。
|
图 3 4种针叶树不同主干高度内生真菌检出率 Fig.3 The isolation rate of endophytic fungi form different height trunk in four conifer species |
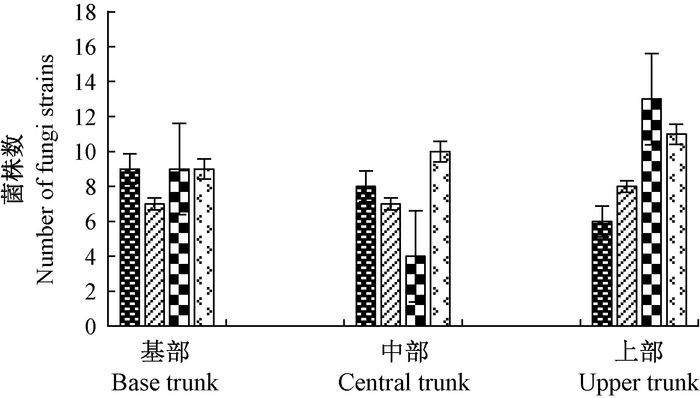
从图 4可知,不同主干高度4种针叶树内生真菌平均菌株数兴安落叶松(10) >红皮云杉(8.7)>樟子松(7.7) >红松(7.3),说明4种针叶树的内生真菌种类兴安落叶松最多,樟子松最小。其中:上部红皮云杉最多为13株,樟子松最小6株;中部兴安落叶松最多10株,红皮云杉最小4株;基部红松最小为7株,其他都为9株。说明在同一林分内,基部内生真菌多样性差别小,中上部差别大。不同主干高度的真菌菌株数无规律。
|
图 4 4种针叶树不同主干高度内生真菌菌株数 Fig.4 The number of endophytic fungi strains from different height trunk in four conifer species |
混交林内4种针叶树种内生真菌的多样性水平存在差异。Shannon物种多样性指数和均匀度指数,从大到小依次为红皮云杉>樟子松>兴安落叶松>红松,丰富度指数红皮云杉>兴安落叶松>樟子松=红松,红皮云杉的3种指数均最大,红松的指数均最小,樟子松、兴安落叶松和红松的物种多样指数相接近,樟子松和红松的丰富度指数相同,都为2.0246。均匀度指数相对来说波动较小,兴安落叶松和红松均匀度指数相接近,说明均匀度指数受树种影响较小(表 3)。
|
|
如表 4所示,比较4种针叶树内生真菌的相似性指数可知,樟子松与红松的相似性指数为0.3,樟子松与兴安落叶松的相似性指数为0.304 3,樟子松与红皮云杉的相似性指数为0.416 7,红松与兴安落叶松的相似性指数为0.25,红松与红皮云杉的相似性指数为0.133 3,兴安落叶松与红皮云杉的相似性指数为0.473 7。只有兴安落叶松与红皮云杉的相似性接近中等,其他树种内生真菌的相似性较小,说明不同树种间内生真菌的种类差别较大。
|
|
树木内生真菌区系容易受多种因素影响,如树木类型、材质硬度、健康状态、木材挥发物以及采集时间和地点等。本研究表明,4种针叶树内都会存在一定数量的内生真菌,不同树种间内生真菌种类数量差别较大,内生真菌的数量兴安落叶松最大,樟子松最小;内生真菌的种类红皮云杉最多,红松和樟子松同为最少,造成这种现象的原因可能是由于不同树木的材质硬度和挥发物质不同导致内生真菌的种类和数量有差异,也可能是云杉枝叶密集,枯枝残叶较多,增加了一些病原菌种类,如拟茎点霉和拟盘多毛孢属,而樟子松和红松树枝稀疏,针叶稀少,群落环境单一,导致内生真菌种类较少。对不同主干高度的内生真菌数量而言,除樟子松外,其他针叶树种均呈上部>中部>基部的规律,而樟子松中部最多,基部最少,周秀华(2011)认为樟子松内生真菌数量基部最多,上部最少,笔者认为造成这种差异的原因可能是该研究的对象是樟子松幼林,且采样地群落环境复杂,地被物丰富,内生真菌易受外界环境的影响较大,所以基部真菌数量最多;本研究对象为成熟林,地被物稀少,群落环境稳定,所以基部真菌数量最少。
本文采用了生物多样性指数、丰富度指数、均匀度指数和相似性指数,对松树蜂危害后混交林内4种针叶树的内生真菌种群进行了多样性和相似性分析,结果表明:不同树种间内生真菌多样性差异较大,其中云杉的3种多样性指数(多样性、丰富度和均匀度)均最大,红松的3种指数均最小。以上3种多样性指数与地理位置、环境条件以及树木微环境息息相关,由于本试验选取的林分水源充足、土壤肥沃、气候条件适宜,所以4种针叶树内生真菌多样性指数较高(2.41~3.63)。Paulus等(2006)报道澳大利亚热带雨林4种常见植物内生真菌的多样性指数在2.96~3.76之间。但是因不同树种的生理条件、组织结构和营养物质等因素不同,从而使树种间内生真菌多样性差异较大。此外,只有4种内生真菌在4种针叶树内均有分布,20种内生真菌对不同针叶树种有单一选择性,且4种针叶树内生真菌的相似度均较低,这说明针叶树内生真菌对寄主的专一性较大。
小长喙壳和松球壳孢菌在受松树蜂危害的樟子松中占主导优势(王立祥等,2016),未受害的樟子松以球毛壳菌的相对多度最高,红松以深绿木霉的相对多度最高,兴安落叶松以毛霉属的相对多度最高,云杉以深绿木霉的相对多度最高,而小长喙壳和松球壳孢菌也是一类重要的蓝变菌,它可以阻塞寄主木质部水分运输,使树木加速死亡,这可能是松树蜂危害的一个原因。此外,同一种内生真菌在不同树种间的分布也有明显差异,如可用于工业发酵的黑曲霉,在受松树蜂的樟子松和未受害的樟子松中检出率分别达35.2%和25.6%,在红松中只有1.6%。在4种健康针叶树中都占优势的木霉属真菌,具有生长迅速、拮抗和重寄生的特点,对许多病原菌具有拮抗生防作用(Papavizas et al., 1985; Whipps, 2001),在受松树蜂危害的樟子松中分离较少,笔者在许多发育不完全而死亡的松树蜂坑道内也能分离到大量的木属真菌,所以木霉属真菌与松树蜂共生菌之间的关系值得进一步研究。
虽然松树蜂卵的孵化和幼虫的生长离不开A.areolatum(Slippers et al., 2012; King, 1966),但A. areolatum的生长速度缓慢,竞争生态位的能力较弱,研究发现Leptographium wingfieldii、小长喙壳、松球壳孢菌、Leptographium procerum等一些蓝变菌均可抑制松树蜂共生菌的生长(Whitney, 1982; Nevill et al., 1992; Hausner et al., 2005),因此,寄主树木内生真菌的种类和数量会对共生菌的生长有竞争作用。松树蜂产卵前会在寄主树木表面探索、搜寻和浅钻(产卵器只钻到寄主韧皮部)为后代找一个适宜的生长环境,这对共生菌在寄主体内占据有利的生态位至关重要(Vasiliauskas et al., 1998; Thomsen et al., 1999; Vasiliauskas et al., 1999; Slippers et al., 2001)。自然状态下,松树蜂危害的混交林中4种针叶树的内生真菌对松树蜂的产卵选择及后代发育影响不同,本课题组在松树蜂的寄主选择试验中发现,松树蜂可以在红松上产卵,但不能成功羽化,这可能是因为红松的内生真菌抑制了松树蜂共生菌的生长。
4 结论本研究发现受松树蜂危害的混交林中,4种针叶树的木质部内都会存在一定数量的内生真菌,不同树种间内生真菌种类和数量差异较大。且受松树蜂危害的樟子松优势内生真菌与4种针叶树健康木的优势内生真菌差别很大。在混交林中,樟子松内生真菌的种类和数量均最小,这表明野外与A. areolatum竞争的真菌最少,有利于松树蜂共生菌A. areolatum入侵樟子松。因此,目前樟子松可能是松树蜂在自然状态下的最适寄主。
| [] |
王娜, 吕国忠, 孙晓东, 等. 2012. 烟草根际土壤真菌多样性的研究. 菌物学报, 31(6): 827–836.
( Wang N, Lü G Z, Sun X D, et al. 2012. Fungal diversity in tobacco rhizosphere soil. Mycosystema, 31(6): 827–836. [in Chinese] ) |
| [] |
王立祥, 骆有庆, 任利利, 等. 2016. 松树蜂入侵樟子松的内生真菌区系. 菌物学报, 35(10): 1–10.
( Wang L X, Luo Y Q, Ren L L, et al. 2016. The mycobiota of Pinus sylvestris var. mongolica trunk invaded by Sirex noctilio. Mycosystema, 35(10): 1–10. [in Chinese] ) |
| [] | 周秀华. 2001. 樟子松干栖真菌类群的研究. 安徽农业科学, 39(5): 2784–2785. |
| [] | Zhou X H. 2011. Study on groups of fungi on boles of Pinus sylvestris var. mongolica. Journal of Anhui Agricultural Sciences, 39(5): 2784–2785. |
| [] | Camargo J A. 1992. Can dominance influence stability in competitive interactions?. Oikos,, 64: 605–609. DOI:10.2307/3545183 |
| [] | Hausner G, Iranpour M, Kim J J, et al. 2005. Fungi vectored by the introduced bark beetle Tomicus piniperda in Ontario, Canada, and comments on the taxonomy of Leptographium lundbergii, Leptographium terebrantis, Leptographium truncatum, and Leptographium wingfieldii. Canadian Journal Botany, 83(10): 1222–1237. DOI:10.1139/b05-095 |
| [] | Hurley B P, Slippers B, Wingfield M J. 2007. A comparison of control results for the alien invasive woodwasp, Sirex noctilio, in the southern hemisphere. Agriculture Forest Entomology, 9(3): 159–171. DOI:10.1111/afe.2007.9.issue-3 |
| [] | Hoebeke E R, Haugen D A, Haack R A. 2005. Sirex noctilio: discovery of a palearctic siricid woodwasp in New York. The Great Lakes Entomologist, 50(1): 24–25. |
| [] | Kirk P M, Cannon P F, Minter D W, et al. 2008. Ainsworth & Bisby's Dictionary of the Fungi. 10th edn. Wallingford:CAB International.. |
| [] | King J M. 1966. Some aspects of the biology of the fungal symbiont of Sirex noctilio. Australian Journal of Botany, 14(1): 25–30. DOI:10.1071/BT9660025 |
| [] | Li D P, Shi J, Luo Y Q, et al. 2015. Detection and identification of the invasive Sirex noctilio (Hymenoptera:Siricidae) fungal symbiont, Amylostereum areolatum (Russulales:Amylostereacea), in China and the stimulating effect of insect venom on laccase production by A. areolatum YQL03. Journal of Economic Entomology, 108(3): 1136–1147. DOI:10.1093/jee/tov072 |
| [] | Neumann F G, Minko G. 1981. The sirex wood wasp in Australian radiata pine plantations. Australian Forestry, 44(1): 46–63. DOI:10.1080/00049158.1981.10674289 |
| [] | Noritoshi M. 2002. Kazuyoshi futi factors affecting the number of Bursaphelenchus xylophilus (Nematoda:Aphelenchoid idae) carried by several species of beetles. Nematology, 5(4): 653–658. |
| [] | Nevill R J, Alexander S A. 1992. Transmission of Leptographium procerum to eastern white pine by Hylobius pales and Pissodes nemorensis (Coleoptera:Curculionidae). Plant Disease, 76(3): 307–310. DOI:10.1094/PD-76-0307 |
| [] | Papavizas G C. 1985. Trichoderma and Gliocladium: biology, ecology, and potential for biocontrol. Annual Review of Phytopathology, 2(1): 23–54. |
| [] | Paulus B C, Kanowski J, Gadek P A, et al. 2006. Diversity and distribution of saprobic microfungi in leaf litter of an Australian tropical rainforest. Mycologial Research, 110(12): 1441–1454. DOI:10.1016/j.mycres.2006.09.002 |
| [] | Ryan K, Groot P, Davis C, et al. 2012. Effect of two bark beetle-vectored fungi on the on-host search and oviposition behavior of the introduced woodwasp Sirex noctilio (Hymenoptera:Siricidae) on Pinus sylvestris trees and logs. Journal of Insect Behavior, 25(5): 453–466. DOI:10.1007/s10905-011-9313-5 |
| [] | Slippers B, Wingfield B D, Coutinho T A, et al. 2002. DNA sequence and RFLP data reflect geographical spread and relationships of Amylostereum areolatum and its insect vectors. Molecular Ecology, 11(9): 1845–1854. DOI:10.1046/j.1365-294X.2002.01572.x |
| [] | Slippers B, Wingfield M J, De Groot P. 2012. The Sirex woodwasp and its fungal symbiont. Dordrecht, Heidelberg, London, New York:Springer. |
| [] | Slippers B, Wingfield M J, Coutinho T A, et al. 2001. Population structure and possible origin of Amylostereum areolatum in South Africa. Plant Pathology, 50(2): 206–210. DOI:10.1046/j.1365-3059.2001.00552.x |
| [] | Spradbery J P, Kirk A A. 1981. Experimental studies on the responses of European siricid woodwasps to host trees. Annals of Applied Biology, 98(2): 179–185. DOI:10.1111/aab.1981.98.issue-2 |
| [] | Sun X T, Tao J, Luo Y Q, et al. 2016. Identification of Sirex noctilio (Hymenoptera:Siricidae) using a species-specific cytochrome C oxidase subunit I PCR Assay. Journal of Economic Entomology, 109(3): 1424–1430. DOI:10.1093/jee/tow060 |
| [] | Taylor K. 1981. The Sirex woodwasp:ecology and control of an introduced forest insect//kitching R L, Jones R E.The ecology of pests:some Australian cases histories. Melbourne, CSIRO, 231-248. |
| [] | Thomsen I M, Koch J. 1999. Somatic compatibility in Amylostereum areolatum and A. chailletii as a consequence of symbiosis with siricid woodwasps. Mycological Research, 103(7): 817–823. DOI:10.1017/S0953756298007783 |
| [] | Tribe G. 1995. The woodwasp Sirex noctilio Fabricius (Hymenoptera:Siricidae), a pest of Pinus species, now established in South Africa. African Entomology, 3(2): 215–217. |
| [] | Vasiliauskas R, Tenlid J, Thomsen I M. 1998. Clonality and genetic variation in Amylostereum areolatum and A. chailletii from Northern Europe. New Phytologist, 139(4): 751–758. DOI:10.1046/j.1469-8137.1998.00240.x |
| [] | Vasiliauskas R, Stenlid J. 1999. Vegetative compatibility groups of Amylostereum areolatum and A. chailletii from Sweden and Lithuania.. Mycologial Research, 103(7): 824–829. DOI:10.1017/S0953756298007862 |
| [] | Whipps J M. 2001. Microbial interactions and biocontrol in the rhizosphere. Journal of Experimental Botany, 52(Suppl.1): 487–511. |
| [] | Whitney H S. 1982. Relationships between bark beetles and symbiotic organisms//Mitton J B, Sturgeon K. Bark beetles in North American conifers:a system for the study of evolutionary biology. University of Texas Press, Austin, 183-211. |
 2017, Vol. 53
2017, Vol. 53

