文章信息
- 张玉龙, 池玉杰, 冯连荣
- Zhang Yulong, Chi Yujie, Feng Lianrong
- 偏肿革裥菌锰过氧化物酶酶学性质和染料脱色
- Enzymology Characteristics and Dye Decolorization of Manganese Peroxidase from Lenzites gibbosa
- 林业科学, 2017, 53(9): 73-80.
- Scientia Silvae Sinicae, 2017, 53(9): 73-80.
- DOI: 10.11707/j.1001-7488.20170909
-
文章历史
- 收稿日期:2016-06-07
- 修回日期:2016-11-10
-
作者相关文章
2. 辽宁省杨树研究所 盖州 115213
2. The Poplar Institute of Liaoning Province Gaizhou 115213
白腐真菌分泌的锰过氧化物酶(MnPs)能裂解木质素聚合物、多环芳烃、多氯联苯等农药和染料中的侧链和芳环部分,近年来国内外很多的研究者都进行了白腐菌的酶学性质及MnPs、漆酶等在染料脱色领域的研究(Lu et al., 2007; 赵丽红, 2008; Si et al., 2013)。对MnPs的酶学性质的研究主要集中在对MnP相对分子量、等电点和米氏常数(Km)的测定;MnP最适反应温度及pH值;MnP对温度及pH值的稳定性(Cheng et al., 2007);Mn2+、Cu2+、Fe3+、Zn2+、Ca2+、Co3+、Mg2+等金属离子对MnP稳定性的影响(Cai et al., 2010);不同底物如2, 6-二甲氧基苯酚(2, 6-DMP)、ABTS [2, 2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐]、藜芦醇、愈创木酚对MnP稳定性的影响(Périé et al., 1996)。每种白腐菌所产的MnPs是有差别的,而且同一种白腐菌也可以产生几种催化特性不完全相同的MnP同工酶(Steffen et al., 2002)。本试验在对偏肿革裥菌(Lenzites gibbosa)分泌的MnPs进行纯化、获得Lg-MnP纯酶的基础上,用SDS-PAGE检测了MnP表观分子量,对纯化后的酶进行氨基酸序列鉴定与酶学性质研究,并用菌种培养液和纯酶对茜素红、刚果红、中性红和结晶紫等4种染料进行了脱色降解研究,以期详细了解Lg-MnP的性质,以期了解菌种培养物和纯酶各自对染料的脱色降解能力及其在木质素降解、染料脱色领域的实际应用奠定酶学基础。
1 材料与方法 1.1 纯化后的电泳样品中氨基酸序列的测定凝胶过滤柱层析后经浓缩和冷冻干燥的MnP蛋白纯化样品(总MnP活力和比活力分别为43.38 U和33.63 U·mg-1),经SDS-PAGE后,将获得的唯一MnP条带切割,送ProtTech公司采用纳米液相色谱-电喷雾电离串联质谱法联用(Nano LC-ESI-MS/MS)多肽测序技术进行蛋白氨基酸序列的测定。对从凝胶中回收的唯一条带中所含有的蛋白质样品,利用根据测序梯度改良的胰蛋白酶消化后的多肽混合物用LC-ESI-MS/MS测序系统进行具体分析,这一过程中,高效液相色谱(HPLC)和带有一个离子捕捉器的质谱仪联机工作,HPLC中具有一个内径为75 nm的反相C18毛细管分离柱的测微计,获得的质谱数据在ProtTech公司软件中搜索最新的非冗余蛋白序列数据,在得出报告之前还要对数据库的输出结果进行手动验证,更多试验的细节可参阅www.prottech.com。LC-ESI-MS/MS法的结果是基于独立的肽段测序,可得到确切存在于样品中的蛋白质名单,对蛋白质的鉴定有近100%的可靠性,一般情况下由2个或以上的多肽组成的蛋白质可靠性大于99.99%。
1.2 SDS-PAGE检测纯化后的MnP蛋白表观分子量上述MnP蛋白纯化样品,用SDS-PAGE检测分子量。计算已知分子量的蛋白质Marker在电泳谱带图中的相对迁移率Rf,并和已知分子量作图,建立标准直线,根据MnP酶液样品唯一条带的Rf值,从标准直线上求出MnP纯酶的表观分子量。
1.3 MnP酶学性质研究 1.3.1 最适反应温度及温度稳定性参照酶活测定方法:分别向8只1 mL的比色皿中依次加入pH4.5的840 μL 50 mmol·L-1的丙二酸钠、50 μL 10 mmol·L-1的MnSO4、50 μL 10 mmol·L-1的2, 6-DMP,在15、25、35、45、55、65、75、85 ℃下保温5 min,再迅速加入50 μL纯酶样品和10 μL 10 mmol·L-1的H2O2,启动反应,测定MnP酶活,以相同温度1 mL去离子水作为对照,以温度为横坐标,以相对酶活力为纵坐标作图(以酶活最高者为100%)。在8只1.5 mL离心管中加入0.5 mL酶液,分别在4、10、20、30、40、50、60、70 ℃下保温1 h,然后在室温下测酶活,以未保温酶液的酶活力为100%。
1.3.2 最适反应pH值及pH值稳定性称取一定量的丙二酸溶于去离子水中,用NaOH调节pH值使其分别成为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0的50 mmol·L-1丙二酸钠缓冲液,用这些缓冲液替代原来pH4.5的缓冲液后测定酶活力,以pH值为横坐标,以相对酶活力为纵坐标作图(以酶活最高者为100%)。在室温下,将50 μL纯酶样品分别加入到pH值为3、4、5、6、7、8、9的50 mmol·L-1丙二酸钠缓冲液溶液中1和12 h,分别测定其残余酶活力,以1 h和12 h的酶活为纵坐标作图(以在pH4.5中缓冲体系的酶活为100%)。
1.3.3 米氏动力学常数Km值的测定采用lineweaver-Burk双倒数作图法求解Km值:将2, 6-DMP分别配制成5、10、15、20和25 mmol·L-1浓度的溶液,作为底物。在采用不同浓度底物测定酶活的反应体系中室温保存5 min,再迅速加入50 μL纯酶样品和10 μL 10 mmol·L-1的H2O2,启动反应,测定A470,以计算酶促反应初速度。以底物浓度的倒数为横坐标,以酶反应的初速度的倒数为纵坐标,作lineweaver-Burk双倒数图,建立标准直线,求解标准直线方程式,再从标准直线方程式导出Km值。
1.4 菌种培养液和MnP纯酶对4种染料的脱色试验 1.4.1 4种染料最大吸收峰处的波长值、吸光度A与浓度C标准曲线的绘制选择蒽醌类的茜素红、偶氮类的刚果红、杂环类的中性红和三苯基甲烷类的结晶紫4种不同结构类型的染料,分别配制50 mg·L-1的水溶液,用紫外分光光度计在波数300~800 nm区间内扫描,以得到吸收光谱图,从中查找4种染料最大吸收峰处的吸光值Ao及其对应的波长值λmax,以去离子水为对照。将4种染料分别配制成浓度为0、20、40、60、80、100 mg·L-1的溶液,在各自的最大吸收峰处波数值下测定其吸光度值Ai,以浓度C(mg·L-1)为横坐标,吸光值Ai为纵坐标,绘制标准直线,得出吸光度值与浓度相互关系的标准方程。
1.4.2 L.gibbosa培养液的染料脱色试验利用已经优化的培养基与培养条件培养L. gibbosa(张玉龙等,2012),称取4种染料各0.07 g,加入100 mL去离子水,灭菌后吸取5 mL加入到已经培养15天的菌种液体培养基中,使各种染料的终浓度为50 mg·L-1。静止培养脱色,在加入染料后的1 min、1 h、12 h、36 h,或直到达到最大脱色率为止,测定各自染料最大吸收峰波长处的吸光值Ai,根据1.4.1中的标准直线将染料的Ao和Ai值转化为相应的染料浓度Co和Ci,以不加染料的菌液为对照,计算其脱色率,脱色率(%)=[(Co-Ci)/Co]×100%。
1.4.3 MnP纯酶液的染料脱色试验纯酶降解体系参照酶活测定体系:pH4.5的50 mmol·L-1丙二酸钠缓冲液840 μL、10 mmol·L-1的MnSO4 50 μL、10 mmol·L-1的染料样品50 μL、MnP纯酶液50 μL、10 mmol·L-1的H2O210 μL。进行2个对照试验:对照1是将50 μL酶液用缓冲液替代;对照2是将H2O2用缓冲液替代。上述各反应在比色皿中进行,第1 min、1 h、2 h、3h、4 h测定各染料在各自最大吸收峰处波数值下的吸光值。用1.4.1中的标准直线计算出染料浓度,用1.4.2中的方法计算脱色率。
2 结果与分析 2.1 纯化后的MnP电泳样品中氨基酸序列鉴定送检样品为SDS-PAGE得到的唯一电泳条带,在电泳之前和电泳过程中蛋白质样品会受到多次干扰而充分变性,并分解成独立的肽段,测序是从杂乱的多种肽段序列中寻找保守的MnPs等氨基酸序列,ProtTech公司的蛋白氨基酸序列鉴定结果见表 1,单一电泳条带中存在几种分子量相近的蛋白质肽段,表明纯化的MnP样品中含有多种蛋白。解析出的每种多肽序列数量可用来指示其在蛋白样品中的相对含量,如一序列被多次扫描就是多次出现的。串联质谱扫描出2条MnPs的保守序列肽段,1条序列LTFHDAIGISPK的分子量是1 297.70 Da,重复出现25次,为MnP的远端组氨酸保守区;1条TVPEPFDTVDSILAR的分子量为1 658.85 Da,出现1次,为MnP的芳香环结合位点及其后序列。这2条MnPs肽段与笔者已经克隆到的Lg-mnp1基因编码的Lg-MnP1(GenBank登录号:ACO92620) 蛋白(闫洪波等,2014)完全吻合,是L. gibbosa同一个MnP上的序列,在表 1的Sequence Header中也明确显示出来。由于肽段LTFHDAIGISPK数量最多,表明其所代表的锰过氧化物酶蛋白Lg-MnP1就是唯一电泳带中的主要蛋白。表 1最下方显示1条漆酶的保守序列肽段ANPSFGTTGFAGGINSAILR,分子量为1 950 Da,出现1次,这是真菌漆酶特征性的LoopⅡ及其后面的序列,与笔者已经克隆到的Lg-lac2基因编码的漆酶Lg-Lac2(GenBank登录号:AEQ28164) 序列完全吻合,在Sequence Header中以gb|ADK13091.1|显示出来。由于该肽段重复出现次数少,表明其所代表的漆酶蛋白Lg-Lac2是非主要的蛋白。3条LiP的保守序列肽段分别出现1次、3次和3次,都列在同一个LiP下,与Eggert等(1996)发表的朱红密孔菌(Pycnoporus cinnabarinus)的LiP保守序列完全吻合,在Sequence Header中以gb|ADK60913.1|显示出来。其中第1条肽段序列仅比第2条多一个赖氨酸K,其后24个氨基酸序列完全一致,是含有VPEP芳香环结合位点的序列。这3条LiP肽段所代表的LiP蛋白也是非主要的蛋白。由于笔者尚未克隆出完整的L. gibbosa lip基因,无法得知LiP蛋白序列,这3条LiP的肽段序列还有待进一步验证。
|
|
根据纯化后MnP样品SDS-PAGE谱带图绘制的蛋白Marker分子量与迁移率的标准直线见图 1,得出直线方程式。电泳图中纯化样品的迁移率为64.56%,计算出Lg-MnP1的表观分子量为45.39 kDa,这与大多数文献报道的MnPs纯化后的表观分子量相当(Schneegaβ et al., 1997; Bermek et al., 2004; Cai et al., 2010)。电泳带中主要蛋白Lg-MnP1其一级结构得到的精确分子量为35.94 kDa,与表观分子量45.39 kDa略有不符,推测原因可能是由于酶蛋白一级序列表达形成三级结构时糖基化而增加了分子量的结果,虽然成熟蛋白在电泳之前和之时三级结构遭到破坏,血红素辅基可能断掉,但是连接的糖基化分子可能未断裂掉。
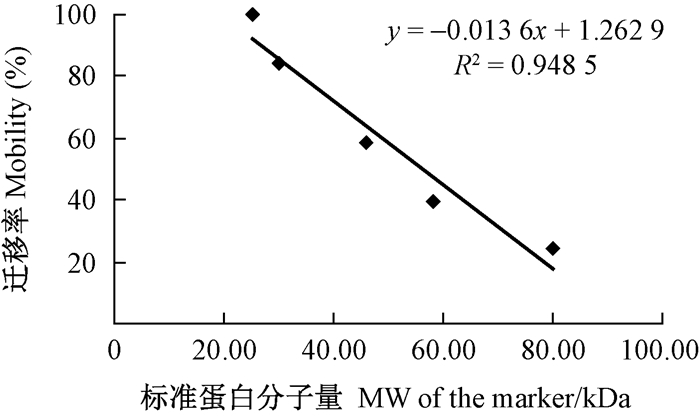
|
图 1 标准蛋白分子量标准直线 Fig.1 The standard curve of molecular weight of protein marker |
图 2A所示为MnP最适反应温度曲线图,初期随温度的升高酶促反应逐渐升高,在35 ℃时达到最高,之后缓慢下降。适当的高温能加速酶促反应,但是温度过高会导致酶活性丧失,从而失去催化能力。图 2B所示为MnP对于温度的耐受性,表明在低于40 ℃的条件下MnP都具有一定的催化能力,但是温度超过50 ℃后活力迅速下降直至失活。
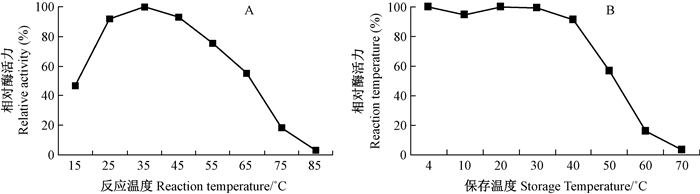
|
图 2 Lg-MnP1最适反应温度和温度稳定性 Fig.2 The optimal reaction temperature and thermal stability of Lg-MnP1 |
图 3A和3B表明Lg-MnP1最适反应pH值和不同pH下的稳定性,其最适反应pH值为3.5,超过4.5活性就会迅速下降,其在pH2—3时最稳定。酶的最适反应pH值与底物的基团和参与催化基团的pK值有关,pH会影响底物分子和酶蛋白分子的解离状态,通常只有一种解离状态最有利于酶与底物的结合,即在此pH下酶活力最高,过高过低都会影响酶蛋白的构象,甚至导致酶的变性失活。当缓冲液的pH值改变不很大时,酶蛋白虽然不变性,但其活力会受到影响。已有报道MnPs最适反应pH值一般为2~6(Cheng et al., 2007),而Lg-MnP1较适宜偏酸性的环境。
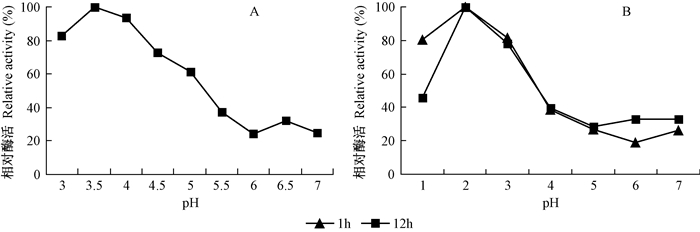
|
图 3 MnP最适反应pH值和在不同pH值下的稳定性 Fig.3 The optimal reaction pH value and stability under different pH value of MnP |
图 4为以底物浓度的倒数为横坐标,以酶反应的初速度的倒数为纵坐标,获得的lineweaver-Burk双倒数图,获得的标准直线方程式标注其上,通过该方程式求得的X轴截距倒数的绝对值即为Lg-MnP1以2, 6-DMP为底物的米氏常数,在室温21 ℃条件下Km=6.124 mmol·L-1,大多数纯酶的Km值在0.01~100 mmol·L-1,该Km值表明Lg-MnP1与底物2, 6-DMP的亲和力较大。
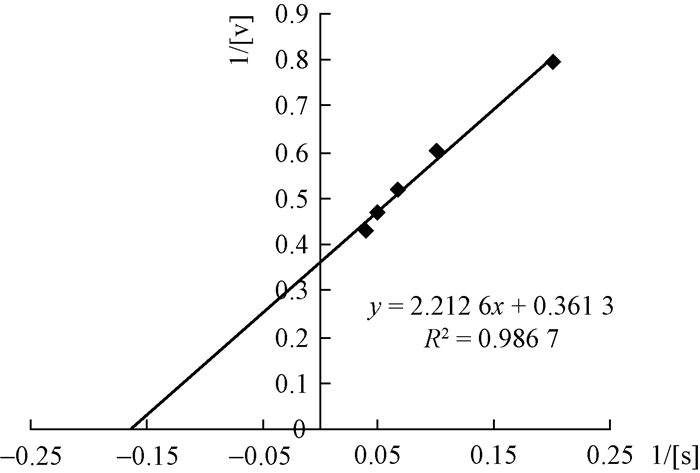
|
图 4 Lg-MnP1的lineweaver-Burk双倒数图 Fig.4 The lineweaver-Burk double bottom figure of Lg-MnP1 |
从4种染料最大吸收峰光谱图查到最大吸收峰处的吸光值Ao及其对应的波长值λmax如下:茜素红0.700、422 nm;刚果红1.900、496 nm;中性红3.615、517 nm;结晶紫3.811、568 nm。4种染料在其最大吸收峰处波数值下吸光度A与浓度C标准直线见图 5A-D。
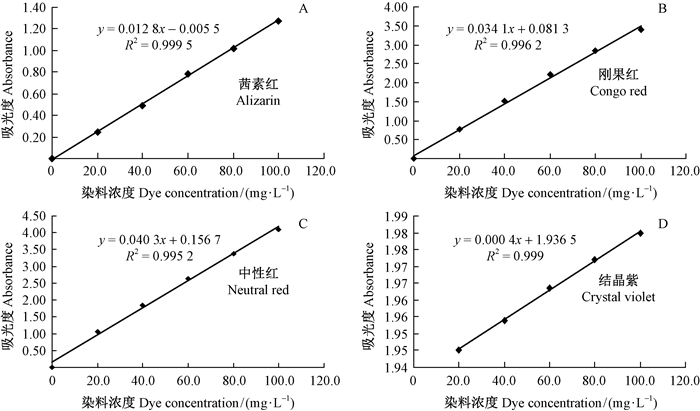
|
图 5 4种染料最大吸收峰光谱图和吸光度A与浓度C标准直线 Fig.5 The maximum absorption peak spectrogram and Absorbance(A) and Concentration (C) standerd curve of four dyes |
4种染料浓度随时间变化曲线见图 6A-C。L.gibbosa含有菌丝体的培养液对茜素红的脱色率在1 h时就达到了100%;而对中性红和刚果红在1 h的脱色率分别为22.17%和19.09%,在36 h的脱色率分别为33.63%和25.09%;对结晶紫的脱色率很低,在36 h脱色率仅为0.018%。
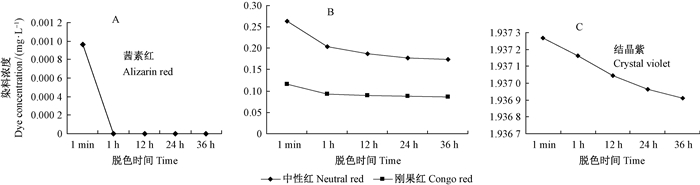
|
图 6 在L.gibbosa培养液内4种染料浓度随时间的变化曲线 Fig.6 The concentration change curve of four dyes with time in the culture fluid of L.gibbosa |
Lg-MnP1纯酶液对4种染料的脱色降解效果见图 7A-D,可以看出染料浓度一般在2 h内迅速下降,并在之后的时间里趋于稳定。对照1为不加酶液的反应体系,对照2为加酶液不加H2O2的反应体系。由于H2O2对染料同样具有氧化降解作用,并且它是启动MnP催化降解反应的因子,试验组数据减去对照2,就是酶在添加H2O2的情况下减去了酶不添加H2O2时的降解效果,即H2O2的作用;试验组数据减去对照1,就是减去了H2O2对染料的降解效果,排除掉H2O2对染料降解的干扰作用后,从而反映Lg-MnP1的真实降解能力。数据分析的结果表明,对于中性红、刚果红和茜素红,试验组数据减去对照1总是比试验组数据减去对照2的降解效果要好(结晶紫的除外,但二者接近),说明酶在不添加H2O2时对中性红、刚果红和茜素红也有较强的降解效果,而单独H2O2对染料降解能力较低。统计Lg-MnP1对4种染料的最大脱色率,在2 h分别为中性红100.00%、刚果红95.55%、茜素红75.85%和结晶紫36.57%;在3 h刚果红为96.29%,在4 h茜素红为77.51%、结晶紫为51.82%。前3种染料的最大脱色率都是试验组数据减去对照1得到的,只有结晶紫是试验组数据减去对照2的结果。
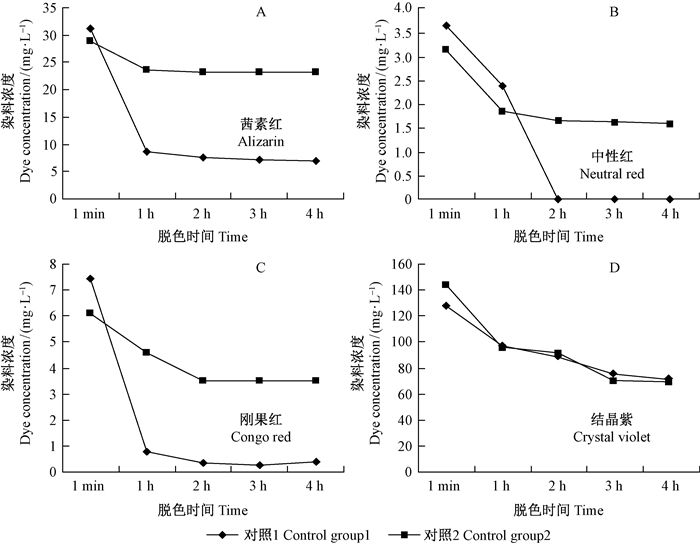
|
图 7 Lg-MnP1纯酶液对4种染料的脱色降解效果 Fig.7 The decoloring effect with time to four dyes of the purified Lg-MnP1 solution |
L.gibbosa在木质素条件下能分泌漆酶和MnPs,其液体培养物除了液面液内含有菌丝体外,液内还含有这2种酶。纯化后的Lg-MnP1其比活力和蛋白浓度都比培养液高很多,比较培养液和Lg-MnP1纯酶对4种染料的脱色效果可知,中性红、刚果红和结晶紫,纯酶的脱色效果明显高于同时含有菌丝体、漆酶和MnPs的培养液,而且纯酶的脱色时间缩短很多,通常在2 h就达到较高的脱色率。Lg-MnP1纯酶对中性红和刚果红脱色效果显著,这与慕庆峰等(2005)报道的白腐菌在Mn2+浓度较高Cu2+浓度较低的条件下对刚果红脱色效果显著相一致,推测L.gibbosa MnP对刚果红的降解可能强于漆酶所起的作用,并且依赖于较高浓度Mn2+的存在。而对于茜素红,培养液的脱色效果高于纯酶,在1 h时就达到了100%,推测菌丝体或漆酶对茜素红有较强的吸附脱色作用和酶促降解作用。
3 讨论本试验氨基酸测序结果表明,SDS-PAGE电泳的唯一条带虽然不是纯一的蛋白肽段,但其中多数属于同一个MnP蛋白,表明L.gibbosa的MnP已得到基本纯化。Lg-MnP1纯酶在4~40 ℃之间均有良好的催化稳定性,笔者的跟踪检测也表明该纯酶在4 ℃时保存1个月后依然具有催化活性。纯酶的脱色效率高,需要H2O2的协助。在氨基酸测序结果中发现了3条LiP氨基酸保守序列,与朱红密孔菌L. gibbosa能够分泌LiP,P. cinnabarinus的LiP氨基酸保守序列类似,说明L. gibbosa在液体培养条件下不但有MnPs和漆酶产生,也有少量的LiP产生,但是酶活检测都没有检测到LiP活性。LiP活性没有检测到,推测原因一是表达量可能很低;二是测定方法可能还需改进。酶活性的测定通常以这种酶能够作用的某种特异性底物来衡量,测定LiP的底物藜芦醇为3,4-二甲氧基苯甲醇,是具有芳香结构的有机化合物之一,用这种底物可能即使酶液里有微量的LiP,也不容易测定出来。笔者已克隆到一个疑似LiP的基因片段(闫洪波等,2014),但由于尚未得到全长,还无法确定与在氨基酸测序结果中发现的LiP氨基酸保守序列的关系。在虫拟蜡菌(Ceriporiopsis subvermispora)等白腐菌中,也发现了在培养液中没有检测到LiP活性,却克隆到LiP基因的现象(Rajakumar et al., 1996)。
4 结论SDS-PAGE得到的唯一一条电泳带中的MnP是Lg-MnP1。Lg-MnP1是一种中温性、偏酸性的酶,与2, 6-DMP的亲和力较大。L.gibbosa含菌丝的培养液对茜素红具有彻底的降解效果,但Lg-MnP1纯酶液对中性红、刚果红和结晶紫的降解效率要远高于同时含有菌丝、漆酶和MnPs的培养液。
| [] |
慕庆峰, 赵敏, 钱程. 2005. 血红密孔菌对刚果红脱色的共培养体系优化的研究. 中国造纸学报, 20(2): 95–100.
( Mu Q F, Zhao M, Qian C. 2005. Optimization of Pycnoporus sanguineus to dye degradation co-culturing system. Transactions of China Pulp and Paper, 20(2): 95–100. [in Chinese] ) |
| [] |
闫洪波, 池玉杰, 吴书景. 2014. 偏肿草裥苗Lg-mnp1基因克隆及表达研究. 安徽农业科学, 42(11): 3186–3190.
( Yan H B, Chi Y J, Wu S J. 2014. Cloning of Lg-mnp1 gene from Lenzites gibbosa and heterologous expression. Journal of Anhui Agri Sci, 42(11): 3186–3190. DOI:10.3969/j.issn.0517-6611.2014.11.011 [in Chinese] ) |
| [] |
赵丽红. 2008. 糙皮侧耳(Pleurotus ostteatus)降解棉浆黑液木质素的研究. 大连: 大连理工大学博士学位论文. ( Zhao L H. 2008. Study on the degradation of lignin in cotton pulp black liquor by Pleurotus ostreatus. Dalian:PhD thesis of Dalian University of Technology.) |
| [] | Bermek H, Yazıcı H, Öztürk H. 2004. Purification and characterization of manganese peroxidase from wood-degrading fungus Trichophyton rubrum LSK-27. Enzyme and Microbial Technology, 35(1): 87–92. DOI:10.1016/j.enzmictec.2004.04.004 |
| [] | Cai Y, Wu H, Liao X, et al. 2010. Purification and characterization of novel manganese peroxidase from Rhizoctonia sp. SYBC-M3. Biotechnology and Bioprocess Engineering, 15(6): 1016–1021. DOI:10.1007/s12257-010-0130-z |
| [] | Cheng X, Jia R, Li P, et al. 2007. Purification of a new manganese peroxidase of the white-rot fungus Schizophyllum sp. F17, and decolorization of azo dyes by the enzyme. Enzyme and Microbial Technology, 41(3): 258–264. DOI:10.1016/j.enzmictec.2007.01.020 |
| [] | Lu L, Zhao M, Zhang B B, et al. 2007. Purification and characterization of laccase from Pycnoporus sanguineus and decolorization of an anthraquinone dye by the enzyme. Appl Microbiol Biotechnol, 74(6): 1232–1239. DOI:10.1007/s00253-006-0767-x |
| [] | Périé F H, Sheng D, Gold M H. 1996. Purification and characterization of two manganese peroxidase isozymes from thewhite-rot basidiomycete Dichomitus squalens. Biochimica et Biophysica Acta, 1297(2): 139–148. DOI:10.1016/S0167-4838(96)00096-9 |
| [] | Rajakumar S, Gaskell J, Cullen D, et al. 1996. lip-like genes in Phanerochaete sordida and Ceriporiopsis subvermispora, white rot fungi with no detectable lignin peroxidase activity. Applied and environmental microbiology, 62(7): 2660–2663. |
| [] | Schneegaẞ I, Hofrichter M, Scheibner K, et al. 1997. Purification of main manganese peroxidase isoenzyme MnP2 from the white-rot fungus Nematoloma frowardii b19. Appl Microbiol Biotechnol, 48(5): 602–605. DOI:10.1007/s002530051102 |
| [] | Si J, Peng F, Cui B. 2013. Purification, biochemical characterization and dye decolorization capacity of analkali-resistant and metal-tolerant laccase from Trametes pubescens. Bioresource Technology, 128: 49–57. DOI:10.1016/j.biortech.2012.10.085 |
| [] | Steffen K T, Hofrichter M, Hatakka A. 2002. Purification and characterization of manganese peroxidase from thelitter-decomposing basidiomycetes Agrocybe praecox and Stropharia coronilla. Enzyme and Microbial Technology, 30(4): 550–555. DOI:10.1016/S0141-0229(01)00525-7 |
 2017, Vol. 53
2017, Vol. 53

