文章信息
- 徐嘉娟, 李火根
- Xu Jiajuan, Li Huogen
- 鹅掌楸LcPAT8基因的克隆及功能初步分析
- Cloning and Primary Functional Analysis of LcPAT8 Gene from Liriodendron chinense
- 林业科学, 2017, 53(9): 45-54.
- Scientia Silvae Sinicae, 2017, 53(9): 45-54.
- DOI: 10.11707/j.1001-7488.20170906
-
文章历史
- 收稿日期:2016-12-19
- 修回日期:2017-03-29
-
作者相关文章
2. 贵州省林业科学研究院 贵阳 550005
2. Guizhou Academy of Forestry Guiyang 550005
植物的生长发育由基因控制,不同组织器官的形态、结构、功能的分化与特异基因的种类、数量及时空上的表达差异密切相关(张春玲, 2014)。分离有潜在应用价值的基因并进行深入研究,运用基因工程技术手段进行基因表达分析,对于功能基因挖掘及开展植物分子育种等方面均具有十分重要的意义。林木种质资源丰富,种质间遗传差异大,克隆林木重要性状基因并通过遗传转化加以利用,这是未来开展林木分子育种的一条重要途径。
蛋白的翻译后修饰(posttranslational modification)与植物体内许多的过程,如DNA复制和损伤修复、细胞分化、染色质凝聚和转录活性等相关,与蛋白质完整功能的正确行使息息相关(Pedro et al., 2012;Schönichen et al., 2013;阮班军等, 2014;Marino et al., 2015)。蛋白质翻译后修饰包括乙酰化、甲基化、磷酸化、泛素化、糖基化、脂质化等(Hildmann et al., 2007)。蛋白质乙酰化能够改变染色质的结构以及调控基因的转录、DNA复制和损伤修复,在植物生长发育、衰老和胁迫应答中发挥重要作用(Yuan et al., 2013),组蛋白去乙酰化酶基因HD1可能通过胁迫和激素响应和应答途径调控植物的衰老。许多蛋白质的甲基化酶在植物衰老和发育过程中也具有重要作用(Dijk et al., 2010;Zong et al., 2013;Widiez et al., 2014)。棕榈酰化修饰是众多翻译后修饰类型中最普遍且唯一可逆的脂质修饰形式,在蛋白活性调控(Abrami et al., 2008;Linder et al., 2007)、稳定性维持、膜结构之间的转运以及信号传导等过程中发挥着重要作用(Smotrys et al., 2004;Huang et al., 2005;Batistič et al., 2008),其可逆性增加了对底物蛋白调控的动态性和精确性(Greaves et al., 2011;Guan et al., 2011)。催化棕榈酰化修饰的酶被称为蛋白质棕榈酰基转移酶(protein S-acyltransferases,PATs),DHHC-CRD(半胱氨酸富集域)类蛋白质酰基转移酶是真核生物PATs中研究最多的家族。DHHC(Asp-His-His-Cys)型锌指结构域是一种富含高度保守的半胱氨酸残基聚集域,具有C2H2型锌指结构特征,属于类C2H2型锌指结构。目前将富含DHHC型锌指结构域的蛋白称为DHHC蛋白,它们组成DHHC蛋白质家族(Abrami et al., 2008)。已有的研究表明,DHHC型锌指蛋白在植物的生长发育过程中起着非常重要的作用。例如,从拟南芥(Arabidopsis thaliana)突变体中分离得到的DHHC型锌指蛋白TIPl是首个报道的具有棕榈酰基转移酶活性的植物PAT,参与植株细胞的极性生长和细胞延伸,在植株生长发育过程中具有极为重要的作用(Hemsley et al., 2005)。周良子(2013)发现拟南芥中的PAT10参与植株生长发育的多个过程,同时在植株对外界盐胁迫响应过程中起着重要作用(Zhou et al., 2013)。水稻(Oryza sativa)DHHC型锌指蛋白基因OsDHHC1和OsDHHC13分别参与水稻株型构建和氧化胁迫反应(周波, 2011;王文文, 2016)。2个同源的蛋白质酰基转移酶PAT13和PAT14参与拟南芥叶片衰老调控(Lai et al., 2015;Zhao et al., 2016)。
鹅掌楸(Liriodendron chinense)是木兰科(Magnoliaceae)鹅掌楸属(Liriodendron)植物,分布在我国长江流域以南的亚热带中、低山区(王章荣, 2005),是我国特有的珍稀植物。目前,国内外有关鹅掌楸功能基因组学研究还很少,也缺乏相关功能基因的研究,限制了对其表型性状的遗传学机制的了解。研究鹅掌楸生长发育的遗传基础、发掘生长性状相关的功能基因,对于了解鹅掌楸重要性状的遗传基础,以及今后开展鹅掌楸分子育种等方面均具有重要意义。本课题组前期工作筛选到与鹅掌楸生长性状关联的7个SSR位点(姚俊修, 2013)。本研究以其中1个位点(642位点)为目标,以鹅掌楸叶芽为材料,运用RT-PCR和RACE相结合的方法,克隆分离该位点对应基因的全长,分析该基因的序列特征;利用实时荧光定量PCR(quantitative real-time PCR,qPCR)技术分析其组织表达特性;同时,构建该基因的植物过量表达载体,转化模式植物拟南芥对其功能进行初步研究,以期为揭示鹅掌楸生长发育、形态建成的分子机制及功能基因的挖掘奠定一定的基础。
1 材料与方法 1.1 试验材料供试材料来源于南京林业大学下蜀实习林场鹅掌楸属种源试验林(种源来自江西庐山,代号LS),树龄20年,4月份采集花芽,5月份采其盛花期的叶芽、叶片、花瓣、雄蕊、雌蕊,分装于无RNA酶的离心管并迅速放入液氮速冻,-80 ℃保存备用。
1.2 基因全长cDNA序列的获取采用天根公司的RNAprep Pure Plant Kit(DP432) 试剂盒提取上述鹅掌楸样品的总RNA。根据从本实验室鹅掌楸转录组数据库(Yang et al., 2014)中筛选获得的与鹅掌楸生长性状相关联的642号位点对应的EST序列(姚俊修, 2013),利用Oligo 6软件按照TaKaRa公司的3′-Full RACE Core Set with PrimeScript RTase试剂盒巢式PCR的要求,设计基因3′末端扩增引物:LcPAT8-3GSP1(5′-GTTGCTTCTTGCTACTTCTGCCC-3′),LcPAT8-3GSP2(5′-CCAAGTCTACAGTTTCCTCGTACC-3′)。用上述3′RACE试剂盒以叶芽总RNA为模板合成3′RACE cDNA,利用LcPAT8-3GSP1、LcPAT8-3GSP2分别进行第1轮和第2轮嵌套式PCR,扩增3′端序列,反应体系及扩增条件同3′RACE试剂盒说明书,退火温度分别为56 ℃和57 ℃;扩增产物经2%琼脂糖凝胶电泳检测切取目的条带,利用AxyPrep DNA Gel Extraction Kit(Axygen)试剂盒进行回收、纯化,连接到pEASY-T1 Cloning Vector(TransGen Biotech)载体,转化Trans1-T1感受态细胞(TransGen Biotech);经蓝白斑筛选,挑取阳性单克隆,由上海英骏生物技术有限公司测序,获得基因3′端序列。
根据获取的3′端序列,按照5′-Full RACE Kit(TaKaRa)试剂盒要求设计5′末端扩增引物:LcPAT8-5GSP1(5′-TTCTCGTATGTGGTCTGGTTGGT G-3′),LcPAT8-5GSP2(5′-AGTAAGACCACCAACA AACCACAGGGAG-3′)。以叶芽总RNA为模板,利用该试剂盒合成5′RACE cDNA,用LcPAT8-5GSP1和LcPAT8-5GSP2分别进行第1轮和第2轮PCR,扩增5′端序列,反应体系及扩增条件同5′ RACE试剂盒说明书,退火温度分别为58 ℃和63 ℃。克隆测序过程同上,获得基因的5′端序列。
将获得的3′端和5′端序列利用DNAMAN 6.0软件进行拼接,获得基因全长cDNA序列,利用FGENESH软件预测所得基因的ORF序列,设计正向引物LcPAT8OF(5′-ATGGCCAAGCGCGTCTACCA AG-3′)和反向引物LcPAT8OR(5′-CTAATGGCGT GCTTCCCTCTGC-3′),利用RevertAid strand cDNA Synthesis Kit(Thermo Scientific)反转录试剂盒,以叶芽总RNA为模板合成cDNA第1链,用2×TransStart FastPfu PCR SuperMix(TransGen Biotech)进行PCR扩增,获取基因ORF序列,反应体系参照徐嘉娟等(2016)。反应条件为:预变性(94 ℃,3 min);变性(94 ℃,30 s),退火(60 ℃,30 s),延伸(72 ℃,2 min),30个循环;总延伸(72 ℃,10 min)。克隆测序过程同上,连接载体为pEASY-Blunt(TransGen Biotech)。
1.3 基因生物信息学分析利用各生物信息学分析软件对目的基因的ORF、编码的氨基酸序列、结构域、二级结构等进行分析(表 1)。
|
|
以花芽、叶芽、叶片、花瓣、雄蕊、雌蕊6个不同组织样品总RNA为模板,均一化浓度后,利用Invitrogen的M-MLV First Strand Kit试剂盒合成用于qPCR的cDNA,进行实时定量分析,检测目的基因在6个组织中的相对表达量。根据SYBR Premix Ex Taq(Tli RNaseH Plus)(TaKaRa)qPCR试剂盒的要求,利用Primer Express Software version 3.0(Applied Biosystems)软件设计qPCR引物(胥猛等, 2011):LcPAT8qF(5′-AGAGGGAAGCACGCCATTAG GT-3′)和LcPAT8qR(5′-TTACACCAGCCTACCGCC TTTGA-3′);内参基因上下游引物:ACT-F(5′-TCGAGCAGGAGCTAGAGACA-3′)和ACT-R:(5′-AAGAGATGGCTGGAAGAGGA-3′)(罗群凤等, 2015)。qPCR反应在ABI 7500 PCR仪上完成,每个反应重复3次,反应体系及PCR程序参照上述试剂盒说明书。
1.5 LcPAT8植物过表达载体构建根据克隆所得LcPAT8基因全长cDNA序列,在ORF开头和结尾设计引物(包含终止密码子)(见1.2),扩增基因编码区,通过克隆测序确定目的片段。采用Gateway技术构建植物表达载体:利用pCR 8/GW/TOPO TA Cloning Kit进行TOPO克隆,将目的基因克隆到供体载体pCR 8/GW/TOPO上,通过克隆测序确定含有目的基因的入门载体;利用Gateway LR Clonase Ⅱ Enzyme Mix将入门载体与目的载体pH35GS(由南京林业大学胥猛副教授惠赠)进行LR重组反应,构建目的基因过表达载体,克隆测序确定目的片段及插入方向后,回收纯化LR反应所得的目的基因植物过表达载体,-20 ℃保存备用。
1.6 拟南芥转化、转基因植株检测与表型观察采用电击法将含有目的基因的植物过表达载体质粒转入根癌农杆菌(Agrobacterium tumefaciens)菌株GV3101感受态细胞,并通过拟南芥花絮浸染法转化拟南芥(刘青等, 2014),培养收种获得大量T0代种子。经潮霉素B抗性筛选(潮霉素B 30 mg·L-1)种植获得T1代植株。正常生长的T1代阳性转基因植株及野生型拟南芥植株移植2周后,用植物基因组DNA提取试剂盒(TIANGEN)提取拟南芥叶片DNA,利用表达载体pH35GS上的35S引物和基因特异性后向引物LcPAT8OR(见1.2) 进行PCR扩增检测,同时以质粒DNA和野生型拟南芥的DNA作为对照。PCR鉴定的T1代阳性植株成熟后收种子,进行抗性筛选(潮霉素B 30 mg·L-1),将筛选所得阳性植株移栽获得T2代植株,观察转基因植株的表型变异并拍照。
2 结果与分析 2.1 LcPAT8基因全长序列的获得及编码蛋白分析 2.1.1 LcPAT8基因cDNA全长的获得及序列分析通过3′ RACE和5′ RACE扩增分别获得1 102 bp(图 1A)和1 247 bp(图 1B)的序列;采用DNAMAN 6.0软件进行拼接获得基因全长cDNA序列(1 968 bp)。根据全长序列预测目的基因ORF,设计引物进行ORF扩增(图 1C)和测序验证,测序结果与拼接结果一致,获得基因全长cDNA序列。利用在线工具FGENESH对其ORF及所编码氨基酸序列进行预测,将其在NCBI蛋白质数据库中进行blastp比对。结果表明,该基因编码的蛋白与其他植物中预测的PAT高度相似,并根据与拟南芥PAT的比对结果,将其命名为LcPAT8。
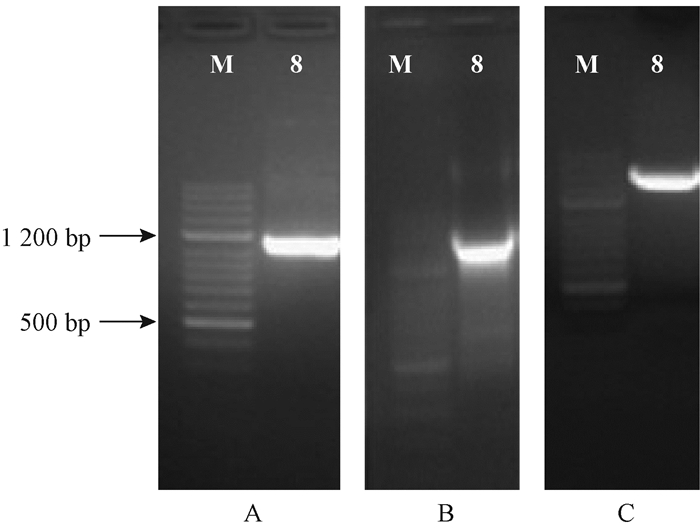
|
图 1 鹅掌楸LcPAT8基因的PCR扩增结果 Fig.1 Amplification results of LcPAT8 gene fragments M: 100 bp-ⅣMarker(GENEray); 8: LcPAT8. A:3′RACE获得片断;B:5′RACE获得片断;C:ORF扩增片段。 A: Fragments obtained by 3′ RACE; B: Fragments obtained by 5′ RACE; C: ORF fragments. |
LcPAT8基因全长1 968 bp(GenBank登录:KU883608),其中5′非编码区有376 bp,3′非编码区有323 bp,ORF序列为1 269 bp(377—1 645 bp),起始密码子为ATG,终止密码子为TGA,编码422个氨基酸;编码的蛋白分子量约为48 kDa;理论等电点为8.45,属于碱性蛋白;该蛋白脂溶指数为83.60;不稳定指数为42.37。
2.1.2 LcPAT8基因编码蛋白的结构分析蛋白结构分析表明,LcPAT8基因所编码的蛋白包含1个典型的DHHC-CRD结构域(C-x2-C-x9-HC-x2-C-x2-C-x4-DHHC-x5-C-x4-N-x3-F-x4,C代表半胱氨酸、H代表组氨酸、x代表任意氨基酸)(Putilina et al., 1999),该蛋白属于DHHC蛋白家族成员,同时还包含1个DPG和TTxE结构域,与具有S-酰基转移酶活性的蛋白质所特有的结构域相符。利用SignalP 4.1进行信号肽预测,结果表明,LcPAT8基因不存在信号肽酶切位点,是1个非分泌型蛋白。TMHMM 2.0蛋白质跨膜结构分析结果显示,该基因所编码的蛋白具有4个跨膜区(图 2)。Pfam结构域分析表明,该基因含有zf-DHHC结构域,位于跨膜域TM2和TM3之间。

|
图 2 鹅掌楸LcPAT8蛋白跨膜结构模式 Fig.2 Transmembrane domain models of LcPAT8 |
SOPMA二级结构分析表明,α螺旋(alpha helix)和无规则卷曲(random coil)是该DHHC蛋白二级结构的主要成分。α螺旋占37.68%,无规则卷曲占32.46%,延伸链占21.80%,β转角占8.06%。ProtComp 9.0蛋白亚细胞定位分析表明:该蛋白属于膜蛋白,定位于叶绿体类囊体膜。
2.1.3 编码蛋白同源性比较及系统进化分析通过在NCBI搜索,初步得到了8个含有DHHC结构域并且已经证明具有蛋白质酰基转移酶活性的基因(Akr1p:NP_010550;Erf2:NP_013347;Swf1:NP_010411;Pfa3:NP_014073;ZDHHC8:XP_006724302;Pfa4:NP_014640;ZDHHC3:NP_001128651;AtTIP1:NP_197535),将LcPAT8基因的氨基酸序列与8个PAT基因的氨基酸进行比对后发现,LcPAT8编码的蛋白存在S-酰基转移酶活性蛋白质所特有的结构域:DHHC-CRD结构域,同时还具有DPG结构域和TTxE结构域(图 3),因此推测鹅掌楸LcPAT8基因编码的蛋白具有S-酰基转移酶活性。
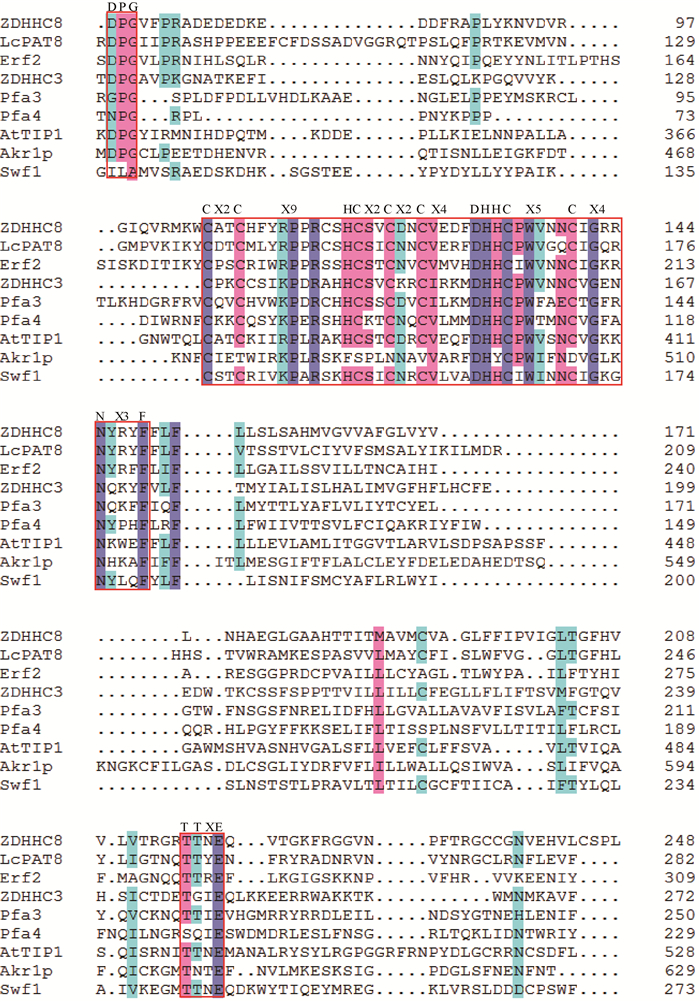
|
图 3 鹅掌楸LcPAT8蛋白与其他PAT蛋白的序列比对 Fig.3 The multiple alignments of the deduced amino acid sequence of LcPAT8 with those of other PATs 黑色字体彩色背景标示保守氨基酸残基;红色方框标示保守基序。 The identical amino acids are shown in black fonts with colored background; The conserved motifs are boxed in red. |
通过NCBI上的protein blast进行同源性搜索,发现与LcPAT8蛋白同源的序列大部分都为预测的蛋白质酰基转移酶(PAT),LcPAT8与莲(Nelumbo nucifera)、甜橙(Citrus sinensis)、海枣(Phoenix dactylifera)、野草莓(Fragaria vesca)、胡杨(Populus euphratica)、油棕(Elaeis guineensis)、大豆(Glycine max)、拟南芥中预测的PAT8相似性分别为79%、75%、74%、73%、73%、73%、72%、63%。
使用MEGA 5.1将鹅掌楸LcPAT8蛋白与其他物种中预测的PAT8蛋白构建Neighbor-Joining系统进化树(图 4),蛋白聚类分析表明,物种间的聚类基本符合物种的演化规律。首先苹果(Malus domestica)和梅(Prunus mume)处于同一小分支,同为蔷薇科(Rosaceae)的野草莓与其关系较近;十字花科(Cruciferae)的芜菁(Brassica rapa)、野甘蓝(Brassica oleracea var. oleracea)、欧洲油菜(Brassica napus)聚合在一起;茄科(Solanaceae)的绒状毛烟草(Nicotiana tomentosiformis)、林烟草(Nicotiana sylvestris)、番茄(Solanum lycopersicum)、马铃薯(Solanum tuberosum)聚合在一起;豆科(Leguminosae)的鹰嘴豆(Cicer arietinum)、绿豆(Vigna radiata)、大豆、蒺藜苜蓿(Medicago truncatula)聚合在一起;禾本科(Gramineae)的二穗短柄草(Brachypodium distachyum)、谷子(Setaria italica)、短花药野生稻(Oryza brachyantha)聚合在一起;而鹅掌楸LcPAT8蛋白独处一个分支,与莲、无油樟(Amborella trichopoda)、棕榈科(Palmae)、禾本科的PAT8蛋白聚为一大类,与蔷薇科、豆科、十字花科等的PAT8蛋白明显分离开来。
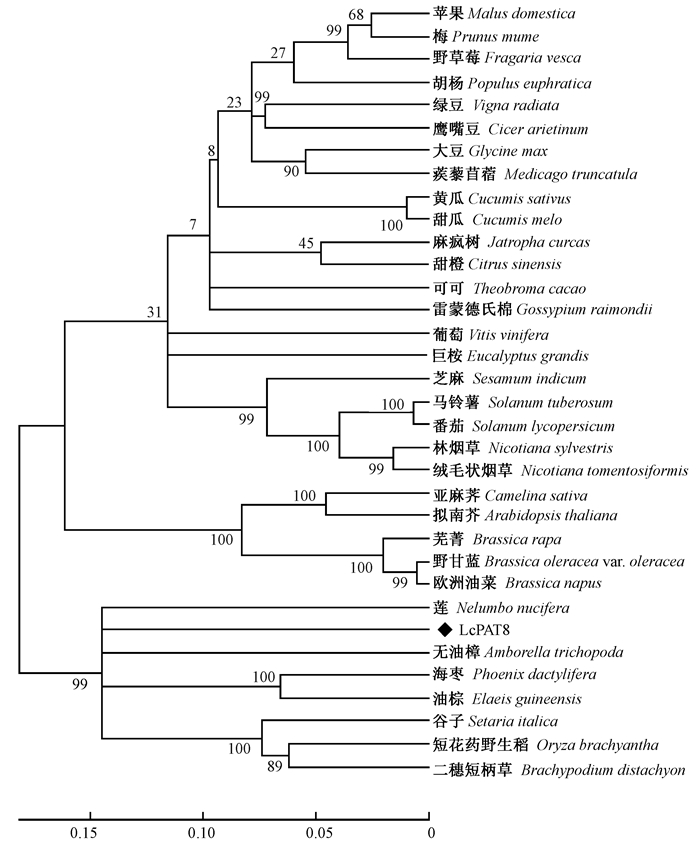
|
图 4 LcPAT8蛋白的系统进化树分析 Fig.4 The phylogenetic tree analysis of LcPAT8 节点上的数值表示Bootstrap验证中基于1 000次重复该节点可信度的百分比。 The number at the nodes represents the reliability percent (%) of bootstraps values based on 1 000 replications. |
分别以鹅掌楸叶芽、花芽等6个不同组织的总RNA反转录合成的cDNA为模板,以鹅掌楸肌动蛋白基因Actin(ACT)为内参(罗群凤, 2013;罗群凤等, 2015),进行实时荧光定量PCR。对LcPAT8基因在不同组织中的相对表达量进行分析(图 5)。从图中可以看出:LcPAT8基因在叶芽、叶片、花芽、花瓣、雄蕊、雌蕊6个不同组织中均有不同程度的表达,其中雌蕊中表达量最高,花瓣和叶片中的表达量高于叶芽和花芽,雄蕊的表达量最低。

|
图 5 LcPAT8基因在鹅掌楸不同组织中的表达 Fig.5 Expression level of LcPAT8 in different tissues of Liriodendron chinense 1.叶芽;2.叶片;3.花芽;4.花瓣;5.雄蕊;6.雌蕊。叶芽表达量被定义为1。 1. Leaf bud; 2. Leaf; 3. Floral bud; 4. Petal; 5. Stamen; 6. Pistil. The expression is defined as 1 of leaf bud. |
为验证LcPAT8基因的功能,利用Gateway技术构建LcPAT8基因的植物过量表达载体。用引物LcPAT8OF和LcPAT8OR扩增目的片段,测序验证表明插入片段为1 269 bp。通过入门反应和LR反应将LcPAT8基因的编码区连接到pH35GS过表达载体上,形成由CaMV 35S启动的LcPAT8植物过量表达载体。测序结果表明LcPAT8基因正确重组到过表达载体pH35GS上,序列显示正确,没有发生移码或单碱基突变的现象,证明LcPAT8基因的植物过表达载体构建成功。利用电击法LcPAT8基因的LR重组质粒转入农杆菌GV3101,花序浸染法转化拟南芥,收取种子。
利用含有潮霉素B(30 mg·L-1)的MS培养基平板进行筛选,得到阳性转基因拟南芥植株。RT-PCR检测显示:10株阳性植株能扩增出带位大小符合要求且清晰的特异性条带,而野生型拟南芥则不能扩增出相应片段(图 6),说明LcPAT8基因已整合到拟南芥基因组中。

|
图 6 转基因拟南芥植株PCR检测 Fig.6 The PCR detection of the transgenic Arabidopsis thaliana M:100 bp-ⅣMarker(捷瑞);1, 2:阴性对照;3, 4:阳性对照;5-15:潮霉素B抗性筛选为阳性的植株。 M: 100 bp-ⅣMarker(GENEray); 1, 2: Negative control; 3, 4: Positive control; 5-15: The respective positive A.thaliana lines survived under Hyg B screening. |
T2代转基因植株表型分析表明:筛选获得的27株LcPAT8过表达转基因拟南芥植株莲座叶片数以及抽薹时间与野生型无显著差异,在土壤中生长40天的转基因植株生长发育情况与野生型植株没有明显差别,都已长出大量花絮和部分角果。培养至70天左右,转基因植株与野生型植株相比表现出明显的差异,野生型植株在移栽后73天,大部分角果都已成熟、叶片枯黄掉落,而转基因植株依然生长旺盛,叶片鲜绿并且还有大量花絮。在移栽后102天,野生型植株已经干枯,转基因植株还有大量侧枝生长、开花(图 7)。由此说明35S启动子驱动的LcPAT8基因的表达导致拟南芥植株生长期延长。

|
图 7 野生型及转基因拟南芥生长发育过程 Fig.7 Growth and development process of wild-type and transgenic Arabidopsis thaliana A:移栽后40天; B:移栽后73天; C:移栽后102天。1, 3, 5:野生型植株; 2, 4, 6:转基因植株。 A: 40 days after transplanting; B: 73 days after transplanting; C: 102 days after transplanting. 1, 3, 5: Wild-type; 2, 4, 6: Transgenic. |
植物的生长发育及形态建成是由基因表达调控的,同一基因及不同基因随时间、空间选择性地表达,形成了不同的形态结构及特异的生理功能。DHHC蛋白家族是一类与棕榈酰化修饰相关的蛋白,多数DHHC蛋白家族成员具有蛋白质酰基转移酶(protein S-acyltransferase,PAT)活性(Greaves et al., 2011)。已有的研究表明,DHHC型锌指蛋白在植物的生长发育、形态建成过程中起着非常重要的作用(Hemsley et al., 2005;Xiang et al., 2010;Zhou et al., 2013)。徐嘉娟等(2016)研究发现鹅掌楸LcPAT7基因在花瓣中表达丰度最高,花芽和叶芽中较低。Wang等(2011)对拟南芥PAT基因家族中20个基因的研究表明:AtPAT8(At4g24630) 在成熟果荚中表达量最高,其次是花,叶和茎中表达量很低。本研究中LcPAT8基因在鹅掌楸花芽和盛花期的叶片、叶芽、花瓣、雄蕊、雌蕊中均有表达,在雌蕊中表达量最高,其次是花瓣,可能参与花瓣的扩展、心皮及胚的发育。
目前,将目的基因在模式植物中过量表达是研究基因功能的重要手段之一。本研究将鹅掌楸LcPAT8基因通过遗传转化技术转化拟南芥植株,利用载体pH35GS中的CaMV35S启动子驱动表达,通过观察转基因拟南芥植株表型特征,以期来研究LcPAT8基因的功能。目前,对植物DHHC蛋白家族的研究相对较少,但已有的研究表明,大多植物DHHC蛋白具有PAT活性,通过介导其他蛋白的棕榈酰化在植物的生长发育、形态建成及逆境响应过程中起着极为重要的作用。拟南芥TIP1与根毛和花粉管生长、细胞延伸密切相关(Hemsley et al., 2005),PAT10在拟南芥生长发育和盐胁迫响应过程中发挥着重要作用(Zhou et al., 2013),PAT13、PAT14与NOA1的棕榈酰化有关进而参与拟南芥叶片衰老的调控(Lai et al., 2015);水稻OsDHHC13基因在氧化胁迫条件下能促进清除ROS的相关酶基因表达(王文文, 2016)。本研究结果表明,在拟南芥中过表达LcPAT8基因,明显延长了植株的生长期。生长期的长短决定着生物体或器官的寿命,影响到作物的产量、品质以及观赏植物花期和牧草产量等。对植物生长发育调控机制的研究不仅具有重要的理论意义还有较好的实际应用价值,如有助于抗性强、抗衰老品种的选育,延长观赏植物花期,森林、草原的更新保护等。但LcPAT8基因在鹅掌楸生长发育过程中的具体功能还有待系统深入的研究。
4 结论本研究从鹅掌楸中克隆得到与鹅掌楸生长性状相关联的642号位点对应基因LcPAT8的全长cDNA序列(GenBank登录号:KU883608),该基因编码的LcPAT8蛋白具有4个跨膜结构域,与已报道的动植物DHHC蛋白家族的跨膜结构域数目(4~6) 一致,并且在跨膜域TM2和TM3之间存在1个蛋白质酰基转移酶的活性位点(DHHC-CRD结构域:C-X2-C-X9-HC-X2-C-X2-C-X4-DHHC-X5-C-X4-N-X3-F-X4)。系统进化树分析表明鹅掌楸LcPAT8基因所编码的蛋白与拟南芥中已在蛋白水平证实的PAT蛋白同源,表明LcPAT8基因编码的蛋白可能具有蛋白质酰基转移酶活性。成功构建了该基因的植物过量表达载体,在拟南芥中过表达该基因,明显延长了拟南芥植株的生长期。本研究结果为揭示鹅掌楸生长发育、形态建成的分子机制奠定了一定的基础。
| [] |
刘青, 汪玉凤, 赵韩生, 等. 2014. 麻竹同源异型盒基因DlKNOX1的克隆及功能初步分析. 林业科学, 50(2): 56–62.
( Liu Q, Wang Y F, Zhao H S, et al. 2014. Molecular characteristics and primary functional analysis of DlKNOX1 gene from Dendrocalamus latiflorus. Scientia Silvae Sinicae, 50(2): 56–62. [in Chinese] ) |
| [] |
罗群凤. 2013. 鹅掌楸属基因进化差异研究——基于Chs、Adh序列证据. 南京: 南京林业大学硕士学位论文. ( Luo Q F. 2013. Study on differences of gene evolution in Liriodendron based on Chs and Adh sequences. Nanjing:MS thesis of Nanjing Forestry University.) http://cdmd.cnki.com.cn/Article/CDMD-10298-1013046221.htm |
| [] |
罗群凤, 胥猛, 冯源恒, 等. 2015. 北美鹅掌楸LtCHS基因的克隆及生物信息学与组织表达特征分析. 林业科学, 51(5): 37–45.
( Luo Q F, Xu M, Feng Y H, et al. 2015. Cloning and bioinformatics of chalcone synthase gene (CHS) in Liriodendron tulipifera and characterization of its tissue expression. Scientia Silvae Sinicae, 51(5): 37–45. [in Chinese] ) |
| [] |
阮班军, 代鹏, 王伟, 等. 2014. 蛋白质翻译后修饰研究进展. 中国细胞生物学学报, 36(7): 1027–1037.
( Ruan B J, Dai P, Wang W, et al. 2014. Progress on post-translational modification of proteins. Chinese Journal of Cell Biology, 36(7): 1027–1037. DOI:10.11844/cjcb.2014.07.0299 [in Chinese] ) |
| [] |
王文文. 2016. 水稻OsDHHC基因的生物信息学分析及OsDHHC13基因的功能研究. 长沙: 湖南大学硕士学位论文. ( Wang W W. 2016. Functional study of OsDHHC13 and bioinformatics analysis of OsDHHC in rice. Changsha:MS thesis of Hunan University.) http://d.g.wanfangdata.com.cn/Thesis_Y3097220.aspx |
| [] | 王章荣. 2005. 鹅掌楸属树种杂交育种与利用. 北京, 中国林业出版社. |
| [] | Wang Z R. Hybrid breeding and utilization of Liriodendron. Beijing, China Forestry Publishing House. |
| [] |
徐嘉娟, 李火根. 2016. 鹅掌楸DHHC型锌指蛋白家族基因的克隆及表达分析. 广西植物, 36(9): 1052–1060.
( Xu J J, Li H G. 2016. Gene cloning and expression analysis of DHHC protein family genes from Liriodendron chinense. Guihaia, 36(9): 1052–1060. DOI:10.11931/guihaia.gxzw201503026 [in Chinese] ) |
| [] |
胥猛, 谢雯凡, 潘惠新, 等. 2011. 杨树ARGONAUTE基因的克隆及序列分析. 林业科学, 47(3): 46–51.
( Xu M, Xie W F, Pan H X, et al. 2011. Cloning and characterization of ARGONAUTE genes in Populus. Scientia Silvae Sinicae, 47(3): 46–51. DOI:10.11707/j.1001-7488.20110308 [in Chinese] ) |
| [] |
姚俊修. 2013. 鹅掌楸杂种优势分子机理研究. 南京: 南京林业大学博士学位论文. ( Yao J X. 2013. Studies on the molecular mechanism of heterosis in Liriodendron based on SSR markers. Nanjing:PhD thesis of Nanjing Forestry University.) http://cdmd.cnki.com.cn/Article/CDMD-10298-1013045850.htm |
| [] |
张春玲. 2014. 毛竹笋-竹生长发育过程系统分析与生长素相关基因研究. 北京: 中国林业科学研究院博士学位论文. ( Zhang C L. 2014. The comprehensive analysis of shoot-culm and study of auxin-related genes of Phyllostachys edulis. Beijing:PhD thesis of Chinese Academy of Forestry.) http://cdmd.cnki.com.cn/Article/CDMD-82201-1014336624.htm |
| [] |
周波. 2011. DHHC型锌指蛋白基因OsDHHC1在水稻株型构建中的功能分析. 长沙: 湖南大学博士学位论文. ( Zhou B. 2011. Function analysis of the DHHC type zinc finger protein gene OsDHHC1 in the plant architecture construction of rice(Oryza sativa L.). Changsha:PhD thesis of Hunan University.) http://cdmd.cnki.com.cn/Article/CDMD-10532-1012326629.htm |
| [] |
周子良. 2013. 蛋白质酰基转移酶10参与拟南芥的发育及盐胁迫响应. 泰安: 山东农业大学博士学位论文. ( Zhou Z L. 2013. PROTEIN S-Acyl TRANSFERASE 10 is critical for development and salt tolerance in Arabidopsis. Tai'an:PhD thesis of Shandong Agricultural University.) http://cdmd.cnki.com.cn/Article/CDMD-10434-1014157012.htm |
| [] | Abrami L, Kunz B, Iacovache I, et al. 2008. Palmitoylation and ubiquitination regulate exit of the Wnt signaling protein LRP6 from the endoplasmic reticulum. Proceedings of the National Academy of Sciences of the United States of America, 105(14): 5384–5389. DOI:10.1073/pnas.0710389105 |
| [] | BatistiDč O, Sorek N, Schültke S, et al. 2008. Dual fatty acyl modification determines the localization and plasma membrane targeting of CBL/CIPK Ca2+ signaling complexes in Arabidopsis. Plant Cell, 20(5): 1346–1362. DOI:10.1105/tpc.108.058123 |
| [] | Dijk K V, Ding Y, Malkaram S, et al. 2010. Dynamic changes in genome-wide histone H3 lysine 4 methylation patterns in response to dehydration stress in Arabidopsis thaliana. BMC Plant Biology, 10(1): 1–12. DOI:10.1186/1471-2229-10-1 |
| [] | Greaves J, Chamberlain L H. 2011. DHHC palmitoyl transferases:substrate interactions and (patho)physiology. Trends in Biochemical Sciences, 36(5): 245–253. DOI:10.1016/j.tibs.2011.01.003 |
| [] | Guan X M, Fierke C A. 2011. Understanding protein palmitoylation:Biological significance and enzymology. Science China(Chemistry), 54(12): 1888–1897. |
| [] | Hemsley P A, Kemp A C, Grierson C S. 2005. The TIP GROWTH DEFECTIVES-acyl transferase regulates plant cell growth in Arabidopsis. Plant Cell, 17(9): 2554–2563. DOI:10.1105/tpc.105.031237 |
| [] | Hildmann C, Riester D, Schwienhorst A. 2007. Histone deacetylases-an important class of cellular regulators with a variety of functions. Applied Microbiology and Biotechnology, 75(3): 487–497. DOI:10.1007/s00253-007-0911-2 |
| [] | Huang K, El-Husseini A. 2005. Modulation of neuronal protein trafficking and function by palmitoylation. Current Opinion in Neurobiology, 15(5): 527–535. DOI:10.1016/j.conb.2005.08.001 |
| [] | Lai J B, Yu B Y, Cao Z D, et al. 2015. Two homologous protein S-acyltransferases, PAT13 and PAT14, cooperatively regulate leaf senescence in Arabidopsis. Journal of Experimental Botany, 66(20): 6345. DOI:10.1093/jxb/erv347 |
| [] | Linder M E, Deschenes R J. 2007. Palmitoylation:policing protein stability and traffic. Nature Reviews Molecular Cell Biology, 8(1): 74–84. DOI:10.1038/nrm2084 |
| [] | Marino G, Eckhard U, Overall C M. 2015. Protein termini and their modifications revealed by positional proteomics. Acs Chemical Biology, 10(8): 1754. DOI:10.1021/acschembio.5b00189 |
| [] | Pedro B, Véronique A, Lillian R K, et al. 2012. Systematic functional prioritization of protein posttranslational modifications. Cell, 150(2): 413–425. DOI:10.1016/j.cell.2012.05.036 |
| [] | Putilina T, Wong P, Gentleman S. 1999. The DHHC domain:a new highly conserved cysteine-rich motif. Molecular and Cellular Biochemistry, 195(1/2): 219–226. DOI:10.1023/A:1006932522197 |
| [] | Schönichen A, Webb B A, Jacobson M P, et al. 2013. Considering protonation as a posttranslational modification regulating protein structure and function. Annual Review of Biophysics, 42: 289–314. DOI:10.1146/annurev-biophys-050511-102349 |
| [] | Smotrys J E, Linder M E. 2004. Palmitoylation of intracellular signaling proteins:regulation and function. Annual Review of Biochemistry, 73(1): 559–587. DOI:10.1146/annurev.biochem.73.011303.073954 |
| [] | Wang Q, Sun J L, Bao L, et al. 2011. Twenty putative palmitoyl-acyl transferase genes show distinct expression pattern in Arabidopsis thaliana. African Journal of Biotechnology, 10(52): 10575–10584. DOI:10.5897/AJB |
| [] | Widiez T, Symeonidi A, Luo C Y, et al. 2014. The chromatin landscape of the moss Physcomitrella patens and its dynamics during development and drought stress. The Plant Journal, 79(1): 67–81. DOI:10.1111/tpj.2014.79.issue-1 |
| [] | Xiang J, Lin J, Tang D, et al. 2010. A DHHC-type zinc finger protein gene regulates shoot branching in Arabidopsis. African Journal of Biotechnology, 9(45): 7759–7766. |
| [] | Yang Y, Xu M, Luo Q F, et al. 2014. De novo transcriptome analysis of Liriodendron chinense petals and leaves by Illumina sequencing. Gene, 534(2): 155–162. DOI:10.1016/j.gene.2013.10.073 |
| [] | Yuan L Y, Liu X C, Luo M, et al. 2013. Involvement of histone modifications in plant abiotic stress responses. Journal of Integrative Plant Biology, 55(10): 892–901. |
| [] | Zhao X Y, Wang J G, Song S J, et al. 2016. Precocious leaf senescence by functional loss of PROTEIN S-ACYL TRANSFERASE14 involves the NPR1-dependent salicylic acid signaling. Scientific Reports, 6: 20309. DOI:10.1038/srep20309 |
| [] | Zhou L Z, Li S, Feng Q N, et al. 2013. Protein S-ACYL Transferase10 is critical for development and salt tolerance in Arabidopsis. Plant Cell, 25(3): 1093–1107. DOI:10.1105/tpc.112.108829 |
| [] | Zong W, Zhong X C, You J, et al. 2013. Genome-wide profiling of histone H3K4-tri-methylation and gene expression in rice under drought stress. Plant Molecular Biology, 81(1/2): 175–188. |
 2017, Vol. 53
2017, Vol. 53

