文章信息
- 翟婉璐, 钟哲科, 高贵宾, 杨慧敏
- Zhai Wanlu, Zhong Zheke, Gao Guibin, Yang Huimin
- 覆盖经营对雷竹林土壤细菌群落结构演变及多样性的影响
- Influence of Mulching Management on Soil Bacterial Structure and Diversity in Phyllostachys praecox Stands
- 林业科学, 2017, 53(9): 133-142.
- Scientia Silvae Sinicae, 2017, 53(9): 133-142.
- DOI: 10.11707/j.1001-7488.20170916
-
文章历史
- 收稿日期:2016-01-14
- 修回日期:2016-09-12
-
作者相关文章
土壤微生物作为土壤生态系统中物质转化和养分循环的驱动者,是维持土壤生产力的重要组分,而土壤中的细菌占微生物总数的70%~90%,是土壤中有机质的分解、腐殖质的形成、土壤养分转化和循环等过程的最主要的参与者(夏围围等,2014),如每年微生物从大气中的氮素固定量近2×106 t, 其中约有2/3以上由细菌参与完成,土壤中的硝化细菌、氨化细菌含量和活性直接影响土壤中氮的有效性和土地生产率,而土壤中的纤维分解细菌是土壤中参与碳循环的最主要的微生物类型(秦华等,2010;Pace,1997)。可见,土壤细菌在土壤微生物中占有十分重要的地位。土壤细菌的群落结构和多样性对土壤环境的变化较为敏感,因此,其结构变化是评价自然或人为干扰引起土壤质量改变的重要指标(Zelles et al., 1992; Geisseler et al., 2014)。但由于微生物体积小、形态简单及繁殖速度快,基于纯培养技术的表型特征分类具有很大的局限性。在土壤微生物培养方面虽然出现了高通量培养技术、土壤基质膜培养和细胞微囊包埋技术等一系列的方法,但是土壤中微生物的可培养率仍然只有0.1%到10% (Torsvik et al., 1990;王保军等,2013),土壤中的极大多数微生物种群仍处于不明的状态。近十年来,宏基因组高通量测序法的出现使大规模客观揭示土壤微生物种类及遗传多样性成为可能(Gomez-Alvarez et al., 2009;Chistoserdova,2010)。该方法不经过微生物培养而直接提取土壤中的DNA,避开了土壤微生物培养、分离难度大的问题,极大地提高了土壤微生物的研究效率。利用高通量测序技术可以一次对几十万到几百万条DNA分子进行序列测定,且具有数据产出通量高的特点,在土壤微生物物种、结构、功能和遗传多样性等各个方面都可以获得丰富的信息。虽然该技术在引物设计、文库构建等方面尚不够成熟,但该方法可全面覆盖土壤中的微生物种群,重复性较好,适用性较强,已成为解析复杂环境中微生物群落物种组成和相对丰度的最重要工具之一(Gosling et al., 2006;Damon et al., 2012)。
雷竹(Phyllostachys praecox)作为我国南方广泛种植的优良笋用竹,具有易栽培,竹笋营养丰富,味道鲜美的特点,因而其栽培面积不断扩大。近年来,为促进竹笋提前发笋及提高产量,冬季覆盖经营技术已在雷竹生产上得到了广泛应用。冬季覆盖经营技术是指在秋冬季在竹林土壤上覆盖大量的有机材料,如稻草、猪粪和砻糠,并在土壤中使用足量的化肥。有机覆盖材料的主要功能是增温保湿,而大量使用化肥的目的是促进土壤中笋芽个体快速生长(赵丽丽等,2015),通过覆盖经营,打破地下笋芽的休眠,使雷竹提早出笋,延长出笋期,从而提高雷竹林的经济效益。研究表明,相较于未覆盖竹林,用稻草和砻糠进行双层覆盖后的竹林地表温度能够提高3 ℃以上(杨明等,2012),但随之而来也出现了雷竹林生产力的退化现象。目前,针对雷竹林退化的研究很多,包括退化林立竹情况、鞭根生长状态、土壤养分性质、土壤生物活性及土壤酸化等。覆盖过厚使竹林长期处于高湿和缺氧状态造成地下鞭根系统严重退化,竹林生产力下降(孙晓等,2009);施用复合肥过量造成土壤磷残留积累过高、养分含量比例失调和土壤磷酸酶活性下降(秦华等,2010);连年用高C/N的稻草等材料覆盖竹林导致土壤C/N明显升高、土壤酸化严重等(赵丽丽等,2015),但是,覆盖经营导致竹林生态系统退化的过程和机制仍没有完全清楚,也没有在生产实践中提出更好的解决方法,至今,覆盖经营技术仍然是雷竹高效培育的主要技术措施。为此,本文采用第2代高通量测序技术,研究不同覆盖年限的竹林土壤中细菌群落结构及多样性分布特征,从微观角度阐述覆盖过程中土壤养分的动态变化,并分析可能造成这种变化的原因,为在生产中科学利用竹林覆盖经营技术提供依据,为科学评价该种植模式的生态风险提供科学依据。
1 研究区概况研究区域位于浙江省杭州市余杭区径山镇(120°30′E,30°33′N)。年均气温15.8 ℃,平均相对湿度80%,年降水量1 454 mm,年日照时数1 765 h。该区属亚热带季风气候。调查雷竹林处于低丘地貌,坡度较一致,小于5°,土壤类型为红壤。种植年龄都在30年以上,立竹密度在12 000株·hm-2左右。
2 材料与方法 2.1 竹林地覆盖方法在第1年11月份对竹林进行翻土至30 cm深,并施用有机肥和化肥,施用量为10 t·hm-2(未发酵猪粪)和1 t·hm-2, 施肥结束后给竹林浇足发笋水,再覆盖稻草为发酵层,厚约为5 cm,15~20 t·hm-2,并喷撒水使其湿度达70%左右。再覆盖砻糠作为保温层,厚度为15~20 cm,80~90 t·hm-2,以保持覆盖层地表温度在15~25 ℃,满足笋芽正常萌发所需温度。在第2年3、4月,当气温逐渐回升,月均温15 ℃以上时,逐步去除覆盖物,移除覆盖物的数量大约为加入量的2/3, 约有1/3的覆盖物留在林地中(高贵宾等,2013)。
2.2 土壤样品采集与处理为研究不同覆盖年限雷竹林土壤细菌的群落特征,于2014年11月在立地条件一致但覆盖年限不同的雷竹林,选择覆盖0(CK)、3、6、9、12年的5种雷竹林,在每种林分内选定面积为20 m×20 m的采样区,在采样区内以Z型选取7个样点,采集0~20 cm深的土壤样品,混合均匀。各年份的竹林地都重复3次,共计15份土样。新鲜土样充分混匀后,用镊子去除大的石砾和植物残体,再过2 mm钢筛后分2份保存:一份立即冷冻干燥,用于提取土壤细菌DNA,供细菌群落结构分析使用;另一份于室内自然风干,研磨过筛后用于土壤基本理化性质分析。
2.3 土壤环境因子土壤pH值采用1:5土水比,酸度计测定;土壤有机质采用重铬酸钾外加热法测定;总氮采用半微量凯氏定氮法;全磷采用硫酸-高氯酸消煮,钼锑抗比色法;全钾采用氢氟酸消煮-火焰光度法;有效磷用0.5 mol·L-1NaHCO3法,分光光度计测定;速效钾采用乙酸铵浸提-火焰光度法(鲁如坤,2000)。
2.4 土壤总DNA提取、PCR扩增及文库的构建本试验所有样品均采用Ezup柱式土壤基因组DNA抽提试剂盒,购自生工生物工程(上海)有限公司, 称取0.2 g于-80 ℃保存的土壤样品,按试剂盒说明书进行土壤DNA提取;得到15个土壤DNA样本。用浓度为1.0%的琼脂糖凝胶电泳检测DNA片段大小,电压为110 V,电泳时间为30 min。用微量核酸蛋白质分析仪(Nanodrop Technologies)测定浓度和纯度。
土壤细菌16S rDNA基因序列的V3与V4 2个可变区域的PCR扩增,采用土壤中总提取的DNA为模板,细菌通用型引物(5’-CCTACGGGNGGCW GCAG-3’)/ (5’-GACTACHVGGGTATCTAATCC-3’)。PCR扩增反应体系为:2.5 μL细菌模板DNA(5 ng·μL-1), 上游引物和下游引物各5 μL(引物浓度1 μmol·L-1),12.5 μL 2×KAPA HiFi HotStart ReadyMix。扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火40 s,72 ℃延伸30 s,共25次循环;最后72 ℃终延伸5 min结束。采用AMPure XP beads对PCR产物进行纯化。
对纯化后产物进行PCR并加上特定标签序列,为index PCR。反应体系为:DNA,Nextera XT Index Primer 1及Nextera XT Index Primer 2各5 μL,2× KAPA HiFi HotStart ReadyMix 25 μL,PCR Grade water 10 μL。扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火40 s,72 ℃延伸30 s,共8次循环;最后72 ℃终延伸5 min结束。将PCR产物再次用AMPure XP beads进行纯化, 所得产物即为16S文库。
利用qubit定量计和Agilent Technologies 2100 Bioanalyzer分别对文库进行浓度与片段的质检,参照Illumina文库构建试剂盒(16S Metagenomic Sequencing Library Preparation)指南进行文库的构建,将构建好的DNA文库均一化至4 nmol·L-1后等体积混合,将混合好的文库加入等体积的0.2 mol·L-1 NaOH进行变性,在Illumina MiSeq(Illumina Inc., San Diego CA)平台进行2×300的测序模式。
2.5 原始数据整理、过滤及统计分析首先对获得的原始测序数据进行质量控制,由于MiSeq平台采用双末端测序,因此需对双端的序列做质量过滤,使用FAXTS软件去掉序列末尾质量低于Q15的碱基并使用FLASH软件对数据进行合并。
为获得更高质量及更准确的生物分析结果,则需要对有效序列进行去杂。对后引物也按照不超过2个碱基错配进行过滤;修剪、去除长度≤200 bp的序列;最后剔除总碱基错误率高于1的序列。
使用UPARSE对按97%的相似性非singleton序列聚OUT的同时检测并去除其中的Chimeric序列;将质控后的clean reads与OUT中的序列进行比较并根据97%的相似性将clean reads归并到相关OTU中。使用UPARSE对优质序列按相似度≥97%进行操作分类单元(OTU)的聚类,选取每个类最长的序列为代表序列。然后调用RDP-classifier的分类方法,以RDP数据库的序列为训练集对OTU代表序列进行注释,最终得到每个OTU分分类学信息。利用mothur软件对所有序列进行随机抽样,以抽取到的序列数与它们所能代表OTU的数目构建稀疏曲线(rarefaction curve)。同时计算各个林龄样本的细菌群落丰富度指数(Ace)、多样性指数(Shannon-Wiener)(王宝军等,2013)。数据统计分析采用SPSS软件。
3 结果与分析 3.1 土壤环境因子由表 1可以看出,覆盖经营造成雷竹林土壤有机质及N、P、K等养分含量的增加,其中,有机质、全P、有效P含量的增加幅度在42.9%~63.5%之间,全N和速效K含量的最大增值分别达106%和237.7%。土壤有机质和速效K含量在覆盖第3年显著增加(P<0.05),有机质含量在3年后变动幅度很小,而速效K含量仍保持一定的幅度增加。覆盖经营3年后出现pH显著下降,覆盖12年的竹林土壤pH已呈极强酸性。
|
|
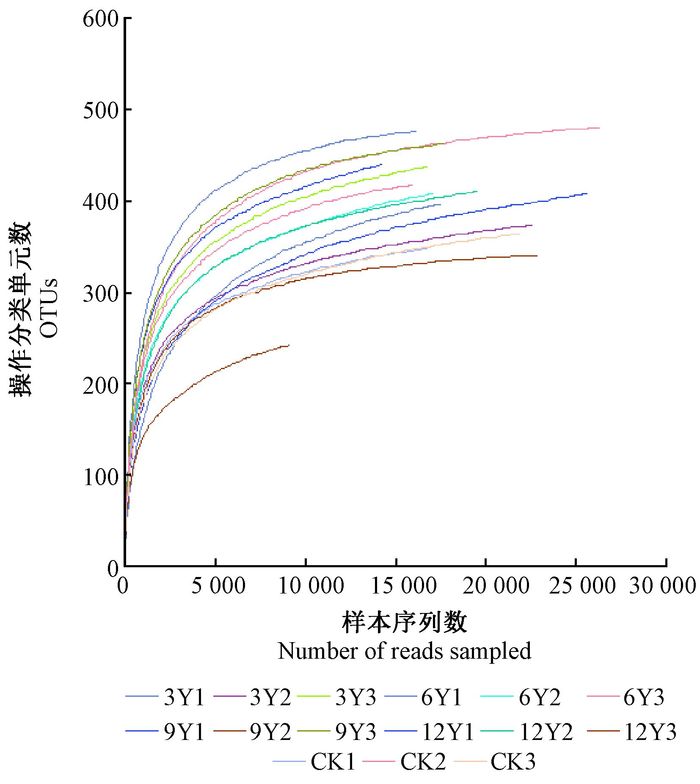
根据高通量测序结果统计分析,15个土壤样本共获得优质DNA序列数280 548条。平均长度为453.5 bp。分布在覆盖0(CK)、3、6、9、12年的竹林地土壤细菌DNA优质序列分别为54 650、56 934、59 623、41 226、68 115条。把相似度水平≥97%的序列聚为一个操作分类单元(OTU),共获得598个OTUs。从测定细菌OTUs的稀释曲线(图 1)可以看出,15个样本的稀释曲线均趋于平缓,说明测序趋于饱和,测得的数据可以反映土壤细菌群落的真实情况。
|
图 1 雷竹林土壤细菌OTUs稀释曲线 Fig.1 Rarefaction curves of soil bacteria OTUs CK、3、6、9、12分别表示覆盖0、3、6、9、12年竹林土壤,Y1、Y2、Y3为3个重复。 CK, 3, 6, 9, 12 mean the soil mulching with 0, 3, 6, 9, 12 years, respectively, Y1, Y2, Y3 mean 3 replicates.下同.The same below. |
调用RDP-classifier的分类方法,对OTU代表序列进行注释,并对所获得的分类学信息进行统计,结果表明:在门水平上,变形菌门(Proteobacteria)占总数的32.02%,酸杆菌门(Acidobacteria)占总数的22.89%,放线菌门(Actinobacteria)占总数的13.19%;在纲水平上,酸杆菌纲(Acidobacteria)占总数的25.89%,γ-变形菌纲(Gammaproteobacteria)占总数的16.97%,α-变形菌纲占总数的15.96%;在目水平上, 酸杆菌目(Acidobacteriales)占总数的27.61%, 放线菌目(Actinomycetales)占总数的11.5%,黄色单胞菌目(Xanthomonadales)占总数的7.82%。雷竹林土壤样本细菌OTU目分类水平上的具体信息可见表 2。
|
|
1) 覆盖年限对细菌丰度及多样性的影响使用筛选出的V3—V4区序列,可得到细菌的丰度指数和多样性指数(表 3)。覆盖率是指各样品文库的覆盖率,其数值越高,则样本中序列没有被测出的概率越低。从表 3可以看出,各覆盖年份的土壤样品中微生物基因序列的覆盖率均达到99%以上,表明所测定序列可以充分反映各采样区域细菌群落的种类和结构。细菌群落物种的丰度、多样性分别用Ace指数、Shannon-Wiener指数表示(朱琳,2006)。不同覆盖年限土样的Ace指数及Shannon-Wiener指数存在较大差异, 均呈现先升高后降低的趋势。土壤细菌丰度、多样性在覆盖6年时达到最大值,与CK相比分别提高17.3%和5.27%;此时,随着覆盖年限的继续增加,土壤细菌丰度、多样性则开始呈现下降的趋势,其中,多样性指数在覆盖12年时达到最小值,与CK相比下降了3.37%。
|
|
2) 覆盖年限对土壤主要细菌群落组成的影响
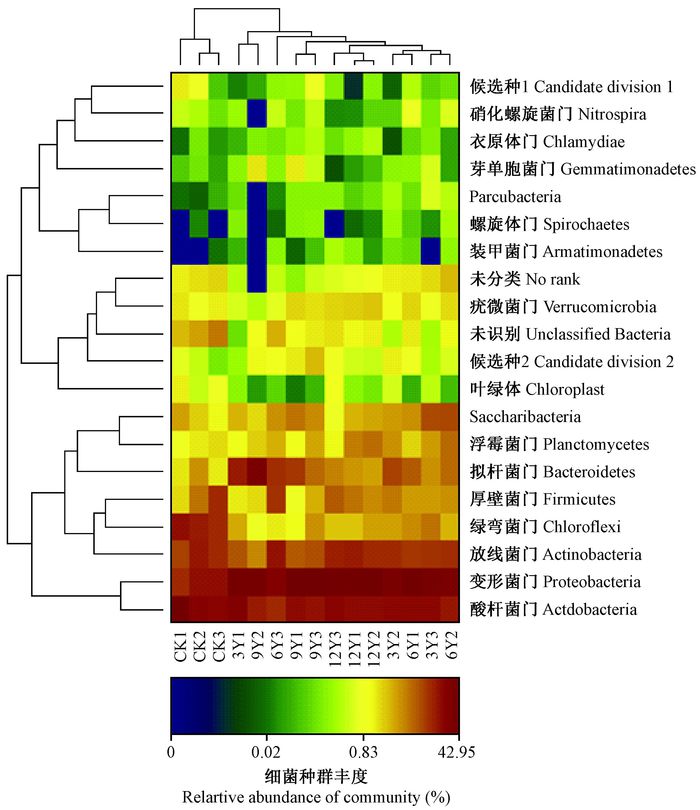
采用Mothur软件对不同覆盖年限土壤细菌群落在门水平构建分层聚类图(hierarchical heatmap)(图 2), 分层聚类图可以用颜色变化直观地将数据值的大小以定义的颜色深浅表示出来,通过颜色的梯度及相似程度来反映数据的相似性和差异性。由图 2可以看出, 15个土壤样品明显地分成2大类, 未经覆盖的竹林土壤的细菌群落聚为一支,经过覆盖处理后的12个土壤样品细菌群落结构较接近,聚为一支。由此可以得出, 覆盖对土壤细菌在门水平上群落结构影响较大,覆盖后不同年限间土壤细菌群落差异不明显。分层聚类图中红色部分是相对丰度较高的门, 从图中可以看出,酸杆菌门、变形菌门、放线菌门在不同覆盖年限的土壤中相对丰度均较高。
|
图 2 不同覆盖年限土壤门水平上细菌分层聚类 Fig.2 Hierarchical clustering diagram of bacteria at phylum level in the soil with different mulching time |
在门的分类水平上,雷竹林土壤细菌分布在13个已知细菌门, 除未被分类群体外, 还有2个候选细菌门。所占丰度在1%以上的门分别为变形菌门、酸杆菌门、放线菌门、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)和浮霉菌门(Planctomycetes)(表 4)。其中,属于变形菌门、酸杆菌门、放线菌门、拟杆菌门的序列占全部序列的74.13%。衣原体门(Chlamydiae)、芽单胞菌门(Gemmatimonadetes)、螺旋体门(Spirochaetes)、疣微菌门(Verrucomicrobia)、蓝藻门(Cyanobacteria)等在不同覆盖年限雷竹林土壤中均有分布,但其相对丰度极小,均低于1%。
|
|
由表 4可以看出,随着覆盖年限的增加,变形菌门,酸杆菌门,拟杆菌门,绿弯菌门的丰度变化出现了显著性差异,其中,变形菌门作为百分比最高的细菌群落,其丰度明显增加。绿弯菌门则为受覆盖措施影响最大的细菌群落。随着覆盖年限的增加,土壤酸化加剧,pH由5.23(CK)降至3.42(12年),土壤中有机质的含量从未覆盖时的21.75 g·kg-1(CK)上升为为32.61 g·kg-1(9年),由此造成的影响即是变形菌门的丰度由17.6%上升为40.6%,而绿弯菌门则由未覆盖时的16.57%(CK)下降为2.03%(9年)。
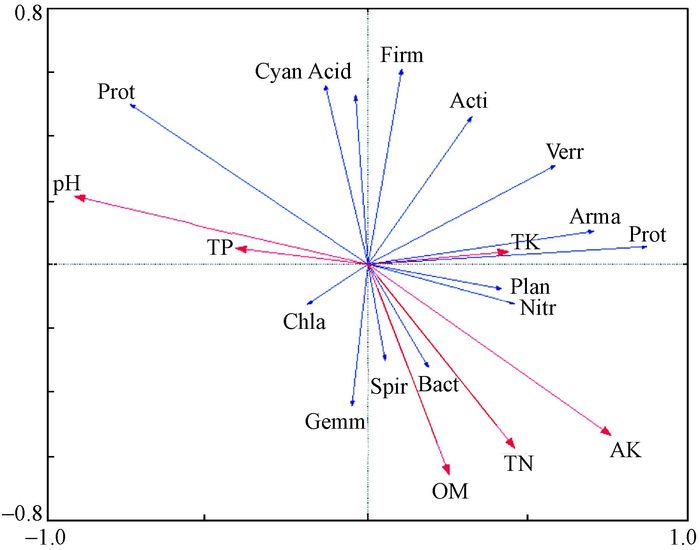
3.4 土壤细菌种群与环境因子RDA分析采用Canoco 5.0对土壤细菌种群与环境因子进行分析,在DCA结果中,第一排序轴的梯度长度(lengths of gradient)值为1.247(<2),则环境因子对细菌群落分布的影响较适合用RDA进行评估。该排序图的前两轴解释了覆盖竹林土壤细菌群落变异程度的88.5%,由此可知,排序轴的前两轴能够真实的反应环境因子对细菌群落的影响程度。
从RDA双序图中可以看出土壤有机质,全N、全K,AK对土壤细菌群落结构影响较大,装甲菌门、变形菌门与土壤全钾相关性最大;螺旋菌门、拟杆菌门与土壤中全氮和有机质含量相关性最大;绿弯菌门与土壤中pH相关性最大。
4 讨论 4.1 覆盖对土壤环境因子的影响不同覆盖年限雷竹林土壤pH值呈逐年下降的趋势,覆盖初期与未覆盖竹林并无显著性差异,覆盖进行到第12年时,pH值出现显著性差异,由5.23(0年)降至3.42。覆盖12年后竹林土壤有机质、全P、全K含量的增加幅度分别为52.4%、38.8%、63.3%,全N含量的最大增值达106.59%。土壤有机质在覆盖3年后就出现显著增加,但在覆盖6年后增幅趋于平缓;土壤中AP、AK的含量则一直保持较高的增长幅度。
4.2 覆盖对土壤细菌群落的影响在覆盖6年后土壤中,土壤细菌的Ace指数及Shannon-Wiener指数达到最大值。覆盖前期大量有机物质的加入,带来养分元素含量的显著增大,对土壤细菌的繁殖、增加具有正向的作用(刘文娜等,2006)。在覆盖12年后土壤细菌的OTU值、Ace指数及Shannon-Wiener指数都有一定程度的下降,但与覆盖初期相比并无较大差别,这可能是由于长期覆盖施肥以及覆盖后部分覆盖物的还田处理使土壤养分结构及通气性等较未覆盖前发生了较大变化,使得土壤细菌丰度及多样性达到了一个新的相对稳定的状态(王伏伟等,2015)。
|
图 3 基于16S rDNA文库的RDA双序 Fig.3 RDA biplots based on 16S rDNA cloning libraries Acid:酸杆菌门Acidobacteria;Acti:放线菌门Actinobacteria;Bact:拟杆菌门Bacteroidetes;Firm:厚壁菌门Firmicutes;Verr:疣微菌门Verrucomicrobia;Gemm:芽单胞菌门Gemmatimonadetes;Plan:浮霉菌门Planctomcetes;Nitr:硝化螺旋菌门Nitrospirae;Chlo:绿弯菌门Chloroflexi;Cyan:蓝藻菌门Cyanobacteria;Prot:变形菌门Proteobacteria; Arma:装甲菌门Armatimonadetes;Spir:螺旋体门Spirochaetes. |
对不同覆盖年限土壤细菌群落进行分层聚类分析,未覆盖林地土壤聚为一类,覆盖后竹林土壤聚为一类,说明覆盖对土壤细菌群落产生一定影响。对调查林分中各竹林土壤细菌种群的平均值比较,变形菌门丰度随着覆盖时间的增加出现明显增加,由17.60%(对照)上升为37.77%(覆盖12年),尤其是该类细菌中α-变形菌纲、γ-变形菌纲的种群占多数。变形菌门细菌属于革兰氏阴性细菌,其中α-变形菌包括大量的参与C、N循环的细菌、与植物共生的细菌(如根瘤菌属)及能够抑制植物致病菌的有益菌等重要菌种,如变形菌门中α纲的红螺菌大多为光合细菌和固氮细菌,这些细菌的增加能对生态系统氮的稳定性和土壤能量的平衡起到重要的作用,对植物生长具有重要意义;Zhang等(2014)通过调查湖南、湖北等4个省份的土壤细菌认为,变形菌细菌的增加同土壤有机质含量关系密切。γ-变形杆菌有很强的适应性,其中包括很多来源于动物排泄物的病原菌,如猪粪等有机肥的大量投入可能带来这些菌群的增加,研究表明,γ-变形杆菌中的部分细菌(如假单胞菌属),能够溶解土壤中的难溶性磷酸盐(Elliott et al., 1987)。因此,变形菌门相对丰度的大幅增加在一定程度上表明土壤中有机质及C、N等养分的积累量升高,随着覆盖物的分解和有机肥的大量投入,土壤的微生物群落构成变得复杂。酸杆菌门是新近被分出的一门细菌,属于嗜酸菌,在自然界的各种环境中都广泛存在,该类菌可在一些特殊的生境中生存,包括酸雨灌溉、重金属污染的土壤及其他一些极端环境(Barns et al., 2007),但在生态系统中的具体作用尚未得到很好的研究结论。本研究表明:该类细菌随着覆盖年限的增加,土壤pH出现显著的下降,土壤酸化十分严重,从理论上来说,这一环境应更加适合嗜酸菌的繁殖。但本研究中酸杆菌种群出现下降的趋势,这一现象可能同土壤其他环境因子的改变有关,长期覆盖后其他环境因子的变化对酸杆菌繁殖造成的遏制效果要大于土壤酸化带来的正向作用。酸杆菌种群更倾向于生长在于可溶性有机碳含量较低的土壤中(Sul et al., 2013),因此,在长期覆盖后,土壤中酸杆菌的下降可能表明土壤中易分解碳含量上升,土壤固碳能力下降。Magill等(2000)对森林土壤的研究表明,土壤中N含量的增加会使酸杆菌门的多样性增加,其中Gp1和Gp3对土壤中的N循环起重要作用,Gp1和Gp3能够促进土壤中硝酸盐和亚硝酸盐的转化,从而降低土壤中硝酸盐和亚硝酸盐的含量。Acacio等(2013)把酸杆菌划分成若干种群,发现酸杆菌中不同种群对土壤环境因子变化反应具有差异性,一些种群同土壤可交换性铝的含量成正相关,但一些种群同土壤中Ca、Mg、Mg及B含量的相关性更密切,对酸杆菌种群的特征能够指示土壤不同环境因子的变化。放线菌属于革兰氏阳性菌,大部分属于腐生菌,Crawford等(1978)的研究表明放线菌门的部分细菌种群能够产生分解木质素的酶,具有分解木质素和纤维素的能力,起到分解植物有机残体的作用。放线菌门相对丰度在覆盖过程中整体呈上升趋势,这表明土壤中植物纤维的积累量在逐步升高,覆盖时竹叶、砻糠等覆盖物的部分还田是土壤中植物纤维的主要来源。同时放线菌门还具有共生固氮和解磷作用(Elliott et al., 1987),其丰度的上升也可能是土壤N、P含量升高的标志。
覆盖经营使绿弯菌门的相对丰度显著下降,覆盖后的相对丰度只有对照的1/8左右,覆盖后3~12年该值的数据基本保持稳定。绿弯菌门是一类通过光合作用产生能量的细菌,它具有兼性厌氧的特点,在光合作用中不产生氧气,绿弯菌门的大幅度减少可能同土壤中有机质增加及覆盖导致的光照条件改变有关(Fierer et al., 2007;Xun et al., 2016)。
4.3 土壤细菌群落与土壤环境因子的关系土壤微生物作为土壤生态系统中的重要组分,可将有机质分解为腐殖质,并释放养分,参与土壤C、N、P、S等元素的循环过程,pH、有机质组成、土壤养分及人为活动会对其群落结构和组成产生主要影响。RDA结果显示,土壤有机质,N、P、K等养分含量的变化均会对土壤细菌群落产生影响,变形菌门、拟杆菌门、绿弯菌门为土壤中丰度较高的细菌种群,其相对丰度分别与土壤中K、N和有机质含量、pH相关,变形菌门、拟杆菌门为土壤中相对丰度升高的属,而绿弯菌门为相对丰度降低的属,因此在覆盖过程中应当适当降低土壤N肥和K肥的使用量,同时在覆盖过程中适当增施熟石灰或碱性肥料,提高土壤酸碱度。
5 结论覆盖措施对土壤性质和主要养分含量产生了一定影响,导致表层土壤pH呈逐年降低的趋势,土壤酸化的现象在长期覆盖的竹林中尤为明显;同时雷竹林土壤有机质及N、P、K等养分含量也逐渐增加。受覆盖措施的影响,雷竹林土壤细菌群落结构、丰度及多样性均发生变化;短期覆盖能够促进土壤细菌的繁殖,对其丰度及多样性带来一定的促进作用,但在覆盖后期,其促进作用逐渐减弱,微生物群落结构及多样性趋于稳定。变形菌门、酸杆菌门、放线菌门在竹林土壤细菌群落中占据主要地位,随着覆盖年限的增加,其丰度呈现不同的变化趋势。土壤中各种养分元素含量的变化对土壤细菌群落产生了不同的影响,这是因为土壤细菌种类在土壤养分循环过程中各自的功能不同;且细菌对土壤养分的变化较为敏感,通过对其群落结构及多样性的研究,能够及时准确地分析土壤养分的变化,对改善竹林土壤质量、提高竹林生产力具有重要意义。
| [] | 高贵宾, 吴良如, 钟浩, 等. 2013. 竹林覆盖栽培研究综述. 竹子研究汇刊, 32(4): 7–11. |
| [] | Gao G B, Wu L R, Zhong H, et al. Rsesarch review of bamboo forest mulching cultivation. Journal of Bamboo Research, 32(4): 7–11. |
| [] |
刘文娜, 吴文良, 王秀斌, 等. 2006. 不同土壤类型和农业用地方式对土壤微生物量碳的影响. 植物营养与肥料学报, 12(3): 406–411.
( Liu W N, Wu W L, Wang X B, et al. 2006. Effects of soil type and land use pattern on microbial biomass carbon. Plant Nutrition and Fertilizer Science, 12(3): 406–411. DOI:10.11674/zwyf.2006.0320 [in Chinese] ) |
| [] |
鲁如坤. 2000. 土壤农业化学分析方法. 北京, 中国农业科技出版社.
( Lu R K. 2000. Soil argrochemistry analysis protocoes. Beijing, China Agriculture Science Press. [in Chinese] ) |
| [] |
秦华, 李国栋, 叶正钱, 等. 2010. 集约种植雷竹林土壤细菌群落结构的演变及其影响因素. 应用生态学报, 21(10): 2645–2651.
( Qin H, Li G D, Ye Z Q, et al. 2010. Evolvement of soil bacterial community in intensively managed Phyllostachys praecox stand and related affecting factors. Chinese Journal of Applied Ecolog, 21(10): 2645–2651. [in Chinese] ) |
| [] |
孙晓, 庄舜尧, 刘国群, 等. 2009. 集约经营下雷竹种植对土壤基本性质的影响. 土壤, 41(5): 784–789.
( Sun X, Zhuang S Y, Liu G Q, et al. 2009. Effect of Lei bamboo plantation on soil basic properties under intensive cultivation management. Soil, 41(5): 784–789. [in Chinese] ) |
| [] | 王保军, 刘双江. 2013. 环境微生物培养新技术的研究进展. 微生物学通报, 40(1): 6–17. |
| [] | Wang B J, Liu S J. Perspectives on the cultivability of environmental microorganisms. Microbiology China, 40(1): 6–17. |
| [] |
王伏伟, 王晓波, 李金才, 等. 2015. 施肥及秸秆还田对砂姜黑土细菌群落的影响. 中国生态农业学报, 23(10): 1302–1311.
( Wang F W, Wang X B, Li J C, et al. 2015. Effects of fertilization and straw incorporation on bacterial communities in lime concretion black soil. Chinese Journal of Eco-Agriculture, 23(10): 1302–1311. [in Chinese] ) |
| [] |
夏围围, 贾仲君. 2014. 高通量测序和DGGE分析土壤微生物群落的技术评价. 微生物学报, 54(12): 1489–1499.
( Xia W W, Jia Z J. 2014. Comparative analysis of soil m icroblal communities by pyrosequencing and DGGE. Acta Microbiologica Sinica, 54(12): 1489–1499. [in Chinese] ) |
| [] |
杨明, 艾文胜, 孟勇, 等. 2012. 毛竹林覆盖技术研究. 湖南林业科技, 5(39): 39–50.
( Yang M, Ai W S, Meng Y, et al. 2012. Covering technique in bamboo forest of Phyllostachys pubescens. Hunan Forestry Science and Technology, 5(39): 39–50. [in Chinese] ) |
| [] |
赵丽丽, 钟哲科, 杨慧敏, 等. 2015. 覆盖经营对早竹林土壤酸化过程的影响. 竹子研究汇刊, 24(3): 19–24.
( Zhao L L, Zhong Z K, Yang H M, et al. 2015. Effect on Phyllostachys praecox forest soil acidification process by covering management. Journal of Bamboo Research, 24(3): 19–24. [in Chinese] ) |
| [] |
朱琳, 黄建, 陈天阳, 等. 2006. 文冠果人工林根际土壤真菌和根系内生真菌群落多样性. 东北林业大学学报, 43(1): 105–111.
( Zhu L, Huang J, Chen T Y, et al. 2006. Root-associated and endophytic fungal community diversity in xanthoceras sorbifolia bunge plantation. Journal of Northeast of Forestry University, 43(1): 105–111. [in Chinese] ) |
| [] | Acacio A N, Eiko E K. 2013. Acidobacterial community responses to agricultural management of soybean in Amazon forest soils. FEMS Microbiolgy Ecology, 83(3): 607–621. DOI:10.1111/fem.2013.83.issue-3 |
| [] | Barns S M, Cain E C, Sommerville L, et al. 2007. Acidobactetia phylum sequences in uranium-contaminated subsurface sediments greatly expand the known diversity within the phylum. Appl Environ Microbiology, 73(9): 3113–3116. DOI:10.1128/AEM.02012-06 |
| [] | Chistoserdova L. 2010. Recent progress and new challenges in metagenomics for biotechnology. Biotechnology Letters, 32(10): 1351–1359. DOI:10.1007/s10529-010-0306-9 |
| [] | Crawford D L. 1978. Lignocellulose decomposition by selected streptomyces strains. Applied and Environmental Microbiology, 35(3): 1041–1045. |
| [] | Damon C, Lehembre F, Oger-Desfeux C, et al. 2012. Metatranscriptomics reveals the diversity of genes expressed by a eukaryotes in forest soils. PloS One, 7(1): e28967. DOI:10.1371/journal.pone.0028967 |
| [] | Elliott J M, Mathre D E, Sands D C. 1987. Identification and characterization of rhizosphere-competent bacteria of wheat. Applied & Environmental Microbiology, 53(12): 2793. |
| [] | Fierer N, Bradford M A, Jackson R B. 2007. Toward an ecological classification of soil bacteria. Ecology, 88(6): 1354–1364. DOI:10.1890/05-1839 |
| [] | Geisseler D, Scow K M. 2014. Long-term effects of mineral fertilizers on soil microorganisms-A review. Soil Biology and Biochemistry, 75: 54–63. DOI:10.1016/j.soilbio.2014.03.023 |
| [] | Gomez-Alvarez V, Teal T K, Schmidt T M. 2009. Systematic artifacts in metagenomes from complex microbial communities. The ISME Journal, 3(11): 1314–1317. DOI:10.1038/ismej.2009.72 |
| [] | Gosling P, Hodge A, Goodlass G, et al. 2006. Arbuscular mycorrhizal fungi and organic farming. Agriculture Ecosystems and Environment, 113(1/4): 17–35. |
| [] | Magill A H, Aber J D. 2000. Variation in soil net mineralization rateswith dissolved organic carbon additions. Soil Biology and Biochemistry, 32(5): 597–601. DOI:10.1016/S0038-0717(99)00186-8 |
| [] | Pace N R. 1997. A molecular view of microbial diversity and the biosphere. Science, 276(5313): 734–740. DOI:10.1126/science.276.5313.734 |
| [] | Sul W J, Asuming-Brempong S, Wang Q, et al. 2013. Tropicalagricultural land management influences on soil microbial communities through its effect on soil organic carbon. Soil Biology and Biochemistry, 65(5): 33–38. |
| [] | Torsvik V, Goksoyr J, Daae F L. 1990. High diversity in DNA of soil bacteria. Apply Environ Microb, 56(3): 782–787. |
| [] | Xun W, Wu X, Ting H, et al. 2016. Swine manure and quicklime have different impacts on chemical properties and composition of bacterial communities of an acidic soil. Applied Soil Ecology, 100: 38–44. DOI:10.1016/j.apsoil.2015.12.003 |
| [] | Zelles L, Bai Q Y, Beck T, et al. 1992. Signature fatty acids in phospholipids and lipopolysaccharides as indicators of microbial biomass and community structure in agricultural soils. Soil Biology and Biochemistry, 24(4): 317–323. DOI:10.1016/0038-0717(92)90191-Y |
| [] | Zhang G Y, He J Z, Liu F, et al. 2014. Iron-manganese nodules harbor lower bacterial diversity and greater proportions of proteobacteria compared to bulk soils in four locations spanning from north to south China. Geomicrobiology Journal, 7(31): 562–577. |
 2017, Vol. 53
2017, Vol. 53

