文章信息
- 王圣洁, 王胜坤, 林彩丽, 于少帅, 汪来发, 朴春根, 郭民伟, 田国忠
- Wang Shengjie, Wang Shengkun, Lin Caili, Yu Shaoshuai, Wang Laifa, Piao Chungen, Guo Minwei, Tian Guozhong
- 以tuf基因为靶标的5种16SrⅠ组植原体环介导恒温扩增技术
- Loop-Mediated Isothermal Amplification Assay for Detection of Five Phytoplasmas Belonging to 16SrⅠ Group Based on Target tuf Gene
- 林业科学, 2017, 53(8): 54-63.
- Scientia Silvae Sinicae, 2017, 53(8): 54-63.
- DOI: 10.11707/j.1001-7488.20170807
-
文章历史
- 收稿日期:2017-01-02
- 修回日期:2017-03-12
-
作者相关文章
2. 中国林业科学研究院热带林业研究所 广州 510520
2. Research Institute of Tropical Forestry, CAF Guangzhou 510520
植原体(phytoplasma,原称mycoplasma-like organism),是一类无细胞壁的原核生物,此类病害具有分布范围广、传播速度快、致病力强、染病植物难以治愈等特点(McCoy et al., 1979)。该病原在全世界范围内引起了许多重要的粮食作物、蔬菜、观赏植物和果树等经济林木的严重病害(Firrao et al., 2004),如由16SrⅣ组植原体引起的椰子(Cocos nucifera)致死黄化病,因其很难治愈和快速致死椰树而影响到全球的椰子生产(Bertaccini et al., 2014);由16SrⅤ组植原体引起的葡萄(Vitis vinifera)黄化病,在法国西南部发生,造成该地区80%葡萄感病,产量减少20% ~30%(Magarey,1986);由16SrⅩ组植原体引起的苹果丛簇病,在欧洲的苹果(Malus sieversii)林中暴发,造成果实减小、质量减轻,影响苹果的质量和商品价值,给德国和意大利等国的苹果生产造成严重损失(Strauss,2009)。植原体种类多样,根据国际比较菌原体研究组(international research programme on comparative mycoplasmology, IRPCM)基于16SrRNA基因序列RFLP的分类规则,目前已报道植原体有30余组(Zhao et al., 2016),而且每个组内又划分为许多亚组,其中翠菊(Callistephus chinensis)黄化组植原体(16SrⅠ组),无论从种类、多样性还是传播范围上来看都是分布最广和危害最严重的。Lee等(2004)将翠菊黄化组植原体分成了16SrⅠ-A亚组的翠菊黄化、番茄(Lycopersicon esculentum)巨芽、洋葱(Allium cepa)黄化,16SrⅠ-B亚组的莴苣(Lactuca sativa)黄化、桑(Morus alba)萎缩、绣球花(Hydrangea macrophylla)变叶,16SrⅠ-C亚组的橄榄(Canarium album)丛枝、三叶草(Trifolium repens)变叶、草莓(Fragaria × ananassa)绿瓣,16SrⅠ-D亚组的泡桐(Paulownia spp.)丛枝,16SrⅠ-E亚组的蓝莓(Vaccinium angustifolium)萎缩等15个亚组,其中在我国发生和危害比较严重的该组植原体包括泡桐丛枝、苦楝丛枝、桑树萎缩、莴苣黄化以及长春花(Catharanthus)绿变等。此外,16SrⅡ组植原体引起的花生(Arachis)丛枝、甘薯(Dioscorea esculenta)丛枝和臭矢菜(Cleome viscosa)丛枝,16SrV组植原体引起的枣疯病、槐树(Sophora)丛枝病、樱桃(Cerasus pseudocerasus)致死黄化以及重阳木(Bischofia polycarpa)丛枝等也发生比较严重,这些植原体病害给我国林业及农业造成了严重的经济损失(赖帆等, 2008)。2013年国家林业局把泡桐丛枝病和枣疯病列入了全国林业危险性有害生物名单。由于植原体尚不能实现体外培养,针对该类病害的高度抗性品种又很难获得,实际生产中该类病害的防治措施主要依靠清除染病的植株、杜绝侵染来源、综合治理媒介昆虫以切断传播途径等措施。因此,建立快速、高效、简便的植原体检测技术,有助于及时发现病原和感病植物,提前采取控制措施,对该类病害防治具有重要意义(耿显胜等, 2015)。
植原体的检测,早期主要依靠生物学、电镜观察、抗生素试验相结合的传统方法进行,这些方法耗时长,检测灵敏度也不高,而且检测结果还容易被其他因素干扰(朱澂等, 1991)。随着生物技术的发展,基于酶联免疫反应、核酸杂交以及PCR技术的检测方法相继建立,检测的灵敏度和准确性不断提高(兰平等, 2001; 廖晓兰等, 2002),但是这些方法往往需要精密的变温设备以及复杂的分析仪器,且操作程序复杂,检测时间长,对检测人员的技术水平及熟练程度要求较高,大大限制了此类诊断方法的使用和推广。环介导恒温扩增技术(loop-mediated isothermal amplification, LAMP)是Notomi等(2000)开发的一种恒温核酸扩增方法,是一种新型的分子诊断方法。该方法具有特异性强、操作简单、不需要复杂的仪器、检测周期短和结果可视化的特点,非常适合作为基层和现场的病害诊断方法进行推广使用。自该技术建立以来,已经广泛地应用到真菌、细菌、病毒等病原菌的检测中(戴婷婷等, 2016; 张永江等, 2016; 贾雅菁等, 2016),其中也包括一些针对植原体的LAMP检测技术,如Tomlison等(2010)以16S—23S间隔区作为靶标建立了翠菊黄化、草莓绿瓣、三叶草变叶、杏(Armeniaca)褪绿卷叶和圣保罗岛椰子枯萎病植原体的LAMP检测方法; Bekele等(2011)以IGS和23S作为靶标序列建立了番木瓜(Carica)黄化和银胶菊(Parthenium)丛枝植原体的LAPMP检测方法; Nair等(2016)以16SrRNA基因作为靶标建立了引起椰子根枯萎和槟榔(Areca)叶黄化植原体的LAMP检测体系。
目前, 针对我国发生普遍的植原体所建立的LAMP检测技术报道较少,仅见韩剑等(2015)用16SrRNA基因作为靶标设计引物开展的LAMP可视化检测枣疯病植原体的研究;而针对我国发生普遍而严重的16SrⅠ组植原体引起的泡桐丛枝、苦楝丛枝等病害的快速检测技术尚未见报道。因此本研究以蛋白延伸因子EF-Tu编码基因(tuf)作为靶标基因设计LAMP引物,针对泡桐丛枝、苦楝丛枝等16SrⅠ组植原体,建立了16SrⅠ-LAMP检测技术,以期为16SrⅠ组植原体的田间快速精准诊断、植物繁殖材料的带菌检测以及病害的精准高效检疫和防控提供技术支撑。
1 材料与方法 1.1 材料与试剂试验所使用的植原体感染材料及其健康对照,采集自我国不同地区,其编号及分类信息详见表 1。CTAB法植物基因组DNA快速提取试剂盒(DN14) 购自北京艾德莱生物科技有限公司;恒温核酸扩增试剂盒购自广州迪澳生物科技有限公司;2 × PCR预混液购自博迈德生物科技有限公司。
|
|
NanoDrop2000超微量分光光度计为赛默飞世尔科技公司产品;Rotor-Gene3000荧光定量PCR仪为澳大利亚Corbett公司产品;朗基A300 PCR仪为杭州朗基科学仪器有限公司产品;恒温水浴锅为上海亚荣生化仪器产品。
1.2 植物总DNA提取与PCR扩增检测称取1~2 g新鲜植物材料,液氮冷冻并充分研磨,取0.10 g研磨后的粉末,参照CTAB法植物基因组DNA快速提取试剂盒(DN14) 说明书提取总DNA,提取的总DNA -20 ℃保存备用。利用植原体通用引物R16mF2/R16mR1(Gundersen et al., 1996)对提取的植物总DNA进行PCR扩增,PCR扩增体系及反应条件参考李永等(2005)的方法进行。25 μL扩增反应体系中含有制备的DNA模板1 μL,正反向引物各0.5 μL(10 μmol ·L-1),2 × PCR预混液(0.05 U ·μL-1 Taq DNA聚合酶, 4 mmol ·L-1 MgCl2和0.4 mmol ·L-1 dNTPs)12.5 μL,ddH2O补至25 μL。反应条件:94 ℃ 5 min;94 ℃ 45 s, 52 ℃ 45 s, 72 ℃ 1 min, 共35个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测。
1.3 16SrⅠ-LAMP检测体系的建立 1.3.1 LAMP引物的设计与合成在GeneBank中下载不同组植原体tuf基因的核酸序列,利用DNAMAN软件对上述序列进行比较及相似性比对,找出不同组植原体的基因差异位点和高度保守区域,使用荣研公司的LAMP引物在线设计软件Primer Explorer V4,按照LAMP引物筛选原则,针对16SrⅠ组植原体tuf基因的保守序列,设计多套LAMP引物,从中筛选出一套特异性好的引物(表 2)。LAMP扩增的引物包括正向外引物F3、反向外引物B3、正向内引物FIP(FIC+F2)、反向内引物BIP(BIC+B2)。引物由生工生物工程(上海)股份有限公司按照HPLC纯度级别合成。
|
|
参考广州迪澳生物科技有限公司所提供的恒温扩增试剂盒,建立植原体16SrⅠ-LAMP扩增体系,并以试剂盒所提供的阳性和阴性标样做对照。
16SrⅠ-LAMP扩增体系为:总体积45 μL,包含有10 μmol ·L-1 PaWB-F3 0.5 μL、10 μmol ·L-1 PaWB-B3 0.5 μL,40 μmol ·L-1 PaWB-FIP 1 μL、40 μmol ·L-1 PaWB-BIP 1 μL,LAMP反应液RM(2×)12.5 μL,8 U ·μL-1 Bst DNA聚合酶1 μL,荧光染料10×SYBR Green Ⅰ 0.5 μL,待测样品DNA 0.5 μL,用超纯水补齐到25 μL,同时加入20 μL密封液。反应条件为:将配制好的反应管混匀后离心,置于63 ℃恒温反应60 min,80 ℃灭活5 min。
1.3.3 LAMP扩增产物的判断方法LAMP反应结束后,采用2种方法鉴别阳性LAMP扩增结果:1) 将扩增反应管置于恒温荧光检测仪或荧光PCR仪中,实时读取荧光信号,如果出现“S”形扩增曲线则判定为阳性,即待测样品中含有植原体;如果无“S”形扩增曲线则判定为阴性,即待测样品中无植原体;2) 在扩增产物中加入1 μL显色液(钙黄绿素-氯化锰溶液),在日光下肉眼观察颜色变化,如果扩增产物变为翠绿色则判定为阳性,即待测样品中含有植原体;如果扩增产物仍为橘黄色则判定为阴性,即待测样品中无植原体。
1.4 16SrⅠ-LAMP检测体系的特异性验证应用建立的16SrⅠ-LAMP检测体系对收集的我国不同地区发生的不同16Sr组植原体病害进行特异性验证。供试的样品包括16SrⅠ组:泡桐丛枝、苦楝丛枝、桑树萎缩病、长春花绿变和莴苣黄化的发病与健康组织样品(于少帅,2016);16Sr Ⅱ组:花生丛枝、甘薯丛枝和臭矢菜丛枝的发病与健康组织样品;16SrⅤ组:枣疯病、重阳木丛枝、紫花槐(Sophora japonica var. violacea)丛枝和樱桃致死黄化的发病与健康组织样品和白杜的发病组织样品。提取各样品基因组DNA进行LAMP扩增,反应结束后观察LAMP反应结果。试验至少重复3次。
1.5 16SⅠ-LAMP检测体系的灵敏度试验利用本实验室组培保存的泡桐丛枝组培苗作为标准样品提取基因组DNA,测定基因组DNA浓度后,用灭菌的ddH2O按2倍梯度进行稀释。随后以稀释后的稀释液作为模板,同时进行LAMP扩增反应和以R16mF2和R16mR1为引物的常规PCR和LAMP检测,每个梯度设置3次重复,反应结束后观察结果,比较2种方法的灵敏度。
1.6 16SrⅠ-LAMP检测体系检测的稳定性及应用供试样品包括6份来自贵州贵阳、辽宁大连、河北保定、河南开封、福建福州和北京海淀的田间采集泡桐丛枝样品,1份泡桐丛枝的组培苗(BJ+),1份健康泡桐的组培苗(BJ-),1份实验室组培保存的南阳泡桐丛枝组培苗(NY),3份不同品系脱毒组培苗(MB33、ZH3、ZP16) 以及相对应的这3个品系进行病组织微芽嫁接传病的组培苗(邓宝红,2016),同时提取植物总DNA。并以此为模板,同步进行常规PCR、巢式PCR和LAMP检测,比较不同检测方法的检测效果,并验证LAMP检测体系的稳定性。
2 结果与分析 2.1 16SrⅠ-LAMP检测方法的建立试验以泡桐丛枝为检测对象,健康泡桐为对照,同时用恒温核酸扩增试剂盒自带阳性样品(positive)与阴性样品(negative)作为对照(确定酶是否失活和反应体系稳定性),筛选以tuf基因作为靶标设计的多套LAMP引物组,并参考恒温扩增试剂盒所提供的反应程序,建立植原体16SrⅠ-LAMP检测体系。从图 1可以看出,试剂盒自带阳性样品(positive)和泡桐丛枝样品(PaWB)均出现了“S”形扩增曲线,加入显色液后变成翠绿色,而试剂盒自带阴性样品(negative)和健康泡桐样品(PH)均未出现扩增曲线和变色反应。16SrⅠ-LAMP检测体系从基因组DNA加入至阳性结果出现,可以在40 min内完成,实现对16SrⅠ组植原体染病组织的快速检测。

|
图 1 16SrⅠ-LAMP检测结果的荧光检测及显色反应 Fig.1 Amplification plot and colorimetric analysis of 16SrⅠ-LAMP products |
以不同来源、不同16Sr组别的植原体感染的组织材料及其对应的健康组织材料的基因组DNA作为模板,按照所建立的LAMP检测体系进行反应,验证LAMP体系的检测特异性。结果表明,泡桐丛枝(PaWB)、苦楝丛枝(CWB)、桑树萎缩病(MD)、长春花绿变(PePWB)和莴苣黄化(LY)5种感病的组织材料均可以产生良好的扩增曲线,并且均能在40 min以内出现信号,16SrⅡ组、16SrⅤ组、16SrⅩ Ⅸ组植原体感染的组织材料以及所有的健康组织材料都没出现扩增曲线(图 2)。扩增产物经溶解性曲线分析,基本处于相同的温度(图 3),显色反应结果也与扩增曲线检测结果吻合(图 4)。由此表明所建立的16SrⅠ-LAMP扩增体系可以完成5种16SrⅠ组植原体的检测,而且特异性良好,对其他组的植原体及健康对照不产生阳性结果。
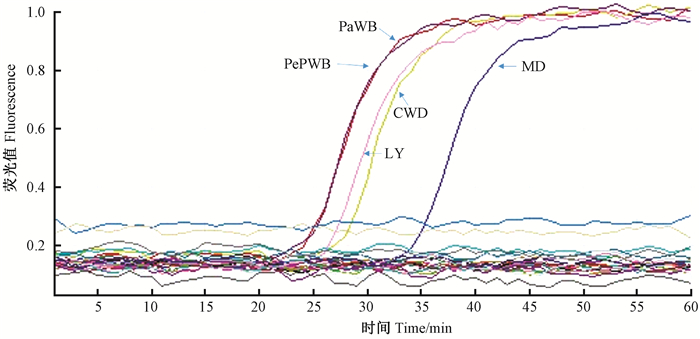
|
图 2 16SrⅠ-LAMP检测体系特异性验证荧光检测 Fig.2 Specificity test of 16SrⅠ-LAMP using amplification plot |

|
图 3 16SrⅠ-LAMP检测体系特异性溶解性曲线 Fig.3 Solubility curve of 16SrⅠ-LAMP using amplification plot |

|
图 4 16SrⅠ-LAMP检测体系特异性验证显色 Fig.4 Specificity test of 16SrⅠ-LAMP using colorimetric analysis 1.PaWB; 2.CWB; 3.MD; 4.PePWB; 5, 6.PnWB; 7.SpWB; 8.ClWB; 9.JWB; 10.BiWB; 11.CeLY; 12.RoWB; 13.CnYC; 14.PH; 15.CH; 16.MH; 17.PeH; 18.LH; 19.PnH; 20.SpH; 21.ClH; 22.JH; 23.BiH; 24.CeH; 25.RoH; 26.CnH. |
以泡桐丛枝病组培苗的植物总DNA作为原液,按2倍梯度进行稀释,以稀释后的稀释液作为模板,同步进行PCR和LAMP检测,PCR结果以1%琼脂糖凝胶电泳进行判读,LAMP结果以显色法进行判读。结果显示,PCR在2-11倍的稀释模板下时无明显扩增反应,达到检测下限(图 5),LAMP在2-13倍的稀释模板时仍有确定的阳性结果,但在2-14倍的稀释模板时颜色变化不明显,达到检测下限(图 6)。LAMP的检测灵敏度较普通PCR提高了8倍。
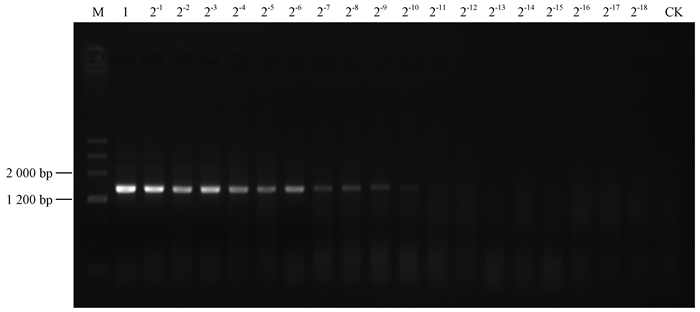
|
图 5 泡桐丛枝病样品的普通PCR检测 Fig.5 Detection of PaWB DNA dilution with conventional PCR |

|
图 6 泡桐丛枝病样品的LAMP检测 Fig.6 Detection of PaWB DNA dilution with LAMP |
利用建立的16SrⅠ-LAMP检测方法,对来自贵阳、保定、北京、福州、大连和开封6个地区的田间泡桐丛枝病样品以及实验室组培保存的不同品系泡桐丛枝病苗、脱毒苗和病组织微芽嫁接接种脱毒苗共15份样品进行检测,并与普通PCR、巢式PCR的检测结果进行比较。结果(表 3)表明,6份来自不同省市的田间采集的泡桐丛枝病样品、1份泡桐丛枝新组培苗(BJ+)、1份实验室保存的南阳泡桐丛枝病组培苗(NY)的检测结果皆为阳性,1份健康泡桐新组培苗(BJ-)、3份不同品系脱毒组培苗(MB33、ZH3、ZP16) 的检测结果均为阴性,病组织微芽嫁接接种脱毒苗(病接穗-脱毒砧木)18天后,NY-MB33、NY-ZH3的检测结果为阳性。NY-ZP16的PCR、LAMP检测结果为阴性,而巢式PCR检测结果为阳性。综合以上结果分析,不论针对田间样品还是组培样品,16SrⅠ-LAMP检测方法均可以稳定地实现对病组织中泡桐丛枝植原体的准确检测。但是从检出率上来看,LAMP与PCR相当(66.66%),但比巢式PCR略低(73.33%)。不同品系脱毒苗微芽嫁接传病试验显示,与MB33、ZH3品系相比,植原体在ZP16品系的嫁接传毒效果较差,可能与该品系抗病性更强有关,为植原体抗性品系潜在选育对象。
|
|
植原体病害是系统侵染性病害,媒介昆虫是自然传播途径,而种苗和各种营养繁殖材料包括种根、接穗、砧木、块根、块茎等是病害人为传播的主要途径。从源头上杜绝病原的自然和人为传播扩散是防止此类病害流行的最常用也是最根本的方法。因此植原体的准确快速诊断、实用检测与鉴别方法的建立在病害各方面的研究中都至关重要,特别是在病害监测、种苗检疫及综合防治方面占据着无法替代的地位并发挥着关键作用。较之常规核酸扩增的检测方法,新型的核酸等温扩增技术包括LAMP、滚环扩增技术(RCA)、单引物扩增技术(SPIA)、切刻内切酶介导恒温扩增技术(NEMA)、依赖核酸序列扩增技术(NASBA)、重组酶聚合酶扩增技术(RPA)等已开始广泛应用于病毒、细菌、真菌病害的早期检测中(汪琳等, 2011)。其中LAMP技术的改进和不断完善与发展使得检测病原靶标核酸的扩增可以在恒温条件下进行,简化了试验步骤,避免了对昂贵热循环仪器的依赖,在缩短检测时间的同时,使得其更能满足快速、简便、现场检测的需求;而且该技术不仅可用于各类病原微生物的检测和鉴定,也可用于肿瘤和转基因生物的检测、基因拷贝的定量、微生物单核苷酸多态性和基因分型(Fakruddin,2011)。16SrⅠ-LAMP是针对泡桐丛枝病等16SrⅠ组植原体靶序列的6个区域设计特异性引物,在扩增过程中,在链置换DNA聚合酶的作用下,形成哑铃状结构,并以此为复制单元实现核酸的恒温扩增;而且扩增的副产物——焦磷酸镁沉淀,可以通过指示剂钙黄绿素、HNB等进行可视化的结果判断,不再需要通过琼脂糖凝胶电泳判断扩增结果,从而实现了扩增结果更快速、更高通量的检测和鉴定。本研究采用了荧光曲线和显色2种方法对结果加以判定,起到了相互验证的效果,同时进一步提高了检测准确性。Bekele等(2011)为了确证阴性检测结果,设置植物COX或ACTIN基因序列引物作为内参(Vu et al., 2016)。本研究利用试剂盒附带的阳性和阴性标样对照标样同样起到了避免出现假阳性或假阴性试验结果的目的,因而每次测定都要设置内参或阳性和阴性对照标样,是发现检测体系问题、保证检测结果可靠性的必要条件。
LAMP检测技术的关键在于靶标基因的选择和引物组合的筛选,靶标基因要选择种内高度保守、种间变异较高的序列。由于植原体对植物的专性寄生特性,因而要求LAMP引物不能扩增寄主植物的同源基因。目前以保守的16S、23S和IGS DNA为靶标基因的植原体LAMP检测技术已见报道,但这些技术主要针对的是国外发生比较普遍的翠菊黄化、椰子黄化萎缩等植原体病害的检测,且不同LAMP检测体系的特异性也有很大差异,如Obura等(2011)基于16S DNA设计的LAMP引物能够检测不同组的植原体,而多数引物仅能检测同组内的植原体。本研究首次以持家基因tuf基因作为靶标基因建立了16SrⅠ组植原体病害的LAMP检测技术,特异性较好,检测灵敏度比普通PCR技术提高了8倍,填补了我国在16SrⅠ组植原体快速检测领域的空白;而且本检测体系不仅能检测16SrⅠ-D亚组的泡桐丛枝植原体,也能检测16SrⅠ-B亚组桑树萎缩、苦楝丛枝病等植原体,所以推测其对该组内相同亚组或者不同亚组的其他国内外植原体也能实现检测,但这需要后续试验验证。已知我国发生的主要16SrⅠ组植原体的tuf基因序列变异范围(0.73% ~0.74%)高于16Sr DNA(低于0.42%),推测应该更有利于设计组内亚组或株系特异性的引物(于少帅, 2016)。Sugawara等(2012)曾用植原体的持家基因groEL设计引物用于植原体的检测,并随其变异性大于16S等基因但所设计的LAMP引物也能检测16SrⅠ组的多种植原体,这与tuf基因LAMP引物检测的结果类似。
对于LAMP检测植原体的灵敏度,不同研究因选择的靶标序列、引物、测定方法、植原体种类等不同而得出了差异很大的结论。如有报道采用浊度法和溴化乙锭染色琼脂糖电泳检测LAMP的灵敏度比巢式PCR还高100倍(Obura et al., 2011);而Sugawara等(2012)研究发现不同的引物其检测灵敏度不同,分别比常规PCR高10倍和100倍。本研究体系的检测灵敏度高于普通PCR但低于巢式PCR,可能与引物特性或者无环引物有关。
针对LAMP技术容易出现痕量样品气溶胶污染、特异性靶标选择困难等问题,本研究注意到通过将样品制备室与检测室分离,选择新的靶标,避免进行琼脂糖凝胶电泳,在反应管中添加密封液等措施可以有效地减少假阳性的出现,取得了理想的检测效果。针对反应结果的判断方式,预计将LAMP技术与横向侧流试纸结合(蔡怡等, 2016),亦或是将LAMP与微流控芯片技术结合(Gansen et al., 2012),在加快检测速度的同时,可能会提高植原体检测通量及自动化检测能力。另外在检测样品制备和成品制备、运输方面仍有很大的改进和完善空间,比如尝试一步法DNA提取,或者直接裂解样品进行扩增(苟大平等, 2015),筛选不同的冻干保护剂,制成干粉制剂,增长产品的货架期等(吴彤等, 2016)。为了直接在田间进行大量样品的快速检测,已有研究采用叶片、花、果部位直接匀浆而不必经过DNA提纯步骤即能取得理想的植原体检测效果,这可能与LAMP检测体系对样品中存在的抑制物质较PCR不敏感有关,从而为该技术在病害检疫和生产上的推广应用展示了更广阔的前景(Junghe et al., 2016; Kogovsek et al., 2015)。
泡桐在我国分布广泛,且经历过种苗与种根大规模引种栽培,使得泡桐丛枝病在全国大部分泡桐种植区扩展蔓延,在危害比较严重的黄淮平原等病害适生暴发流行区,病害的发生率在70%以上。通过工厂化的脱毒育苗,进行无毒苗栽培以及加大抗性品系的栽培面积,可以有效控制此类病害的大流行(邓宝红,2016)。本研究所建立的快速检测体系,可以为快速地鉴定脱毒组培苗的带毒情况提供更简便、快捷、实用的新技术,且检测灵敏度比常规PCR略高。在抗病品系筛选中,通过微芽嫁接传病,LAMP技术可以为快速鉴定出具有抗性的一些品种提供强有力的支持,加快优良抗病品系的选育和推广应用。本试验所涉及的3个品系中,通过感病组织材料NY微芽嫁接传病,脱毒组培苗MB33和ZH3均被成功传毒,且植原体在其苗中繁殖正常,浓度较高;而脱毒组培苗ZP16经过微芽嫁接传病后,并未显示明显的丛枝现象;普通PCR和LAMP均未检出植原体,只有通过巢式PCR才检出低浓度植原体的存在,由此说明植原体在此品系中繁殖受限,ZP16品系可以作为潜在抗病品系进行选育。
4 结论本研究以tuf基因作为靶标,首次建立了针对我国泡桐丛枝病、苦楝丛枝病、桑树萎缩病、莴苣黄化及长春花绿变5种16SrⅠ组植原体的环介导恒温扩增技术。该技术快速、简便、结果可视化,适合科研单位及基层生产单位使用。通过在应用实践中进一步技术改进、优化和完善,将在植原体的早期诊断、脱毒苗检测以及抗性品种选育等方法发挥很大的作用,为植原体病害的科学防治提供技术支撑。
| [] |
蔡怡, 周前进, 陈炯. 2016. 环介导等温扩增联合横向侧流试纸(LAMP-LFD)对嗜水气单胞菌快速检测方法的建立. 中国兽医学报, 36(2): 256–264.
( Cai Y, Zhou Q J, Chen J. 2016. Establishment of loop-mediated isothermal amplification method combined with a lateral flow dipstick for rapid detection of Aeromonas hydrophila. Chinese Journal of Veterinary Science, 36(2): 256–264. [in Chinese] ) |
| [] |
戴婷婷, 吴小芹. 2015. 等温扩增技术快速检测棕榈疫霉. 林业科学, 52(10): 161–166.
( Dai T T, Wu X Q. 2015. A method for rapidly identifying Phytophthora palmivora using the LAMP technique. Scientia Silvae Sinicae, 52(10): 161–166. DOI:10.11707/j.1001-7488.20161020 [in Chinese] ) |
| [] |
邓宝红. 2016. 泡桐优选品系脱毒组培苗繁育及抗丛枝病测定. 北京. 中国林业科学研究院博士学位论文. ( Deng B H. 2016. Thephytoplasma-free seedling production of selected Paulownia clones and their resistance against withes'-broom disease. Beijing:PhD thesis of Chinese Academy of Forestry.[in Chinese]) |
| [] |
耿显胜, 舒金平, 王浩杰, 等. 2015. 植原体病害的传播、流行和防治研究进展. 中国农学通报, 31(25): 164–170.
( Geng X S, Shu J P, Wang H J, et al. 2015. Research advance on transmission, epidemic and control of phytoplasmal disease. Chinese Agricultural Science Bulletin, 31(25): 164–170. DOI:10.11924/j.issn.1000-6850.casb15050052 [in Chinese] ) |
| [] |
苟大平, 王曦茁, 汪来发, 等. 2015. 一种适于PCR和LAMP检测的松木中松材线虫DNA快速提取方法. 林业科学, 51(6): 100–110.
( Gou D P, Wang X Z, Wang L F, et al. 2015. A method for rapidly extracting DNA of Bursaphelenchus xylophilus from the infested pine wood for PCR and LAMP detection. Scientia Silvae Sinicae, 51(6): 100–110. [in Chinese] ) |
| [] |
韩剑, 罗明, 何贵伦, 等. 2015. 枣疯病植原体LAMP可视化检测方法的建立. 西北农业学报, 24(6): 125–131.
( Han J, Luo M, He G L, et al. 2015. Development of a loop-mediated isothermal amplification assay for visual detection of jujube witches'-broom phytoplasma. Acta Agriculturae Boreali-Occidentalis Sinica, 24(6): 125–131. DOI:10.7606/j.issn.1004-1389.2015.06.020 [in Chinese] ) |
| [] |
贾雅菁, 付博宇, 王羽, 等. 2016. 实时荧光环介导等温扩增技术检测牛乳中的蜡样芽孢杆菌. 食品科学, 37(6): 184–189.
( Jia Y J, Fu B Y, Wang Y, et al. 2016. Detection of Bacillus cereus in milk by real-time fluorescence loop-mediated isothermal amplification method. Food Science, 37(6): 184–189. DOI:10.7506/spkx1002-6630-201606033 [in Chinese] ) |
| [] |
赖帆, 李永, 徐启聪, 等. 2008. 植原体的最新分类研究动态. 微生物学通报, 35(2): 291–295.
( Lai F, Li Y, Xu Q C, et al. 2008. The present status on classification of phytoplasmas. Institute of Microbiology, 35(2): 291–295. [in Chinese] ) |
| [] |
兰平, 李文凤, 朱水芳, 等. 2001. 甘薯丛枝病植原体的PCR检测. 植物学报, 18(2): 210–215.
( Lan P, Li W F, Zhu S F, et al. 2001. PCR detection of phytoplasma from sweet potato witches'-broom disease. Chinese Bulletin of Botany, 18(2): 210–215. [in Chinese] ) |
| [] |
李永, 田国忠, 朴春根, 等. 2005. 我国几种植物植原体的快速分子鉴别与鉴定的研究. 植物病理学报, 35(4): 293–299.
( Li Y, Tian G Z, Piao C G, et al. 2005. Rapid molecular differentiation and identification of different phytoplasmas from several plants in China. Acta Phytopathologica Sinica, 35(4): 293–299. [in Chinese] ) |
| [] |
廖晓兰, 朱水芳, 陈红运, 等. 2002. 植原体TaqMan探针实时荧光PCR检测鉴定方法的建立. 植物病理学报, 32(4): 361–367.
( Liao X L, Zhu S F, Chen H Y, et al. 2002. Establishment of real-time fluorescent PCR method with TaqMan probe for phytoplasma detection and identification. Acta Phytopathologica Sinica, 32(4): 361–367. [in Chinese] ) |
| [] |
汪琳, 罗英, 周琦, 等. 2011. 核酸恒温扩增技术研究进展. 生物技术通讯, 22(2): 296–302.
( Wang L, Luo Y, Zhou Q, et al. 2011. Advances in the research of nucleic acid isothermal amplification technologies. Letters in Biotechnology, 22(2): 296–302. [in Chinese] ) |
| [] |
吴彤, 刘旭, 李佳禾, 等. 2016. 牛支原体等温扩增冻干试剂盒研究. 中国农业科学, 49(16): 3251–3260.
( Wu T, Liu X, Li J H, et al. 2016. Development of a freeze-dried kit for isothermal amplification assay of mycoplasma bovis. Scientia Agricultura Sinica, 49(16): 3251–3260. DOI:10.3864/j.issn.0578-1752.2016.16.018 [in Chinese] ) |
| [] |
于少帅. 2016. 植原体tuf基因启动子分子特征和枣树抗植原体物质研究. 北京: 中国林业科学研究院博士学位论文. ( Yu S S. 2016. Molecular characterization of phytoplasmatuf gene promoter and phytoplasma-resistant substances from jujube. Beijing:PhD thesis of Chinese Academy of Forestry.[in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-82201-1016251308.htm |
| [] |
张永江, 辛言言, 李桂芬, 等. 2016. 葡萄A病毒RT-LAMP检测方法的建立. 中国农业科学, 49(1): 103–109.
( Zhang Y J, Xin Y Y, Li G F, et al. 2016. Development of a RT-LAMP assay for detection of grapevine virus A. Scientia Agricultura Sinica, 49(1): 103–109. [in Chinese] ) |
| [] |
朱澂, 徐丽云, 金开璇, 等. 1991. 用DAPI荧光显微术检测泡桐丛枝病. 植物学报, 33(7): 495–500.
( Zhu C, Xu L Y, Jin K X, et al. 1991. Detection of mycoplasmalike organism of paulownia witches'-broom with DAPI fluorescence microscopy. Journal of Integrative Plant Biology, 33(7): 495–500. [in Chinese] ) |
| [] | Bekele B, Hodgetts J, Tomlinson J, et al. 2011. Use of a real-time LAMP isothermal assay for detecting 16SrⅡ and Ⅻ phytoplasmas in fruit and weeds of the Ethiopian Rift Valley. Plant Pathology, 60(6): 345–355. |
| [] | Bertaccini A, Duduk B, Paltrinieri S, et al. 2014. Phytoplasmas and phytoplasma diseases:a severe threat to agriculture. American Journal of Plant Sciences, 5(12): 1763–1788. DOI:10.4236/ajps.2014.512191 |
| [] | Fakruddin M. 2011. Loop mediated isothermal amplification (LAMP)-an alternative to polymerase chain reaction (PCR). Bangladesh Research Publications Journal, 5(4): 425–439. |
| [] | Firrao G, Andersen M, Bertaccini A, et al. 2004. Candidatus Phytoplasma', a taxon for the wall-less, non-helical prokaryotes that colonize plant phloem and insects. International Journal of Systematic and Evolutionary Microbiology, 54(4): 1243–1255. DOI:10.1099/ijs.0.02854-0 |
| [] | Gansen A, Herrick A M, Dimov I K, et al. 2012. Digital LAMP in a sample self-digitization (SD) chip. Lab on A Chip, 12(12): 2247–2254. DOI:10.1039/c2lc21247a |
| [] | Gundersen D E, Lee I M. 1996. Ultrasensitive detection of phytoplasmas by nested-PCR assays using two universal primer pairs. Phytopathologia mediterranea, 35(3): 144–151. |
| [] | Jonghe K D, Roo I D, Maes M. 2016. Fast and sensitive on-site isothermal assay (LAMP) for diagnosis and detection of three fruit tree phytoplasmas. European Journal of Plant Pathology, 10.1007/s10658-016-1039-y.1-11. |
| [] | Kogovsek P, Hodgetts J, Hall J, et al. 2015. LAMP assay and rapid sample preparation method for on-site detection of flavescence dorée phytoplasma in grapevine. Plant Pathology, 64(2): 286–296. DOI:10.1111/ppa.2015.64.issue-2 |
| [] | Lee I, Gundersen-Rindal D E, Davis R E, et al. 2004. 'Candidatus Phytoplasma asteris', a novel phytoplasma taxon associated with aster yellows and related diseases. International Journal of Systematic and Evolutionary Microbiology, 54(4): 1037–1048. DOI:10.1099/ijs.0.02843-0 |
| [] | Magarey P A. 1986. Grapevineyellows-Aetiology, epidemiology and diagnosis. South African Journal of Enology & Viticulture, 7: 90–100. |
| [] | McCoy R E, Whitcomb R F, Tully J G. 1979. Mycoplasmas and yellows diseases. Mycoplasmas, 2: 229–264. |
| [] | Nair S, Manimekalai R, Raj P G, et al. 2016. Loop mediated isothermal amplification (LAMP) assay for detection of coconut root wilt disease and arecanut yellow leaf disease phytoplasma. World Journal of Microbiology and Biotechnology, 32(7): 1–7. |
| [] | Notomi T, Okayama H, Masubuchi H, et al. 2000. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research, 28(12): E63. DOI:10.1093/nar/28.12.e63 |
| [] | Obura E, Masiga D, Wachira F, et al. 2011. Detection of phytoplasma by loop-mediated isothermal amplification of DNA (LAMP). Journal of Microbiological Methods, 84(2): 312–316. DOI:10.1016/j.mimet.2010.12.011 |
| [] | Strauss E. 2009. Microbiology. Phytoplasma research begins to bloom. Science, 325(5939): 388–390. DOI:10.1126/science.325_388 |
| [] | Sugawara K, Himeno M, Keima T, et al. 2012. Rapid and reliable detection of phytoplasma by loop-mediated isothermal amplification targeting a housekeeping gene. Journal of General Plant Pathology, 78(6): 389–397. DOI:10.1007/s10327-012-0403-9 |
| [] | Tomlinson J A, Boonham N, Dickinson M. 2010. Development and evaluation of aone-hour DNA extraction and loop-mediated isothermal amplification assay for rapid detection of phytoplasmas. Plant Pathology, 59(3): 465–471. DOI:10.1111/(ISSN)1365-3059 |
| [] | Vu N T, Pardo J M, Alvarez E, et al. 2016. Erratum to:Establishment of a loop-mediated isothermal amplification (LAMP) assay for the detection of phytoplasma-associated cassava witches' broom disease. Applied Biological Chemistry.10.1007/s13765-015-0134-7. |
| [] | Zhao Y, Davis R E. 2016. Criteria for phytoplasma 16Sr group/subgroup delineation and the need of a platform for proper registration of new groups and subgroups. International Journal of Systematic and Evolutionary Microbiology, 66(5): 2121–2123. DOI:10.1099/ijsem.0.000999 |
 2017, Vol. 53
2017, Vol. 53

