文章信息
- 王璇, 理永霞, 张星耀
- Wang Xuan, Li Yongxia, Zhang Xingyao
- 营养和蒎烯胁迫条件下松材线虫雌雄比变化规律
- Changing Pattern of Sex Ratio of Pine Wood Nematode (Bursaphelenchus xylophilus) under Different Nutrition Conditions and Pinene Stress
- 林业科学, 2017, 53(8): 149-154.
- Scientia Silvae Sinicae, 2017, 53(8): 149-154.
- DOI: 10.11707/j.1001-7488.20170817
-
文章历史
- 收稿日期:2016-04-21
- 修回日期:2017-06-12
-
作者相关文章
2. 南京林业大学南方现代林业协同创新中心 南京 210037
2. Co-Innooation Center for Sustainable Forestry in Southern China, Nanjing Forestry University Nanjing 210037
松材线虫病,即松树萎蔫病(pine wilt disease,PWD),是一种以松材线虫(Bursaphelenchus xylophilus)(Nickle et al., 1981)为病原,墨天牛属昆虫(Monochamus spp.)(Mamiya, 1983)为主要媒介,寄主松树(Pinus)、相关伴生菌和环境因素互作的复杂病害系统(张星耀等,2003)。该病传播蔓延迅速,防治难度极大,是我国目前最为严重的森林灾害。
松材线虫繁殖率是影响其致病性的关键因素,而雌雄比是决定种群繁殖率的重要因素之一。线虫能通过改变雌雄比调整群体繁殖率从而适应不同环境(Blackmore et al., 1989)。关于松材线虫在不同环境条件下的雌雄比动态变化的报道较少,研究发现温度能影响松材线虫雌雄比和繁殖潜力(Heip et al., 1978),在一定范围内,温度越高,松材线虫活性越高,生殖能力越强。松材线虫在雌雄比较高时繁殖能力较高(Rutherford et al., 1992),其雌雄比为3.4时繁殖效率最高(刘宝军,2014):松材线虫雌雄比还会随着化学物质胁迫(黄晓娟,2014),光照胁迫(张田园,2014)等培养条件的变化而变化。
松材线虫侵染后,线虫取食松树薄壁细胞引起松树萜烯类物质代谢紊乱,松树树脂道内大量积累单萜、倍半萜等物质(Kuroda, 1989; Hara et al., 2006)。松树释放的单萜类物质主要是α-蒎烯和β-蒎烯。低浓度的α-蒎烯和β-蒎烯会抑制松材线虫繁殖,而高浓度时能促进松材线虫繁殖(Niu et al., 2012)。同时,随着松材线虫的入侵,群体数量急剧增加,松材线虫将面临不同的营养环境。松材线虫在树体内的成功定殖后,会面临不同的营养环境,同时也必须克服松树萜烯类次级代谢产物的抑制作用。因此,为了探讨松材线虫病的扩张机制,了解影响松材线虫繁殖的因素及其变化规律,为调控松材线虫病发生提供理论依据,笔者研究了松材线虫在不同营养环境和蒎烯胁迫条件下的雌雄比变化。
1 材料与方法 1.1 松材线虫培养和收集供试高致病性松材线虫来自于本实验所保存的Nxy61虫株,该虫株分离于2012年10月浙江宁波当年发病的马尾松(Pinus massoniana)枝条,通过贝尔曼漏斗法分离后用玉米(Zea mays)培养基长期保存。试验接种线虫为混合虫态松材线虫(包括虫卵、2~4龄幼虫以及成虫),在PDA灰葡萄孢培养基上25 ℃黑暗培养7天后,通过贝尔曼漏斗法分离线虫,5 000 r·min-1离心5 min,无菌水清洗3遍,通过光学显微镜统计线虫悬浮液中雌虫和雄虫数量,并加入相应数量的雌虫或雄虫来调整线虫悬浮液雌雄比为1.5,最后用无菌水调整线虫悬浮液浓度为15 000头·mL。
1.2 松材线虫性别比计数200 μL线虫悬浮液(3 000头)接种于直径为9 cm PDA灰葡萄孢培养基上,25 ℃黑暗培养。分别培养2、3、4、5、6、7和8天后,用无菌水冲洗3次,完全收集平板上的线虫,5 000 r·min-1离心5 min后,统计每个平板上线虫后代的雌雄比。计数时观察到阴门的4龄幼虫和成虫计为雌虫,有交合刺的计为雄虫。每个试验处理重复4次,每个平板计数不少于500头线虫。
1.3 PDA灰葡萄培养基上雌雄比变化检测为了研究松材线虫在PDA灰葡萄孢培养基上雌雄比变化规律,将3 000头混合虫态的松材线虫接种于直径为9 cm的PDA灰葡萄孢培养基上,根据1.2中雌雄比计数方法分别统计接种后2、3、4、5、6、7、8、10和15天时的线虫后代雌雄比。
1.4 不同培养基上雌雄比变化检测为了研究松材线虫在不同营养条件下的雌雄比变化规律,分别制备了不同营养条件的培养基:PDA(200 g马铃薯;20 g葡萄糖;17 g琼脂)、HPDA(100 g马铃薯;10 g葡萄糖;17 g琼脂)、PA(200 g马铃薯;17 g琼脂)、DA(20 g葡萄糖;17 g琼脂)、WA(17 g琼脂)。不同培养基上接种相同大小的灰葡萄孢菌丝体,25 ℃黑暗培养7 d后,完全刮取培养基上灰葡萄孢菌丝,烘干后称量其干质量,得到不同培养基上灰葡萄孢菌丝生物量。同时,接种200 μL雌雄比为1.5的线虫悬浮液(15 000头·mL-1)到不同营养含量的灰葡萄孢培养基上,根据1.3节方法统计接种后2、3、4、5、6、7和8天时不同营养培养基上的线虫后代雌雄比。
1.5 不同萜烯类物质处理条件下松材线虫雌雄比检测不同浓度蒎烯的制备:以Triton X-100为乳化剂制备不同浓度的α-蒎烯(Acros Organics, Purity 97%)和β-蒎烯(Alfa Aesar, Purity 99%)以及其混合物的蒎烯溶液(Choi, 2007)。其中α-蒎烯浓度分别是56.33 mg·mL-1(low concentration α-pinene, AL)和214.5 mg·mL-1(high concentration α-pinen, AH),β-蒎烯浓度分别是21.66 mg·mL-1(low concentrationβ-pinene, BL)与214.5 mg·mL-1(high concentration β-pinene, BH),两者混合物(mixture of α-pienene and β-pienene, M)中α-蒎烯浓度为56.33 mg·mL-1,β-蒎烯浓度为21.66 mg·mL-1,对照组(CK)为0.5%的Triton X-100(m/m)。
蒎烯胁迫的雌雄比检测:采用棉球生测法(Kong et al., 2007)测定不同萜烯类物质对松材线虫雌雄比的影响。在培养好的灰葡萄孢平板(9 cm)中央用0.5 cm无菌打孔器打孔,放入无菌脱脂棉球(5 mm直径)后,加入200 μL线虫液(15 000头·mL-1)后,加入50 μL不同浓度的萜烯溶液,对照加入50 μL的0.5%Triton X-100(m/m)溶液,封口膜封口后,25 ℃黑暗培养,根据1.3节方法分别计数接种后第2、3、4、5、6、7和8天的松材线虫雌雄比。
1.6 数据分析所有统计学数据均用SPSS19.0分析。通过方差分析不同处理条件下的平均值显著性,所有作图数据均用平均值和标准差表示。
2 结果与分析 2.1 PDA真菌培养基上松材线虫雌雄比松材线虫接种PDA灰葡萄孢培养基后,松材线虫雌雄比第3天最大,大约为3。接种后第7天时松材线虫雌雄比降低为1.5,一直到接种后的15天,松材线虫雌雄比保持在1.2~1.5。接种后期,随着培养时间的延长,松材线虫雌雄比变化较小,且比较稳定(图 1)。

|
图 1 PDA培养基上松材线虫雌雄比 Fig.1 The sex ratio of PWN on the PDA fungi media |
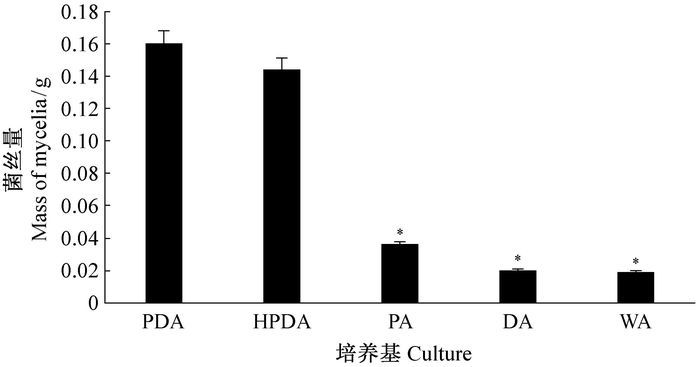
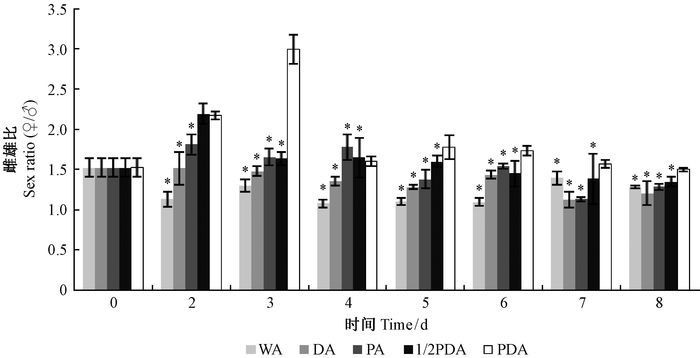
由于5种培养基营养成分含量不同,接种相同数量的菌丝体7天后,5种培养基上灰葡萄孢菌丝生物量存在差异,从高到低依次是PDA、HPDA、PA、DA和WA,其中PDA与PA、DA和WA培养基上菌丝生物量差异显著(图 2)。接种相同数量的混合虫态松材线虫悬浮液后,松材线虫在PDA培养基上的雌雄比最高,在DA和WA培养基上的最低。接种到PDA、HPDA和PA培养基上后,松材线虫雌雄比接种早期逐渐增大,但随着线虫数量的逐渐增加,其雌雄比逐渐降低,而接种到DA和WA培养基后,松材线虫雌雄比波动较小,且一直稳定在1.0~1.5。松材线虫雌雄比在PDA培养基上接种第3天时达到最大,在HPDA上的雌雄比第2天最高,而且在PDA上的最大值高于HPDA的最大值。以PDA培养基为对照,其他4种营养条件的培养基的雌雄比差异显著(图 3)。
|
图 2 不同营养培养基上菌丝质量 Fig.2 The mass of mycelia on the different nutrition media *:平均值在0.05水平差异显著The mean difference is significant at the 0.05 level.下同The same below. |
|
图 3 不同营养培养基上松材线虫雌雄比 Fig.3 The sex ratio of PWN on the different nutrition media |
高浓度α-蒎烯处理后,松材线虫雌雄比分别在第2、4天出现2个峰值,第4天后逐渐降低最后稳定在较低水平。低浓度处理后第2天时降低,随后缓慢升高最后趋于稳定。总的来说,高浓度α-蒎烯处理后雌雄比波动比较大,低浓度处理时波动较小。与对照组相比,高浓度和低浓度α-蒎烯处理差异显著(图 4)。

|
图 4 α-蒎烯胁迫后松材线虫雌雄比 Fig.4 The sex ratio of PWN under the α-pinene stress |
根据图 5所示,接种前期,低浓度β-蒎烯比高浓度β-蒎烯处理后松材线虫雌雄比高,但接种后第7天,高浓度β-蒎烯处理条件下的雌雄比高于低浓度β-蒎烯处理和对照组雌雄比。总体来说,低浓度与高浓度β-蒎烯处理后,松材线虫雌雄比变化趋势相同,松材线虫雌雄比都是在第2天时降低随后逐渐缓慢增加,且均稳定在1.2~1.6。高浓度和低浓度β-蒎烯处理条件下没有显著差异,但与对照组相比,均有明显差异。

|
图 5 β-蒎烯胁迫后松材线虫雌雄比 Fig.5 The sex ratio of PWN under the β-pinene stress |
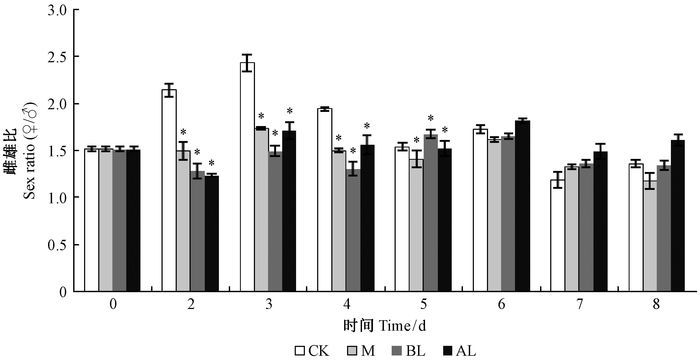
如图 6所示,接种后第2天所有处理中松材线虫雌雄比均降低,随后缓慢增加且有轻微波动。与低浓度的α-蒎烯和β-蒎烯处理相比,α-蒎烯和β-蒎烯混合处理后松材线虫雌雄比波动较小且一直稳定在较低水平。在接种后期,低浓度α-蒎烯和β-蒎烯混合处理的松材线虫雌雄比最低。与对照处理相比,接种前5天,α-蒎烯、β-蒎烯以及其混合处理后松材线虫雌雄比存在显著差异,第6天后差异不显著。
|
图 6 α-蒎烯和β-蒎烯混合胁迫后松材线虫雌雄比 Fig.6 The sex ratio of PWN under the mixture of α-pinene and β-pinene stress |
松材线虫入侵后,在寄主树脂道迅速繁殖和迁移,最终导致松树萎蔫甚至是死亡(Futai, 1980; Jones et al., 2008)。松树是否萎蔫或死亡与线虫的繁殖率和迁移率相关(Filipiak, 2015)。松材线虫繁殖率与迁移率越高,其致病力越强(Wang et al., 2005; Odani et al., 1985)。雌雄比是线虫繁殖率的决定性因素,雌雄比率越高,线虫繁殖能力越强。
松材线虫接种到PDA灰葡萄孢培养基后,在第3天时雌雄比最高,在3左右,而松材线虫雌雄比为3.4时,其繁殖能力最高(Liu et al., 2014),这可能是因为,在接种第3天后,松材线虫适应了营养丰富的新环境,繁殖率较强且活性较高。因此,PDA灰葡萄孢培养基上菌丝体营养丰富且适合松材线虫生长繁殖。而松材线虫接种第7天以后,雌雄比稳定在1.2~1.5,这可能是因为随着松材线虫数量逐渐增加,其密度不断增大,达到了该真菌平板的最大容纳量,此时松材线虫必须通过控制其雌雄比调整其繁殖率从而适应环境的不断变化。这个时期的松材线虫种群数量较大,活性适中,且雌雄比稳定。因此,本试验选择了第7天的PDA灰葡萄孢培养基上的松材线虫作为试验线虫。
松材线虫在营养富足环境条件下其雌雄比较高,在营养贫乏或密度较高时,雌雄比较低,这可能是因为营养充足条件下,适合雌性线虫繁殖,产生大量的雌性线虫后代,导致雌雄比比较高且呈现上升趋势。而在种群数量的急剧增加,食物骤然减少情况下,抑制了雌性线虫的发育,雄性线虫逐渐增多,雌雄比降低。因此,适宜条件将促进雌性线虫产生,而逆境胁迫时容易产生雄性后代。该现象在其他植物寄生性线虫中也有研究,马铃薯根结线虫(H. rostochiensis)在巨细胞较大的时候或者营养含量较高时也会容易产生雌性后代,同时随着入侵后代逐渐增加,在营养缺乏或者巨细胞空间不够条件下产生雄性后代(Trudgill, 1967)。根结线虫(M. incognita)和爪哇根结线虫(M. javanica)在寄主马铃薯(Solanum tuberosum)上浓度比较高时,雄性后代的比例也会增加(Davide et al., 1967)。
松材线虫在不同雌雄比条件下采取不同交配对策,该对策符合状态制约选择理论,即在雌性比例较高时采用Y交配对策,此时种群交配效率高,繁殖速率快;而雄性比例较高时采用X交配对策,此时交配效率低,种群繁殖慢(刘宝军,2014)。在所有不适合环境如低浓度α-蒎烯和β-蒎烯及两者混合处理条件下,松材线虫雌雄比较低其波动较小,此时松材线虫采取X交配对策,其繁殖率较低,而在高浓度α-蒎烯环境条件下,松材线虫采取Y对策,繁殖率较高。
松材线虫入侵后,寄主在树脂道产生大量的单萜和倍半萜,主要是α-蒎烯和β-蒎烯等(Kuroda, 1989)。松材线虫接种5年生马尾松后,松树α-蒎烯和β-蒎烯存在2次积累,第1次积累是松树响应松材线虫入侵的主动防御反应,而第2次大量积累是松材线虫大量繁殖后,干扰寄主次级代谢反应,从而诱导寄主次级代谢紊乱,是松树被动防御的结果(王璇等,2017)。本研究发现低浓度α-蒎烯和β-蒎烯以及两者混合处理条件下,松材线虫雌雄比较低且变化较小,而高浓度的α-蒎烯处理条件下其雌雄比较高。由于偏雌性的线虫群体更容易产生后代,因此松材线虫在低浓度α-蒎烯和β-蒎烯处理条件下种群繁殖率降低,而高浓度条件下松材线虫繁殖率增加。另外,松材线虫入侵后,解毒相关的基因响应萜烯胁迫而大量表达(Kikuchi et al., 2011; Shinya et al., 2013),该类基因有利于消除萜烯类次级代谢产物对松材线虫的毒害作用,提高线虫抗性,从而有利于线虫在树体内大量繁殖。因此,在与寄主互作过程中,松材线虫通过调整种群雌雄比,调节种群繁殖率,适应松树体内萜烯等次级代谢产物变化,同时通过解毒相关功能因子提高抗性,从而在树体内大量繁殖。
4 结论松材线虫在适宜环境条件下产生较多雌性后代,种群加速繁殖,提高种群数量;而在不适宜环境条件下产生较多的雄性后代,此时种群繁殖慢,产生较少的个体,从而提高种群适应性。因此,在不同环境条件下,松材线虫具有不同繁殖对策,松材线虫会通过改变种群雌雄比来调整种群繁殖率从而适应环境的变化。
| [] |
黄小娟. 2014. 化学胁迫下松材线虫的繁殖与交配行为. 临安: 浙江农林大学硕士学位论文. ( Huang X J. 2014. Chemical stress against the reprouduction and mating behavior of Bursaphelenchus xylophilus.Lin'an:MS thesis of Zhejiang A & F University.[in Chinese]).) http://cdmd.cnki.com.cn/Article/CDMD-10341-1015502422.htm |
| [] |
刘宝军. 2014. 松材线虫择偶对策及择偶偏向的转录组分析. 北京: 中国林业科学研究院博士学位论文. ( Liu B J. 2014. The mating strategy of Bursaphelenchus xylophilus and transcriptome sequencing of mating preference. Beijing:PhD thesis of Chinese Academy of Forestry.[in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-82201-1014336638.htm |
| [] |
王璇, 理永霞, 刘振宇, 等. 2017. 松材线虫CYP450基因与松树蒎烯类物质代谢的相关性. 林业科学, 53(6): 105–110.
( Wang X, Li Y X, Liu Z Y, et al. 2017. Relationship between the cytochrome P450 gene of Pine Wood Nematode and the accumulation of pine pinene. Scientia Silvae Sinicae, 53(6): 105–110. DOI:10.11707/j.1001-7488.20170612 [in Chinese] ) |
| [] |
张田园. 2014. 光照对松材线虫的种群抑制作用及光敏感基因初探. 浙江农林大学硕士学位论文. ( Zhang T Y. 2014. The inhibition of light on the pine wood nematode populations and thelight-sensitive genetic preliminary research. Lin'an:MS thesis of Zhejiang A & F University.[in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10341-1015504732.htm |
| [] |
张星耀, 骆有庆. 2003. 中国森林重大生物灾害. 北京, 中国林业出版社: 1-29.
( Zhang X Y, Luo Y Q. 2003. Major Forest Diseases and Insect Pests in China. Beijing, China Forestry Publishing House: 1-29. [in Chinese] ) |
| [] | Blackmore M S, Charnov E L. 1989. Adaptive variation in environmental sex determination in a nematode. The American Naturalist, 134(5): 817–823. DOI:10.1086/285013 |
| [] | Choi I, Kim J, Shin S, et al. 2007. Nematicidal activity of monoterpenoids against the pine wood nematode (Bursaphelenchus xylophilus). Russian Journal of Nematology, 15(1): 35. |
| [] | Davide R G, Triantaphyllou A C. 1967. Influence of the environment on development and sex differentiation of root-knot nematodes. Nematologica, 13(1): 102–110. DOI:10.1163/187529267X00986 |
| [] | Filipiak A. 2015. Pathogenicity of selected isolates of the quarantine pinewood nematode Bursaphelenchus xylophilus to Scots pine (Pinus sylvestris L.). Journal of Plant Protection Research, 55(4): 378–382. |
| [] | Futai K. 1980. Pathogenicity of selected isolates of the quarantine pinewood nematode Bursaphelenchus xylophilus to Scots pine (Pinus sylvestris L.). Applied Entomology and Zoology, 15(4): 458–464. DOI:10.1303/aez.15.458 |
| [] | Hara N, Takeuchi Y, Futai K. 2006. Cytological changes in ray parenchyma cells of seedlings of three pine species infected with the pine wilt disease. Japanese Journal of Nematology, 36(1): 23–32. DOI:10.3725/jjn.36.23 |
| [] | Heip C, Smol N, Absillis V. 1978. Influence of temperature on the reproductive potential of Oncholaimus oxyuris (Nematoda:Oncholaimidae). Marine Biology, 45(3): 255–260. DOI:10.1007/BF00390608 |
| [] | Jones J T, Moens M, Mota M, et al. 2008. Bursaphelenchus xylophilus: opportunities in comparative genomics and molecular host-parasite interactions. Molecular Plant Pathology, 9(3): 357–368. DOI:10.1111/j.1364-3703.2007.00461.x |
| [] | Kikuchi T, Cotton J A, Dalzell J J, et al. 2011. Genomic insights into the origin of parasitism in the emerging plant pathogen Bursaphelenchus xylophilus. PLoS Pathog, 7(9): e1002219. DOI:10.1371/journal.ppat.1002219 |
| [] | Kong J O, Park I K, Choi K S, et al. 2007. Nematicidal and propagation activities of thyme red and white oil compounds toward Bursaphelenchus xylophilus (Nematoda:Parasitaphelenchidae). Journal of Nematology, 39(3): 237–242. |
| [] | Kuroda K. 1989. Terpenoids causingtracheid-cavitation in Pinus thunbergii infected by the pine wood nematode (Bursaphelenchus xylophilus). Ann Phytopathol Soc Jpn, 55(2): 170–178. DOI:10.3186/jjphytopath.55.170 |
| [] | Liu B J, Hu J F, Liu Z Y, et al. 2014. Behavioural features of Bursaphelenchus xylophilus in the mating process. Nematology, 16(8): 895–902. DOI:10.1163/15685411-00002816 |
| [] | Mamiya Y. 1983. Pathology of the pine wilt disease caused by Bursaphelenchus xylophilus. Annual Review of Phytopathology, 21(1): 201–220. DOI:10.1146/annurev.py.21.090183.001221 |
| [] | Nickle W R, Golden A M, Mamiya Y, et al. 1981. On the taxonomy and morphology of the pine wood nematode, Bursaphelenchus xylophilus (Steiner & Buhrer 1934) Nickle 1970. Journal of Nematology, 13(3): 385. |
| [] | Niu H, Zhao L L, Lu M, et al. 2012. The ratio and concentration of two monoterpenes mediate fecundity of the pinewood nematode and growth of its associated fungi. PLoS One, 7(2): e1002219. |
| [] | Odani K, Sasaki S, Yamamoto N, et al. 1985. Differences in dispersal and multiplication of two associated nematodes, Bursaphelenchus xylophilus and Bursaphelenchus mucronatus in pine seedlings in relation to the pine wilt disease development. Journal of the Japanese Forestry Society, 61(10): 398–403. |
| [] | Reece S E, Drew D R, Gardner A. 2008. Sex ratio adjustment and kin discrimination in malaria parasites. Nature, 453(7195): 609–614. DOI:10.1038/nature06954 |
| [] | Rutherford T A, Riga E, Webster J M. 1992. Temperature-mediated behavioral relationships in Bursaphelenchus xylophilus, B. mucronatus, and their hybrids. Journal of Nematology, 24(1): 40. |
| [] | Shinya R, Morisaka H, Takeuchi Y, et al. 2013. Making headway in understanding pine wilt disease:What do we perceive in the postgenomic era?. Journal of Bioscience and Bioengineering, 116(1): 1–8. DOI:10.1016/j.jbiosc.2013.01.003 |
| [] | Trudgill D L. 1967. The effect of environment on sex determination in Heterodera rostochiensis. Nematologica, 13(2): 263–272. DOI:10.1163/187529267X00120 |
| [] | Wang Y, Yamada T, Sakaue D, et al. 2005. Variations in life history parameters and their influence on rate of population increase of different pathogenic isolates of the pine wood nematode, Bursaphelenchus xylophilus. Nematology, 7(3): 459–467. DOI:10.1163/156854105774355545 |
 2017, Vol. 53
2017, Vol. 53

