文章信息
- 张鹏, 赵彤彤, 李明月, 吴灵东, 沈海龙
- Zhang Peng, Zhao Tongtong, Li Mingyue, Wu Lingdong, Shen Hailong
- 氯化钙、ABA和蔗糖预处理对解除休眠水曲柳种子低温脱水萌发的影响
- Effects of CaCl2, ABA or Sucrose Pretreatment on Germination of Dormancy Released Seeds of Fraxinus mandshurica Dehydrated at Low Temperature
- 林业科学, 2017, 53(7): 54-61.
- Scientia Silvae Sinicae, 2017, 53(7): 54-61.
- DOI: 10.11707/j.1001-7488.20170706
-
文章历史
- 收稿日期:2016-10-13
- 修回日期:2016-11-25
-
作者相关文章
水曲柳(Fraxinus mandshurica)是东北林区重要的用材树种,由于其种子具有形态生理休眠特性,需要分别经过暖温和冷湿层积处理才能萌发(凌世瑜等,1983),给播种育苗造成了一定困难。打破水曲柳种子休眠的传统方法有越冬埋藏、隔年埋藏等,但传统的打破休眠的方法处理需时长,易造成水曲柳种子的霉烂、提前萌发等问题。如果将经过催芽解除休眠的水曲柳种子进行再干燥贮藏,便可以随时提供非休眠种子而不需要苗圃工作者再进行催芽处理。这样可以使有条件的(如容器育苗)苗圃在一年中的任何时候进行播种育苗,不再受种子休眠造成的季节性限制,也可以避免因为播种时间延误而影响种子的播种品质和苗木质量。有研究发现,解除休眠的水曲柳种子在室温条件下进行再干燥后贮藏是可行的,但在较低温度(5 ℃)条件下再干燥后种子萌发率、发芽指数显著下降,平均发芽时间明显延长,低温脱水过程中种子脱水耐性发生变化,导致种子萌发能力下降(吴灵东,2012;吴灵东等,2012)。
种子在脱水过程中受到一些保护性物质的影响,进而减少脱水伤害。LEA蛋白、油素蛋白、亲水脂分子以及糖都属于脱水伤害的保护性物质(Kranner et al., 2005);蔗糖、寡糖和半乳糖苷环多醇等糖类物质在种子发育到成熟过程中不断积累,这些糖类物质在种子脱水过程中起保护作用。还有一些研究认为氯化钙(Song et al., 2002)、ABA(Ingram et al., 1996)等物质在种子脱水过程中也起到了一定的保护作用。但是,以往关于水曲柳种子休眠与萌发研究中,并没有涉及氯化钙、ABA和蔗糖处理提高种子萌发能力的报道,尤其是这些预处理措施在提高种子低温脱水后的萌发能力上是否有作用也没有研究。综上所述,结合水曲柳种子低温脱水干燥后萌发能力下降的现象,本文提出假设:适宜浓度的糖、氯化钙和ABA等脱水保护物质预处理能够提高水曲柳种子低温脱水后的萌发能力。为验证这一假设并探究其内在的生理机制,以水曲柳解除休眠种子为材料,研究不同浓度氯化钙、ABA、蔗糖溶液预处理对种子在低温(5 ℃)下脱水后萌发的影响,并研究在此过程中种子浸出液相对电导率、抗氧化酶系统活性以及贮藏物质的变化,旨在为解除休眠水曲柳种子的干燥贮藏提供理论和技术依据,并揭示种子脱水耐性调控的生理机制。
1 材料与方法 1.1 试验材料试验用种子采自黑龙江省带岭林业科学研究所水曲柳种子园。种子经过裸(无基质)层积处理,裸层积条件为:先暖温(18 ℃)3个月,再低温(5 ℃)3个月(张鹏,2008)。以层积处理结束后解除休眠的水曲柳种子为材料。
1.2 研究方法 1.2.1 低温脱水前的预处理对种子脱水后萌发的影响层积处理结束后,利用不同浓度(10-2,10-3,10-4,10-5 mol·L-1)的氯化钙溶液、不同浓度(10-3,10-4,10-5,10-6 mol·L-1)的ABA溶液和不同质量浓度(1,10,50,100 g·L-1)的蔗糖溶液浸泡种子,种子于室温(20~23 ℃)下浸种24 h,以使用蒸馏水浸种24 h的种子作为对照。种子经过不同预处理后在5 ℃条件下自然阴干脱水至种子相对含水量为10%以下(采用称重法确定,约为90 h)时结束。脱水后立即进行种子发芽试验。
1.2.2 不同预处理对种子细胞膜透性、抗氧化系统和贮藏物质代谢的影响根据上述不同预处理对水曲柳种子萌发影响的试验结果,分别选择出提高种子萌发能力最有效的处理浓度(氯化钙10-3 mol·L-1、ABA 10-6 mol·L-1、蔗糖100 g·L-1),以经过上述溶液预处理24 h后低温脱水的种子为材料,以蒸馏水浸泡24 h后低温脱水种子为对照,进行种子浸出液相对电导率、种子抗氧化酶活性、丙二醛含量及可溶性糖、可溶性蛋白和淀粉含量测定,以考查不同预处理措施对种子细胞膜透性、抗氧化系统酶活性和贮藏物质代谢的影响。
1.2.3 种子发芽能力及生理指标测定发芽试验于种子脱水后立即进行。在室温(20~23 ℃)下,将不同处理的种子用冷水浸泡24 h,然后置于底部垫有2层滤纸的塑料培养皿(直径为9 cm)中。培养皿放入人工气候箱内,种子在黑暗条件下培养,萌发条件采用日变温(白天15 ℃ 8 h,夜间10 ℃16 h),每种处理有4个培养皿(4次重复),每个培养皿中有50粒种子,每天观察记录种子发芽情况,以胚根突破种子并超过2 mm作为种子萌发的标志。发芽率、发芽指数和平均发芽时间的计算公式如下:
| ${\rm{发芽率}}{\rm{(GR)}} = \frac{{{\rm{发芽种子粒数}}}}{{{\rm{供试种子总数}}}} \times 100\% ;$ | (1) |
| ${\rm{发芽指数}}{\rm{(GI)}} = \sum {\frac{{{n_g}}}{{{t_g}}}} ;$ | (2) |
| ${\rm{平均发芽天数}}{\rm{(MGT)}} = \frac{{\sum {{n_g} \times {t_g}} }}{{\sum {{n_g}} }}$ | (3) |
式中:tg为发芽时间(d),ng为与tg相对应的每日发芽种子数。
细胞膜透性测定采用相对电导率法(宋松泉等,2005),略有改动,取经过不同处理脱水后的大小一致且无损伤的种子并剥去果翅,用双蒸水冲洗3次,然后用滤纸将种子表面水分吸干。将各处理种子放于具塞玻璃试管中(每种处理3次重复,每个重复20粒种子),加5 mL去离子水浸泡(25 ℃下),加水后立即测定浸泡液的电导率(初始值,R1),加水浸泡12 h后再次测定浸泡液的电导率(种子外渗电导率,R2)。将连同种子在内的浸泡液于100 ℃水浴中煮沸30 min后取出,待种子冷却至室温后立即测定浸泡液的电导率(R3)。用相对电导率表示电解质渗漏率。计算公式为:相对电导率(%)=(R2-R1)×100/(R3-R2)。
超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法测定,过氧化物酶(POD)活性采用愈创木酚法(高俊凤,2006)测定,过氧化氢酶(CAT)活性采用紫外吸收法测定,丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定,可溶性糖及淀粉含量采用蒽酮试剂法(李合生,2000)测定,可溶性蛋白含量采用考马斯亮蓝G-250染色法(张志良,1990)测定。取不同条件下干燥的种子,每种处理取种3份(即3次重复),用解剖刀将种胚和胚乳(带种皮)分开,分别测定胚和胚乳(各取0.2 g)的超氧化物歧化酶、过氧化物酶、过氧化氢酶活性及丙二醛、可溶性糖和可溶性蛋白含量。
1.3 数据统计分析试验数据的单因素或双因素方差分析采用SPSS18.0软件处理,多重比较方法使用Duncan法。发芽率和电导率数据为百分数,对其进行反正弦平方根转换后再进行方差分析。
2 结果与分析 2.1 预处理对水曲柳种子低温脱水后萌发的影响 2.1.1 氯化钙溶液预处理对种子脱水后萌发的影响氯化钙溶液预处理对水曲柳种子经低温脱水后的发芽率影响不显著(P>0.05),经浓度为10-3 mol·L-1氯化钙处理后的种子发芽率最高(表 1)。氯化钙溶液预处理对水曲柳种子经低温脱水后的发芽指数影响显著(P < 0.05),除10-4mol·L-1氯化钙处理与对照差异不显著外,其他处理与对照差异均显著,其中经氯化钙10-5 mol·L-1处理的种子发芽指数最高(表 1)。氯化钙溶液预处理对水曲柳种子经低温脱水后的发芽时间影响极显著(P<0.01),浓度为10-5mol·L-1或10-3 mol·L-1氯化钙处理的种子平均发芽时间明显较对照短(表 1)。
|
|
ABA溶液预处理对水曲柳种子经低温脱水后的发芽率影响显著(P<0.05),10-4 mol·L-1 ABA处理与对照差异显著(P < 0.05),可以显著提高种子在5 ℃条件下脱水干燥后的发芽率(表 2)。ABA溶液预处理对水曲柳种子经低温脱水后的发芽指数影响显著(P < 0.05),浓度为10-3 mol·L-1和10-5 mol·L-1 ABA处理与对照差异不显著,10-4 mol·L-1和10-6 mol·L-1 ABA溶液处理种子的发芽指数显著高于对照(P < 0.05)。ABA溶液预处理对水曲柳种子经低温脱水后的发芽时间影响极显著(P < 0.01),10-6 mol·L-1 ABA溶液预处理的种子发芽时间比对照显著缩短(约2天)(表 2)。
|
|
蔗糖溶液预处理对水曲柳种子经低温脱水后的发芽率影响显著(P < 0.05),浓度100 g·L-1的蔗糖溶液预处理后的种子在5 ℃条件下脱水后萌发率显著高于对照(表 3)。蔗糖溶液预处理对水曲柳种子经低温脱水后的发芽指数和发芽时间影响均不显著(P>0.05)(表 3)。
|
|
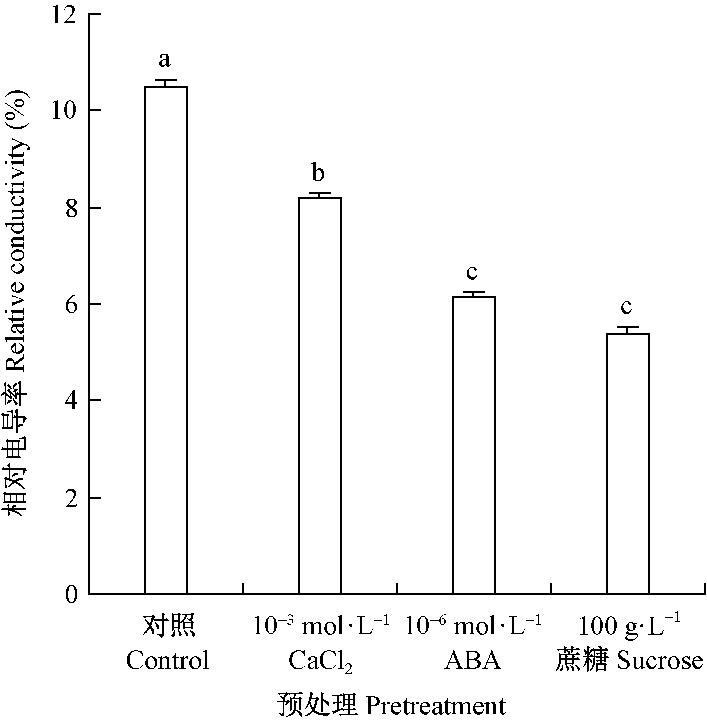
由图 1可见,种子经不同预处理后,低温(5 ℃)条件下干燥脱水后的相对电导率差异极显著(P<0.01),经100 g·L-1的蔗糖、10-6 mol·L-1 ABA或10-3mol·L-1氯化钙溶液预处理后,种子相对电导率分别为5.39%、6.14%和8.17%,显著低于对照种子电导率(10.49%)。多重比较结果(图 1)显示,10-6 mol·L-1 ABA、10-3 mol·L-1氯化钙或100 g·L-1的蔗糖溶液预处理均显著降低了种子低温脱水后的电导率,且10-6 mol·L-1 ABA或100 g·L-1的蔗糖溶液预处理降低种子电导率的作用显著强于10-3 mol·L-1氯化钙预处理。
|
图 1 氯化钙、ABA和蔗糖预处理的水曲柳种子经低温脱水后的电导率 Fig.1 The electrical conductivity of Fraxinus mandshurica seeds pretreated by ABA, CaCl2 and sucrose and then dehydrated at low temperature 图中垂直线表示标准误差,不同小写字母表示采用Duncan法进行多重比较差异显著(P < 0.05)。 The vertical line represents the standard error, and the different small letters indicate significant difference at 0.05 level. |
不同预处理的种子低温脱水后胚和胚乳中SOD活性差异均极显著(P < 0.01),但不同预处理对低温脱水后种子胚和胚乳中SOD活性的影响趋势不同(表 4)。蔗糖预处理的种子,胚乳中SOD活性显著低于其他处理,而胚中SOD活性却显著高于其他处理;种子经ABA预处理后,胚中SOD活性极低,显著低于对照,但在胚乳中却最高,显著高于对照;氯化钙处理的种子则是胚与胚乳中SOD活性都显著高于对照(表 4)。
|
|
不同预处理的种子低温脱水后胚乳中的POD活性差异不显著(P>0.05),但胚中的POD活性差异极显著(P < 0.01)(表 4)。经过蔗糖与ABA预处理的种子,其胚中的POD活性明显高于氯化钙处理和对照,氯化钙处理与对照差异不显著(表 4)。
不同预处理的种子低温脱水后胚和胚乳中CAT活性差异均不显著(P>0.05)(表 4)。
不同预处理极显著(P < 0.01) 影响了种子低温脱水后胚和胚乳中的MDA含量,但不同预处理对种子低温脱水后胚和胚乳中的MDA含量影响规律不同(表 4)。经氯化钙、ABA或蔗糖预处理的种子与对照相比,显著降低了胚中MDA含量,而胚乳中MDA含量有所提高(表 4)。
2.3.2 预处理对种子可溶性蛋白、可溶性糖和淀粉含量的影响不同预处理的种子低温脱水后胚和胚乳中可溶性蛋白含量差异均极显著(P < 0.01),经氯化钙、ABA或蔗糖预处理的种子与对照相比,显著降低了胚和胚乳中可溶性蛋白的含量(表 5)。
|
|
不同预处理的种子低温脱水后胚乳中可溶性糖含量的差异不显著(P>0.05),但胚中可溶性糖含量差异极显著(P < 0.01)(表 5)。经氯化钙、ABA或蔗糖预处理的种子与对照相比,显著提高了胚中可溶性糖的含量(表 5)。
不同预处理种子低温脱水后胚和胚乳中的淀粉含量差异显著(P < 0.05)。经蔗糖预处理的种子胚中淀粉含量最高,显著高于氯化钙或ABA预处理种子,但经氯化钙、ABA和蔗糖预处理的种子,与对照相比胚中淀粉含量差异均不显著(表 5)。经氯化钙或蔗糖预处理的种子与对照相比,显著提高了胚乳中淀粉含量;经ABA预处理的种子与对照相比,胚乳中淀粉含量有所提高,但差异不显著(表 5)。
3 讨论植物体的许多生理代谢过程都受到钙的调节,尤其在环境胁迫下,钙和钙调素通过参与胁迫信号的感受、传递、响应与表达来提高植物的抗逆性(宗会等,2001;刘小龙等,2014)。许多研究也证实氯化钙处理种子可提高其耐脱水性(Song et al., 2002;钱春梅等,2004;向旭等,1997)。ABA能诱导种子脱水过程中Lea基因的表达,种子脱水耐性与种子的ABA含量呈高度正相关(宗梅等,2011),已经发现ABA预处理后,可以提高植物组织的脱水耐性(刘福平,2011;杨晓泉等,1998)。糖类在种子脱水过程中能起到保护作用(杨期和等,2003;Stanis et al., 2009;Black et al., l996;Blackman et al., 1992),可以提高植物组织或种子的脱水耐性。本研究发现,经过10-3 mol·L-1氯化钙和10-6mol·L-1 ABA预处理后,显著提高了种子低温(5 ℃)下再脱水后的发芽率和发芽指数,缩短了发芽时间;经过100 g·L-1的蔗糖预处理后,显著提高了种子低温(5 ℃)下再脱水后的发芽率,但在提高发芽指数和缩短发芽时间上并没有明显效果。这些结果验证了本研究的假设:适宜浓度的ABA、糖和氯化钙预处理能够提高水曲柳种子低温脱水后的萌发能力。
种子脱水是一个复杂的生理生化过程,随着干燥脱水的进行,种子会因不断失水而导致其细胞膜结构和抗氧化系统发生变化。干旱、高低温和盐碱胁迫等都会在一定程度上损伤细胞膜,致使大量的离子渗漏,造成细胞内的自由基清除能力减弱或自由基增加并积累,导致脂质过氧化反应产生过多的MDA直接毒害细胞。同时,细胞内的抗氧化酶(SOD、POD、CAT等)活性增强,进而清除活性氧,保护膜结构(Kranner et al.,2005)。许多种子脱水耐性变化都与其膜透性和抗氧化酶活性的变化有关(李文君等,2009;李朋等,2011;伍贤进等,2002)。本研究发现,10-3 mol·L-1氯化钙预处理的种子,低温脱水后种子相对电导率和MDA含量显著降低,胚中SOD活性显著提高;10-6 mol·L-1 ABA预处理的种子,低温脱水后种子相对电导率和MDA含量显著降低,胚中POD活性明显提高;100 g·L-1的蔗糖预处理的种子,低温脱水后胚中SOD和POD活性均显著提高,种子相对电导率和MDA含量显著降低。可见,经氯化钙、ABA或蔗糖预处理,会显著提高低温脱水条件下种子胚中的抗氧化系统酶活性,更好地维持细胞膜结构的完整性,降低细胞的离子泄漏和MDA含量。但不同预处理种子胚中的抗氧化酶活性表现不同,氯化钙预处理提高胚中SOD活性的作用更明显,ABA预处理提高胚中POD活性的作用更明显,而蔗糖预处理则同时提高胚中的SOD和POD活性。SOD能够催化
种子脱水过程中,糖类、LEA蛋白、亲水脂分子和油素蛋白等脱水保护性物质会迅速被诱导并积累(杨晓泉等,1998;宋松泉等,1999;李永红等,2009;李煦等,2011)。本研究结果表明,氯化钙、ABA或蔗糖预处理,显著提高了胚中可溶性糖的含量。据报道,禾谷类、大豆(Glycine max)、花生(Arachis hypogaea)等种子发育和萌发过程中脱水耐性的变化都和蔗糖、棉子糖、水苏糖等可溶性糖有关(Black et al., 1996;Blackman et al., 1992;杨晓泉等,1998),还有研究利用转基因烟草材料直接证明了可溶性糖与脱水耐性的关系(Holmström et al., 1996)。有研究表明,自由基会在脱水敏感的组织干燥时损伤细胞,蔗糖和其他还原糖可以很好地清除自由基(Leprince et al., 1990)。糖类在种子脱水过程中的保护作用还可以通过以下方式来实现:1) 脱水时,糖中的羟基可以代替膜、酶、蛋白质和其他大分子中的水分来提高膜、蛋白质结构和酶的稳定性(Crowe et al., 1988);2) 脱水时,水苏糖和棉子糖可以防止蔗糖因结晶而形成玻璃化状态,阻止膜的融合并防止渗漏(Koster,1991)。综上所述,水曲柳种子经适宜浓度的氯化钙、ABA或蔗糖预处理后低温脱水过程中脱水保护功能的提高可能与可溶性糖的增加有关,通过可溶性糖的积累提高了蛋白质和膜的稳定性,维持了它们在脱水干燥状态下的功能,增强了自由基清除能力,从而使种子能够抵御脱水的伤害,保持高活力水平。
4 结论适宜浓度的氯化钙(10-3 mol·L-1)、ABA(10-6 mol·L-1)和蔗糖(100 g·L-1)预处理能够提高水曲柳种子低温脱水后的萌发能力。氯化钙、ABA和蔗糖预处理能够显著提高低温脱水条件下种子胚中的抗氧化系统酶活性,更好地维持细胞膜结构的完整性,降低细胞的离子外渗和MDA含量,提高种子在低温条件下的耐脱水性。氯化钙、ABA和蔗糖预处理后低温脱水过程中种子胚中可溶性糖含量显著增加,这可能是种子低温条件下脱水保护功能提高的原因之一。
| [] |
高俊凤. 2006. 植物生理学实验指导. 北京, 高等教育出版社.
( Gao J F. 2006. Experimental instruction of plant physiology. Beijing, Higher Education Press. [in Chinese] ) |
| [] | 李朋, 唐安军, 柳建平, 等. 2011. 蒲葵种子脱水耐性及脱水对其膜脂过氧化的影响. 园艺学报, 38(8): 1572–1578. |
| [] | Li P, Tang A J, Liu J P, et al. 2012. Desiccation tolerance of Livistona chinensis seeds and effect of desiccation on peroxidation of their membrane lipid. Acta Horticulturae Sinica, 38(8): 1572–1578. |
| [] |
李煦, 汪晓峰. 2011. 油菜(Brassica napus L. )种子脱水耐性获得过程中肌醇半乳糖苷合成酶活性与可溶性糖含量的变化.植物生理学报, 47(12): 1173–1180.
( Li X, Wang X F. 2011. Galactinol synthase activity and soluble carbohydrate contents during acquisition of seed desiccation tolerance in Brassica napus L. Plant Physiology Journal, 47(12): 1173–1180. [in Chinese] ) |
| [] |
李合生. 2000. 植物生理生化实验原理和技术. 北京, 高等教育出版社.
( Li H S. 2000. Principles and techniques of plant physiology and biochemistry experiment. Beijing, Higher Education Press. [in Chinese] ) |
| [] |
李文君, 沈永宝. 2009. '紫柄籽银桂'桂花种子脱水耐性与抗氧化系统的关系. 园艺学报, 36(2): 279–284.
( Li W J, Shen Y B. 2009. Changes on physiological characteristics of Osmanthus fragrans 'Zibing Ziyingui' seeds during dehydration. Acta Horticulturae Sinica, 36(2): 279–284. [in Chinese] ) |
| [] |
李永红, 马颖敏, 韩蕾. 2009. 超氧化物歧化酶与马拉巴栗种子脱水耐性之间的关联. 林业科学, 45(5): 74–79.
( Li Y H, Ma Y M, Han L. 2009. Relationship between the tolerance to dehydration and superoxide dismutases (SODs) in Pachira macrocarpa. Scientia Silvae Sinicae, 45(5): 74–79. DOI:10.11707/j.1001-7488.20090511 [in Chinese] ) |
| [] |
凌世瑜, 董愚得. 1983. 水曲柳种子休眠生理的研究. 林业科学, 19(4): 349–358.
( Ling S Y, Dong Y D. 1983. Research on the physiology of seed dormancy of Manchurian ash. Scientia Silvae Sinicae, 19(4): 349–358. [in Chinese] ) |
| [] |
刘福平. 2011. ABA预处理对蝴蝶兰类原球茎耐脱水性及生理基础的影响. 热带作物学报, 32(9): 1715–1719.
( Liu F P. 2011. Effects of ABA pretreatment on dehydration tolerance and it's physiological bases of Phalaenopsis PLB. Chinese Journal of Tropical Crops, 32(9): 1715–1719. [in Chinese] ) |
| [] |
刘小龙, 李霞, 钱宝云, 等. 2014. 植物体内钙信号及其在调节干旱胁迫中的作用. 西北植物学报, 34(9): 1927–1936.
( Liu X L, Li X, Qian B Y, et al. 2014. Ca2+ signal transduction and its regulation role under drought stress in plant. Acta Botanica Boreali-Occidentalia Sinica, 34(9): 1927–1936. [in Chinese] ) |
| [] |
钱春梅, 伍贤进, 宋松泉, 等. 2004. 钙对吸胀的绿豆种子脱水耐性的影响. 西北植物学报, 24(9): 1599–1603.
( Qian C M, Wu X J, Song S Q, et al. 2004. Effect of calcium on desiccation tolerance of imbibed Phaseolus radiatus seeds. Acta Botanica Boreali-Occidentalia Sinica, 24(9): 1599–1603. [in Chinese] ) |
| [] |
宋松泉, 陈玲, 傅家瑞. 1999. 种子脱水耐性与LEA蛋白. 植物生理学通讯, 35(5): 424–432.
( Song S Q, Chen L, Fu J R. 1999. Desiccation tolerance and the molecular basis of LEA proteins in seeds. Plant Physiology Communications, 35(5): 424–432. [in Chinese] ) |
| [] |
宋松泉, 程红焱, 龙春林, 等. 2005. 种子生物学研究指南. 北京, 科学出版社.
( Song S Q, Cheng H Y, Long C L, et al. 2005. Guide to research on seed biology. Beijing, Science Press. [in Chinese] ) |
| [] |
吴灵东. 2012. 解除休眠水曲柳种子在不同脱水条件下的萌发生理研究. 哈尔滨: 东北林业大学硕士学位论文. ( Wu L D. 2012. Germination physiology of dormancy-released seeds of Manchurian ash (Fraxinus mandshurica L.) dehydrated in different conditions. Harbin: MS thesis of Northeast Forestry University. [in Chinese]) |
| [] |
吴灵东, 张鹏, 郭敏, 等. 2012. 解除休眠水曲柳种子的再干燥贮藏. 林业科技开发, 26(2): 86–88.
( Wu L D, Zhang P, Guo M, et al. 2012. Redrying and storage of dormancy-released seeds of Manchurian ash (Fraxinus mandshurica). China Forestry Science and Technology, 26(2): 86–88. [in Chinese] ) |
| [] |
伍贤进, 宋松泉, 钱春梅, 等. 2002. 吸胀玉米种子脱水耐性变化与活性氧清除酶活性的关系. 中山大学学报:自然科学版, 41(4): 63–66.
( Wu X J, Song S Q, Qian C M, et al. 2002. Changes in desiccation tolerance during imbibition of Zea mays L. relate to activity of reactive-oxygen-scavenging enzymes. Acta Scientiarum Naturalium Universitatis Sunyatseni, 41(4): 63–66. [in Chinese] ) |
| [] |
向旭, 傅家瑞. 1997. 提高黄皮种子活力的途径. 热带亚热带植物学报, 5(4): 39–44.
( Xiang X, Fu J R. 1997. The ways to increase vigour of wampee (Clausena lansium) seeds. Journal of Tropical and Subtropical Botany, 5(4): 39–44. [in Chinese] ) |
| [] |
杨期, 宋松泉, 叶万辉, 等. 2003. 种子脱水耐性与糖的关系. 植物研究, 23(2): 204–210.
( Yang Q H, Song S Q, Ye W H, et al. 2003. Relationship between desiccation tolerance and sucrose in seeds. Bulletin of Botanical Research, 23(2): 204–210. [in Chinese] ) |
| [] |
杨晓泉, 姜孝成, 傅家瑞. 1998. 花生种子耐脱水力的形成与可溶性糖积累的关系. 植物生理学报, 24(2): 165–170.
( Yang X Q, Jiang X C, Fu J R. 1998. Soluble sucrose and the acquisition of desiccation tolerance in peanut(Arachis hypogaea) seeds. Acat Phytophysiologica Sinica, 24(2): 165–170. [in Chinese] ) |
| [] |
张鹏. 2008. 不同发育阶段水曲柳种子的休眠与萌发生理. 哈尔滨: 东北林业大学博士学位论文. ( Zhang P. 2008. The dormancy and germination physiology of Manchurian ash seeds in different development stage. Harbin: PhD thesis of Northeast Forestry University. [in Chinese]) |
| [] |
张志良. 1990. 植物生理学实验指导. 北京, 高等教育出版社.
( Zhang Z L. 1990. Plant physiology experiment guide. Beijing, Higher Education Press. [in Chinese] ) |
| [] |
宗梅, 蔡永萍, 范志强. 2011. 板栗种子发育期间ABA等生理指标与脱水耐性的相关性研究. 广西植物, 31(6): 818–822.
( Zong M, Cai Y P, Fan Z Q. 2011. Study on the correlation between physiological indexes as ABA, etc and desiccation tolerance in developing chestnut seeds. Guihaia, 31(6): 818–822. [in Chinese] ) |
| [] |
宗会, 李明启. 2001. 钙信使在植物适应非生物逆境中的作用. 植物生理学通讯, 37(4): 330–335.
( Zong H, Li M Q. 2001. Role of calcium messenger in plant acclimation to abiotic stresses. Plant Physiology Communications, 37(4): 330–335. [in Chinese] ) |
| [] | Black M, Côme D. 1996. Carbohydrate metabolism in the developing and maturing wheat embryo in relation to its desiccation tolerance. Journal of Experimental Botany, 47(2): 161–169. DOI:10.1093/jxb/47.2.161 |
| [] | Blackman S A, Obendorf R L, Leopold A C. 1992. Maturation proteins and sugars in desiccation tolerance of developing soybean seeds. Plant Physiology, 100(1): 225–230. DOI:10.1104/pp.100.1.225 |
| [] | Crowe J H, Crowe L M, Carpenter J F, et al. 1988. Interactions of sugars with membranes. Biochimica Et Biophysica Acta, 947(2): 367–84. DOI:10.1016/0304-4157(88)90015-9 |
| [] | Holmström K O, Mäntylä E, Welin B, et al. 1996. Drought tolerance in tobacco. Nature, 379(6567): 683–684. DOI:10.1038/379683a0 |
| [] | Ingram J, Bartels D. 1996. The molecular basis of dehydration tolerance in plant. Annual Review of Plant Physiology and Plant Molecular Biology, 47: 377–403. DOI:10.1146/annurev.arplant.47.1.377 |
| [] | Koster K L. 1991. Glass formation and desiccation tolerance in seeds. Plant Physiology, 96(1): 302–304. DOI:10.1104/pp.96.1.302 |
| [] | Kranner I, Birtic S. 2005. A modulating role for antioxidants indesiccation tolerance. Integrative and Comparative Biology, 45(5): 734–740. DOI:10.1093/icb/45.5.734 |
| [] | Leprince O, Hendry G A F. 1990. The role of free radicals and radical processing systems in loss of desiccation tolerance in germinating maize (Zea mays L. ). New Phytologist, 116(4): 573–580. DOI:10.1111/nph.1990.116.issue-4 |
| [] | Song S Q, Pammenter N, Berjak P, et al. 2002. Desiccation sensitivity and its calcium regulation of Trichilia dregeana axes//Li D J. Proceedings of 2nd international conference on sustainable agriculture for food, energy and industry. Beijing, China, 1151-1159. https://www.intechopen.com/books/abiotic-and-biotic-stress-in-plants-recent-advances-and-future-perspectives/stress-induced-proteins-in-recalcitrant-seeds-during-deep-dormancy-and-early-germination |
| [] | Stanis L P, Ewelina R, Ewa K. 2009. Non-reducing sucrose levels in beech (Fagus sylvatica) seeds as related to withstanding desiccation and storage. Journal of Plant Physiology, 166(13): 1381–1390. DOI:10.1016/j.jplph.2009.02.013 |
 2017, Vol. 53
2017, Vol. 53
