文章信息
- 金勤, 朱丹雪, 周国英, 李河, 何苑皞, 张茜
- Jin Qin, Zhu Danxue, Zhou Guoying, Li He, He Yuanhao, Zhang Qian
- 绿色荧光蛋白标记枯草芽孢杆菌Y13UV在油茶体内的定殖
- Colonization of GFP-Tagged Bacillus subtilis Y13UV in Camellia oleifera
- 林业科学, 2017, 53(7): 111-117.
- Scientia Silvae Sinicae, 2017, 53(7): 111-117.
- DOI: 10.11707/j.1001-7488.20170712
-
文章历史
- 收稿日期:2016-04-08
- 修回日期:2016-12-26
-
作者相关文章
2. 湖南汽车工程职业学院 株洲 412001
2. Hunan Automotive Engineering Vocational College Zhuzhou 412001
在油茶(Camellia oleifera)生产中,油茶炭疽病(Colletotrichum gloeosporioides)是一种最主要的病害,在各大产区普遍发生,造成严重的落叶、落果、落蕾,产量降低(杨华等,2015)。目前,防治油茶炭疽病主要是采取化学防治和生物防治手段(陈彧等,2010)。但大量使用化学农药容易导致植物病原菌产生抗药性,造成环境污染,引起人畜中毒等问题(周国英等,2007)。国内外已有不少关于生物防治植物病害的报道。周建宏等(2011)通过对40多种植物进行筛选,利用筛选出来的丁香(Syringa oblata)和黄苓(Scutellaria baicalensis)研制出了防治油茶炭疽病的纯植物源农药。宋光桃(2009)从油茶林土壤中分离出了对油茶炭疽病具有拮抗作用的放线菌CF17。美国Agraquest公司(2001) 将枯草芽孢杆菌QST713制成生物杀菌剂,具有广谱性。
利用能够在寄主植物体内定殖的内生拮抗菌对病害进行防治具有独特的优势(杨光道等,2009),实际应用中拮抗作用强并不一定是最好的生防因子,生防菌能否在植株体内定殖才是取得防效的关键。研究内生细菌定殖的常用方法有同位素示踪法(葛银林等,1995)、免疫学方法(刘云霞等,1996)、抗生素标记法(吴蔼民等,2001)、荧光标记法(殷幼平等,2010)。荧光标记中的绿色荧光蛋白(green fluorescent protein,GFP)荧光性能稳定、无需外源反应底物、对宿主细胞无毒害作用、检测方便,成为研究微生物与宿主或环境互作的重要工具(王卿等,2015)。刘邮洲等(2014)发现绿色荧光蛋白基因标记的枯草芽孢杆菌(Bacillus subtilis)在番茄(Lycopersicon esculentun)根际土壤中有一定的定殖能力,接种30天后仍可检测到标记菌株。杜芳等(2015)研究了枯草芽孢杆菌Y10在白菜(Brassica rapa)根、茎及叶部组织的定殖情况,结果表明枯草芽孢杆菌在白菜体内有良好的定殖能力,且这种特性可能与其防治根肿病有关。Yang等(2013)将携带质粒gfpmut3a基因的穿梭载体pGFP4412导入生防枯草芽孢杆菌中,通过浸种、蘸根以及灌根接种研究其在黄瓜(Cucummis sativus)根表的定殖,发现在根基部和中部都有标记菌株聚集而形成膜状结构,在根的分叉和根冠处可观察到大量标记菌株。关于绿色荧光蛋白标记枯草芽孢杆菌在油茶体内定殖的研究,国内目前未见相关报道。
枯草芽孢杆菌Y13UV是本实验室经过诱变获得的优良菌株,本试验通过GFP标记研究Y13UV在油茶体内的定殖及消长动态,为提高Y13UV防治油茶炭疽病效果和制定施用方法提供理论依据。
1 材料与方法 1.1 供试材料供试菌株:枯草芽孢杆菌(Bacillus subtilis)Y13UV,本实验室分离、诱变保存。
供试质粒和内切酶:pHT315-GFP,高效表达绿色荧光蛋白基因的大肠杆菌(Escherichia coli)一苏云金芽孢杆菌(Bacillus thuringiensis)穿梭载体,Hind Ⅲ和XbaⅠ内切酶均由本实验室保存。
供试油茶苗:湘林210品种,2年生健康盆栽苗,购于湖南省林业种苗中心;长势、苗高、大小一致。
1.2 GFP标记菌株Y13UV的构建及检测参考陈燕红等(2014)的方法,本实验室自行构建标记菌株。
1.2.1 荧光显微镜检测挑取少许绿色荧光蛋白标记菌株菌体涂布固定,盖上盖玻片,在荧光显微镜下检测(激发光波长480 nm,发射光波长520 nm),观察有无荧光产生。
1.2.2 GFP标记菌株生长动力学测定挑取GFP标记菌单菌落接种到LB液体培养基中,30 ℃、200 r·min-1培养24 h,按1%的接种量接种到100 mL新鲜的LB液体培养基中,每隔4 h测定OD600值。
1.2.3 GFP标记菌株抑菌活性测定采用平板对峙法:取炭疽病菌菌饼放在PDA平板中央,将GFP标记菌株接种至距离炭疽病菌1.5 cm处,置于28 ℃恒温培养箱中。待朝向标记菌株方向的病原菌菌落不再生长时,采用十字交叉法测量菌落直径,计算抑菌率。
1.3 GFP标记菌株在油茶体内的定殖动态 1.3.1 单次接种监测GFP标记菌株在油茶体内的定殖动态采用喷叶法、灌根法和喷叶灌根结合法接种标记菌菌悬液,浓度为3.2×108 cfu·mL-1,每处理3次重复,每处理100株,以无菌水处理为对照。喷叶法:用喷雾器将菌液均匀地喷洒到油茶叶片上,每株10 mL;灌根法:将GFP标记菌株菌液浇灌于油茶根部,每株10 mL;喷叶灌根综合法:喷叶和灌根同时接种,分别为每株5 mL,共10 mL。分别于接种0,1,3,5,7天……对油茶根(主根与侧根混匀)、茎(茎下:地表 3~8 cm茎部;茎中:8~13 cm茎部;茎上:13~20 cm茎部)、叶(从上往下不同部位的叶子混匀)进行取样回收,每处理随机抽取3株,每份组织样品0.5 g,直至回收不到标记菌株。
1.3.2 重复接种监测GFP标记菌株在油茶体内的定殖动态单次接种7天后,进行第2次接种。采用的接种方法、菌液浓度及用量与1.3.1相同。
分别于接种后1,3,5,10,15,20,30天对油茶根、茎、叶进行取样回收,每处理随机抽取3株,每份组织样品0.5 g,直至回收不到标记菌株。
1.3.3 标记菌株的回收与鉴定分别称取油茶苗根、茎、叶组织各0.5 g,经表面消毒后研磨成匀浆,分别取0.1 mL各梯度稀释液涂布LB氯霉素抗性平板,28 ℃培养2~3天,在荧光显微镜下观察荧光菌落数。用接种环挑取单菌落到10 ml LB液体培养基中,37 ℃、180 r·min-1培养6 h,提取质粒,用HindⅢ和XbaⅠ从GFP两端切开验证回收的菌株是否为标记菌株。
1.4 数据统计分析数据均为平均数±标准误差,采用Excel 2007和SPSS19.0软件处理,显著性水平采用Duncan’s新复极差法分析。
2 结果与分析 2.1 绿色荧光蛋白标记枯草芽孢杆菌Y13UV的构建及其检测 2.1.1 绿色荧光蛋白标记枯草芽孢杆菌Y13UV的荧光检测绿色荧光蛋白标记菌株构建好之后,挑取标记菌株于载玻片上涂布并固定,在荧光显微镜下检测到菌株发荧光(图 1),并将绿色荧光蛋白标记菌株记为Y13UV-GFP。

|
图 1 Y13UV-GFP在荧光显微镜下的表现 Fig.1 Fluorescence under the fluorescence microscope of Y13UV-GFP |
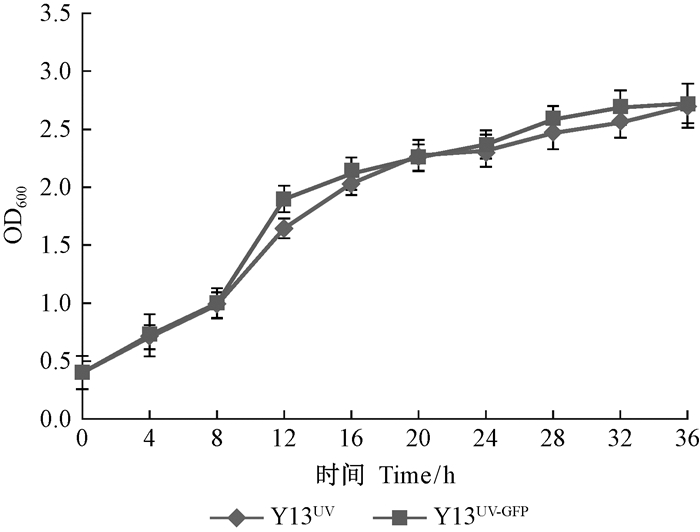
从图 2可以看出,绿色荧光蛋白标记菌株Y13UV-GFP的生长趋势与原始菌株Y13UV基本一致。这表明外源质粒的转入以及绿色荧光蛋白的表达对菌株Y13UV生长没有产生不利影响。
|
图 2 Y13UV菌株及Y13UV-GFP标记菌株生长曲线 Fig.2 Growth curve of Y13UV and Y13UV-GFP strains |
从表 1可知:标记菌株Y13UV-GFP和原始菌株Y13UV相比,对炭疽病的抑制效果无显著差异,因此Y13UV-GFP可以用来进行定殖动态和生防能力的研究。
|
|
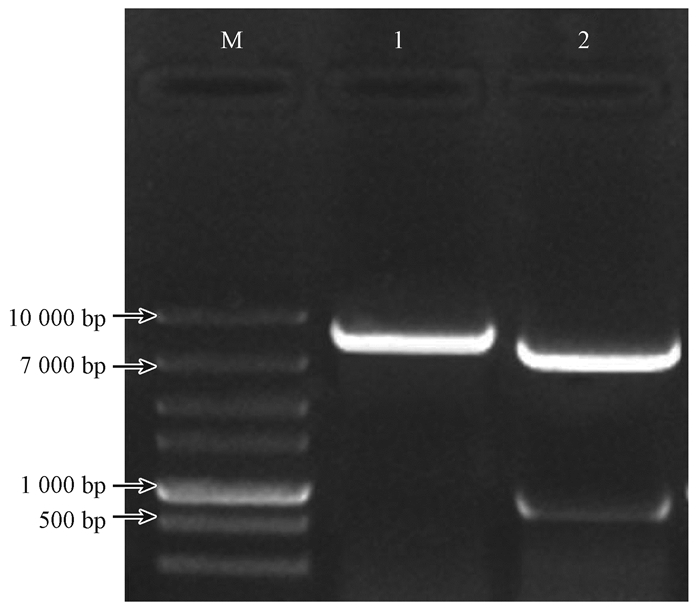
从LB平板上挑取的Y13UV-GFP中提取出pHT315-GFP(约7.2 kb)质粒,对质粒进行双酶切后可获得与GFP片段(约714 bp)长度相当的片段。由此可以确定回收到的菌株是Y13UV-GFP。如图 3:M为DL10000 marker,1为从回收菌株中提取的质粒pHT315-GFP,2为Hind Ⅲ和XbaⅠ双酶切后的产物。
|
图 3 Y13UV-GFP酶切鉴定 Fig.3 Enzyme identification of Y13UV-GFP |
如表 2所示:灌根处理当天,油茶苗根部能够检测到Y13UV-GFP,其定殖数量高达1.07×105 cfu·g-1。接种后第1天,在茎及叶组织可以检测到标记菌株;茎上部位及叶片,定殖数量随时间递增逐渐减少。接种后第7天,叶片内定殖数量显著低于根部(P < 0.05);并且回收的植株中,有的叶内已经检测不到标记菌株。表明Y13UV-GFP能够通过油茶苗根部短时间内侵入并向上传递,但定殖时间有限。
|
|
喷叶处理后,根、叶片、茎下部位的Y13UV-GFP定殖数量呈现递减趋势。接种后第1天叶内的定殖数量显著高于灌根处理(P < 0.05);茎上部位的定殖数量为1.1×103 cfu·g-1,茎中部位仅有2.1×102 cfu·g-1。在3,5,7天均出现了茎上部位的定殖量高于茎中,此现象在喷叶灌根结合处理后再次出现,且第7天回收的大部分油茶苗叶片内检测不到Y13UV-GFP,说明通过叶部侵入的Y13UV-GFP有一定向下传递的能力。
喷叶灌根结合处理后,接种后1天根部定殖数量为2.00×104 cfu·g-1,显著高于灌根处理的数量3.00×103 cfu·g-1(P < 0.05);茎上部位的定殖数量高于茎中部位,此现象与喷叶方式处理相同。第7天根部定殖数量为8.70×102 cfu·g-1,仍然高于灌根处理;叶内Y13UV-GFP定殖数量也高于喷叶处理的数量。
综合来看,3种接种方式下Y13UV-GFP定殖量存在显著性差异,喷叶灌根结合处理为最优接种方式。
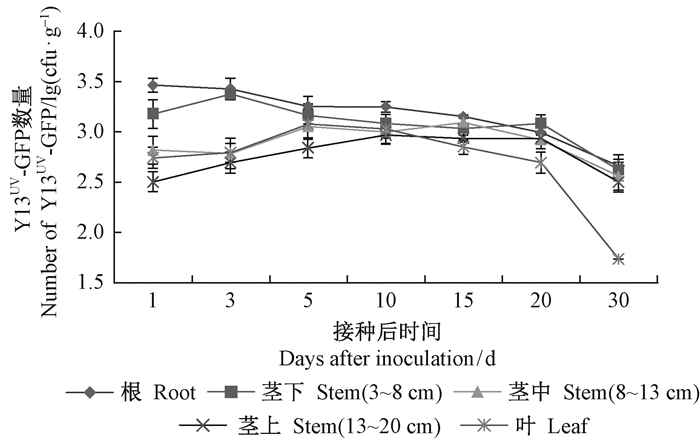
2.2.3 重复接种监测Y13UV-GFP在油茶体内的定殖动态1) 灌根接种标记菌株Y13UV-GFP在油茶体内的定殖动态 通过灌根处理,回收检测结果显示:在油茶根茎叶组织中均可分离检测到标记菌株Y13UV-GFP,且根内的定殖量显著高于叶(P < 0.05)。在接种初期,根内的定殖量为3.73×103 cfu·g-1,高于茎和叶中的定殖量。随着接种时间的延长,在根中的定殖量逐渐下降,在30天时仅有5.30×102 cfu·g-1。在茎的各部位(茎下、茎中、茎上)和叶中的定殖量呈现先上升后下降的趋势,茎下部位定殖量在第3天达到高峰,而茎中、茎上和叶的高峰期均为第5天。各组织中标记菌株的数量在第5~15天较为稳定,20天后数量迅速减少。在第30天时,根内的数量高于茎内各部位和叶。
|
图 4 灌根接种标记菌株Y13UV-GFP在油茶体内的定殖动态 Fig.4 Colonization of Y13UV-GFP in Camellia oleifera by pouring root |
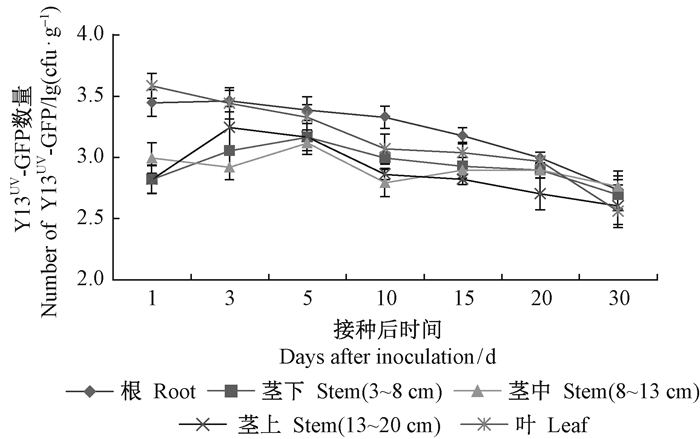
2) 喷叶接种标记菌株Y13UV-GFP在油茶体内的定殖动态 采用喷叶法将标记菌株Y13UV-GFP接入油茶苗后,回收检测结果表明:在接种后第1天,标记菌株Y13UV-GFP在油茶叶内的定殖数量为6.00×103 cfu·g-1,然后迅速下降;在无套袋处理、自然滴落的情况下,在接种1天后根部回收到的Y13UV-GFP数量为3.27×103 cfu·g-1,与灌根处理的油茶根部第1天的回收量基本一致。茎内各部位Y13UV-GFP的定殖量先增后减,茎下部的定殖量在第5天达到最大值1.60×103 cfu·g-1,而茎中部和上部在第3天就达到最大值,3~10天茎上部位回收量均高于茎中部位。第30天时,根内的数量高于叶和茎内各部位;叶内Y13UV-GFP的定殖数量为4.00×102 cfu·g-1,略高于灌根处理叶内30天的定殖量。
|
图 5 喷叶接种标记菌株Y13UV-GFP在油茶体内的定殖动态 Fig.5 Colonization of Y13UV-GFP in Camellia oleifera by spraying leaf |
3) 喷叶灌根接种标记菌株Y13UV-GFP在油茶体内的定殖动态 通过喷叶灌根接种处理,根内标记菌株的定殖数量高于喷叶或灌根单独处理的数量。在接种后第1天,根部标记菌株Y13UV-GFP数量达8.67×103 cfu·g-1,然后降低,第30天的数量与灌根接种处理的相同。茎各部位的定殖量呈现先上升后下降的趋势,高峰期分别为3天和5天。接种后1天,叶内Y13UV-GFP的数量较高,第3天有所下降,第5天出现第2次高峰,之后下降。第30天时,叶内的定殖量高于其他2种处理方式。
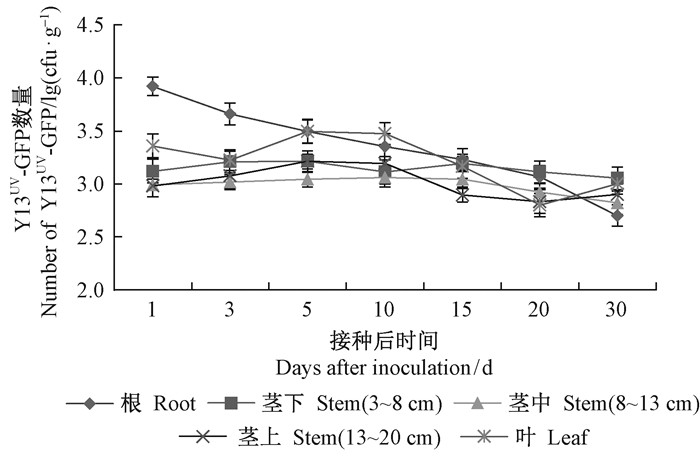
|
图 6 喷叶灌根接种标记菌株Y13UV-GFP在油茶体内的定殖动态 Fig.6 Colonization of Y13UV-GFP in Camellia oleifera by spraying leaf and pouring root |
采用喷叶法、灌根法、喷叶灌根结合法3种接种方法接种,均能使标记菌株侵入油茶根茎叶内,并在油茶植株体内繁殖和传导。单次接种时,3种接种方式下标记菌株的定殖时间短,不同接种方式的定殖量存在差异。重复接种使标记菌株在油茶体内的定殖时间长达30天,喷叶灌根结合处理30天后,根部定殖量为5.3×102 cfu·g-1,叶部为6.7×102cfu·g-1,茎各部(茎上、茎中和茎下)的定殖量均高于其他2种处理方法。经酶切鉴定分析,回收菌株均为标记菌株Y13UV-GFP。
王瑞芹(2014)用抗利福平标记Y13菌株,虽然抗利福平标记的菌株与绿色荧光蛋白标记的菌株在油茶体内定殖没有显著性差异,但抗性菌株接种到植物后,部分菌株会因为在植物体内没有了选择压力而在增殖过程中丢失了抗利福平的能力(范晓静,2007),再者植物内生菌有些也可能对利福平具有抗药性,从而造成分离到的细菌数量不准确,绿色荧光蛋白基因标记就减小了分离菌量与实际定殖菌量的差异。
研究中发现,单次接种时Y13UV-GFP定殖时间短,重复接种时叶部回收并未出现5天和7天就已检测不到标记菌株的情况,由此猜想,重复接种的方式更易于内生拮抗细菌对植株生境的适应并稳定定殖。重复接种延长了Y13UV-GFP在油茶体内的定殖时间,也有报道(王卿等,2015)指出强化接种1次可能会使生防菌保持一定的种群优势,进而将可能对植物有较长的保护作用。彭袆等(2010)研究发现多黏芽孢杆菌(Paenibacillus polymyxa)能在番茄根表面形成生物膜,国外也有研究(Timmusk et al., 2005)报道多黏芽孢杆菌可以在植物根尖形成生物膜,生物膜所包被的细菌群体,对不良环境有较强的耐受力(Costerton et al., 1995)。至于枯草芽孢杆菌Y13UV是否能在油茶根部形成生物膜则有待进一步研究。
喷叶灌根结合处理30天后,叶片中的定殖数量比根部多,相比喷叶灌根单独处理的效果好。出现这一结果,笔者分析其原因可能是综合处理增强了菌株在叶内的定殖效果。叶内的标记菌株包括从根部进入并传递到叶片的标记菌株和直接从叶片侵入的标记菌株,更多的标记菌株与其他内生菌竞争生态位,在油茶体内繁殖,具有生长优势。针对此结果,笔者展开了后续试验,研究Y13UV菌株在油茶体内定殖对叶内微生物的影响。
国内外研究表明,生防菌能否在植物体内有效定殖是其发挥防病作用的重要因素(Kloepper et al., 1981;连玲丽等,2011)。本试验初步明确了Y13UV菌株能够在油茶体稳定定殖,不同部位定殖量也有较大差异,这说明对特定部位有所偏好,可能与各部位分泌的营养物质有关(李世贵等,2009;杜芳等,2015)。本试验也只研究了Y13UV-GFP在油茶体内的定殖动态,能否在其他植物体内稳定定殖,进而发挥防治效果,还需进一步研究,为大范围推广Y13UV提供依据。
4 结论将绿色荧光蛋白基因导入到枯草芽孢杆菌Y13UV中,标记菌株Y13UV-GFP在蓝光激发下可以发出强而稳定的绿色荧光、生长好、具有较好的抑菌效果。标记菌株可以通过灌根和喷叶的方式侵入油茶体内,并进行繁殖和传导;20天后达到稳定定殖状态,定殖时间长达30天,为制定枯草芽孢杆菌Y13UV的林间施用措施提供了理论基础。
| [] |
陈彧, 周国英, 宋光桃, 等. 2010. 油茶抗炭疽病优良单株筛选及抗病机理研究. 湖南农业大学学报:自然科学版, 36(4): 426–429.
( Chen Y, Zhou G Y, Song G T, et al. 2010. Mechanism of resistance and Colletotrichum gloeosporides in resistant individual trees of Camellia oleifera. Journal of Hunan Agricultural University:Natural Science, 36(4): 426–429. [in Chinese] ) |
| [] |
陈燕红, 黎永坚, 喻国辉, 等. 2014. 绿色荧光蛋白标记的枯草芽胞杆菌R31在西芹根际定殖研究. 中国农学通报, 30(9): 237–241.
( Chen Y H, Li Y J, Yu G H, et al. 2014. Colonization of green fluorescent protein gene tagged Bacillus subtilis R31 in celery rhizosphere. Chinese Agriculhiral Science Bulletin, 30(9): 237–241. DOI:10.11924/j.issn.1000-6850.2013-1713 [in Chinese] ) |
| [] |
杜芳, 何鹏飞, 陈君卓, 等. 2015. GFP标记内生枯草芽孢杆菌Y10及其在白菜体内的定殖. 生物学杂志, 34(7): 2064–2070.
( Du F, He P F, Chen J Z, et al. 2015. Colonization of GFP-tagged endophytic Bacillus subtilis Y10 in Chinese cabbage. Chinese Journal of Ecology, 34(7): 2064–2070. [in Chinese] ) |
| [] |
范晓静, 邱思鑫, 吴小平, 等. 2007. 绿色荧光蛋白基因标记内生枯草芽孢杆菌. 应用与环境生物学报, 13(4): 530–534.
( Fan X J, Qiu S X, Wu X P, et al. 2007. Endophytic Bacillus subtilis strain BS-labeled with green fluorescent protein gene. Chinese Journal of Applied & Environmental Biology, 13(4): 530–534. DOI:10.7679/j.issn.2095-1353.2007.121 [in Chinese] ) |
| [] |
葛银林, 李德葆. 1995. 植物抗病性的诱导、机制、分子生物学研究进展. 中国生物防治, 11(3): 134–141.
( Ge Y L, Li D B. 1995. Induced plant disease-resistance, its mechanism and molecular biology. Chinese Journal of Biological Control, 11(3): 134–141. [in Chinese] ) |
| [] |
郝变青, 马利平, 乔雄梧, 等. 2010. GFP标记的植物促生菌B96-Ⅱ-gfp的定殖能力研究. 中国生态农业学报, 18(4): 861–865.
( Hao B Q, Ma L P, Qiao X W, et al. 2010. Colonization ability of plant growth promoting Bacillus B96-Ⅱ-gfp labeled with GFP. Chinese Journal of Eco-Agriculture, 18(4): 861–865. [in Chinese] ) |
| [] |
连玲丽, 谢荔岩, 陈锦明, 等. 2011. 生防菌EN5的定殖能力及其对根际土壤微生物类群的影响. 植物保护, 37(2): 31–35.
( Lian L L, Xie L Y, Chen J M, et al. 2011. Colonization of biocontrol strain EN5 and its effects on rhizosphere soil microbial communities. Plant Protection, 37(2): 31–35. [in Chinese] ) |
| [] |
李世贵, 吕天晓, 顾金刚, 等. 2009. 绿色荧光蛋白在微生物根际定殖研究中的应用. 生物技术通报(2): 34–37.
( Li S G, Lü T X, Gu J G, et al. 2009. Green fluorescent protein and its application to microbial colonization in rhizosphere. Biotechnology Bulletin(2): 34–37. [in Chinese] ) |
| [] |
刘邮洲, 梁雪杰, 乔俊卿, 等. 2014. 枯草芽胞杆菌PTS-394的GFP标记及其定殖能力. 植物保护学报, 41(4): 416–422.
( Liu Y Z, Liang X J, Qiao J Q, et al. 2014. Bacillus subtilis PTS 394 labeled by green fluorescent protein and its colonization. Acta Phytophylacica Sinica, 41(4): 416–422. [in Chinese] ) |
| [] |
刘云霞, 张青文, 周明群. 1996. 电镜免疫胶体金定位水稻内生细菌的研究. 农业生物技术学报, 4(4): 354–358.
( Liu Y X, Zhang Q W, Zhou M Q. 1996. Immuno-gold staining techniques for detection of endophytic bacteria in rice plant. Journal Of Agricultural Bdtechnology, 4(4): 354–358. [in Chinese] ) |
| [] |
彭袆, 谭悠久, 黄永春, 等. 2010. GFP标记的多粘芽孢杆菌1114在番茄根际的定殖. 中国生物防治, 26(3): 307–311.
( Peng Yi, Tan Youjiu, Huang Yongcun, et al. 2010. Colonization of gfp tagged Paenibacillus polymyxa strain around tomato roots. Chinese Journal of Biological Control, 26(3): 307–311. [in Chinese] ) |
| [] |
宋光桃, 周国英, 罗秋良, 等. 2009. 油茶林土壤放线菌的分离及其拮抗油茶炭疽病菌的筛选. 福建农林大学学报, 29(4): 297–300.
( Song G T, Zhou G Y, Luo Q L, et al. 2009. Isolation of actinomycetes and screening of their antagonistic strains to Colletotrichum gloeosporioides in soil of Camellia oleifera forest. Journal of Fujian College of Forestry, 29(4): 297–300. [in Chinese] ) |
| [] |
王卿, 林玲, 罗楚平, 等. 2015. 生防内生枯草芽孢杆菌Jaas ed1在西瓜植株内的定殖能力检测. 西南农业学报, 28(5): 2079–2085.
( Wang Q, Lin L, Luo C P, et al. 2015. Colonization of biocontrol endophytic Bacillus subtilis Jaas ed1 inside plant of watermelon. Southwest China Journal of Agricultural Sciences, 28(5): 2079–2085. [in Chinese] ) |
| [] |
王瑞芹. 2014. 油茶内生拮抗细菌Y13定殖动态及对叶内微生物调整效应研究. 长沙: 中南林业科技大学硕士学位论文. ( Wang R Q. 2014. Colonization and adjusted effect of inoculating with antagonistic strains Y13 on microbe in Camellia oleifera. Changsha: MS thesis of Central South University of Forestry and Technology, 1-57. [in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10538-1014235121.htm |
| [] |
吴蔼民, 顾本康, 傅正擎, 等. 2001. 内生菌73a在不同抗性品种棉花体内的定殖和消长动态研究. 植物病理学报, 31(4): 289–294.
( Wu A M, Gu B K, Fu Z Q, et al. 2001. Studies on the population fluctuation of entophytic bacteria 73a in cotton plant. Acta Phytopathologica Sinica, 31(4): 289–294. [in Chinese] ) |
| [] |
杨华, 赵丹阳, 秦长生, 等. 2015. 不同油茶种和品种对炭疽病的抗性观察. 植物保护, 41(2): 195–199.
( Yang H, Zhao D Y, Qin C S, et al. 2015. Resistance of different species and cultivars of oil-tea Camellia to Colletotrichum gloeosporioides. Plant Protection, 41(2): 195–199. [in Chinese] ) |
| [] |
杨光道. 2009. 油茶不同品种对炭疽病的抗性机制研究. 合肥: 安徽农业大学博士学位论文. ( Yang G D. 2009. Resistance mechanism of Camellia oleifera cultivars to Colletotrichum gloeosporioides. Hefei: PhD thesis of Anhui Agricultural University, 1-135. [in Chinese]) http://cdmd.cnki.com.cn/Article/CDMD-10364-2009207759.htm |
| [] |
殷幼平, 袁训娥, 李强, 等. 2010. 生防菌枯草芽孢杆菌CQBS03的绿色荧光蛋自基因标记及其在柑橘叶片上的定殖. 中国农业科学, 43(17): 3555–3563.
( Yin Y P, Yuan X E, Li Q, et al. 2010. Construction of green fluorescent protein gene tagged biocontrol bacteria Bacillus subtilis CQBS03 and its colonization on the citrus leaves. Scientia Agriculture Sinica, 43(17): 3555–3563. DOI:10.3864/j.issn.0578-1752.2010.17.009 [in Chinese] ) |
| [] |
周国英, 宋光桃, 李河, 等. 2007. 油茶病虫害防治现状及应对措施. 中南林业科技大学学报, 27(6): 179–182.
( Zhou G Y, Song G T, Li H, et al. 2007. Present Situation and Countermeasures to Control Camellia oliefera Pest and Disease. Journal of Central South University of Forestry & Technology, 27(6): 179–182. [in Chinese] ) |
| [] |
周建宏, 刘君昂, 邓小军, 等. 2011. 植物提取物对油茶主要病害的抑菌作用. 中南林业科技大学学报, 31(4): 42–45.
( Zhou J H, Liu J A, Deng X J, et al. 2011. Inhibition effects of plant extracts against major diseases of Camellia oleifera. Journal of Central South University of Forestry & Technology, 31(4): 42–45. [in Chinese] ) |
| [] | Costerton J W, Lewandowski Z, Caldwell D E, et al. 1995. Microbial biofilms. Annual Reviews in Microbiology, 49: 711–745. DOI:10.1146/annurev.mi.49.100195.003431 |
| [] | Kloepper J W, Schroth M N. 1981. Plant growth-promoting rhizobacteria and plant growth under gnoipbiotic conditions. Phytopatholog, 71(6): 642–644. DOI:10.1094/Phyto-71-642 |
| [] | Paulitz TC, Belanger R R. 2001. Biological control in greenhouse systems. Annual Review of Phytopathology, 39: 103–133. DOI:10.1146/annurev.phyto.39.1.103 |
| [] | Timmusk S, Grantcharova N, Gerhart E, et al. 2005. Paenibacillus polymyxa invades plant roots and forms biofilms. Applied and Environment Microbiology, 71(11): 7292–7300. DOI:10.1128/AEM.71.11.7292-7300.2005 |
| [] | Yang X R, Tian T, Sun S Q, et al. 2013. GFP-expressing Bacillus subtilis B579 strain and its colonization detection. Acta Phytopathologica Sinica, 41(3): 82–87. |
 2017, Vol. 53
2017, Vol. 53

