文章信息
- 唐绯绯, 赵玉琳, 王培龙, 冯德明, 宋怡, 高彩球
- Tang Feifei, Zhao Yulin, Wang Peilong, Feng Deming, Song Yi, Gao Caiqiu
- 刚毛柽柳ThP5CR基因的克隆及抗逆功能分析
- Cloning and Stress Tolerance Analysis of ThP5CR from Tamarix hispida
- 林业科学, 2017, 53(7): 1-9.
- Scientia Silvae Sinicae, 2017, 53(7): 1-9.
- DOI: 10.11707/j.1001-7488.20170701
-
文章历史
- 收稿日期:2016-08-15
- 修回日期:2016-12-27
-
作者相关文章
植物的抗逆性是数量性状,涉及大量抗性基因的表达与调控作用,有着复杂的分子调控机制。因此,研究植物逆境表达调控网络对揭示植物抗逆机制至关重要。脯氨酸是植物体内重要的渗透调节物质,在植物抗渗透胁迫过程中起重要作用,主要通过稳定生物膜的完整性、维持蛋白质的高级结构、参与蛋白质的折叠等生理生化过程发挥作用(Verbruggen et al., 2008)。研究表明脯氨酸具有清除活性氧的作用,提高了过氧化物酶、超氧化物歧化酶和过氧化氢酶的活性;可以调节细胞稳态。在盐胁迫下植物脯氨酸的合成增加,可以使NADPH/NADP+保持低比值,进而维持光反应中心的电子流,稳定氧化还原态,降低光合机构的光抑制(陈吉宝等,2010;Chaves et al., 2009)。
脯氨酸生物合成途径首先在大肠杆菌(Escherichia coli)上被阐明,目前植物体中存在2种脯氨酸合成途径:1) Glu途径:谷氨酸首先在γ-谷氨酰激酶(glutamylkinase)的催化下合成谷氨酰磷酸,其被还原成谷氨酸-半醛(GSA),GSA再自发地环化形成吡咯啉-5-羧酸(P5C),P5C最后在P5C还原酶(P5CR)催化下还原为脯氨酸(Székely et al., 2008)。2) Orn途径(氮素充足途径):精氨酸由精氨酸酶(ARG)转化为鸟氨酸。鸟氨酸通过δ-转氨酶(δ-OAT)直接诱导发生转氨反应失去氨基后形成GSA,GSA再通过谷氨酸途径最终在P5CR的催化作用下合成脯氨酸(Da Rocha et al., 2012)。表明P5CR在脯氨酸合成途径中具有重要作用。目前已报道的P5CR有400多种,其中3个蛋白的晶体结构已被成功解析(Meng et al., 2006)。但目前对脯氨酸参与植物抗逆性的研究,多集中于△1-吡咯啉-5-羧酸合成酶基因(P5CS),而对P5CR基因的抗逆功能研究非常少。
刚毛柽柳(Tamarix hispida)是生长在干旱沙漠中的树种,它能吸收到深层的地下水,还有很强的抗盐碱能力,能在含盐0.5%~1%的盐碱地上生长。因此鉴定和分离刚毛柽柳耐盐抗旱基因并研究这些基因的抗逆功能具有重要意义(张道远等, 2003)。本研究从刚毛柽柳中克隆获得ThP5CR基因,利用实时荧光定量RT-PCR分析了ThP5CR基因响应不同非生物胁迫(高盐、干旱)和激素处理(ABA、GA3、JA)下的相对表达模式,进一步构建了ThP5CR基因过表达载体(pROKⅡ-ThP5CR),将其在刚毛柽柳中瞬时表达,分析比较转基因刚毛柽柳和对照刚毛柽柳(转pROKⅡ空载体)抗逆性差异,以初步鉴定ThP5CR基因功能。该研究为进一步分析柽柳抗逆机制和P5CR基因的抗逆功能以及进一步利用基因工程手段提高植物抗逆性奠定理论基础。
1 材料与方法 1.1 植物材料及胁迫处理将刚毛柽柳种子播种于塑料筐中,栽培基质为2:1(V/V)的泥炭土和砂子混合基质。温室中培养,温室平均温度控制在24 ℃,光暗周期14 h/10 h,相对湿度在70%~75%。2个月生刚毛柽柳幼苗分别用0.4 mol·L-1 NaCl、20%(W/V)PEG6000、100 μmol·L-1 ABA、50 μmol·L-1 GA3和100 μmol·L-1 JA溶液进行浇灌处理,处理时间为6,12,24,48,72 h。同时以正常浇水刚毛柽柳材料作为对照。胁迫处理后分别取刚毛柽柳根部和叶部组织。经液氮速冻后,保存于-80 ℃冰箱用于RNA的提取。
1.2 柽柳ThP5CR基因的克隆和序列分析以“Pyrroline 5 Carboxylate Reductase”作为关键词,对实验室前期构建的刚毛柽柳7个转录组的Unigenes BLAST比对结果进行查找,获得ThP5CR基因cDNA序列,通过ORF founder(http://www.ncbi.nlm.nih.gov/gorf.htmL)程序,综合BLASTX比对结果确定其开放读码框,选择具有完整ORF的ThP5CR基因,设计引物,引物序列为:ThP5CR-F:GAAGACAGCGATGTGGTTGTAT;ThP5CR-R:CTTC CCAATCGCTCCAAACAAT。以刚毛柽柳cDNA为模板进行RT-PCR,进一步测序确定所获得的ThP5CR基因序列。对克隆获得的ThP5CR基因进行序列分析。用ProtParam(http://au.expasy.org/tools/protparam.html)软件计算推导ThP5CR基因编码蛋白质的分子量及理论等电点。在NCBI上对刚毛柽柳ThP5CR基因进行氨基酸序列同源比较,选取与刚毛柽柳ThP5CR基因同源性较高的9种植物的P5CR基因蛋白序列,利用BioEdit软件进行多序列比较,并利用MEGA软件邻接法(Neighbor-Joining,NJ)预测系统发生树。这9种植物分别是林烟草(Nicotiana sylvestris)、烟草(Nicotiana tabacum)、商陆(Phytolacca acinosa)、番薯(Ipomoea batatas)、菠菜(Spinacia oleracea)、胡萝卜(Daucus carota subsp. sativus)、甜菜(Beta vulgaris subsp. vulgaris)、阳芋(Solanum tuberosum)和芜菁(Brassica rapa)。
1.3 实时荧光定量RT-PCR利用CTAB法提取刚毛柽柳不同组织总RNA,经DNaseⅠ(Promega)消化处理,去除DNA污染。分别取1 μg总RNA进行反转录,反转录反应体系和操作参照Primer ScriptTM RT Reagent Kit(Perfect Real Time)(Takara)说明。将反转录产物稀释10倍,用作Real time RT-PCR反应模板。选择刚毛柽柳β-tubulin、α-tubulin和β-Actin基因作为内参基因。内参和ThP5CR基因的定量PCR引物见表 1。Real time RT-PCR反应体系为20 μL,其中包括模板2 μL、基因特异性上下游引物各1 μL(10 μmol·L-1)和2×Power SYBR Green PCR master mix 10 μL。反应程序为:95 ℃预变性30 s;95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸30 s,80 ℃读板1 s,45个循环;72 ℃延伸7 min。3次重复。反应在MJ OpticonTM2仪器(BioRad Hercules.CA. USA.)上完成。实时定量RT-PCR数据利用2CT-△△法(Livak et al., 2001)进行分析。
|
|
根据植物过表达载体pROKⅡ的多克隆位点及ThP5CR基因特征,设计引物时在ThP5CR基因5′端和3′端分别引入XbaⅠ和KpnⅠ限制性内切酶位点。以刚毛柽柳cDNA为模板,进行ThP5CR基因RT-PCR克隆,RT-PCR反应体系为20 μL,其中包括模板2 μL,基因特异性上下游引物(10 μmol·L-1)各1 μL,dNTP Mix (10 mmol·L-1) 0.40 μL,10 ×LA Taq PCR buffer 2.00 μL,LA Taq (5 U·μL-1)0.25 μL。反应程序为94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,40个循环;72 ℃延伸7 min。使用胶回收试剂盒对扩增目的片段进行回收。用KpnⅠ和XbaⅠ酶分别对胶回收ThP5CR基因产物和pROKⅡ质粒进行双酶切,分别回收后用T4连接酶进行连接。将连接产物转化到大肠杆菌(Escherichia coli)感受态细胞,挑取单克隆分别用基因引物(pROKⅡ-ThP5CR-F和pROKⅡ-ThP5CR-R)和载体引物(pROKⅡ-F和pROKⅡ-R)进行PCR验证。获得ThP5CR基因过表达载体,命名为pROKⅡ-ThP5CR,转化根癌农杆菌(Agrobacterium tumefaciens)菌株EHA105。
1.5 ThP5CR基因瞬时转化刚毛柽柳及抗逆功能分析根据Ji等(2014)方法将构建好的EHA105(pROKⅡ-ThP5CR)和EHA105(pROKⅡ)(空载体,作为对照)分别瞬时侵染刚毛柽柳,分别标记为Con、OX。比较NaCl和甘露醇处理后2种瞬时表达刚毛柽柳的生理染色和生理指标以综合评定ThP5CR基因的抗逆功能。具体的步骤为:将生长20~30天刚毛柽柳组培苗放入1.2 mol·L-1甘露醇中浸泡5~10 min(高渗透处理),再分别迅速转移至已加有菌种EHA105(pROKⅡ-ThP5CR)和EHA105(pROKⅡ)(空载体,作为对照)的侵染液中,放入恒温振荡器24 ℃,120 r·min-1侵染4 h。取出苗后,用无菌水洗涤3~4次,无菌滤纸吸干水分,将刚毛柽柳无菌苗接种于MS培养基上,放置于室温为(22±2)℃、相对湿度为65%~75%、光强为400 μmol·m-2s-1的组织培养室共培养36 h。36 h后将瞬时侵染刚毛柽柳转移至含200 mmol·L-1甘露醇、150 mol·L-1 NaCl的MS培养基上进行胁迫处理。分别收集胁迫处理12 h、24 h后的刚毛柽柳苗,用于组织化学染色、RNA提取和生理指标分析。同时以正常MS培养基培养侵染后的植株作为对照。生理指标分析包括脯氨酸、H2O2、MDA含量测定,生理染色包括氯化硝基四氮唑蓝(NBT)、二氨基联苯胺(DAB)、伊文思蓝(Evans blue)染色(Zang et al., 2015; Silvia et al., 2012)。采用SPSS16.0软件(SPSS, Chicago, Ⅱ, USA)分析差异显著性(P < 0.05)。
2 结果与分析 2.1 ThP5CR基因的克隆及序列分析经转录组序列查找和进一步的RT-PCR克隆验证,证实克隆获得了柽柳ThP5CR基因,其cDNA长度为1 432 bp,其中开放阅读框长度为822 bp,编码273个氨基酸,相对分子量(molecular weight)为28.29 kDa;理论等电点(theoretical pI)为9.22。Pfam分析结果表明,柽柳P5CR基因具有典型P5CR结构域;N端是具有催化功能的NADP结构域,C端是具有二聚体功能的P5CR结构域。此外还有典型的PDH脯氨酸脱氢酶结构域、谷氨酸激酶结构域等。
选择9种与刚毛柽柳ThP5CR蛋白同源性较高的已知P5CR蛋白序列,利用BioEdit软件和MEGA软件分别进行多序列比对并构建进化树,结果显示10种植物的P5CR蛋白序列在图中标记的N端的NADP结构域和C端的P5CR二聚体结构域相对保守,PDH脯氨酸脱氢酶结构域和谷氨酸激酶结构域也相对保守,而在225到230之间部分氨基酸序列不一致,但总体来说10种植物P5CR蛋白的氨基酸序列均较保守且序列长度也较相近(图 1A),氨基酸序列一致性在75%~ 84%。其中刚毛柽柳ThP5CR蛋白与商陆、菠菜和甜菜的P5CR蛋白的同源性较高,氨基酸序列一致性分别可达84%、81%和80%。进化树分析结果也显示,刚毛柽柳与商陆、菠菜和甜菜亲缘关系较近,归为一组(图 1B)。

|
图 1 柽柳P5CR蛋白与其他植物P5CR蛋白的多序列比对(A)和系统进化树分析(B) Fig.1 Multiple alignment(A) and clustering analysis(B) of P5CR proteins in Tamarix hispida and other 9 plant species NsP5CR:林烟草Nicotiana sylvestris(XP_009773755); NtP5CR:烟草Nicotiana tabacum(XP_016465541); PaP5CR:商陆Phytolacca acinosa(ACT37661); IbP5CR:番薯Ipomoea batatas(ADY77003); SoP5CR:菠菜Spinacia oleracea(KNA12919); DcP5CR:胡萝卜Daucus carota subsp. sativus(XP_017255032); BvP5CR:甜菜Beta vulgaris subsp. vulgaris(XP_010672976); StP5CR:阳芋Solanum tuberosum(XP_006365049); BrP5CR:芜菁Brassica rapa(XP_009121629). |
为了初步分析ThP5CR基因的功能,利用实时定量RT-PCR分析了PEG和NaCl胁迫处理后刚毛柽柳ThP5CR基因的表达模式。结果显示,PEG胁迫下,叶组织中ThP5CR基因表达在胁迫早期变化不明显,胁迫24 h后表达量才明显下调,随后又逐渐增高,胁迫72 h后表达量是对照的2.73倍;根组织中,ThP5CR基因的表达受PEG胁迫的快速诱导,胁迫6 h时,表达量即为对照的12.7倍,随后表达量逐渐被抑制,至72 h表达量最低,仅为对照的4.6%。NaCl胁迫下,柽柳叶组织中ThP5CR基因的表达变化主要表现为下调表达,24 h表达量最低,仅为对照的14.5%;根中则相反,主要表现为诱导表达,6 h表达量最高,是对照的24.25倍(图 2)。

|
图 2 非生物胁迫处理下柽柳ThP5CR基因表达分析 Fig.2 Expression analysis of ThP5CR in Tamarix hispida under abiotic stresses |
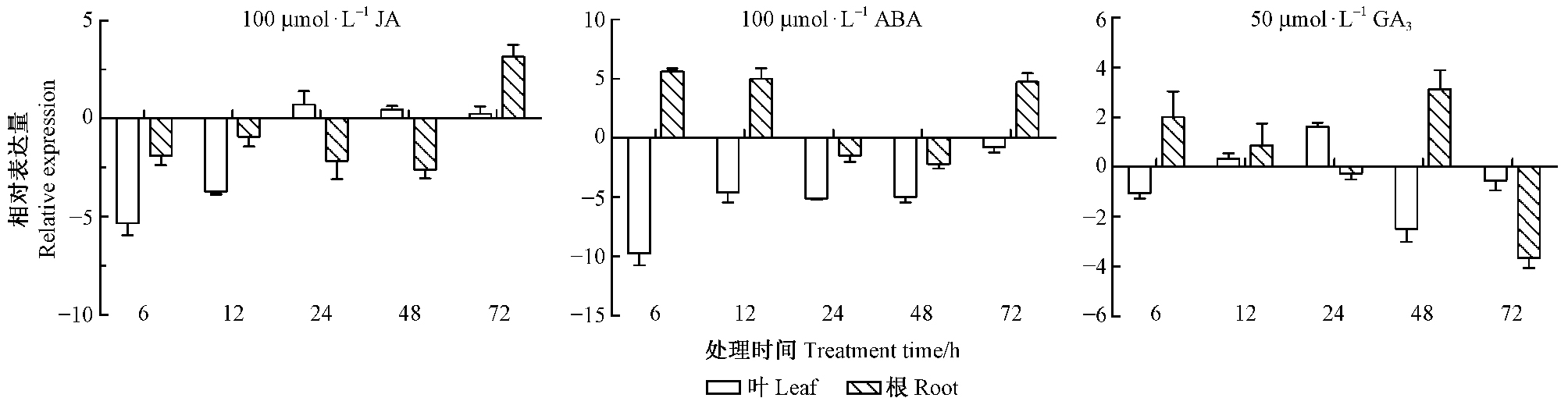
ABA处理后,与NaCl胁迫相似,叶中ThP5CR基因表达主要为下调表达,其中6 h表达量最低,为对照的0.11%;根组织中,在大部分胁迫时间点都明显被上调表达,同样能对ABA处理作出快速应答,在胁迫6 h表达量即最高,为对照的49.66倍。JA处理下,叶中ThP5CR基因在胁迫早期(12 h之前)受明显抑制,胁迫24 h以后表达上调,但和对照相比,差异不明显;根中也主要表现为受抑制(48 h前),但胁迫72 h表达明显受诱导,为对照的8.88倍。与其他几种胁迫相比,GA3处理下,ThP5CR基因表达量变化小一些,但无论根还是叶中,在所研究的5个时间点中,都至少有2个时间点,表达量发生了明显改变:叶中胁迫24 h表达被明显诱导(为对照的3.10倍),48 h表达明显被抑制(为对照的18.9%);根中6 h和48 h都被明显诱导,而胁迫72 h,表达量则明显下调。以上结果表明,ThP5CR基因能对上述5种处理作出应答,但表达模式不完全相同(图 3)。
|
图 3 不同激素处理下柽柳ThP5CR基因表达分析 Fig.3 Expression analysis of ThP5CR in Tamarix hispida under different hormone treatments |
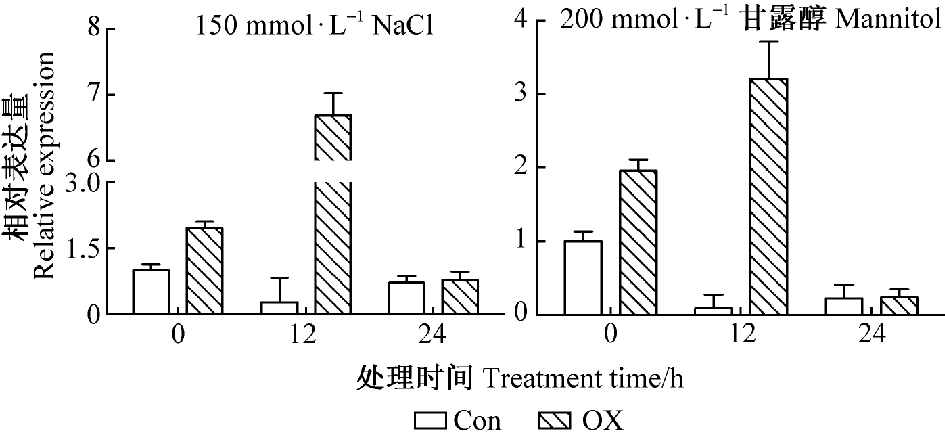
为了初步探究ThP5CR基因抗逆功能,将构建成功的重组载体pROKⅡ-ThP5CR进行刚毛柽柳瞬时转化,同时以pROKⅡ瞬时侵染刚毛柽柳作为对照。提取2种瞬时侵染刚毛柽柳总RNA,反转录成cDNA,利用qRT-PCR分析瞬时转基因株系中ThP5CR基因的表达情况。结果显示,非胁迫条件下,瞬时过表达ThP5CR柽柳中该基因的表达量是对照的1.97倍。而150 mmol·L-1 NaCl和200 mmol·L-1甘露醇胁迫12 h后过表达株系中ThP5CR基因的表达量分别是对照的41.2倍和35.5倍。表明成功获得了瞬时过表达ThP5CR基因刚毛柽柳(图 4)。
|
图 4 非生物胁迫下柽柳ThP5CR基因的表达 Fig.4 Expression analysis of ThP5CR in Tamarix hispida after abiotic stress Con: pROKⅡ空载对照; OX:pROKⅡ-ThP5CR过表达植株.下同.Con: Plants transformed with empty pROKⅡ; OX: Plants transformed with overexpression of pROKⅡ-ThP5CR. The same below. |
NBT和DAB染色结果显示,150 mmol·L-1 NaCl和200 mmol·L-1甘露醇胁迫后,OX植株的颜色明显比对照植株浅,表明OX植株中

|
图 5 非生物胁迫下刚毛柽柳转基因植株和对照NBT、DAB和Evans blue染色比较 Fig.5 NBT, DAB and Evans blue staining comparisons between transgenic and control Tamarix hispida under abiotic stress 1: DAB, NBT和Evans blue没有进行胁迫处理的Con, OX的染色结果; 2:150 mmol·L-1NaCl和200 mmol·L-1甘露醇12 h胁迫处理后Con, OX的染色结果.1: NBT, DAB and Evans blue staining of Con, OX plants without treatment; 2: The staining of Con, OX plants treated with 150 mmol·L-1 NaCl and 200 mmol·L-1mannitol for 12 h. |
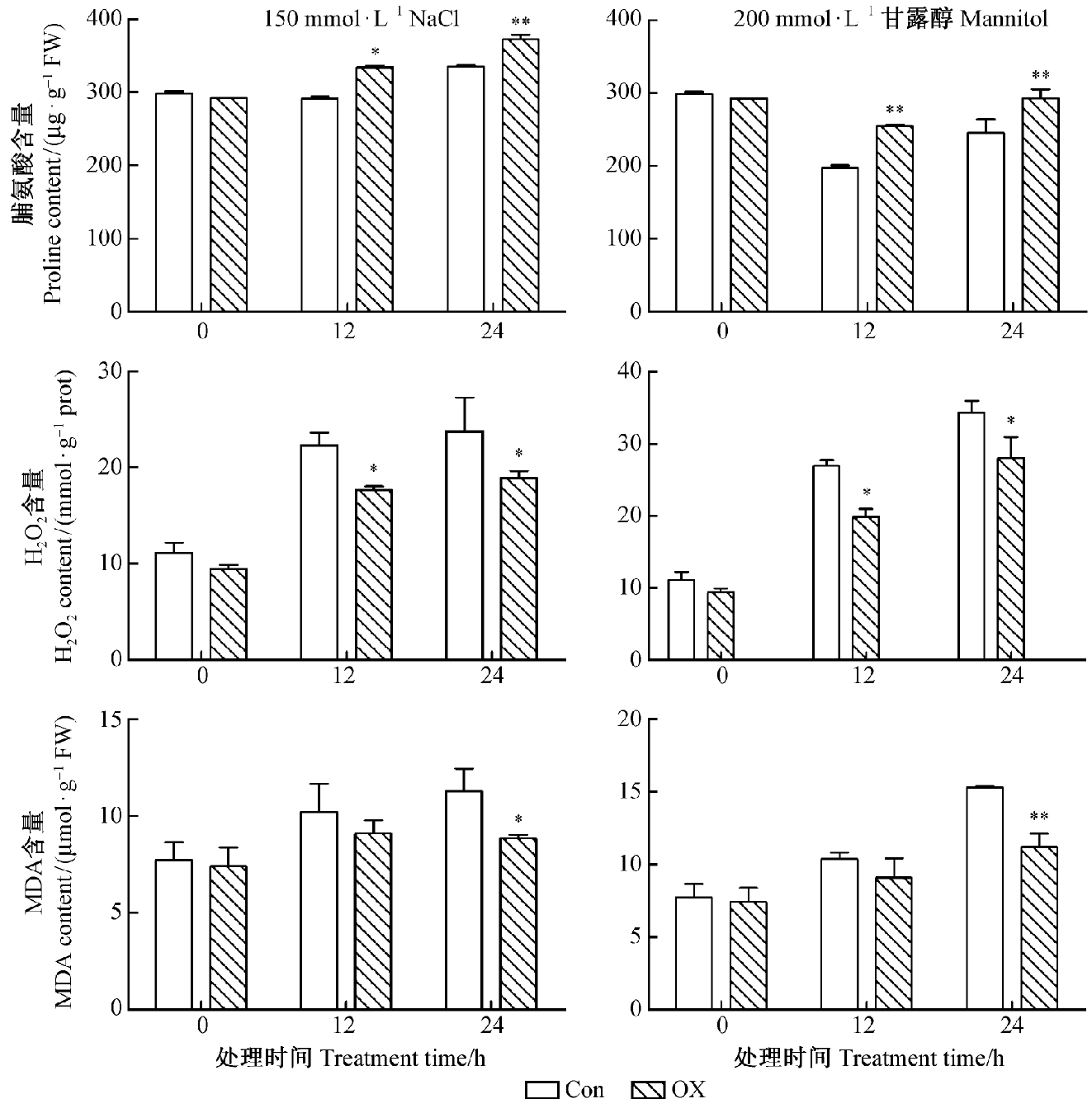
为了探究ThP5CR的抗逆功能,进一步分析比较了NaCl和甘露醇胁迫后过表达ThP5CR基因刚毛柽柳和对照的脯氨酸含量、H2O2含量和MDA含量。结果(图 6)显示,非胁迫处理条件下,OX株系的脯氨酸含量略高于对照,H2O2含量和MDA含量略低于对照,但差异不显著。而在150 mmol·L-1NaCl和200 mmol·L-1甘露醇胁迫后,瞬时过表达ThP5CR植株的脯氨酸含量明显高于对照植株,H2O2含量和MDA含量明显低于对照植株,表明胁迫条件下,瞬时过表达株系的膜脂氧化程度降低,抗逆能力提高。提示ThP5CR基因可能是一个抗旱耐盐能力优良的候选基因。
|
图 6 非生物胁迫下转基因刚毛柽柳和对照刚毛柽柳的生理指标比较 Fig.6 The comparison of physiological indicators between transgenic Tamarix hispida and control under abiotic stresses |
P5CR(吡咯啉-5-羧酸还原酶)是植物乃至生物体内的一种保守蛋白,其作用是催化脯氨酸生物合成的最后一步,即在NAD(P)H的作用下,将吡咯啉-5-羧酸转化为脯氨酸。本研究从刚毛柽柳中克隆得到ThP5CR基因,该基因C端含有典型的P5CR二聚体结构域,N端含有NADP结构域,此外还有典型的PDH脯氨酸脱氢酶结构域、谷氨酸激酶结构域等。选取胡萝卜等10种植物的P5CR氨基酸序列进行多序列比对与进化树分析,结果显示,P5CR蛋白氨基酸序列保守性较高,NADP结构域和P5CR二聚体结构域都是高度保守的结构域,这与Nocek等(2005)报道的结果一致。Ruszkowski等(2015)对蒺藜苜蓿(Medicago truncatula)MtP5CR蛋白的十倍体晶体结构和其产物NAD+、NADP+和L-Proline进行X射线研究表明,NADPH被认为是MtP5CR在体外的唯一辅酶。
实时定量RT-PCR分析ThP5CR基因在不同的胁迫处理后刚毛柽柳叶和根中的表达情况,结果表明5种不同处理均能产生不同程度的影响,尤其是PEG、NaCl和ABA处理后,根和叶中ThP5CR基因表达在大部分胁迫时间点都发生了明显改变。此外,ABA激素处理下的基因表达趋势与NaCl胁迫下表达趋势相似,且ABA激素处理下的基因表达变化更为明显,表明刚毛柽柳ThP5CR基因可能参与ABA信号途径相关的NaCl胁迫应答。以往研究也表明P5CR基因的表达受PEG、NaCl和ABA等处理的影响,如Cao等(2015)对多年生黑麦草(Lolium perenne)进行PEG、NaCl和ABA处理,发现黑麦草LpP5CR基因的表达明显受3种处理影响,且影响最为明显的时间点均为上调表达。在日中花(Mesembryanthemum nodiflorum)中,在400 mmol·L-1 NaCl处理后P5CR的活性是未处理的4倍(Laliberté et al., 1989)。
3.2 P5CR基因的抗逆功能脯氨酸不仅是一种渗透调节物质,还是一种非常有效的抗氧化剂,并且可以调节细胞稳态(Rodriguez et al., 2005)。P5CS和P5CR是合成脯氨酸途径的重要基因,但在P5CR基因方面研究的甚少,但目前发现P5CR是合成脯氨酸过程中重要的中间酶,催化P5C(吡咯啉-5-羧酸)转化为脯氨酸,且可以通过Glu、Orn 2种途径转化为脯氨酸;最近发现植物P5CR基因是通过辅酶的实用性、抑制产物和离子效应等复杂机制进行调控,这些机制可以使植物酶广泛响应由任一P5CS同工酶或OAT合成的P5C,而无需一个转录控制,大大提高了合成脯氨酸的转化效率(Giberti et al., 2014)。因此P5CR基因具有非常高的研究价值和广阔的研究前景。
盐和干旱诱导对脯氨酸合成起重要作用。如在转基因P5CR蚕豆(Vicia faba)中发现,在干旱胁迫后,增加了植物体内脯氨酸的含量进而增强了转基因蚕豆的抗旱性(Trinchant et al., 1998)。在脯氨酸过量积累的转基因蒺藜苜蓿中,通过提高植物的耐渗透胁迫来增强固氮作用(Verdoy et al., 2006)。已有多项研究表明,过表达P5CR基因可提高植物的抗旱能力,如在P5CR过表达甘薯中,盐胁迫后,IbP5CR的表达增加了脯氨酸含量,通过调节渗透压平衡,保护膜的完整性、光合作用,激活ROS清除系统等,增强了转基因甘薯的耐盐性(De Ronde et al., 2004)。本研究分析比较了瞬时过表达ThP5CR基因刚毛柽柳和对照刚毛柽柳的盐和干旱胁迫耐受性,结果显示瞬时过表达ThP5CR 基因刚毛柽柳在盐和干旱胁迫后,也能通过增加脯氨酸含量来增强转基因刚毛柽柳细胞内清除活性氧能力,促使
对刚毛柽柳ThP5CR基因表达分析发现,0.4 mol·L-1 NaCl处理下,叶中ThP5CR基因的表达明显低于对照。对2种瞬时侵染刚毛柽柳的ThP5CR基因表达分析也显示150 mmol·L-1 NaCl处理下,对照刚毛柽柳中ThP5CR基因的表达也低于非胁迫处理,而胁迫后脯氨酸含量无明显差异。但甘露醇胁迫后ThP5CR基因的表达趋势与NaCl胁迫类似,而脯氨酸的含量明显低于对照。这可能由于刚毛柽柳对NaCl和甘露醇胁迫的响应机制不同,ThP5CR基因可能在蛋白水平应对2种胁迫的调控机制不同。NaCl胁迫不仅是渗透胁迫而且还会产生离子毒害,以往研究表明,P5CR基因受辅酶的实用性、抑制产物和离子效应等复杂机制的调控,这些机制可能对2种胁迫产生的作用也会有所不同(Giberti et al., 2014)。
此外,脯氨酸作为20种蛋白氨基酸之一,如果能抑制其合成,则能从一定程度上抑制植物的生长甚至致死。在抑制方面的研究,如Forlani等(2013)报道了26个氨基甲叉基双膦酸类衍生物对P5CR具有抑制作用。还有研究表明,由于在MtP5CR结构的活性中心发现了一些丙磺酸分子,提出了4-羟乙基哌嗪乙磺酸(HEPES)也可作为P5CR的抑制剂。在后期研究中会进一步构建抑制表达载体,进而全面研究P5CR基因功能。
4 结论从刚毛柽柳中克隆获得了ThP5CR基因,该基因cDNA长1 432 bp,开放阅读框长822 bp,编码273个氨基酸,相对分子量为28.29 kDa;理论等电点为9.22。刚毛柽柳P5CR基因具有典型P5CR结构域。该基因能对2种胁迫(NaCl、PEG胁迫)和3种激素(ABA,JA,GA3)处理做出应答,可能参与了刚毛柽柳抗旱耐盐逆境胁迫应答和激素信号转导。150 mmol·L-1 NaCl和200 mmol·L-1甘露醇胁迫后瞬时过表达ThP5CR基因刚毛柽柳植株可通过增加脯氨酸含量,增强细胞内清除活性氧能力,使
| [] |
陈吉宝, 赵丽英, 景蕊莲, 等. 2010. 植物脯氨酸合成酶基因工程研究进展. 生物技术通报(2): 8–10.
( Chen J B, Zhao L Y, Jing R L, et al. 2010. The researching progress of plant proline synthase gene engineering. Advances in Biotechnology Bulletin(2): 8–10. [in Chinese] ) |
| [] |
张道远, 尹林克, 潘伯荣, 等. 2013. 柽柳属植物抗旱性能研究及其应用潜力评价. 中国沙漠, 23(3): 252–256.
( Zhang D Y, Yin L K, Pan B R, et al. 2013. Tamarix plant drought resistance and its potential evaluation. Chinese Desert, 23(3): 252–256. [in Chinese] ) |
| [] | Cao L, Wei S, Han L, et al. 2015. Gene cloning and expression of the pyrroline-5-carboxylate reductase gene of perennial ryegrass(Lolium perenne). Horticultural Plant Journal, 1(2): 113–120. |
| [] | Chaves M M, Flexas J, Pinheiro C. 2009. Photosynthesis under drought and salt stress: regulation mechanisms from whole plant to cell. Annals of Botany, 103(4): 551–560. DOI:10.1093/aob/mcn125 |
| [] | Da Rocha I M A, Vitorello V A, Silva J S, et al. 2012. Exogenous ornithine is an effective precursor and the δ-ornithine amino transferase pathway contributes to proline accumulation under high N recycling in salt-stressed cashew leaves. Journal of Plant Physiology, 169(1): 41–49. DOI:10.1016/j.jplph.2011.08.001 |
| [] | De Ronde J A, Cress W A, Krüger G H J, et al. 2004. Photosynthetic response of transgenic soybean plants, containing an Arabidopsis P5CR gene, during heat and drought stress. Journal of Plant Physiology, 161(11): 1211–1224. DOI:10.1016/j.jplph.2004.01.014 |
| [] | Forlani G, Berlicki L, Duò M, et al. 2013. Synthesis and evaluation of effective inhibitors of plant δ1-pyrroline-5-carboxylate reductase. Journal of Agricultural and Food Chemistry, 61(28): 6792–6798. DOI:10.1021/jf401234s |
| [] | Giberti S, Funck D, Forlani G. 2014. Δ1-pyrroline-5-carboxylate reductase from Arabidopsis thaliana: stimulation or inhibition by chloride ions and feedback regulation by proline depend on whether NADPH or NADH acts as co-substrate. New Phytologist, 202(3): 911–919. DOI:10.1111/nph.12701 |
| [] | Ji X, Zheng L, Liu Y, et al. 2014. A transient transformation system for the functional characterization of genes involved in stress response. Plant Molecular Biology Reporter, 32(3): 732–739. DOI:10.1007/s11105-013-0683-z |
| [] | Laliberté G, Hellebust J A. 1989. Pyrroline-5-carboxylate reductase in Chlorella autotrophica and Chlorella saccharophila in relation to osmoregulation. Plant Physiology, 91(3): 917–923. DOI:10.1104/pp.91.3.917 |
| [] | Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| [] | Meng Z, Lou Z, Liu Z, et al. 2006. Crystal structure of human pyrroline-5-carboxylate reductase. Journal of Molecular Biology, 359(5): 1364–1377. DOI:10.1016/j.jmb.2006.04.053 |
| [] | Nocek B, Chang C, Li H, et al. 2005. Crystal structures of δ 1-pyrroline-5-carboxylate reductase from human pathogens Neisseria meningitides and Streptococcus pyogenes. Journal of Molecular Biology, 354(1): 91–106. DOI:10.1016/j.jmb.2005.08.036 |
| [] | Rodriguez R, Redman R. 2005. Balancing the generation and elimination of reactive oxygen species. Proceedings of the National Academy of Sciences of the United States of America, 102(9): 3175–3176. DOI:10.1073/pnas.0500367102 |
| [] | Ruszkowski M, Nocek B, Forlani G, et al. 2015. The structure of Medicago truncatula δ1-pyrroline-5-carboxylate reductase provides new insights into regulation of proline biosynthesis in plants. Frontiers in Plant Science, 6: 869. |
| [] | Silvia D, Hansjörg S, Julia K, et al. 2012. Stress-induced GSK3 regulates the redox stress response by phosphorylating glucose-6-phosphate dehydrogenase in Arabidopsis. Plant Cell, 24(8): 3380–3392. DOI:10.1105/tpc.112.101279 |
| [] | Székely G, Ábrahám E, Cséplő Á, et al. 2008. Duplicated P5CS genes of Arabidopsis play distinct roles in stress regulation and developmental control of proline biosynthesis. The Plant Journal, 53(1): 11–28. DOI:10.1111/tpj.2008.53.issue-1 |
| [] | Trinchant J C, Yang Y S, Rigaud J. 1998. Proline accumulation inside symbiosomes of faba bean nodules under salt stress. Physiologia Plantarum, 104(1): 38–49. DOI:10.1034/j.1399-3054.1998.1040106.x |
| [] | Verbruggen N, Hermans C. 2008. Proline accumulation in plants: a review. Amino Acids, 35(4): 753–759. DOI:10.1007/s00726-008-0061-6 |
| [] | Verdoy D, Coba De La Peña T, Redondo F J, et al. 2006. Transgenic Medicago truncatula plants that accumulate proline display nitrogen-fixing activity with enhanced tolerance to osmotic stress. Plant, Cell & Environment, 29(10): 1913–1923. |
| [] | Zang D, Wang C, Ji X, et al. 2015. Tamarix hispida zinc finger protein ThZFP1 participates in salt and osmotic stress tolerance by increasing proline content and SOD and POD activities. Plant Science, 235: 111–121. DOI:10.1016/j.plantsci.2015.02.016 |
 2017, Vol. 53
2017, Vol. 53

