文章信息
- 刘佳嘉, 李国雷, 刘勇, 尚治国
- Liu Jiajia, Li Guolei, Liu Yong, Shang Zhiguo
- 容器类型和胚根短截对栓皮栎容器苗苗木质量及造林初期效果的影响
- Combined Effects of Container Type and Radicle Pruning on Seedling Quality and Early Field Performance of Quercus variabilis Container Seedlings
- 林业科学, 2017, 53(6): 47-55.
- Scientia Silvae Sinicae, 2017, 53(6): 47-55.
- DOI: 10.11707/j.1001-7488.20170606
-
文章历史
- 收稿日期:2017-01-25
- 修回日期:2017-03-05
-
作者相关文章
2. 城乡生态环境北京实验室 北京 100083;
3. 栾川县林木种子站 洛阳 471500
2. Laboratory of Urban and Rural Ecological Environment Beijing 100083;
3. Forest Tree Seed Station of Luanchuan County Luoyang 471500
容器类型直接作用于苗木规格、根系结构、生物量和养分含量的积累与分配,进而影响造林苗木的成活与生长(Landis, 1990; Poorter et al., 2012),一直被视为调控苗木质量、改善造林效果的关键措施(李国雷等,2012),在困难立地植被恢复中发挥的作用更为突出(Grossnickle, 2005;Jacobs et al., 2005a; Luis et al., 2010)。选用空气修根较好的无纺布容器,可使生物量更多地向地上部分分配,增加苗木高度(Chapman et al., 2006),从而提高苗木与杂草对于光的竞争能力(Jacobs et al., 2005b;Dumroese et al., 2011);对于干旱立地,选用较深的容器育苗,可促进根系生长,提高根系生物量,使造林苗木从更深的土壤中获取水分(Chirino et al., 2008)。选用合适的容器不仅可以使苗木在苗圃阶段积累更多养分,提高造林初期养分内转移量,直接促进新根形成和顶梢生长,改善造林效果(Dominguez-Lerena et al., 2006;Villar-Salvador et al., 2012),而且还可形成发达的根系,提高造林苗木从土壤中获取水分和养分的能力,增强苗木耐干旱瘠薄能力,从而使苗木尽快适应立地环境(Gordon et al., 2000; Davis et al., 2005)。可见,基于特定立地特征依据苗木造林效果、造林后养分和水分吸收能力,结合苗圃阶段苗木规格、根系特征和养分积累已成为容器类型筛选的方法。该方法充分重视立地类型,从苗木形态、生理和造林效果多维度建立苗木质量与容器类型的关系,因此受到更多的青睐(李国雷等,2012;Poorter et al., 2012;Villar-Salvador et al., 2015)。
胚根短截也叫芽苗切根,是先将种子催芽,待胚根长至一定长度时,截断部分胚根再播种的育苗方式(林志鹏,2000;罗盛健,2006;刘永生等,2008)。胚根短截后,根系在截断处分支,阻止单一主根持续伸长,形成多主根的根系系统,苗木根系结构发生改变(Bonner, 1982; McCreary, 1996; Tilki et al., 2006;Liu et al., 2016),根系表面积和体积改变,并影响苗圃阶段和造林阶段苗木从土壤中获取养分的能力(Ertas, 2002)。胚根短截还影响生物量分配,促进苗木地上部分发育(Tilki et al., 2006; Devine et al., 2009),提高苗木规格,也影响造林效果(Jacobs et al., 2005b;Dumroese et al., 2011)。胚根短截在主根发达树种中应用较多,原因在于容器有限的空间常导致主根盘旋或者逆向生长,通过胚根短截形成多条主根从而缓解窝根(李国雷等,2012)。
容器类型和胚根短截被广泛证明是调控形态、生理和造林效果的有效手段,若同时采用2种措施培育苗木,能否对苗木质量的提高产生叠加效应尚需论证。目前的研究多从容器类型(Dominguez-Lerena et al., 2006;Tsakaldimi et al., 2005; Mariotti et al., 2015)或胚根短截(McCreary, 1996; Tilki et al., 2006)进行单方面探讨。针对乡土树种,我国学者开展容器类型和胚根短截对苗木质量影响的研究,并取得不菲的成绩(林志鹏,2000;罗盛健,2006;王金旺等,2015;田吉等,2016;郑坚等,2016;王琰等,2016),但这些研究更多地集中在苗圃阶段苗木形态和养分积累方面,这些措施对造林效果的影响关注相对较少。
栓皮栎(Quercus variabilis)是我国重要的乡土阔叶树种,主根发达,耐旱耐瘠薄,分布广泛,具良好的生态功能,是我国北方主要的造林树种;且树皮木栓层发达,种子淀粉含量高,具有很大经济价值和应用前景(罗伟祥等,2009)。本研究以主根发达树种栓皮栎为对象,综合评价容器类型和胚根短截对栓皮栎容器苗根系结构、生长、养分吸收和造林效果的影响,从苗圃和造林2个阶段系统研究容器类型和胚根短截的叠加效应,以期为栓皮栎苗木质量调控提供参考。
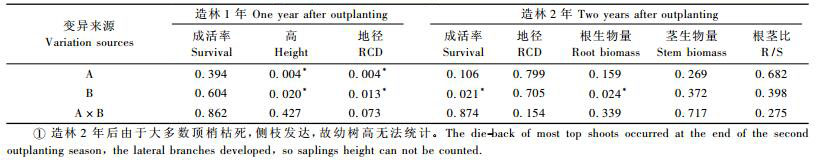
1 材料与方法 1.1 温室育苗试验试验用栓皮栎种子于2012年9月采集自北京市平谷区四座楼林场,采集回来后用50 ℃温水浸泡30 min,杀死虫卵并去除漂浮在水面上的空粒、病粒,然后自然风干后放入10号(24 cm×34 cm)自封袋中,在2 ℃冰箱中贮存至来年春季用于育苗。
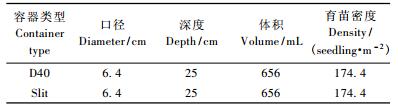
2013年4月初,在中国林业科学研究院温室进行育苗和试验,采用双因素完全随机试验设计,因素分别为容器类型(A)和胚根短截(B)。选用2种硬塑料容器,分别是DeepotTMD40(D40) 和Air-slit(Slit)(Stuewe & Sons, Inc., Corvallis),D40容器为“子弹型”侧壁封闭的容器,容器内部有4条导根肋,无底,下部有若干排水孔,可发挥空气修根的作用,避免根系在容器底部盘旋生长(Landis,1990;Dumroese et al., 2011)。Slit容器的侧壁和底部均有裂缝,既起导根作用,又能充分发挥空气修根的作用,有利于形成“近自然状态”的根系(Rune, 2003; Ortega et al., 2006)(表 1)。设置胚根短截(RP)和不短截对照(CK)2个处理,胚根短截是先将种子催芽至胚根达6 cm,用干净的剪刀截去胚根本身长度的1/3后播种(Liu et al., 2016),对照是直接将种子播种于基质中。
|
|
育苗时,将品氏基质(Pindstrup Plus)(纤维长度0~10 mm,pH 6.0) 与珍珠岩按照3:1(V:V)的比例混合,用多菌灵消毒,加水翻拌,待基质基本湿润后,装入育苗容器中。每20个容器放入1个配套托盘(D20T,Stuewe & Sons, Inc.,37.6 cm×30 cm),每2个托盘为1个重复,每个处理8个托盘,共32个托盘。托盘的作用在于固定容器(容器底部小,无法直接放置在苗床上)使育苗整齐且满足完全随机试验要求,保持育苗密度一致。育苗过程中每隔2周调换托盘位置,防止边缘效应。
播种3周后,出苗率达到90%以上开始施肥。将配好的肥料溶于水后,每株每次施用20 mL,每周施肥1次,共16周(5月13日至8月26日)。到生长季末每株苗木的累计施肥量为100 mg N,60 mg P2O5,40 mg K2O,氮肥通过硝酸铵补充,磷、钾肥通过磷酸二氢钾补充,微量元素以EDTA(乙二胺四乙酸二钠)和DTPA(二乙烯三胺五乙酸)进行补充,累计用量分别为4.03 mg和1.25 mg。其中氮肥采用指数施肥方式,磷肥、钾肥和微量元素采用常规施肥方式(李国雷等,2012)。按照苗木需求浇水,一般为每周1次,夏季连续晴天时每周浇水2~3次,但是Slit容器中基质容易干,需要增加浇水频率,避免由于苗木缺水引起苗木质量下降。
1.2 野外造林试验造林地属于弃耕地,位于河北省保定市河北农业大学标本园(38°9′N,115°43′E),平均海拔为23.9 m。该地区年平均气温为12.2 ℃,属于暖温带半湿润大陆季风气候,春季干旱多风,夏季炎热多雨,秋季凉爽,冬季寒冷,四季分明。年平均降水量为529.7 mm,主要集中在7—8月,占总降水量的60%左右,全年日照时间约为2 500~2 900 h,无霜期165~210天。
2014年4月中旬,将假植苗装箱运输到造林地。试验采用完全随机区组试验设计,设置4个区组,每个区组包含所有4个处理,每个处理12株苗木,即从每个重复(40株)随机选取12株苗木用于造林。整个造林地边缘设置保护行,防止边缘效应。造林株行距为1 m×1 m,造林前先挖好0.4 m×0.4 m×0.4 m(长×宽×深)的穴,然后将苗木从容器中轻轻倒出,带着土坨一起放入栽植穴的中央,注意不要把土坨弄散,避免伤害根系,再覆土压实。栽植时,注意苗木与地面保持垂直,造林之后立即灌水,待水下渗至人能进入后,测定本底苗高、地径。
1.3 破坏取样与测定2013年11月下旬,待苗木停止生长,每个重复随机选取8株苗木进行破坏取样。剩余苗木在室外假植,用于第2年的造林试验。先测定苗高、地径,然后将苗木从容器中取出,抖落根系上的大块基质,并用清水洗干净,尽量避免扯断细根。最后将根和茎分开,将茎剪断后放入信封,在70 ℃烘箱中烘干48 h,测定生物量。根系晾干后放入10号自封袋,用于根系扫描(Epson Twain Pro,加拿大)获得根系结构图像,再采用专业根系形态学和结构分析应用系统WINRhizo对根系表面积和体积等指标进行统计分析。完成根系扫描后,将根系剪断放入信封中烘干,测定生物量。生物量测定完成后,将同一重复的8株苗木的根、茎分别混合后粉碎,过0.5 mm筛,称取0.2 g用于消煮。消煮采用H2SO4-H2O2法,利用UDK-152全自动定氮仪(意大利)测定全氮,采用钼锑抗比色法(8453原子分光光度计,德国)测定全磷,采用火焰光度法(AA220原子吸收分光光度计,美国)测定全钾。
2014和2015年11月中旬,幼树叶片枯黄脱落后,调查造林成活率及幼树高、地径。2015年11月取样,每个区组每个处理挖取生长较为一致3株幼树,将大块土小心抖落,放入大塑料袋中,带回实验室。将根系洗干净,与茎分开,剪断后收入信封,放入70 ℃烘箱中烘干48 h,测定生物量。生物量测定完成后,将同一区组相同处理的3株幼树根和茎混合、粉碎、消煮,测定氮、磷、钾浓度,具体测定方法同上,并计算幼树从土壤中吸收的养分含量,计算公式为:
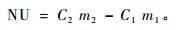
|
(1) |
式中:NU为幼树从土壤中吸收的养分数量(mg),C1和C2分别苗圃期幼苗的养分浓度和造林后幼树的养分浓度(g·kg-1),m1和m2分别为苗圃期幼苗的单株生物量和造林后幼树的单株生物量(g)。
1.4 数据分析先将单株测定的苗(幼树)高、地径及生物量等指标按照重复或者区组计算出平均数,利用SPSS17.0软件对试验数据进行分析。采用一般线性模型(general linear model,GLM)的Univariate方法进行方差分析。若交互效应显著,比较处理组合;若交互效应不显著,比较容器类型和胚根短截主效应。当方差分析差异显著时,采用Duncan多重比较方法(α=0.05)。利用Pearson相关分析法对苗圃阶段根系结构(表面积和体积)、生长和养分指标与造林后的相应指标进行分析,确定苗木质量与造林效果的相关性。利用SigmaPlot软件(Systat Software公司,美国)作图。
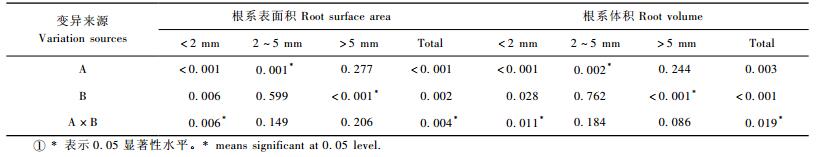
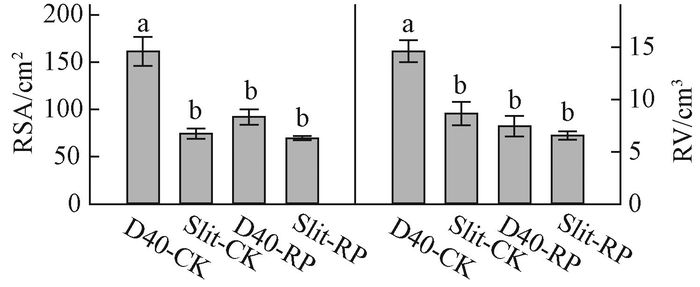
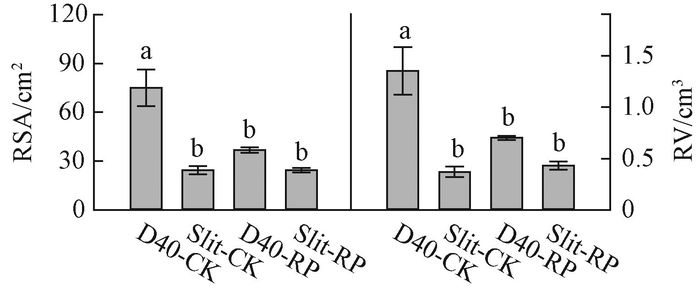
2 结果与分析 2.1 容器类型和胚根短截对栓皮栎苗木质量的影响 2.1.1 容器类型和胚根短截对栓皮栎苗木根系结构的影响容器类型和胚根短截的交互作用对栓皮栎容器苗根系总表面积和总体积影响显著(表 2),其中D40-CK处理的根系总表面积和总体积显著高于其他处理(图 1)。从径级分布来看,<2 mm径级根系表面积和体积显著受交互作用的影响(表 2),D40-CK处理组合<2 mm径级根系表面积和体积显著高于其他处理(图 2)。容器类型主效应对2~5 mm径级根系表面积和体积具有显著影响,D40处理显著高于Slit,D40处理的表面积和体积分别是Slit处理的2.2和2.3倍(表 2,图 3)。>5 mm径级根系表面积和体积显著受胚根短截主效应的影响,胚根短截处理显著低于不短截对照(表 2,图 3)。
|
|
|
图 1 容器类型和胚根短截交互作用下栓皮栎苗木的根系表面积和体积 Fig.1 Interaction of container type and radicle pruning on total root surface area and volume of Q. variabilis seedlings RSA:根系表面积;RV:根系体积。不同字母表示处理组合间存在显著差异(α=0.05)。下同。 RSA: Root surface area; RV: Root volume. Different letters differ statistically at α=0.05. The same below. |
|
图 2 容器类型和胚根短截交互作用下栓皮栎苗木<2 mm的根系表面积和体积 Fig.2 Interaction of container type and radicle pruning on root surface area and volume for root diameter classes < 2 mm of Q. variabilis seedlings |

|
图 3 不同容器类型和胚根短截处理栓皮栎苗木2~5 mm和>5 mm的根系表面积和体积 Fig.3 Main effects of container type and radicle pruning on root surface area and volume for root diameter classes 2~5 mm and >5 mm of Q. variabilis seedlings |
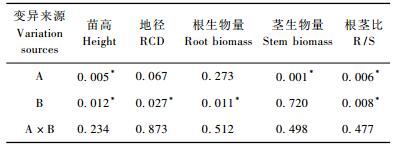
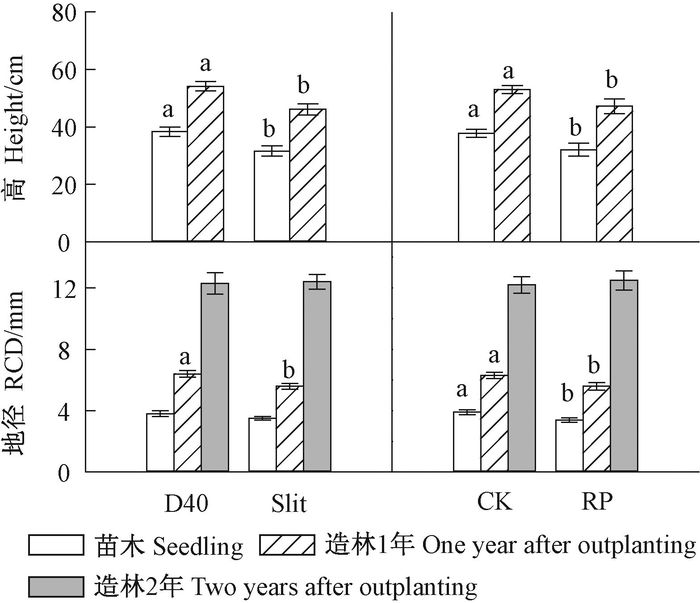
容器类型和胚根短截的交互作用对苗高、地径等生长指标均无显著影响(表 3)。容器类型和胚根短截的主效应都对苗高有显著影响(表 3),D40处理显著高于Slit处理,不短截对照显著高于胚根短截处理(图 4)。地径显著受胚根短截主效应的影响(表 3),同样是不短截对照显著高于胚根短截处理(图 4)。根生物量显著受胚根短截主效应影响(表 3),不短截对照显著高于胚根短截处理(图 5)。容器类型主效应显著影响茎生物量(表 3),D40处理显著高于Slit(图 5)。根茎比显著受容器类型和胚根短截2个主效应影响(表 3),表现为D40处理显著低于Slit处理,不短截对照显著高于胚根短截处理(图 5)。
|
|
|
图 4 不同容器类型和胚根短截处理栓皮栎苗木(幼树)高、地径 Fig.4 Main effects of container type and radicle pruning on height and RCD of Q. variabilis seedlings(saplings) |

|
图 5 不同容器类型和胚根短截处理栓皮栎苗木(幼树)生物量 Fig.5 Main effects of container type and radicle pruning on biomass of Q. variabilis seedlings(saplings) RDM:根生物量; SDM:茎生物量; R/S:根茎比。 RDM:Root biomass; SDM: Stem biomass; R/S: Root to stem ratio. |
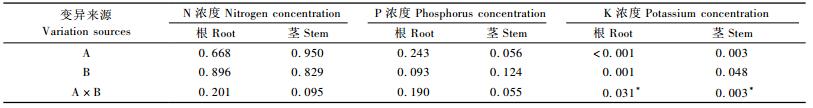
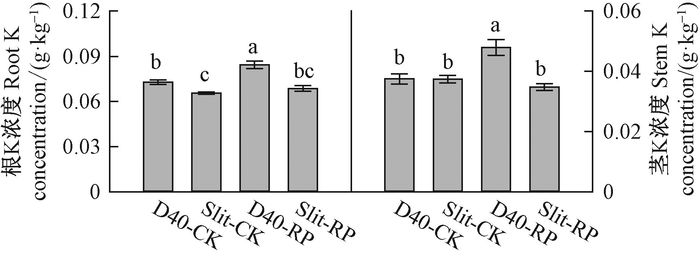
不同容器类型和胚根短截处理的苗木均采用相同育苗基质,施肥量和施肥次数也保持一致,但各处理对肥料的吸收存在差异。容器类型和胚根短截的交互作用对苗木K浓度有显著影响(表 4),表现为D40-RP组合显著高于其他组合,此外D40-CK组合的根K浓度显著高于Slit-CK组合(图 6)。容器类型和胚根短截对苗木N和P浓度没有显著影响。
|
|
|
图 6 容器类型和胚根短截交互作用下栓皮栎苗木根、茎K浓度 Fig.6 Interaction of container type and radicle pruning on root and stem K concentration of Q. variabilis seedlings in nursery |
不同容器类型和胚根短截处理对造林1年后的成活率无显著差异(表 5),平均成活率为89.3%。与苗圃阶段一致,造林1年后的幼树高显著受容器类型和胚根短截主效应的影响(表 5),D40处理高于Slit处理,不短截对照高于胚根短截处理(图 4)。容器类型和胚根短截的主效应对造林1年后的幼树地径也有显著影响,D40处理高于Slit处理,对照高于胚根短截处理(图 4)。
|
|
胚根短截主效应显著影响造林2年后的成活率(表 5),不短截对照成活率显著高于胚根短截处理(图 7)。胚根短截主效应还显著影响造林2年后幼树的根生物量(表 5),效应与苗圃阶段相反,胚根短截处理显著高于不短截对照(图 5)。

|
图 7 不同容器类型和胚根短截处理栓皮栎造林成活率 Fig.7 Main effects of container type and radicle pruning on survival of Q. variabilis seedlings |
容器类型和胚根短截的交互作用对造林2年后栓皮栎幼树的养分浓度均无显著影响。容器类型主效应仅显著影响幼树根K浓度(表 6),Slit处理根K浓度显著高于D40处理(图 8)。试验处理对其他养分浓度均无显著影响。
|
|

|
图 8 不同容器类型和胚根短截处理栓皮栎幼树造林2年后的根K浓度 Fig.8 Main effects of container type and radicle pruning on root K concentration of Q. variabilis saplings at the end of the second outplanting season |
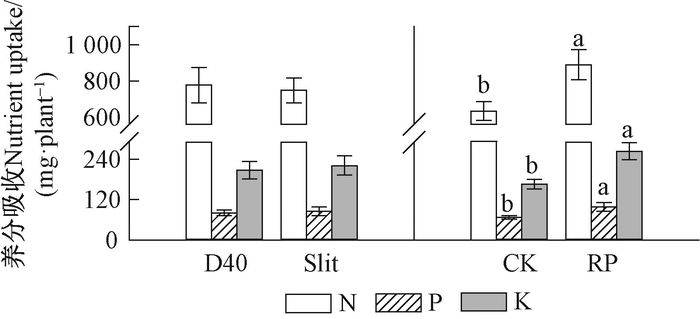
造林2年后,栓皮栎幼树从土壤中吸收的N、P、K数量均受胚根短截主效应的显著影响(表 6),表现为胚根短截处理显著高于不短截对照(图 8)。
|
图 9 不同容器类型和胚根短截处理栓皮栎幼树造林2年后从土壤中吸收的养分数量 Fig.9 Main effects of container type and radicle pruning on nutrient content uptake from soil of Q. variabilis saplings at the end of the second outplanting season |
容器类型和胚根短截对栓皮栎容器苗根系结构和生长作用规律不同。侧壁裂缝的Slit容器具有较强的空气修根效果,抑制了2~5 mm径级根系发育;同时发现,该容器抑制地上部分生长(苗高和茎生物量),而对根系生物量无影响,苗木根茎比提高。辐射松(Pinus radiata)在侧壁裂缝的硬质容器(PF200) 也出现相似现象(Ortega et al., 2006),但采用空气修根效果好的无纺布容器(Jiffy)培育北美短叶松(Pinus banksiana)时却发现,Jiffy容器抑制根系生长,促进生物量向地上部分分配,苗木根茎比下降(Chapman et al., 2006)。这些研究表明容器类型能有效调控生物量的分配,但具体分配方式还受容器材质的影响(硬塑料和无纺布)。胚根短截的种子播种至细长的硬质容器后发现,胚根短截的种子较胚根未短截的种子抑制>5 mm径级粗根发育,且不利于苗圃阶段苗木生长。但胚根短截的种子播种到黑塑料膜容器(H:20 cm,D:8 cm,V:1 050 mL)中并未发现粗根发育和地上部分生长受抑(Liu et al., 2016),表明胚根短截的效果除受容器材质(硬塑料和黑塑料膜)影响外,容器口径也可能引起胚根短截的效果差异,因为较大的横向空间有利于根系发育和地上部分生长。
3.2 容器类型和胚根短截对栓皮栎造林初期效果的影响容器类型和胚根短截对栓皮栎造林初期的生长影响不同。D40容器培育的苗木初始规格较大,造林第1年后这种优势依然保持,表明初始规格大的苗木造林后具有较强的竞争能力(Jacobs et al., 2005b;Dumroese et al., 2011)。初始苗高、地径与造林第1年的幼树高、地径显著相关,相关系数分别达到0.956和0.713,而造林第2年的幼树高、地径与初始苗木规格和造林第1年的幼树规格都不相关,因此大规格苗木在造林第2年优势消失,这可能与造林地气象因素有关。该造林地位于我国华北地区,属于大陆性季风气候类型,主要降雨集中在夏季5—8月,冬春季节干旱多风,季节性干旱突出。第1年造林效果调查为造林当年的11月,幼树并未经历季节性干旱,因此苗圃期的生长优势得以体现;造林第2年幼树经历从冬季到春季的季节性干旱,土壤水分作为首要限制因子影响幼树生长(Wang et al., 2015)。D40容器培育的苗木根茎比较小,在这种干旱立地条件下,根系对土壤水分的吸收与地上部分的蒸腾散失不能平衡(Grossnickle, 2005),苗木初始规格优势在造林第2年调查时丧失,而Slit容器培育的苗木根茎比大,更适合干旱立地造林。在造林2年后,此消(D40容器)彼长(Slit容器)使得2种苗木规格趋于一致。胚根短截在造林2年后虽然成活率降低,但促进根系生长和养分吸收,表明胚根短截的苗木造林后,特别是经历季节性干旱后幼树生长优势在逐渐显现,多主根的根系结构可能更有利于促进造林效果,但还需要进一步持续观测,以客观评价胚根短截的效应。原因在于,根系生物量和养分状态直接影响造林效果(Grossnickle, 2005; Oliet et al., 2013; Villar-Salvador et al., 2015)。
需要指出的是,Slit容器在育苗过程中根系会卡到容器的裂缝中,造林时难以取出苗木,根系容易受损,容器也易损坏,可回收再利用率低;容器侧壁的裂缝,加快水分散失速率,育苗耗水量和灌溉人工成本也较高。因此,从经济角度和便捷性来看,D40容器更适合栓皮栎容器苗的培育。胚根短截在操作上需要浪费一定的人力,从目前苗圃和造林2年的试验结果来看,胚根短截后苗木初始规格小,造林第2年成活率下降;虽然造林2年后根生物量增大和养分吸收能力增强,但是否能促进后期造林效果还尚未得知。
4 结论1) 容器类型和胚根短截的交互作用影响苗圃阶段根系结构和养分浓度,验证了将2种育苗方式组合研究的必要性。D40-CK组合促进<2 mm径级根系发育,并提高根系总表面积和体积,而D40-RP组合有利于苗木K浓度提高。
2) D40容器有利于2~5 mm径级根系发育和地上部分生长,但苗木根茎比低;造林1年后,D40容器依然促进幼树高和地径生长;造林2年后,促进作用消失。
3) 胚根短截抑制>5 mm径级根系发育,对苗高、地径和根生物量都有负面影响;造林1年后,对幼树高和地径的抑制作用依然存在;造林2年后,成活率降低,但促进根系生长和养分吸收。
4) 综合苗圃和2年造林试验结果,结合生产实际,Slit容器育苗耗水量大且根系易穿入容器;胚根短截操作复杂,尚没有全自动的机械化设备,因此培育主根发达树种栓皮栎的最佳组合为D40容器和胚根不短截。
| [] |
李国雷, 刘勇, 祝燕, 等. 2012. 国外容器苗质量调控技术研究进展. 林业科学, 48(8): 135–142.
( Li G L, Liu Y, Zhu Y, et al. 2012. A review on the abroad studies of techniques in regulating quality of container seedling. Scientia Silvae Sinicae, 48(8): 135–142. DOI:10.11707/j.1001-7488.20120822 [in Chinese] ) |
| [] |
林志鹏. 2000. 切根育苗对马尾松苗木及幼林生长的效应. 西南林学院学报, 20(4): 196–199.
( Lin Z P. 2000. Effect of radicle pruning on Pinus massoniana seedlings and young forest growth. Journal of Southwest Forestry College, 20(4): 196–199. [in Chinese] ) |
| [] |
刘永生, 旷天水. 2008. 闽楠芽苗截根移栽育苗技术. 现代农业科技(20): 30–31.
( Liu Y S, Kuang T S. 2008. Technique of radicle pruning transplanting on Phoebe bournei. Modern Agricultural Science and Technology(20): 30–31. DOI:10.3969/j.issn.1007-5739.2008.20.017 [in Chinese] ) |
| [] |
罗盛健. 2006. 湿地松切根育苗及其造林对比试验. 防护林科技(4): 22–24, 27.
( Luo S J. 2006. Comparison experiment for planting and seedling-raising of Pinus elliottii with excised roots. Protection Forest Science and Technology(4): 22–24, 27. [in Chinese] ) |
| [] |
罗伟祥, 张文辉, 黄一钊, 等. 2009. 中国栓皮栎. 北京, 中国林业出版社.
( Luo W X, Zhang W H, Huang Y Z, et al. 2009. Quercus variabilis in China. Beijing, China Forestry Publishing House. [in Chinese] ) |
| [] |
田吉, 王林, 张芸香, 等. 2016. 育苗容器对一年生文冠果苗木生长和根发生的影响. 山西农业大学学报, 36(7): 500–505.
( Tian J, Wang L, Zhang Y X, et al. 2016. Effect of seedling container on the growth and root occurrence of annual Xanthoceras sorbifolia Bunge seedlings. Journal of Shangxi Agricultural University, 36(7): 500–505. [in Chinese] ) |
| [] |
王金旺, 卢翔, 夏海涛, 等. 2015. 容器类型和规格对容器苗生长的影响. 浙江农业科学, 56(7): 1032–1036, 1041.
( Wang J W, Lu X, Xia H T, et al. 2015. Effect of container type and size on growth of container seedlings. Zhejiang Nongye Kexue, 56(7): 1032–1036, 1041. [in Chinese] ) |
| [] |
王琰, 刘勇, 李国雷, 等. 2016. 容器类型及规格对油松容器苗底部渗灌耗水规律及苗木生长的影响. 林业科学, 52(6): 10–17.
( Wang Y, Liu Y, Li G L, et al. 2016. Effects of container types and sizes on water consumption and growth of containerized Pinus tabulaeformis seedlings under sub-irrigation. Scientia Silvae Sinicae, 52(6): 10–17. [in Chinese] ) |
| [] |
郑坚, 陈秋夏, 王金旺, 等. 2016. 不同育苗容器对木荷生理生长及造林效果的影响. 西南林业大学学报, 36(4): 53–58.
( Zheng J, Chen Q X, Wang J W, et al. 2016. The influence of different container on physical growth and afforestation effects of Schima superba container seedlings. Journal of Southwest Forestry University, 36(4): 53–58. [in Chinese] ) |
| [] | Bonner F T. 1982. The effect of damaged radicles of presprouted red oak acorns on seedling production. Tree Planters' Notes, 33(4): 13–15. |
| [] | Chapman K A, Colombo S J. 2006. Early root morphology of jack pine seedlings grown in different types of container. Scandinavian Journal of Forest Research, 21(5): 372–379. DOI:10.1080/02827580600981888 |
| [] | Chirino E, Vilagrosa A, Hernández E I, et al. 2008. Effects of a deep container on morpho-functional characteristics and root colonization in Quercus suber L. seedlings for reforestation in Mediterranean climate. Forest Ecology and Management, 256(4): 779–785. |
| [] | Davis A S, Jacobs D F. 2005. Quantifying root system quality of nursery seedlings and relationship to outplanting performance. New Forest, 30: 295–311. DOI:10.1007/s11056-005-7480-y |
| [] | Devine W D, Harrington C A, Southworth D. 2009. Improving root growth and morphology of containerized Oregon white oak seedlings. Tree Planters' Notes, 53(2): 29–34. |
| [] | Dominguez-Lerena S, Herrero Sierra N, Carrasco Manzano I, et al. 2006. Container characteristics influence Pinus pinea seedling development in the nursery and field. Forest Ecology and Management, 221(1/3): 63–71. |
| [] | Dumroese R K, Davis A S, Jacobs D F. 2011. Nursery response of Acacia koa seedlings to container size, irrigation method, and fertilization rate. Journal of Plant Nutrition, 34: 877–887. DOI:10.1080/01904167.2011.544356 |
| [] | Ertas A. 2002. Effect of radicle clipping on sessile oak (Quercus petraea Lieb.) seedling's root surface area and number of taproots//Proceedings of the Third Balkan Scientific Conference, 2: 159-164. |
| [] | Gordon W S, Jackson R B. 2000. Nutrient concentrations in fine roots. Ecology, 81(1): 275–280. DOI:10.1890/0012-9658(2000)081[0275:NCIFR]2.0.CO;2 |
| [] | Grossnickle S C. 2005. Importance of root growth in overcoming planting stress. New Forest, 30(2/3): 273–294. |
| [] | Jacobs D F, Salifu K F, Seifert J R. 2005a. Growth and nutritional response of hardwood seedlings to controlled-release fertilization at outplanting. Forest Ecology and Management, 214(1): 28–39. |
| [] | Jacobs D F, Salifu K F, Seifert J R. 2005b. Relative contribution of initial root and shoot morphology in predicting field performance of hardwood seedlings. New Forests, 30(2): 235–251. |
| [] | Landis T D.1990. Containers: types and functions//Landis T D, Tinus R W, McDonald S E, et al. Container tree nursery manual:volume 2. Washington, DC: USDA, Forest Service, 1-39. |
| [] | Liu J J, Bloomberg M, Li G L, et al. 2016. Effects of copper root pruning and radicle pruning onfirst-season field growth and nutrient status of Chinese cork oak seedlings. New Forests, 47(5): 715–729. DOI:10.1007/s11056-016-9540-x |
| [] | Luis V C, Llorca M, Chirino E, et al. 2010. Differences in morphology, gas exchange and root hydraulic conductance before planting in Pinus canariensis seedlings growing under different fertilization and light regimes. Trees, 24(6): 1143–1150. DOI:10.1007/s00468-010-0490-1 |
| [] | Mariotti B, Maltoni A, Jacobs D F, et al. 2015. Container effects on growth and biomass allocation in Quercus robur and Juglans regia seedlings. Scandinavian Journal of Forest Research, 30(5): 401–415. |
| [] | McCreary D D. 1996. The effects of stock type and radicle pruning on blue oak morphology and field performance. Annals of Forest Science, 53(2/3): 641–648. |
| [] | Oliet J A, Puértolas J, Planelles R, et al. 2013. Nutrient loading of forest tree seedlings to promote stress resistance and field performance: a Mediterranean perspective. New Forests, 44(5): 649–669. DOI:10.1007/s11056-013-9382-8 |
| [] | Ortega U, Majada J, Mena-Petite, et al. 2006. Field performance of Pinus radiata D. Don produced in nursery with different types of containers. New Forests, 31(1): 97–112. |
| [] | Poorter H, Bühler J, van Dusschoten D, et al. 2012. Pot size matters: a meta-analysis of the effects of rooting volume on plant growth. Functional Plant Biology, 39(11): 839–850. DOI:10.1071/FP12049 |
| [] | Rune G. 2003. Slit in container wall improve root structure and stem straightness of outplanted scots pine seedlings. Silva Fennnica, 37(3): 333–342. |
| [] | Tilki F, Alptekin C U. 2006. Germination and seedling growth of Quercus vulcanica: effect of srratification, desiccation, radicle pruning, and season of sowing. New Forests, 32(3): 243–251. DOI:10.1007/s11056-006-9001-z |
| [] | Tsakaldimi M, Zagas T, Tsitsoni T, et al. 2005. Root morphology, stem growth and field performance of seedlings of two Mediterranean evergreen oak species raised in different container types. Plant and Soil, 278(1/2): 85–93. |
| [] | Villar-Salvador P, Puertolas J, Cuesta B, et al. 2012. Increase in size and nitrogen concentration enhances seedling survival in Mediterranean plantations:Insights from an ecophysiological conceptual model of plant survival. New Forest, 43(5/6): 755–770. |
| [] | Villar-Salvador P, Uscola M, Jacobs D F. 2015. The role of stored carbohydrates and nitrogen in the growth and stress tolerance of planted forest trees. New Forests, 46(5): 813–839. |
| [] | Wang J X, Li G L, Pinto J R, et al. 2015. Both nursery and field performance determine suitable nitrogen supply of nursery-grown, exponentially fertilized Chinese pine. Silva Fennica, 49(3): 1–13. |
 2017, Vol. 53
2017, Vol. 53