文章信息
- 赵培平, 姜培坤, 孟赐福, 何珊琼
- Zhao Peiping, Jiang Peikun, Meng Cifu, He Shanqiong
- 中国亚热带4种林分类型凋落叶分解过程中13C NMR波谱特征
- Changes in 13C NMR Spectroscopy of Leaf-Litter during The Decomposition in Four Subtropical Forest Types in Southern China
- 林业科学, 2017, 53(6): 127-134.
- Scientia Silvae Sinicae, 2017, 53(6): 127-134.
- DOI: 10.11707/j.1001-7488.20170615
-
文章历史
- 收稿日期:2015-09-08
- 修回日期:2017-05-24
-
作者相关文章
2. 浙江省森林生态系统碳循环与固碳减排重点实验室 临安 311300
2. Zhejiang Provincial Key Laboratory of Carbon Cycling in Forest Ecosystems and Carbon Sequestration Lin'an 311300
森林凋落物分解是陆地生态系统中生物地球化学循环的重要过程之一(Attiwill et al., 1993)。减缓凋落物的分解速率可有效提高森林生态系统有机碳库和营养库,且凋落物的数量、质量和分解速率对土壤质量的维持和全球气候的调节有至关重要的作用。凋落物的分解速率主要受气象因素(Aerts et al., 1997)和基质质量的影响(Rovira et al., 2007;Meentemeyer et al., 1978)。气象因素中的温度和水有效性被认为是最重要的因素(Aerts et al., 1997)。凋落叶作为森林地表凋落物的重要组成部分,在整个森林生态系统中扮演着重要角色。研究表明,在森林凋落物各组分中,凋落叶分解速率均高于其他组分(Lemma et al., 2007; Freschet et al., 2012; Birouste et al., 2012),同时在凋落物总量中,凋落叶所占比例也高于其他组分(李正才等,2010;郭婧等,2015)。深入开展森林凋落叶基质质量和分解过程研究,对认识凋落叶分解机制具有重要意义。
以往通常用C含量、N含量、C/N比等传统指标来表征凋落物的分解过程(Freschet et al., 2012;李忠文等,2013),但这些指标不能反映凋落叶分解过程中不同结构碳化合物含量的变化。13C NMR技术(核磁共振)具有非破坏性和可半定量分析等特点,可以更精准表征有机物不同碳组分特征(Gerzabek et al., 2006)。近年来也不断有学者将其成功用于表征不同结构碳化合物的相对含量(Zhang et al., 2013; 李今今等,2015;毛霞丽等,2015),该技术被认为是监测凋落叶分解过程中不同结构碳组分(烷基碳、烷氧碳、芳香碳及羰基碳)变化特征的一种有效手段(Almendros et al., 2000;Preston et al., 2000;Mathers et al., 2007),在深入了解凋落叶分解机制中将发挥重要作用。
本研究选取中国亚热带4种林分类型:毛竹(Phyllostachys edulis)人工林、马尾松(Pinus massoniana)天然次生林、杉木(Cunninghamia lanceolata)人工林和青冈(Cyclobalanopsis glauca)天然次生林为研究对象,监测各林分类型凋落叶分解过程中全C、全N含量及不同结构碳组分(烷基碳、烷氧碳、芳香碳和羰基碳)相对含量的变化特征;探讨C、N含量,C/N比,不同结构碳组分相对含量与凋落叶质量残存率间的关系;比较分析用传统指标(C含量、N含量、C/N比等)和采用13C NMR波谱技术来表征凋落叶分解过程的优劣。以期为深入认识凋落叶分解机制提供理论依据。
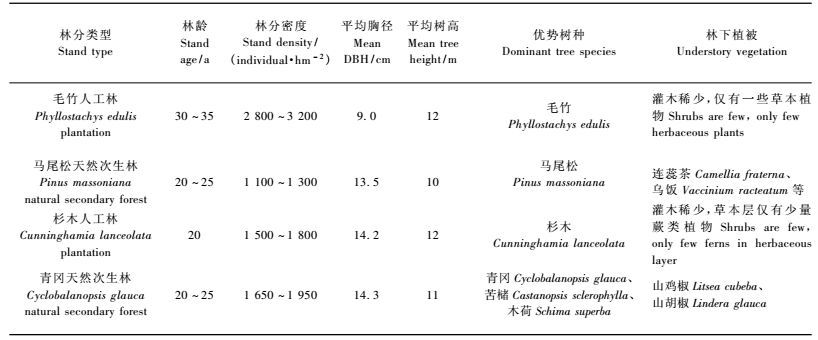
1 研究区概况研究区位于临安市玲珑山(119°42′E, 30°14′N),此地为典型的亚热带季风气候,年均气温15.9 ℃,极端最高气温41.7 ℃,极端最低气温-13.3 ℃,年均有效积温5 774 ℃,年均降水量1 424 mm,年均日照时数1 774 h,全年无霜期236天,海拔83 m,土壤类型为红壤。原生植被为北亚热带常绿阔叶林。本研究所选4种林分为毛竹人工林、马尾松天然次生林、杉木人工林和青冈天然次生林。林分概况见表 1。
|
|
对4种林分类型分别设置3块20 m×20 m样地,共计12块。2013年11月,在每块样地分别收集未分解凋落物样品,剔除凋落物样品中的枯枝、果实、泥沙、动植物残体等杂物,只保留凋落叶。将收集的凋落叶样品小心带回实验室,于室内通风阴凉处风干处理2周后,每一块样地收集的样品充分混匀,保存完好,留待分装分解袋。为保证凋落叶样品物理化学性质与自然状态下尽量一致,整个处理过程中应避免用力揉搓,避免高温处理。
2.2 分解袋的制作、布置及收集选用2 mm孔径的尼龙网布制作凋落叶分解袋(25 cm × 40 cm)。将已处理好的凋落叶样品小心分装在分解袋中,每袋分装80.00 g。每种林分分装36个标准袋,4种林分共144个分解袋。2013年12月21日在每块样地中布置相同林分凋落叶的12个分解袋,分解袋随机投放,确保在样地中均匀分布。分解袋应保证与土壤表面充分接触,具体做法为:将土壤表层凋落物清理干净,使分解袋紧贴于土壤表层,并用竹制铆钉牢牢固定,以保证分解袋中凋落叶样品能有与土壤微生物充分接触的机会。
2014年1月21日开始收集分解袋,记为第1次收集,以后每月21号收集1次,截至2014年12月21日,共收集12次。每次每块样地收集1个分解袋。清理掉已收集分解袋表面的非样品杂物,将其轻放于布袋之中,带回实验室进行风干处理。将分解袋中的残余凋落叶取出,于80 ℃烘干至恒质量,粉碎后于室温保存,留待分析。
2.3 样品分析所有凋落叶样品全C和全N含量用ElementarVario MAX CN碳氮元素分析仪(德国Elementar公司)测定。通过核磁共振仪(AVANCEⅡ300MH,布鲁克公司)测定所有凋落叶样品中Alky1 C(烷基碳,δ为0~46)、O~alky1 C(烷氧碳,δ为46~110)、Aromatic C(芳香碳,δ为110~160) 和Aarbony1 C(羰基碳,δ为160~220) 等各官能团碳波谱,具体为采用固态13C-交叉极化魔角旋转技术,转子直径为7 mm,光谱频率为75.5 MHz,旋转频率为5 000 Hz,接触时间为2 ms,循环延迟时间为2.5 s,核磁共振功能基团面积积分用MestReC软件进行(Zhang et al., 2013)。
2.4 数据处理数据处理采用SPSS19.0进行,采用单因素方差分析(one-way-ANOVA)和多重比较(LSD)检验不同林分类型凋落叶基质质量、碳组分和凋落叶质量残存率间的差异。采用Spearman相关分析法分析凋落叶中各官能团碳组分与凋落叶基质质量、质量残存率之间的关系。用Origin8.0进行作图。
3 结果与分析 3.1 凋落叶质量残存率随分解时间的动态变化在为期12个月的分解过程中,凋落叶质量残存率随时间的推移逐渐下降,且不同林分凋落叶间是有差异的(图 1)。各林分凋落叶经过12个月的分解后,其质量损失率表现为青冈天然次生林(53.80%)>马尾松天然次生林(52.69%)>杉木人工林(48.31%)>毛竹人工林(41.17%),除青冈天然次生林和马尾松天然次生林与毛竹人工林间差异显著(P<0.05) 外,其余林分间均无显著性差异。
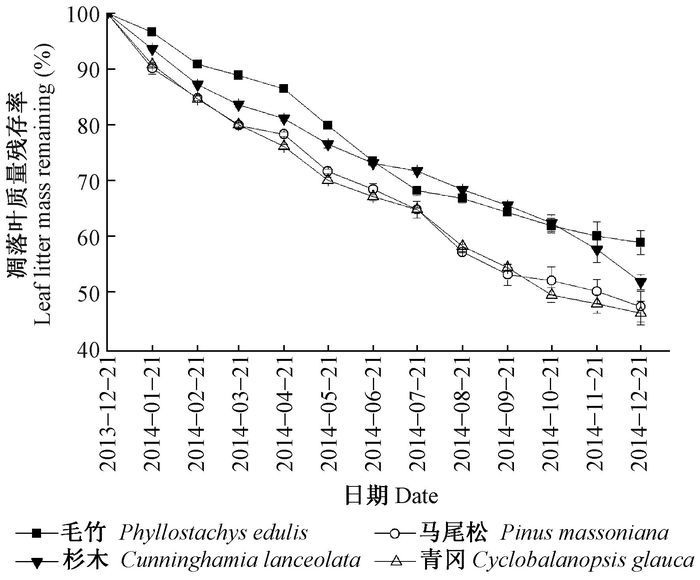
|
图 1 4种林分凋落叶质量残存率随分解时间的变化 Fig.1 Changes of the leaf litter mass remaining ratio from four stand types with decomposition time |
4种林分凋落叶中的起始C含量表现为青冈天然次生林(53.91%)>杉木人工林(52.16%)>马尾松天然次生林(51.26%)>毛竹人工林(40.07%),起始N含量表现为毛竹人工林(1.30%)>青冈天然次生林(1.08%)>马尾松天然次生林(1.03%)>杉木人工林(0.68%),起始C/N比表现为杉木林(77.74)>马尾松林(53.09)>青冈林(50.05)>毛竹林(30.12)(图 2)。
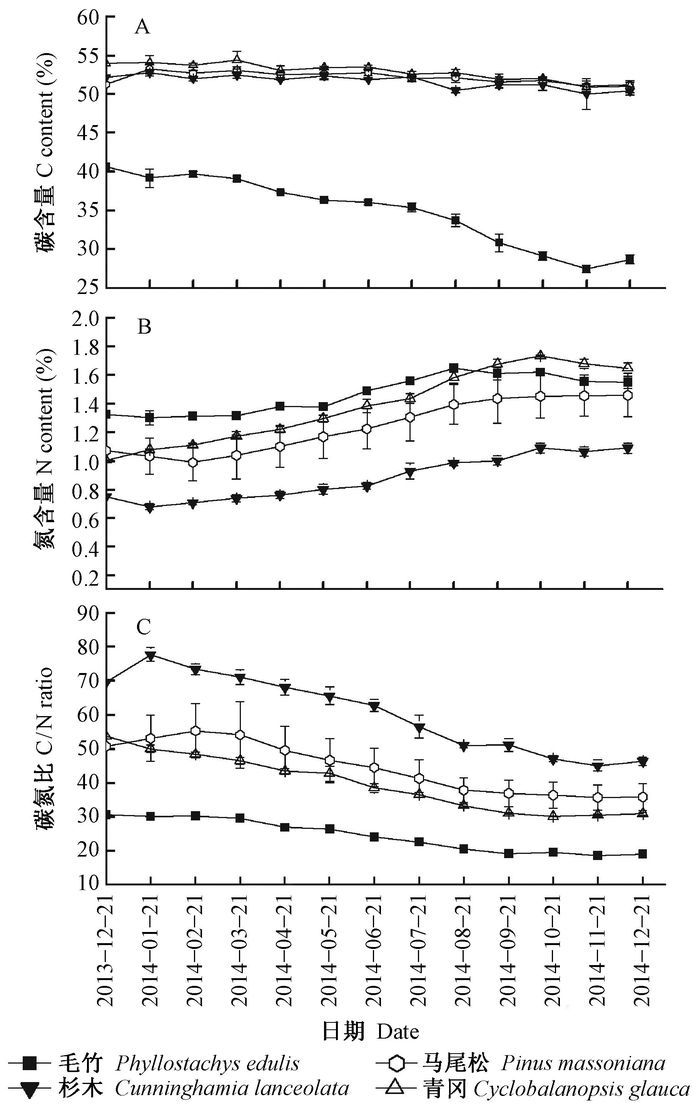
|
图 2 4种森林凋落叶分解过程中C含量、N含量及C/N比的变化 Fig.2 Changes in the concentrations of total C and total N, as well as C/N ratio in the leaf litters collected from four forest stand types with the decomposition process |
4种林分凋落叶分解过程中C,N含量和C/N比动态变化见图 2。凋落叶C含量随分解时间进行而降低,降低率为0.04~0.27,且毛竹人工林凋落叶C含量降低率(0.27) 显著高于青冈天然次生林(0.06)、马尾松天然次生林(0.038) 和杉木人工林(0.044)(P<0.05);凋落叶N含量随分解时间的进行而增加,增加率为0.018~0.60,其中杉木人工林(0.60) 和青冈天然次生林(0.53) 凋落叶N含量增加率显著大于马尾松天然次生林(0.21) 和毛竹人工林(0.18)(P<0.05);凋落叶C/N比随着分解时间的进行而降低,降低率表现为毛竹人工林(0.58)>马尾松天然次生林(0.48)>杉木人工林(0.41)>青冈天然次生林(0.38)。
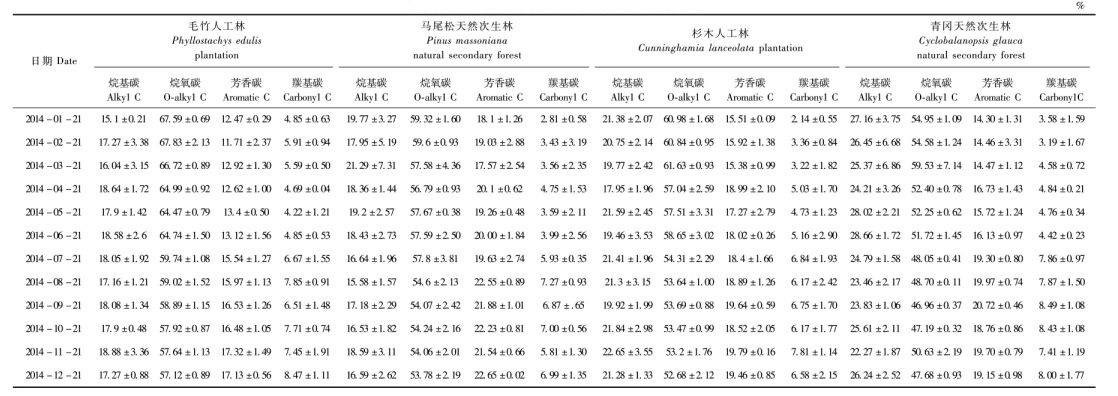
3.3 凋落叶中不同碳组分在13CNMR波谱中的相对含量随分解时间的变化4种森林凋落叶起始13C NMR波谱特征如图 3所示,均包含4个明显共振区,即烷基碳区(δ为0~46)、烷氧碳区(δ为46~110)、芳香碳区(δ为110~160) 和羰基碳区(δ为160~220)。
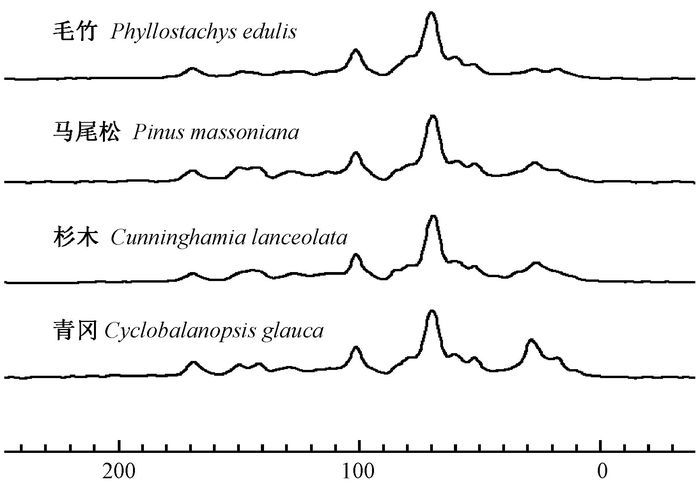
|
图 3 4种林分凋落叶在分解起始时13C NMR波谱 Fig.3 13C NMR spectra of leaf litter materials from four stand types at the beginning of decomposition |
从不同碳组分来看,在分解过程中,4种林分凋落叶中不同碳组分相对含量有很大差异,表现为烷氧碳(54.95%~67.59%)>烷基碳(15.10%~27.16%)>芳香碳(12.47%~18.10%)>羰基碳(2.14%~4.85%)(表 2)。分解过程中,烷氧碳的相对含量明显减少(9.34%~15.48%),芳香碳的相对含量明显增加(25.14%~37.37%),羰基碳的相对含量显著增加(0.75~2.08倍),烷基碳则有增有减。
|
|
在分解过程中,烷基碳的相对含量以青冈天然次生林凋落叶最大,杉木人工林凋落叶次之,毛竹人工林和马尾松天然次生林凋落叶最小;烷氧碳的相对含量以毛竹人工林凋落叶最大,杉木人工林和马尾松天然次生林凋落叶次之,青冈天然次生林凋落叶最小;芳香碳的相对含量表现为马尾松天然次生林>杉木人工林>青冈天然次生林>毛竹人工林;羰基碳的相对含量在各林分凋落叶间没有显著性差异。
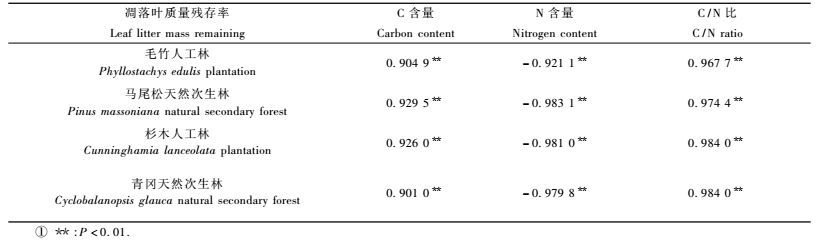
3.4 凋落叶中全C含量、N含量和C/N比与凋落叶质量残存率间的相关性4种林分凋落叶的C含量和C/N比与其质量残存率均极显著正相关(P<0.01),N含量则与凋落叶质量残存率极显著负相关(P<0.01)(表 3)。凋落叶N含量与凋落叶质量残存率间的相关系数(r=0.921 1~0.983 1) 大于C含量与质量残存率间的相关系数(r=0.901 0~0.929 5)。
|
|
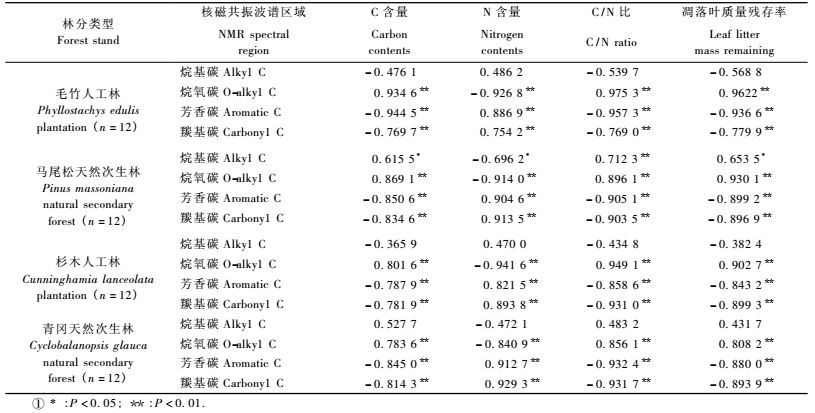
表 4表明:4种林分凋落叶的烷氧碳、芳香碳和羰基碳的相对含量与C含量、N含量、C/N比和凋落叶质量残存率均极显著相关(P<0.01, n=12);除了马尾松天然次生林,其他林分凋落叶的烷基碳相对含量与C含量、N含量、C/N比和凋落叶质量残存率均相关性不显著。
|
|
凋落物的分解受物理、化学、生物等因子的综合控制(Cornelissen, 1996;Tian et al., 2002),其中凋落物基质质量、环境因子和分解者群落的组成与结构是影响森林凋落物分解速率的主要因素。C,N含量等是评价凋落物基质质量的重要指标,C/N比在一定程度上决定着凋落叶降解的难易程度(郭伟等,2009)。
从凋落叶基质质量来看,在分解过程中,高C/N比的凋落物中耐分解化合物的相对含量较多,阻碍凋落物降解。相反,低C/N比加速凋落物降解。本研究中,4种凋落叶分解过程中的C/N比表现为:杉木人工林>马尾松天然次生林>青冈天然次生林>毛竹人工林,表明毛竹人工林和青冈天然次生林凋落叶更易降解。分解过程中,凋落叶质量残存率与其C含量和C/N比极显著正相关,与其N含量极显著负相关,即凋落物C/N比越高时耐分解化合物含量越多;另外,N素能够增强微生物代谢活性和繁殖速度,从而导致凋落叶分解速度加快。这与前人研究结果(Coulson et al., 1978; Mendonca et al., 2003)一致。但已有研究表明,凋落物分解速率与C/N比的显著负相关只存在于分解初期(0~30天),而在中期(30~90天)和晚期(90~180天)则不成立(Bonanomi et al., 2014)。在分解开始时,高氮含量维持较大的微生物种群,迅速消耗了活性碳化合物,从而导致一个高的质量损失率;相反,在分解后期,高N浓度利于抗分解复合物(木质素)形成而抑制凋落叶质量损失(Taylor et al., 1989;Hatakka et al., 2000)。Berg等(2008)研究认为,叶中高N含量对木质素分解酶有抑制作用,从而抑制木质素分解、降低凋落物分解速率。
4.2 4种林分凋落叶中不同结构碳组分的动态变化与其分解过程降低凋落物分解速率可减少碳排放,有利于增加土壤碳库(Janzen et al., 2006),了解凋落物中结构性碳种类及其在分解过程中的变化和作用,对于土壤碳库管理有重要意义。前人研究表明,多糖是微生物降解的良好基质,在土壤中可被迅速降解(Abraham et al., 2008)。在天然有机化合物中,木质素和单宁是最抗分解的物质(Herman et al., 1997),因此,含有木质素和单宁的芳香碳可明显减缓凋落物分解。本研究中,4种森林凋落叶含有多糖C的烷氧碳的相对含量比烷基碳、芳香碳和羰基碳的相对含量大得多,且以毛竹人工林凋落叶的烷氧碳的相对含量最大(57.12%~67.83%),又因其芳香碳的相对含量最小(11.71%~17.32%),可推测,毛竹人工林凋落叶分解速率应当最大,与上节阐述结论一致。从凋落叶C/N比表现来看,与马尾松天然次生林、杉木人工林相比而言,青冈天然次生林凋落叶更易降解。而从不同结构碳组分来讲,青冈天然次生林凋落叶的烷氧碳相对含量最小,芳香碳相对含量与杉木人工林凋落叶差异不大,理论上讲杉木人工林凋落叶更易降解。另外,马尾松天然次生林与杉木人工林凋落叶中烷氧碳相对含量差异不大,但前者芳香碳相对含量明显大于后者,用降解速率表明为毛竹人工林>青冈天然次生林>马尾松天然次生林>杉木人工林。这表明用凋落叶C,N含量,C/N比和不同结构碳组分评价凋落叶分解过程的效果基本一致。
另外,Wang等(2004)研究结果显示,植物凋落物和细根的累积碳矿化率与最初的核磁共振光谱的芳基C和O-芳基C相对含量显著负相关(P<0.05)。而Poret等(2007)的研究却表明,N-烷基/甲氧基和碳水化合物C的相对含量分别与质量损失显著负相关和正相关(P<0.05)。本研究中,4种林分凋落叶中的烷氧碳的相对含量均随分解时间推移而减小,芳香碳和羰基碳的相对含量则不断增大;凋落叶中烷氧碳的相对含量与质量损失率极显著正相关(P<0.01),同凋落叶C/N比与质量损失率的关系相符。而芳香碳和羰基碳与质量损失率极显著负相关(P<0.01),与前人研究结果一致;除马尾松天然次生以外,凋落叶中烷基碳的相对含量与质量损失均无显著相关性。表明在总碳中,烷氧碳、芳香碳和羰基碳等对凋落叶分解起决定作用;也表明,与C,N含量和C/N比相比较而言,固态13C NMR波谱技术在探究凋落叶分解机制中具有明显优势。
本研究证实,传统指标和固态13C NMR波谱技术对凋落叶分解过程的评价结果基本一致,但后者可半定量地监测凋落叶分解过程中不同结构碳组分的变化,对深入认识凋落叶分解机制和过程具有积极意义。本研究支持了Bonanomi等(2013)研究的观点“相比较于传统指标C/N比和木质素/N比而言,用固态13C NMR技术预测凋落物衰减率效果有明显优势”。
本研究中尚有不足之处,如初始凋落叶的收集时间、凋落叶样品风干处理时间的长短、分解袋布置的位置等是否会影响分解结果尚不明确,将还需在后续的研究中不断完善试验方案,以期达到更接近真实的结果。
5 结论4种森林凋落叶中,青冈天然次生林凋落叶降解最快;在总碳中,烷氧碳、芳香碳和羰基碳等组分在凋落叶分解过程中起决定作用;采用C含量、N含量和C/N比等传统指标与采用13C NMR波谱技术评价凋落叶质量衰减率结果基本一致,但后者能半定量地监测凋落叶分解过程中不同形态碳组分的变化,从而更有利于深入认识凋落叶的分解机制与过程。
| [] |
郭婧, 喻林华, 方晰, 等. 2015. 中亚热带4种森林凋落物量、组成、动态及其周转期. 生态学报, 35(14): 4668–4677.
( Guo J, Yu L H, Fang X, et al. 2015. Litter production and turnover in four types of subtropical forests in China. Acta Ecologica Sinica, 35(14): 4668–4677. [in Chinese] ) |
| [] |
郭伟, 张健, 黄玉梅, 等. 2009. 森林凋落物影响因子研究进展. 安徽农业科学, 37(4): 1544–1546.
( Guo W, Zhang J, Huang Y M, et al. 2009. Research progress on the influencing factors of forest litter. Journal of Anhui Agricultural Science, 37(4): 1544–1546. [in Chinese] ) |
| [] |
李今今, 季宏兵. 2015. 土壤腐殖物质的固体13C核磁共振技术研究. 安徽农业科学, 43(10): 111–112.
( Li J J, Ji H B. 2015. Study on solid state 13C nuclear magnetic resonance technology of soil humic substances. Anhui Agricultural Sciences, 43(10): 111–112. DOI:10.3969/j.issn.0517-6611.2015.10.042 [in Chinese] ) |
| [] |
李正才, 杨校生, 周本智, 等. 2010. 北亚热带6种森林凋落物碳素归还特征. 南京林业大学学报:自然科学版, 34(6): 43–46.
( Li Z C, Yang X S, Zhou B Z, et al. 2010. Carbon dynamics of litter-fall under six forests tands in subtropical China. Journal of Nanjing Forestry University: Natural Science Edition, 34(6): 43–46. [in Chinese] ) |
| [] |
李忠文, 闫文德, 郑威, 等. 2013. 亚热带樟树-马尾松混交林凋落物量及养分动态特征. 生态学报, 33(24): 7707–7714.
( Li Z W, Yan W D, Zheng W, et al. 2013. Litter fall production and nutrient dynamic of Cinnamomum camphora and Pinus massoniana mixed forests in subtropics China. Acta Ecologica Sinica, 33(24): 7707–7714. [in Chinese] ) |
| [] |
毛霞丽, 陆扣萍, 孙涛, 等. 2015. 长期施肥下浙江稻田不同颗粒组分有机碳的稳定特征. 环境科学, 36(5): 1827–1835.
( Mao X L, Lu K P, Sun T, et al. 2015. Effect of long-term fertilizer application on the stability of organic carbon in particle size fractions of a paddy soil in Zhejiang Province, China. Journal of Environmental Science, 36(5): 1827–1835. [in Chinese] ) |
| [] | Abraham J, Chudek J A. 2008. Studies on litter characterization using 13C NMR and assessment of microbial activity in natural forest and plantation crops'(teak and rubber) soil ecosystems of Kerala, India. Plant and Soil, 303(1): 265–273. |
| [] | Aerts R. 1997. Climate, leaf litter chemistry and leaf litter decomposition in terrestrial ecosystems: a triangular relationship. Oikos, 79(79): 439–449. |
| [] | Almendros G, Dorado J, Gonzalezvila F J, et al. 2000. 13C NMR assessment of decomposition patterns during composting of forest and shrub biomass. Soil Biology and Biochemistry, 32(6): 793–804. DOI:10.1016/S0038-0717(99)00202-3 |
| [] | Attiwill P M, Adams M A. 1993. Nutrient cycling in forests. New Phytologist, 124(4): 561–582. DOI:10.1111/nph.1993.124.issue-4 |
| [] | Berg B, McClaugherty C. 2008. Plant Litter: decomposition, humus formation, carbon sequestration. New York, Springer-Verlag: 286-286. |
| [] | Birouste M, Kazakou E, Blanchard A, et al. 2011. Plant traits and decomposition: are the relationships for roots comparable to those for leaves?. Annals of Botany, 109(2): 463–472. |
| [] | Bonanomi G, Incerti G, Giannino F, et al. 2013. Litter quality assessed by solid state 13C NMR spectroscopy predicts decay rate better than C/N and Lignin/N ratios. Soil Biology and Biochemistry, 56(6): 40–48. |
| [] | Coulson J C, Butterfield J. 1978. An investigation of the biotic factors determining the rates of plant decomposition on blanket bog. Journal of Ecology, 66(2): 631–650. DOI:10.2307/2259155 |
| [] | Cornelissen J H C. 1996. An experimental comparison of leaf decomposition rates in a wide range of temperate plant species and types. Journal of Ecology, 84(4): 573–582. DOI:10.2307/2261479 |
| [] | Freschet G T, Aerts R, Cornelissen J H C., et al. 2012. A plant economics spectrum of litter decomposability. Functional Ecology, 26(1): 56–65. DOI:10.1111/j.1365-2435.2011.01913.x |
| [] | Gerzabek M H, Antil R S, Kögel-Knabner I, et al. 2006. How are soil use and management reflected by soil organic matter characteristics: a spectroscopic approach. European Journal of Soil Science, 57(4): 485–494. DOI:10.1111/ejs.2006.57.issue-4 |
| [] | Hatakka A. 2000. Biodegradation of lignin. Journal of Hazardous Materials, 74(3): 197–211. DOI:10.1016/S0304-3894(00)00161-8 |
| [] | Herman W A, McGill W B, Dormaar J F. 1997. Effects of initial chemical composition on decomposition of roots of three grass species. Canadian Journal of Soil Science, 57(2): 205–215. |
| [] | Janzen H H. 2006. The soil carbon dilemma: shall we hoard it or use it?. Soil Biology and Biochemistry, 38(3): 419–424. DOI:10.1016/j.soilbio.2005.10.008 |
| [] | Lemma B, Nilsson I, Kleja D B, et al. 2007. Decomposition and substrate quality of leaf litters and fine rootsfrom three exotic plantations and a native forest in the southwestern highlands of Ethiopia. Soil Biology and Biochemistry, 39(9): 2317–2328. DOI:10.1016/j.soilbio.2007.03.032 |
| [] | Mathers N J, Jalota R K, Dalal R C, et al. 2007. 13C NMR analysis of decomposing litter and fine roots in the semi-arid Mulga Lands of southern Queensland. Soil Biology and Biochemistry, 39(5): 993–1006. DOI:10.1016/j.soilbio.2006.11.009 |
| [] | Meentemeyer V. 1978. Macroclimate and lignin control of litter decomposition rates. Ecology, 59(3): 465–472. DOI:10.2307/1936576 |
| [] | Mendonça E S, Stott D E. 2003. Characteristics and decomposition rates of pruning residues from a shaded coffee system in Southeastern Brazil. Agroforestry Systems, 57(2): 117–125. DOI:10.1023/A:1023900822261 |
| [] | Poret N, Twilley R R, Rivera-Monroy V H, et al. 2007. Belowground decomposition of mangrove roots in Florida coastal everglades. Estuaries and Coasts, 30(3): 491–496. DOI:10.1007/BF02819395 |
| [] | Preston C M, Trofymow J A. 2000. Variability in litter quality and its relationship to litter decay in Canadian forests. Canadian Journal of Botany, 78(10): 1269–1287. DOI:10.1139/b00-101 |
| [] | Rovira P, Vallejo V R. 2007. Labile, recalcitrant, and inert organic matter in Mediterranean forest soils. Soil Biology and Biochemistry, 39(1): 202–215. DOI:10.1016/j.soilbio.2006.07.021 |
| [] | Taylor B R, Parsons W F J. 1989. Nitrogen and lignin content as predictors of litter decay rates: a microcosm test. Ecology, 70(1): 97–104. DOI:10.2307/1938416 |
| [] | Tian X J, Takahiro T. 2002. Relative roles of microorganisms and soil animals on needle litter decomposition in a subalpine coniferous forest. Acta Phytoecologica Sinica, 26(3): 257–263. |
| [] | Wang W J, Baldock J A, Dalal R C, et al. 2004. Decomposition dynamics of plant materials in relation to nitrogen availability and biochemistry determined by NMR and wet-chemical analysis. Soil Biology and Biochemistry, 36(12): 2045–2058. DOI:10.1016/j.soilbio.2004.05.023 |
| [] | Zhang Y, Jiang P K, Li Y F, et al. 2013. Chemistry of decomposing mulching materials and the effect on soil carbon dynamics under a Phyllostachys praecox bamboo stand. Journal of Soils and Sediments, 13(1): 24–33. DOI:10.1007/s11368-012-0592-z |
 2017, Vol. 53
2017, Vol. 53