文章信息
- 王璇, 理永霞, 刘振宇, 吕全, 贾秀贞, 张星耀
- Wang Xuan, Li Yongxia, Liu Zhenyu, lü Quan, Jia Xiuzhen, Zhang Xingyao
- 松材线虫CYP450基因与松树蒎烯类物质代谢的相关性
- Relationship between the Cytochrome P450 Gene of Pine Wood Nematode and the Accumulation of Pine Pinene
- 林业科学, 2017, 53(6): 105-110.
- Scientia Silvae Sinicae, 2017, 53(6): 105-110.
- DOI: 10.11707/j.1001-7488.20170612
-
文章历史
- 收稿日期:2015-11-16
- 修回日期:2016-03-10
-
作者相关文章
2. 中国林业科学研究院森林生态环境与保护研究所 国家林业局森林保护学重点实验室 北京 100091;
3. 山东农业大学 泰安 271018
2. Key Laboratory of Forest Protection of State Forestry Administration Research Institute of Forest Ecology, Environment and Protection, CAF Beijing 100091;
3. Shandong Agricultural University Tai'an 271018
松材线虫病,即松树萎蔫病(pine wilt disease,PWD),是一种以松材线虫(Bursaphelenchus xylophilus)(Nickle et al., 1981)为病原,墨天牛属昆虫(Monochamus spp.)(Mamiya, 1983)为主要媒介,综合人为参与、寄主松树、相关伴生菌和环境因素互作的复杂病害系统(张星耀等, 2003)。该病传播蔓延迅速,防治难度极大,是我国目前最为严重的森林灾害。
松材线虫侵入寄主松树后取食松树薄壁细胞,从而诱导薄壁细胞生物合成大量的蒎烯类物质(Kuroda, 1989),研究发现松材线虫和海岸松(Pinus pinaster)共培养后,其挥发物主要是α-蒎烯和β-蒎烯(Wang et al., 2010),该类挥发性的蒎烯类物质在负压条件下汽化形成气泡(Ikeda et al., 1992),在管胞内形成空洞阻断水柱的形成,同时其疏水性防止水分重新回到管胞中,从而引起薄壁细胞的空洞逐渐扩大,最终导致水分运输受阻,松树因缺水而死亡(Faria et al., 2015)。因此,挥发性蒎烯类物质是寄主空洞化病理学过程中的特征性物质。
松树响应松材线虫入侵产生的次生代谢产物是松树防御的重要手段,高浓度的蒎烯类化合物是松树主要次生代谢产物,也是松材线虫在松树体内成功定殖必须面对的主要逆境之一。谈家金等(2009)测定了松树主要蒎烯类物质对松材线虫的影响,结果表明β -蒎烯、β-水芹烯等抑制松材线虫繁殖且β -水芹烯和莰烯具有杀松材线虫活性。Niu(2012)发现α-蒎烯和β-蒎烯等在低浓度条件下抑制松材线虫的繁殖,高浓度下可以促进松材线虫的繁殖。因此,在寄生过程中,松材线虫必须面对寄主次生代谢产物胁迫,对松树次生代谢产物的降解就显得至关重要。
细胞色素P450(cytochrome P450,CYP450) 代谢途径是生物体内有毒物质降解的重要代谢途径(Arlt et al., 2008;Zhao et al., 2007),也是寄生性线虫外源物质代谢中的重要代谢通路(Laing et al., 2015)。因此本研究通过松材线虫接种5年生马尾松(Pinus massoniana)基础上,检测松树主要蒎烯类物质的积累与松材线虫CYP450基因表达模式之间的关系,从而探究松材线虫细胞色素CP450基因在松材线虫致病过程中的作用机制。
1 材料与方法 1.1 松材线虫接种 1.1.1 松材线虫处理供试松材线虫虫株来自于本实验所保存的Nxy61虫株,该虫株分离于2012年10月浙江宁波当年发病的马尾松枝条,通过贝尔曼漏斗法分离后用灰葡萄孢(Botrytis cinerea)玉米培养基长期保存。试验接种线虫为混合虫态松材线虫(包括虫卵、2~4龄幼虫以及成虫),在灰葡萄孢PDA培养基上25 ℃黑暗培养5天后,贝尔曼漏斗法收集分离线虫,无菌水冲洗3次后,再用0.5%硫酸链霉素溶液处理2 min后,无菌水冲洗3次,调整线虫悬浮液浓度20头·μL-1后备用。
1.1.2 松材线虫接种及取样本试验接种所用松树来自于中国林业科学研究院科研温室所培养的5年生马尾松,参照Otoguro等(1988)的方法,在马尾松侧枝距离主干1 cm处,剪断侧枝,将1.5 mL离心管的底部剪断,用封口膜固定于切口处,往离心管注入1 mL NXY61线虫液(10 000头),以1 mL无菌水(CK)作为对照。分别在接种后1个月内,每隔3天取1次样,共10次。每天3个重复。截取接种点以下1~5 cm部位枝条,用以检测树体内蒎烯含量;截取距离接种处5 cm处枝条用以检测松树蒎烯合成酶apin基因表达模式研究;收集接种点及接种松树体内松材线虫,用以松材线虫CYP450基因表达模式研究。
1.2 松树蒎烯合成酶apin基因表达模式研究 1.2.1 松树RNA提取及反转录第1链合成截取距离接种处5 cm处约1 cm长松枝,迅速剪碎装于1.5 mL离心管内,液氮速冻后保存于-80 ℃冰箱,根据多酚植物RNA提取试剂盒(RNAprep pure Tissue Kit,TIANGEN, BeiJing)操作步骤提取松树总RNA,通过电泳检测其完整性,再用cDNA第1链合成试剂盒(FastQuant RT Kit,TIANGEN, BeiJing)反转录合成cDNA模板,其中总RNA的量统一为1 000 ng。
1.2.2 Real-time PCR检测松树蒎烯合成酶apin基因表达本试验所用仪器为ABI 7500 Real-time PCR扩增仪。根据松树蒎烯合成酶apin基因序列设计检测引物,以松树actin基因为内参,根据SYBR PreExTaqTM(TaKaRa code:DRR0820A)操作步骤进行荧光定量检测。
扩增特异性分析:设置5个梯度,分别将松树cDNA模板稀释为1,5,10,15,20倍,执行RT-PCR反应,通过扩增曲线Ct值对起始模板的定量分析,确定最适宜模板应进行10倍稀释。根据融解曲线和PCR产物琼脂糖凝胶电泳检测,确认目的基因和内参基因的特异扩增引物如表 1所示。
|
|
RT-PCR:以接种后不同时间点的松材线虫cDNA样品为模板,并将模板稀释10倍后,进行松树apin基因Real-time PCR相对定量分析,反应体系为20 μL,每个样品设4次重复,用2-ΔΔCt法分析数据,确定基因相对表达量。
1.3 松树蒎烯类物质含量检测 1.3.1 α-蒎烯的提取方法称取1 g接种点1~5 cm处枝条,迅速剪成微小碎块,放入5 mL离心管中,加入4 mL正己烷,盖好管盖,密闭浸泡24 h。然后将溶液振荡摇匀,用0.45 μm滤膜过滤,装入气相瓶中待测。
1.3.2 气相色谱法检测α-蒎烯含量通过气相色谱仪(Agilent(GC-FID,7890A))检测,手性柱(Cycoldex-B(30 m×0.25 mm× 0.25 μm))上样。检测条件为:50 ℃保持3 min,以4 ℃·min-1的速度升至200 ℃,保持10 min;载气:氮气;流速:1.5 mL·min-1;进样温度:250 ℃;进样量0.5 μL;无分流进样;保留时间:3.68 min。将(-)-α-蒎烯和β-标准品按梯度稀释,稀释浓度为20,40,60,80,100 μL·L-1进气相色谱仪检测,制备标准曲线,根据样品峰面积对样品进行定量分析。
1.4 松材线虫CYP450基因表达模式检测 1.4.1 松材线虫RNA提取及反转录第1链合成收集接种松树体内松材线虫,液氮速冻后保存于-80 ℃冰箱,根据动物总RNA提取试剂盒(RNAprep pure Tissue Kit,TIANGEN, BeiJing)操作步骤提取线虫总RNA,cDNA第1链合成同1.2.1。
1.4.2 Real-time PCR检测松材线虫CYP450基因表达以不同接种时间点的松材线虫cDNA为模板,松材线虫β-actin基因为内参,根据松材线虫CYP-33C9和CYP-33C4基因序列设计特异性引物,进行荧光定量检测,操作步骤同1.2.2。最后选定引物序列见表 2。
|
|
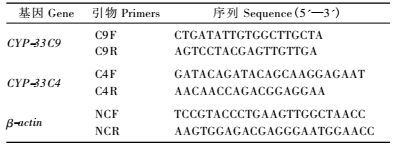
如图 1所示,松树蒎烯合成酶apin基因在松材线虫接种5年生马尾松后1个月内表达量有2个高峰,分别在第6天和第21天大量表达且其表达量远远高于无菌水接种的对照处理。对照组表达量较低且波动幅度较小。松材线虫的入侵诱导了松树蒎烯合成酶的大量表达,为后期蒎烯类物质的大量生物合成提供物质基础。
|
图 1 松树apin基因相对表达量 Fig.1 The apin gene relative expression |
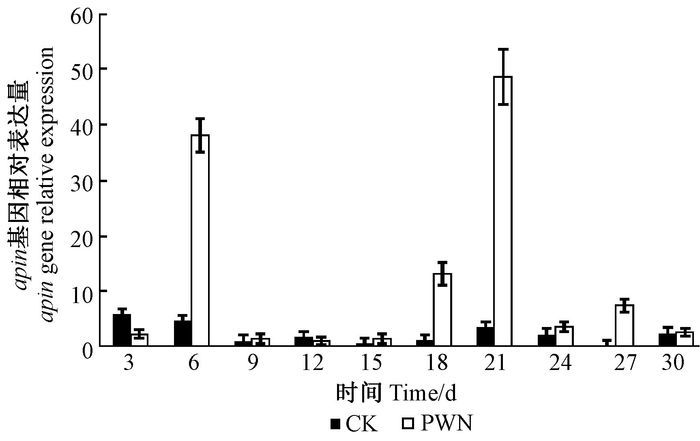
松材线虫接种5年生马尾松后,松树α-蒎含量有2个峰值,分别在9和27天时大量积累,在18和30天时含量最低。不同时期松材线虫接种后松树α-蒎烯含量均高于对照组含量。接种无菌水的对照组α-蒎烯含量21天时最高,12天时最低,整体变化幅度较小,趋于平行,而松材线虫接种后松树α-蒎烯含量变化明显(图 2)。
|
图 2 α-蒎烯含量 Fig.2 The content of α-pinene |
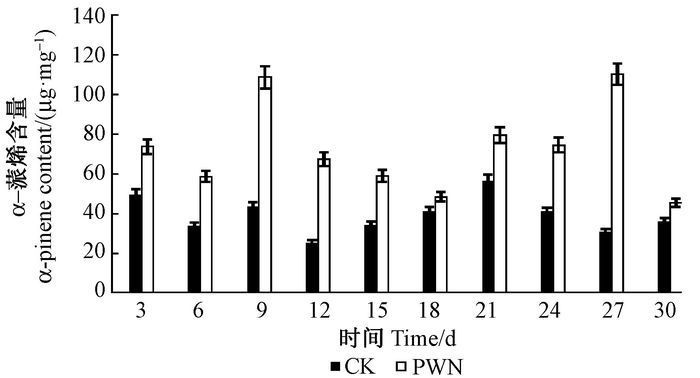
松材线虫接种马尾松后松树β-蒎烯含量也在9和27天时大量积累,呈现2个峰值,在18天时含量最低,21天时含量有所增加,27天时含量最高。对照组3天时β-蒎烯含量最高,9天时含量增加但小于3天的含量,随后趋于不变,30天时有小幅度的增加(图 3)。
|
图 3 β-蒎烯含量 Fig.3 The content of β-pinene |
松材线虫CYP-33C9基因在松材线虫接种后9天之前与对照组表达量相近,12和15天时超量表达,15天时最高,18天后几乎不表达(图 4)。松树α-蒎烯及β-蒎烯含量检测结果发现松树主要蒎烯类物质在9天是含量大幅增加,而CYP-33C9基因在12和15天时突然大量表达,因此,松材线虫CYP-33C9基因响应松树α-蒎烯及β-蒎烯含量的第1次大量积累,可能参与其蒎烯类物质的代谢过程,以便于松材线虫的松树体内的成功定殖和大量繁殖。
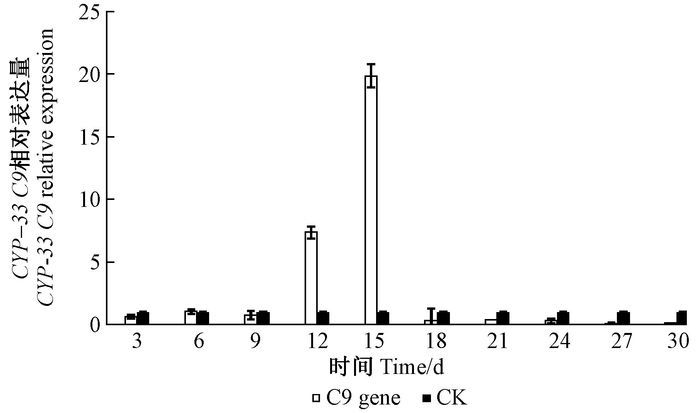
|
图 4 CPY-33C9相对表达量 Fig.4 The CPY-33C9 relative expression |
松材线虫CYP-33C4基因在接种后21天时表达量最高,18和30天时没有检测到表达量;在9天之前,其表达量逐渐增加,12天时有所降低,15天表达量与9天表达量相近,但在第18天时表达量很低,以至于没有检测到,21天时表达量急剧增至最高,随后降低(图 5)。松树蒎烯类物质是在9天时大量积累,而CYP-33C4基因在12~21天之间表达量呈现上升趋势。因此,该基因可能响应蒎烯类物质的积累而大量表达,可能参与了松材线虫蒎烯类物质代谢。
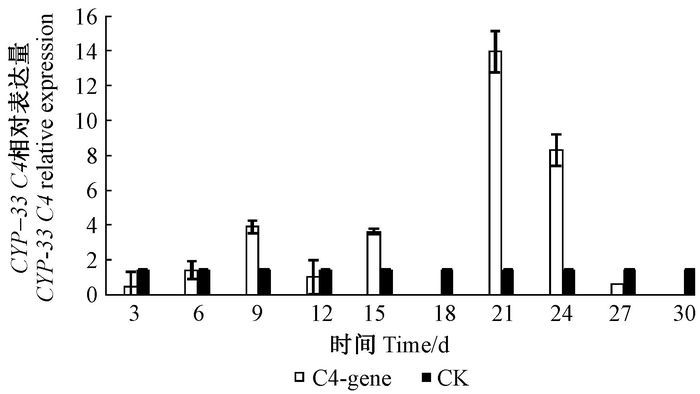
|
图 5 CPY-33C4相对表达量 Fig.5 The CPY-33C4 relative expression |
Myers(1986)首次提出松材线虫病空洞化理论,该理论认为,松树萎蔫主要是由于管胞中出现的空洞影响了松树水分输导造成的。松树感染了松材线虫后,树体内单蒎烯和倍半蒎烯的含量急剧增加,这类物质易汽化、表面张力低,渗入管胞后,在管胞中形成空洞,致使水分输导受阻,从而引起松树萎蔫(杨宝君, 2002)。Kuroda(1995)通过声波发射(acoustic emission,AE)技术研究发现,松材线虫接种后1~2个星期AE信号突然增加,并且在晚上和白天均有信号。接种3~4个星期后,AE信号比正常低,症状可见,老叶变黄,尖端萎蔫。这一时期1/2~2/3的枝条由于空洞化而功能紊乱,形成层和射线部分坏死,松树接近死亡。因此,空洞化的形成是松材线虫病典型的病理学特征。
松树蒎烯特别是单萜类物质的积累是松树响应松材线虫入侵的主要防御反应,高浓度松树单萜挥发物对松材线虫具有生理毒性,被认为是松树防御反应的重要化合物(Seybold et al., 2006)。松材线虫侵染感病松树海岸松时,蒎烯次级代谢(包括杀线虫活性物质)基因大量表达,松树产生大量蒎烯类物质等次级代谢产物,抵御松材线虫的入侵(Santos et al., 2012)。松材线虫入侵后,寄主释放的挥发性物质主要是α-蒎烯、β-蒎烯和长叶烯三种蒎烯类物质,其比例为1:0.1:0.1,α-蒎烯和β-蒎烯是主要的单萜类物质(Zhao et al., 2007)。松材线虫接种黑松(Pinus thunbergii)后,单萜和倍半萜含量显著增加:α-蒎烯含量是健康松树的2~4倍,β-蒎烯和其他几种单萜是2~3倍(Kuroda, 1989)。α-蒎烯是松树响应松材线虫入侵的主要蒎烯类次生代谢产物,Takeuchi等(2006)发现自然感病的松树和人工接种松材线虫的松树体内蒎烯类物质如α-蒎烯释放量大量积累。本研究发现松材线虫接种后,松树蒎烯合成酶(apin)基因大量表达,蒎烯类物质大量积累,且都具有2个峰值。松树apin基因大量表达的时间早于蒎烯类物质大量积累的时间,说明松材线虫接种后,激发松树蒎烯合成酶大量表达,大量合成蒎烯类物质。松材线虫入侵后,分泌纤维素酶等细胞壁相关蛋白(Ma et al., 2011),类毒液过敏原蛋白(Li et al., 2016)等激发寄主防御反应,从而引起蒎烯类次级代谢产物大量积累。因此,松材线虫接种后马尾松蒎烯类物质第1次大量增加是松树响应松材线虫的入侵而进行的主动防御反应;而蒎烯类物质的第2次大量积累可能是因为松材线虫大量繁殖后,通过其他致病基因干扰松树蒎烯类物质代谢,从而使松树蒎烯类物质代谢紊乱的结果。
松材线虫入侵后,分泌一系列代谢相关蛋白通过结合、氧化还原等作用降低寄主次级代谢产物对松材线虫的危害。松材线虫对寄主松树次级代谢产物的代谢利用预计有3个不同阶段:1) 给次级代谢产物加上功能团,使其更适合作为下游反应的底物;2) 分解代谢过程;3) 排出体外。而CYP450可能是第1阶段最重要的酶(Kikuchi, 2011)。松材线虫接种黑松后,CYP450等致病相关的基因高量表达(Urlacher et al., 2012)。Hirao等(2012) 通过抑制消减杂交技术分析不同抗性黑松接种不同致病性线虫的转录组发现,抗性黑松接种松材线虫后CYP450蛋白和细胞壁相关水解酶类蛋白等转录组水平迅速减少,CYP450表达下调可能与松材线虫入侵后树脂道内产生蒎烯类化合物有关。
CYP450家族的酶在次级代谢产物生物转化过程中有重要作用。Yan等(2012)通过松材线虫和拟松材线虫比较转录组学分析结果显示CYP450是外源物质分解利用的主要代谢途径。本研究发现松材线虫CYP-33C9和CYP-33C4基因响应松树蒎烯类物质的增加而表达量增加,推测CYP450基因可能参与了松材线虫蒎烯类物质代谢过程。但随着松材线虫的入侵,松树体内蒎烯类物质再次积累,还存在其他致病基因的作用,有助于松材线虫躲避松树次级代谢产物对松材线虫的抑制作用。Lindblom等(2006)认为线虫体内的外源物质代谢相关基因主要包括CYP450、短链脱氢酶(SDR)、谷胱甘肽转移酶(GST)和糖醛酸脱氢酶(UGT)等。Kikuchi(2011)通过KEGG分析,松材线虫的细胞色素P450的基因拷贝数明显大于秀丽隐杆线虫(C. elegans),是进行外源物质和有毒物质代谢最主要的路径之一,可能是CYP450基因的下游基因。
通过松材线虫与松树互作早期特异表达基因研究中发现有7种CYP450基因显著变化,4种基因上调表达,3种基因下调表达,其中CYP-33C4和CYP-33C9变化最明显(Qiu et al., 2013)。Xu等(2015)通过RACE技术克隆了松材线虫CYP-33C9、CYP-33C4、CYP-33D3基因,RNAi沉默这些基因后,松材线虫活性、迁移率、繁殖率、致病性和对阿维菌素等杀虫剂耐受性降低。本研究发现接种松材线虫后CYP-33C4基因表达量均低于对照组,这可能是因为CYP-33C4基因与CYP-33C9基因存在同工酶的关系,CYP-33C9基因大量表达可能抑制CYP-33C4基因的表达。也有可能是因为取样时间间距太大,CYP-33C4表达量最高点不在各个取样时间点之内。松材线虫CYP-33C9基因响应松树α-蒎烯和β-蒎烯大量积累而超量表达,说明该基因有可能参与了松材线虫对松树蒎烯类物质降解过程。
4 结论本研究发现松材线虫接种后,松树主要挥发性物质α-蒎烯和β-蒎烯的大量积累与松材线虫CYP-33C4和CYP-33C9基因的大量表达在时间上存在紧密联系,因此推测CYP450基因可能参与了松材线虫蒎烯类物质代谢过程,可能是松材线虫致病过程中的相关基因之一。此结果为进一步深入研究CYP450在松材线虫致病机制中的作用提供了重要的参考依据。
| [] |
谈家金, 郝德君, 潘玉雯, 等. 2009. 几种松树挥发物对松材线虫行为的影响. 东北林业大学学报, 37(12): 58–59.
( Tan J J, Hao D J, Pan Y W, et al. 2009. Effects of several pine volatiles on behavior of Bursaphelenchus xylophilus. Journal of Northeast Forestry University, 37(12): 58–59. DOI:10.3969/j.issn.1000-5382.2009.12.019 [in Chinese] ) |
| [] |
杨宝君. 2002. 松材线虫病致病机理的研究进展. 中国森林病虫, 21(1): 27–31.
( Yang B J. 2002. Advance in research of pathogenetic mechanism of pine wood nematode. Forest Pest and Disease, 21(1): 27–31. [in Chinese] ) |
| [] |
张星耀, 骆有庆. 2003. 中国森林重大生物灾害. 北京, 中国林业出版社: 1-29.
( Zhang X Y, Luo Y Q. 2003. Major Forest Diseases and Insect Pests in China. Beijing, China Forestry Publishing House: 1-29. [in Chinese] ) |
| [] | Arlt V M, Stiborová M, Henderson C J, et al. 2008. [a] pyrene in vitro by hepatic cytochrome P450 contrasts with detoxification in vivo: experiments with hepatic cytochrome P450 reductase null mice. Carcinogenesis, 29(3): 656–665. |
| [] | Faria J M S, Sena I, da Silva I V, et al. 2015. In vitro co-cultures of Pinus pinaster with Bursaphelenchus xylophilus: a biotechnological approach to study pine wilt disease. Planta, 241(6): 1325–1336. DOI:10.1007/s00425-015-2257-9 |
| [] | Hirao T, Fukatsu E, Watanabe A. 2012. Characterization of resistance to pine wood nematode infection in Pinus thunbergii using suppression subtractive hybridization. BMC Plant Biology, 12(1): 13. DOI:10.1186/1471-2229-12-13 |
| [] | Ikeda T, Ohtsu M. 1992. Detection of xylem cavitation infield-grown pine trees using the acoustic emission technique. Ecol Res, 7(3): 391–395. DOI:10.1007/BF02347106 |
| [] | Kikuchi T, Cotton J A, Dalzell J J, et al. 2011. Genomic insights into the origin of parasitism in the emerging plant pathogen Bursaphelenchus xylophilus. PLoS Pathogens, 7(9): e1002219. DOI:10.1371/journal.ppat.1002219 |
| [] | Kuroda K. 1989. Terpenoids causingtracheid-cavitation in Pinus thunbergii infected by the pine wood nematode (Bursaphelenchus xylophilus). Ann Phytopathol Soc Jpn, 55(2): 170–178. DOI:10.3186/jjphytopath.55.170 |
| [] | Kuroda K. 1995. Acoustic emission technique for the detection of abnormal cavitation in pine trees infected with pine wilt disease//Yang B J. Proceedings of International Symposium on Pine Wilt Disease Caused by Pine Wood Nematode, 53-58. |
| [] | Laing R, Bartley D J, Morrison A A, et al. 2015. The cytochrome P450 family in the parasitic nematode Haemonchus contortus. International Journal for Parasitology, 45(4): 243–251. DOI:10.1016/j.ijpara.2014.12.001 |
| [] | Li Y X, Wang Y, Liu Z Y, et al. 2016. Functional analysis of the venom allergen-like protein gene from pine wood nematode Bursaphelenchus xylophilus using a baculovirus expression system. Physiological and Molecular Plant Pathology, 93: 58–66. DOI:10.1016/j.pmpp.2015.12.006 |
| [] | Lindblom T H, Dodd A K. 2006. Xenobiotic detoxification in the nematode Caenorhabditis elegans. J Exp Zool A Comp Exp Biol, 305(9): 720–730. |
| [] | Ma H B, Lu Q, Liang J, et al. 2011. Functional analysis of the cellulose gene of the pine wood nematode, Bursaphelenchus xylophilus, using RNA interference. Genetics and Molecular Research: GMR, 10(3): 1931–1941. DOI:10.4238/vol10-3gmr1367 |
| [] | Mamiya Y. 1983. Pathology of the pine wilt disease caused by Bursaphelenchus xylophilus. Annual Review of Phytopathology, 21(1): 201–220. DOI:10.1146/annurev.py.21.090183.001221 |
| [] | Myers R F. 1986. Cambium destruction in conifers caused by pine wood nematodes. Journal of Nematology, 18(3): 398. |
| [] | Nickle W R, Golden A M, Mamiya Y, et al. 1981. On the taxonomy and morphology of the pine wood nematode, Bursaphelenchus xylophilus (Steiner & Buhrer 1934) Nickle 1970. Journal of Nematology, 13(3): 385. |
| [] | Niu H T, Zhao L L, Lu M, et al. 2012. The ratio and concentration of two monoterpenes mediate fecundity of the pinewood nematode and growth of its associated fungi. PLoS One, 7(2): e31716. DOI:10.1371/journal.pone.0031716 |
| [] | Otoguro K, Liu Z X, Fukuda K, et al. 1988. Screening for new nematocidal substances of microbial origin by a new method using the pine wood nematode. The Journal of Antibiotics, 41(4): 573–575. DOI:10.7164/antibiotics.41.573 |
| [] | Qiu X, Wu X, Huang L, et al. 2013. Specifically expressed genes of the nematode Bursaphelenchus xylophilus involved with early interactions with pine trees. PLoS One, 8(10): e78063. DOI:10.1371/journal.pone.0078063 |
| [] | Santos C S, Pinheiro M, Silva A I, et al. 2012. Searching for resistance genes to Bursaphelenchus xylophilus using high throughput screening. BMC Genomics, 13(1): 599. DOI:10.1186/1471-2164-13-599 |
| [] | Seybold S J, Huber D P W, Lee J C, et al. 2006. Pine monoterpenes and pine bark beetles: a marriage of convenience for defense and chemical communication. Phytochemistry Reviews, 5(1): 143–178. DOI:10.1007/s11101-006-9002-8 |
| [] | Takeuchi Y, Kanzaki N, Futai K. 2006. Volatile compounds in pine stands suffering from pine wilt disease: qualitative and quantitative evaluation. Nematology, 8(6): 869–880. DOI:10.1163/156854106779799295 |
| [] | Urlacher V B, Girhard M. 2012. Cytochrome P450 monooxygenases: an update on perspectives for synthetic application. Trends in Biotechnology, 30(1): 26–36. DOI:10.1016/j.tibtech.2011.06.012 |
| [] | Wang Z, Wang C Y, Fang Z M, et al. 2010. Advances in research of pathogenic mechanism of pine wilt disease. Afr J Microbiol Res, 4(6): 437–442. |
| [] | Xu X L, Wu X Q, Ye J R, et al. 2015. Molecular characterization and functional analysis of three pathogenesis-related cytochrome P450 genes from Bursaphelenchus xylophilus (Tylenchida: Aphelenchoidoidea). International Journal of Molecular Sciences, 16(3): 5216–5234. DOI:10.3390/ijms16035216 |
| [] | Yan X, Cheng X Y, Wang Y S, et al. 2012. Comparative transcriptomics of two pathogenic pinewood nematodes yields insights into parasitic adaptation to life on pine hosts. Gene, 505(1): 81–90. DOI:10.1016/j.gene.2012.05.041 |
| [] | Zhao L L, Wei W, Kang L, et al. 2007. Chemotaxis of the pinewood nematode, Bursaphelenchus xylophilus, to volatiles associated with host pine, Pinus massoniana, and its vector Monochamus alternatus. Journal of Chemical Ecology, 33(6): 1207–1216. DOI:10.1007/s10886-007-9289-y |
 2017, Vol. 53
2017, Vol. 53