文章信息
- 余仲东, 陈祖静, 曹支敏, 任争争, 冯世强, 张瑶琦
- Yu Zhongdong, Chen Zujing, Cao Zhimin, Ren Zhengzheng, Feng Shiqiang, Zhang Yaoqi
- 松杨栅锈菌无毒基因型性状分离及AvrL567同源序列分析
- Segregation Patterns and Phylogeny Analysis of AvrL567 Gene in Melampsora larici-populina
- 林业科学, 2017, 53(5): 88-96.
- Scientia Silvae Sinicae, 2017, 53(5): 88-96.
- DOI: 10.11707/j.1001-7488.20170511
-
文章历史
- 收稿日期:2015-01-05
- 修回日期:2016-11-14
-
作者相关文章
2. 华南农业大学林学与风景园林学院 广州 510642;
3. 西北农林科技大学理学院 杨凌 712100;
4. 辽宁省林业有害生物防治检疫局 沈阳 110804;
5. 沈阳市浑南区林业局 沈阳 110163
2. College of Forestry and Landscape Architecture, South China Agricultural University Guangzhou 510642;
3. Science College, Northwest A & F University Yangling 712100;
4. Liaoning Province Forest Pest Control and Quarantine Bureau Shenyang 110804;
5. Hunnan District Forestry Bureau of Shenyang Shenyang 110163
无毒基因在病原物-寄主互作中,是影响寄主对小种垂直抗病性选择的关键因子。无毒基因编码激发子,与寄主抗病基因编码蛋白直接或间接识别和结合后产生信号分子,从而引起或诱导寄主产生过敏性坏死反应(Flor, 1971),使寄主细胞膜结构改变、消解,或产生活性氧,或产生病程相关蛋白诱导寄主防卫基因表达(Dangl, 1994)。也有人认为无毒基因直接编码毒性因子,杀死寄主细胞从而获取营养物质(Lauge et al., 1998)。在丁香假单胞菌(Pseudomonas syringae)的Ⅲ型诱导防卫反应中(Hauck et al., 2003),AvrPto与Pto相结合并改变接受蛋白空间结构,从而激发包括活性氧爆发、基因表达、细胞壁加固等一系列防卫反应。在已分离的300余种无毒基因效应蛋白分子中,大多数分子都含有NB-LRR结构域,在调节和传导信号上发挥重要作用,其中主要有水杨酸途径、茉莉酸途径和乙烯途径等途径中的20多种信号传导相关因子(Innes et al., 1993)。无毒基因蛋白并无功能同源性(Attard et al., 2002; Vivian et al., 2002),在序列结构上,部分无毒基因表现为高度保守的重复序列(Linning et al., 2004;张德水等, 1997),如稻瘟病菌(Magnaporthe grisea)的无毒基因高度保守,已被成功地用于该菌种内系统学的研究(王建飞等,2006)。在亚麻锈菌(M. lini)的F2代锈菌群体中,Dodds等(2004)发现一个与亚麻(Linum usitatissimum)抗锈性L5、L6、L7相关联的复合无毒基因位点AvrL567,编码锈菌吸器细胞中大小为127个氨基酸的分泌蛋白,可在亚麻和烟草(Nicotiana tabacum)细胞内诱导过敏性坏死。在已报道的1 184个松杨栅锈菌(M. larici-populina)的小分泌蛋白中,84%具有家系特异性并以基因家族形式出现(Duplessis et al., 2011)。Hacquard等(2012)发现已描述的20个松杨栅锈菌小分泌蛋白具有63个同源性蛋白,其中8个与亚麻锈菌的AvrM同源,13个与AvrP4同源,1个与AvrL567同源,1个与AvrP123同源,3个与Uromyces fabae的转运蛋白RTP1同源,其余大多数为夏孢子侵染时分泌的效应蛋白。AvrM具有3个串联子,基因间隔区为Pfam转座子结构。AvrP4的C-端除包含6个丝氨酸残基,其余部分高度变异。它与黄枝孢梅(Cladiosporium fulvum)的Avr9蛋白(van den Hooven et al., 2001)、一些毒蛋白或抑制子蛋白结构相似(Pallaghy et al., 1994)。松杨栅锈菌的AvrL567同源基因蛋白同亚麻锈菌的AvrL567蛋白空间结构相似,但在26-50氨基酸区域没有RFYR传导信号肽(Rafiqi et al., 2010),序列结构较亚麻锈菌的保守。松杨栅锈菌的转运蛋白RTP1与亚麻锈菌的吸器分泌蛋白HESP-327/RTP1相同,C-端保守而N-端高度变异,行使细胞核信号定位功能(Fernandez et al., 2012)。
大多数无毒基因以基因家族形式出现,并表现为连锁显性遗传(Duplessis et al., 2011; Lauge et al., 1998)。Lawrence (2010)发现亚麻锈菌中有4个无毒基因家族,分别包含4,3,3, 2个无毒基因。Dodds等(2004)对亚麻锈菌的2个亲本菌系杂交及F1代自交后代,用AvrL567片段探针的cDNA与RNA杂交结果显示,AvrL567家族的A、B、C 3个基因总是连锁遗传分离,在对烟草、拟南芥(Arabidopsis thaliana)的转染中,表现为单显遗传。Zambino等(2000)通过分子标记及图谱技术,掌握了禾柄锈菌(Puccinia graminis)无毒基因数量、显隐性表达方式、连锁遗传及变异规律,并认为禾柄锈菌无毒基因有8个,其中6个主要表现为单显性遗传,2个表现为双显性自由分离,但其中一个表现为偏分离遗传,可能和抑制子基因连锁有关。Newcombe (1998)发现M. medusae f.sp. deltoidae的无毒基因Mmd1在Populus deltoides × P. trichocarpa的自交F2代中表现为3:1的分离方式,但抗病杨树个体上夏孢子堆的直径、密度有显著差异,在变量主成分(PCA)分析中,夏孢子堆直径、密度占了66.6%的贡献率,超过坏死反应、夏孢子堆周长,并推测与AvrMmdl连锁的QTLs基因在夏孢子堆直径和密度大小等方面发挥作用。松杨栅锈菌中也发现类似现象,在MER无毒基因家族中串联的微效基因控制着小种数量性状(Lefevre et al., 1998)。
青杨锈病(M. larici-populina)是青杨(Populus cathayana)、黑杨(P.nigra)和它们的杂交种杨树上危害严重的一种病害。欧洲、北美地区先后选育出了许多针对该锈病的欧美杨(Populus×euramericana)垂直抗病性无性系,如‘Hoogvorst’,‘Hazeendans’,‘Luisa’,‘Donk’,‘Ghoy’,‘Beaupre’等(Pinon et al., 1997),能对E3、E4小种具有垂直抗病性,极大地促进了欧美地区杨树速生丰产林的发展。但栽植过程中,最严重的问题是锈菌小种毒性变异和杨树品种抗性的丧失。至今北美、欧洲已相继报道了MLP的5个生理小种(E1—E5),7种毒性基因(Vir1—Vir7)(Pinon et al., 1997; Steenackers et al., 1998),我国也报道了MLP的5个生理小种(曹支敏, 2005)。目前,中国松杨栅锈菌小种与欧美小种在遗传上的差异还未见报道,小种无毒基因多样性、结构与功能并不清楚。本研究采用同源扩增技术和公共分子信息数据,试图分析中国生理小种无毒基因序列与欧美小种无毒基因序列之间的差异和系统学关系。
1 材料与方法 1.1 供试材料松杨栅锈菌2号生理小种(MLP2,HF2369) 来自秦岭火地塘太白杨(Populus purdomii)(No.2369,海拔1 700 m),亲和型;2号生理小种(MLP2,HZ3542) 采自秦岭厚畛子太白杨(No.3542,海拔670 m),不亲和型。欧美菌系参考相关公共数据库,取其无毒基因序列进行比对(表 1)。
|
|
取太白杨(No.2369) 附近长白落叶松(Larix olgensis)上锈菌HF2369的性子器[雌性(♀)],取太白杨(No.3542) 附近落叶松上锈菌HZ3542的性子器[雄性(♂)],待HZ3542的性子器成熟并有橘黄色的性孢子挤出时,将性子器连同落叶松针叶取下放在装有无菌水保湿的滤纸的培养皿中,将培养皿置冰盒中带到火地塘,并用HZ3524性子器涂抹HF2369的性子器,修剪枝条使涂抹针叶不受其他叶片锈菌干扰,用透明密封袋将枝条连体密封保湿, 5天后,取成熟锈子器叶片按上面方法带回温室接种太白杨。
1.3 接种反应型测定取叶龄10天左右的离体叶片,放在装有滤纸的培养皿中,滤纸用100 mg·kg-1的氯霉素浸湿,叶片正面扣在滤纸上,喷洒无菌水后,用钩针小心将锈孢子涂抹分散在叶背上,用Parafilm密封,光照恒温培养并记录潜育期,并用解剖镜观察测量夏孢子堆直径大小、高度、数量,有无褪绿及坏死斑及周长等,记录亲和型和不亲和型, 图 1A。待夏孢子成熟,小心收集单个夏孢子堆获得F1代夏孢子群体20个。将无坏死斑但具有褪绿斑的单个夏孢子堆按同样方法接种离体叶片,获得F2′代无性夏孢子群体。F1、F2′代无性夏孢子群体均按上述方法离体接种叶片并记录反应型。反应型标准参照曹支敏等(2005)。

|
图 1 离体叶片接种及表现型 Fig.1 Inoculation and phenotype on detached leaf A:离体叶片接种方法Inoculation methods for detached leaf; B:不亲和型Incompatible phenotype; C:亲和型Compatible phenotype. |
不亲和型为显性无毒基因表现型,亲和型为不含无毒基因表现型。不亲和型表型为:有褪绿斑或坏死斑、相同接种孢子浓度下夏孢子堆密度小(<10个·cm-2),潜育期在10天以上,接种反应型为0、1、1+、2-,图 1B;亲和性表型为:无褪绿斑和坏死斑、相同孢子浓度接种下产生夏孢子堆密度大(>10个·cm-2), 潜育期在10天以下,接种反应型为3+、4、4+,图 1C;中间型:无褪绿斑和坏死斑、相同孢子浓度接种下产生夏孢子堆密度大(6~12个·cm-2), 潜育期在11天以下,接种反应型为2+、3、3-。中间型再结合夏孢子堆直径大小、密度、潜育期、夏孢子堆高度分别划归亲和型和不亲和型,进行统计。理论值根据公式(χ2=Σ实得数2/预测数-观察总数)计算,结果按孟德尔比例1:1、1:3、3:1、15:1和偏分离3:13进行卡方检验,统计无毒基因数量和显隐性。
1.5 DNA提取收集无毒基因型夏孢子堆,在盆栽太白杨上进行隔离繁殖,收集成熟夏孢子堆提取DNA。DNA提取方法参考余仲东等(2005)的锈菌夏孢子DNA微量快速提取法。用钩针从每个菌样中取3~5个夏孢子堆,加入提取液100 μL[100 mmol·L-1 Tris-HCl (pH 7.8), 40 μL 20% KOH]和2%(V/V)的chelex-100(Bio-Rad公司)于1.5 mL的离心管中充分研磨后,置90 ℃水浴中温育30 min,冷却后置冰箱保存备用。
1.6 无毒基因序列同源扩增参考亚麻锈菌无毒基因AvrL576-A,AvrL576-B基因序列及末端串联拷贝序列orf3(序列号:AAS66952) 设计简并引物2对,AvrPr1:5′-TAATCC TCGTTGACATCAGTC-3′, 5′-AAGCTTGAGAGCTCCG CTC-3′(Tm=53.5 ℃); AvrPr2:5′-GTCGACCGATCTATATCGAG-3′, 5′-GTCTCTTCGTCCTTCCAAG-3′(Tm=54.1 ℃)。按下面反应条件进行PCR扩增:94 ℃预变性3 min;94 ℃变性2 min,退火50 s,延伸1 min 30 s,25个循环;72 ℃再延伸10 min,25 ℃终止反应。反应体系为:模板DNA 2 μL,Taq酶1 U,dNTPs 2 μL (10 mmol·L-1), 正反引物各1 μL (10 μmol·L-1), 5.0 μL 10×buffer, 2 μL 25 mmol·L-1 MgCl2,双蒸水配平至50 μL。
1.7 无毒基因序列分析PCR产物纯化后,利用ABI 3730型DNA分析仪进行双向测序(生工,上海)。序列经Chromas.exe修订后,用软件Clustalx 1.81进行比对。去除序列中碱基缺失形成的空格(Gap),根据Kimura双参数模型进行遗传距离计算,并参考NCBI (http://www.ncbi.nlm.nih.gov/),Melampsora larici-populina V1.0 (http://genome.jpi-psf.org), Basidomycetes yeast genomic (http://www.tigr.org/)等数据库中无毒基因序列信息(表 1),构建最大似然系统树(maximum likehood, ML),1 000次Bootstrap重抽样统计评价。
2 结果与分析 2.1 人工杂交结果人工涂抹20个性子器,其中10个性子器正常发育并在径向面形成锈子器,取相对成熟、无污染的锈子器7个,即杂交F1代锈孢子堆群体;F1代锈孢子涂抹离体太白杨叶片后,获得20个夏孢子堆,即F1代夏孢子堆群体(表 2)。F1代夏孢子堆群体中的FA2接种离体太白杨叶片后,获得5个夏孢子堆群体,即F2′代夏孢子堆群体(无性系)(表 2)。
|
|
无毒基因表型大多为接种反应型0,1,具有坏死斑或有明显的褪绿斑,夏孢子堆密度小、直径小、高度小等特征。F1代锈孢子堆群体接种太白杨,6个锈孢子堆均发育形成夏孢子堆,1个高度免疫未发育形成。潜育期6~13天不等,3个形成坏死斑,夏孢子堆在直径大小、高度、密度上有差异(表 2),抗:感为1:1,χ62=24.3(P=0.01)。F1代夏孢子堆群体接种反应型类似于F1代锈孢子堆群体,但仅1个具有明显的坏死斑,8个具有褪绿斑,潜育期6~12天不等,夏孢子堆密度、高度、大小有显著差异(表 2),无毒基因型抗:感为1:1,χ192=16.3(P=0.05)。F2′夏孢子堆群体表型分化不明显,均未产生明显坏死斑,仅2个褪绿斑,潜育期5~8天,但夏孢子堆密度、大小、高度有显著差异(表 2),无毒基因型抗:感接近1:1, χ42=4(P=0.30)。2号生理小种家系无毒基因型分离符合孟德尔遗传规律,亲本HZ3542基因型表现为单显性杂合子(Aa型),亲本HF2369基因型为aa型纯合子。
2.3 无毒基因序列分析在供试的2对引物中,引物对AvrPr1扩增产生稳定的单一条带,大小800~900 bp, 如图 2,AvrPr2扩增产物特异性不强而放弃使用。所有供试无毒基因型夏孢子堆均有PCR扩增产物,中间型菌系FC8也有微弱PCR产物,亲和型FA3和中间型FC1无扩增产物。部分PCR产物测序后获得6条无毒基因序列(GenBank接收号:JQ665873-78)。ML系统发育树表明,供试的17条无毒基因序列可以分为2个大类群。第1类群包括了Melampsora, Puccinia,Ustilago等担子菌真菌无毒基因序列,第2群为黑粉菌、柄锈菌、新型隐球菌等无毒基因序列。总的看来,无毒基因序列间同源性较小,2个分支类群鞋带值仅20%。中国松杨栅锈菌的5条无毒基因(JQ665873-8) 同加拿大该菌2条无毒基因具有更高的相似性,被聚在同一个亚分支上,但二者之间仍然存在较大的差异, 分支长度大(图 3)。另一条中国的无毒基因序列JQ665876.1与亚麻锈菌的AvrL567(AAS66952),美国的M. medusae f. sp. deltoidae(DQ404337), 法国的MLP (HG529590) 等聚在另一个亚分支上。Blastn结果表明松杨栅锈菌无毒基因可能编码锈菌RTP和NBP蛋白,在抗病信号传导和夏孢子细胞壁骨架形成中发挥作用。
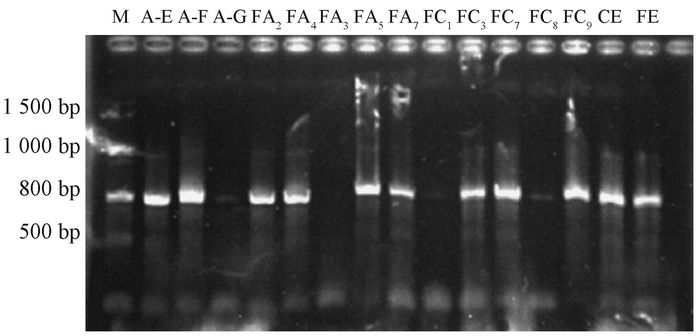
|
图 2 夏孢子堆无毒基因扩增产物 Fig.2 PCR products of avirulence gene by uredinia M:Marker;FA3(反应型4 Reactive type 4):亲和型菌系Compatible with P. purdomii;FC1(反应型3Reactive type 3)、FC8(反应型3+Reactive3+):中间型菌系,其余为不亲和型菌系Middle type of compatible strains, the other lanes are of imcompatible strains;A-E、A-F、A-G:杂交后获得锈孢子堆家系Progenies of cross-fertilization of pycnia by pycniospores;FA2、FA3、FA4、FA5、FA7、FC1、FC3、FC7、FC8、FC9:F1代夏孢子堆家系F1 progenies of urdinia;CE、FE:F2′代无性夏孢子堆家系Asexual F2′uredinia;FA3、FC1:无扩增产物Without PCR products;A-G、FC8:扩增产物弱With weak product band in respectively lane. |
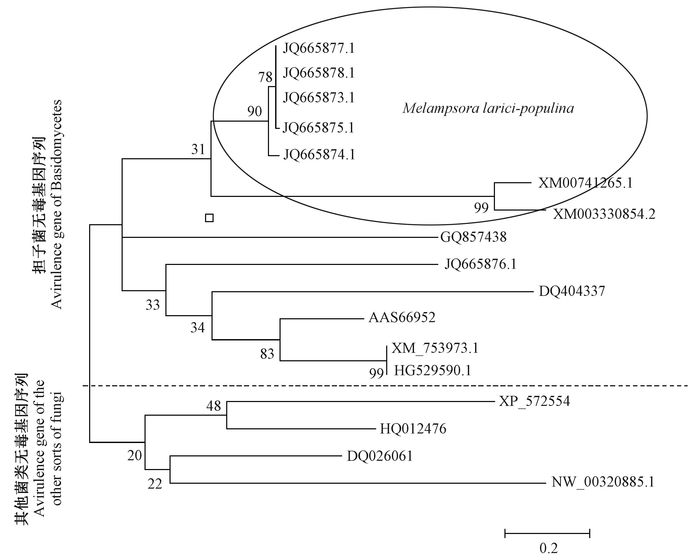
|
图 3 无毒基因序列ML系统发育树 Fig.3 Maxium likehood phylogeny tree of tested averence genes |
在“基因对基因”学说中,植物的1个抗病基因对应着病原菌的1个无毒基因,无毒基因效应蛋白和抗病基因产物结合引发植物过敏性坏死(Flor, 1971)。无毒基因是锈菌侵染时重要的小分泌蛋白基因之一,常以基因家族的形式出现和发挥作用(Dodds et al., 2004;Linning et al., 2004;Nemn et al., 2014)。亚麻锈菌AvrL567包含AvrL567-A、AvrL567-B、AvrL567-C编码蛋白基因, Avr567-A、Avr567-B基因是串联重复拷贝基因,3′端含有2个重复子Sec14和Orf-3。它们在芽管吸器中表达,编码一个127个氨基酸的分泌蛋白,可诱导寄主细胞过敏性坏死反应,但需要和亚麻L5、L6或L7抗病基因共表达。AvrL567-C在串联重复子3′末端,单拷贝,编码致病蛋白,进化较快,与人工选择压力大小相关。本研究采用同源克隆技术获得的6条avr基因序列均为AvrL567-A的同源序列,主要编码锈菌细胞膜转运蛋白(RTP1) 和核酸结合蛋白(NBP),N段含有保守的短肽氨基酸序列,可能和抗病信号的传递有关。Hacquard等(2012)在研究MLP小分泌蛋白时发现,MLP的AvrL567同亚麻锈菌的AvrL567有较大差异,本研究中也发现MLP的5条无毒基因序列同亚麻锈菌都不在同一个亚分支上。无毒基因家族中各拷贝在接种表现型上发挥着不同的作用, AvrL567-C发挥致病性作用而与寄主选择压力相协调(Dodds et al., 2004),往往具有更高的变异性;禾柄锈菌(P. graminis)无毒基因中有一个抑制子,在坏死反应中表现出抑制作用(Zambino et al., 2000)。无毒基因在接种抗病反应中通常表现出过敏性坏死,这些串联因子有可能调控着坏死反应的程度和数量。
太白杨是松杨栅锈菌的天然寄主,通常被认为是高度感病的而在研究中作为扩繁寄主使用(曹支敏等,2005)。但在Burdon等(1997)的研究中,天然寄主黑杨是最容易发现锈菌致病性变异的地方,天然杂交后形成的锈菌家系群体首先在天然寄主上发生性状分离。本研究在严格控制接种条件下获得的家系群体,在太白杨上也发生了性状分离,无毒基因型表现为单基因显性遗传,和Avr9(van Kan et al., 1991)、UhAvr1(Linning et al., 2004)等无毒基因的遗传规律相似。但本研究中的MLP的F1代锈孢子堆家系接种时有明显的坏死反应且孢子堆直径大,而F1和F2′代夏孢子堆家系坏死反应不显著而且褪绿斑大小出现分化,夏孢子堆的直径和周长等也发生较大的变化,推测有QTLs基因发挥作用,或在家系分化中无毒基因部分片段发生重组或消失,需要进一步研究。
在对TD系列自交F2代接种反应型研究中, Newcombe (1998)认为抗病基因Mmd1的QTLs性状来自于祖父的隐性遗传,M. medusae f.sp. deltoidae接种时的坏死反应是对应无毒基因的显性表现,夏孢子堆的直径大小是无毒基因型的最重要QTLs性状。在大多数文献中,寄主抗病表现型定义为人工接种反应型0,1,2-等(田呈明等,2002),很难区分2+、3-等中间表现型和既无坏死也无褪绿斑但潜育期长的表现型。本研究以坏死斑、褪绿斑的有无和大小为主,结合密度、夏孢子堆直径、潜育期等来判别无毒基因型,并通过PCR扩增检测表明这种方法是可行的,对中间反应型也是适用的。
单个夏孢子堆中夏孢子群体通常被认为是同质的,在人工接种致病反应型中可能会发生性状数量大小的变化,但一般不会形成新的致病型(马娥娇等,2014)。本研究中F1代夏孢子堆群体致病型类群和F1代锈孢子堆群体相似,是有性交配后第1代群体,均有性状分离。而F2′夏孢子堆中孢子群体为无性群体,接种反应型分化不明显,卡方检验不显著。Steenacker等(1998)报道松杨栅锈菌在寄主选择压力下或在夏孢子堆混合接种下,容易出现新的致病型。在没有转主寄主情况下,松杨栅锈菌可进行准性生殖,通过芽管融合和细胞核流动而产生新的致病菌系(Yu et al., 2009)。但新性状形成需要较强的选择压力和较长的时间,试验中采用的天然寄主太白杨叶片离体培养技术,可以保证家系群体接种致病性的稳定,为无毒基因型的测定奠定了基础。同时,该方法可减少传统叶盘接种法对叶片的伤害,最大限度地延长离体叶片的生命力和防止孢子分散造成污染。
4 结论MLP2小种无毒基因型表现为单显性遗传,杂合子(HZ3542) 亲本在F1代锈孢子堆、F1代夏孢子堆群体中性状分离均为1:1,符合孟德尔遗传分离定律。无毒基因序列构建的ML系统树表明,真菌无毒基因序列间总体上同源性较低,但同类群真菌无毒基因序列间具有更高的同源性,栅锈菌属(Melampsora spp.)无毒基因序列聚在同一个分支上,中国松杨栅锈菌无毒基因序列与加拿大菌系无毒基因序列聚在一个亚分支上,显示出较高的同源性。
| [] |
曹支敏, 余仲东, 潘彦平, 等. 2005. 中国落叶松-杨栅锈菌生理小种分化. 植物病理学报, 35(2): 184–186.
(Cao Z M, Yu Z D, Pan Y P, et al. 2005. Differentiation of physiological races in Melampsora larici-populina Kleb. in China. Acta Phytopathologica Sinica, 35(2): 184–186. [in Chinese]) |
| [] |
马娥娇, 余仲东, 胥生荣, 等. 2014. 落叶松-杨栅锈菌无性繁殖后代反应型及接种研究. 中国森林病虫, 33(2): 1–3.
(Mao E J, Yu Z D, Xu S R, et al. 2014. Reaction type and inoculation of asexual reproduced isolates from Melampsora larici-populina Kleb. Forest Pest and Disease, 33(2): 1–3. [in Chinese]) |
| [] |
田呈明, 康振生, 梁英梅, 等. 2002. 青杨叶锈病菌(Melampsora larici-populina Kleb)侵染过程的超微结果研究. 植物病理学报, 32(1): 71–78.
(Tian C M, Kang Z S, Liang Y M, et al. 2002. Ultrastructure of poplar leaf infected by rust fungi (Melampsora larici-populina Kleb.). Acta Phytopathologica Sinica, 32(1): 71–78. [in Chinese]) |
| [] |
王建飞, 鲍永美, 李培富, 等. 2006. 基于无毒基因序列的稻瘟病菌指纹类型与致病型的关系初探. 中国水稻科学, 20(1): 109–112.
(Wang J F, Bao Y M, Li P F, et al. 2006. Primary study on correlation between pathotypes and DNA fingerprintings based on avirulence gens sequences of rice blast fungus Magnaporthe grisea. Chinese J Rice Sci, 20(1): 109–112. [in Chinese]) |
| [] |
余仲东, 曹支敏. 2005. 落叶松-杨栅锈菌DNA提取新法研究(英). 西北农林科技大学学报:自然科学版, 33(11): 155–158.
(Yu Z D, Cao Z M. 2005. A renewed DNA extraction method for molecular study of Melampsora larici-populina. Journal of Northwest Sci-Tech University of Agriculture and Forestry:Natural Science Edition, 33(11): 155–158. [in Chinese]) |
| [] |
张德水, 陈受宜. 1997. 植物抗病性的分子生物学研究进展. 植物病理学报, 27(2): 97–103.
(Zhang D S, Chen S Y. 1997. Molecular biology of plant disease resistance. Acta Phytopathologica Sinica, 27(2): 97–103. [in Chinese]) |
| [] | Attard A, Gout L, Gourgues M, et al. 2002. Analysis of molecular markers genetically linked to the Leptosphaeria maculans avirulence gene AvrLm1 in field populations indicates a highly conserved event leading to virulence on Rlm1 genotypes. Molecular Plant-Microbe Interactions, 15(7): 672–682. DOI:10.1094/MPMI.2002.15.7.672 |
| [] | Burdon J J, Silk J. 1997. Source and patterns of diversity in plant-pathogenic fungi. Phytopathology, 87(7): 664–669. DOI:10.1094/PHYTO.1997.87.7.664 |
| [] | Dangl J L. 1994. The enigmatic avirulence genes of phytopathogenic bacteria. Current Topic Microbiology Immunology, 192(1): 99–118. |
| [] | Dodds P N, Lawrence G J, Catanzariti A M, et al. 2004. The Melampsora lini AvrL567 avirulence genes are expressed in haustoria and their products are recognized inside plant cells. The Plant Cell, 16(3): 755–768. DOI:10.1105/tpc.020040 |
| [] | Duplessis S, Cuomo C A, Lin Y C, et al. 2011. Obligate biotrophy features unravelled by the genomic analysis of rust fungi. Proceedings of the Natural Academy of Science U.S.A., 108: 9166–9171. DOI:10.1073/pnas.1019315108 |
| [] | Fernandez D, Tisserant E, Talhinhas P, et al. 2012. 454-pyrosequence of Coffea arabica leaves infected by the rust fungus Hemileia vastatrix reveals in planta-expressed pathogen-secreted proteins and plant functions in a late compatible plant-rust interaction. Molecular Plant Pathology, 13(1): 17–37. DOI:10.1111/mpp.2012.13.issue-1 |
| [] | Flor H H. 1971. Current status of the gene-for-gene concept. Annual Review Phytopathaology, 9(1): 275–296. DOI:10.1146/annurev.py.09.090171.001423 |
| [] | Hacquard S, Joly D L, Lin Y C, et al. 2012. A comprehensive analysis of genes encoding small secreted proteins identifies candidate effectors in Melampsora larici-populina (poplar leaf rust). Molecular Plant-Microbe Interaction, 25(3): 279–293. DOI:10.1094/MPMI-09-11-0238 |
| [] | Hauck P, Thilmony R, He S Y. 2003. A Pseudomonas syingae type Ⅲ effecter suppresses cell wall-based extracellular defense in susceptible Arabidopsis plants. PNAS, 100(14): 8577–8582. DOI:10.1073/pnas.1431173100 |
| [] | Innes R W, Bent A F, Kunkel B N, et al. 1993. Molecular analysis of avirulence gene avrRpt2 and identification of a putative regulatory sequence common to all known Pseudomonas syringae avirulence genes. Journal of Bacteriology, 175(15): 4859–4869. DOI:10.1128/jb.175.15.4859-4869.1993 |
| [] | Lawrence, G J, Dodds P N, Ellis J G. 2010. Transformation of the flax rust fungus, Melampsora lini:selection via silencing of an avirulence gene. Plant Journal, 61(2): 364–369. |
| [] | Lauge R, Wit P J. 1998. Fungal avirulence genes:structure and possible functions. Fungal Genetic Biology, 24: 285–259. DOI:10.1006/fgbi.1998.1076 |
| [] | Lefevre F, Goue-Mourier M C, Faivre-Rampant P, et al. 1998. A single gene cluster controls incompatibility and partial resistance to various Melampsore larici-populina races in hybrid poplars. Phytopathology, 88(2): 156–153. DOI:10.1094/PHYTO.1998.88.2.156 |
| [] | Linning R, Lin D, Lee N, et al. 2004. Marker-based cloning of the region containing the UhAvr1 avirulence gene from the basidiomycete barley pathogen Ustilago hordei. Gentics, 166(1): 99–111. DOI:10.1534/genetics.166.1.99 |
| [] | Nemn A, Saunders D G O, Anderson C, et al. 2014. The genome sequence and effector complement of the flax rust pathogen Melampsora lini. Frontiers in Plant Science, 5(98): 1–14. |
| [] | Newcombe G. 1998. Association of MmdI, a major gene for resistance to Melampsora medusae f.sp. deltoidae with quantitative traits in poplar rust. Phytopathology, 88(2): 114–121. DOI:10.1094/PHYTO.1998.88.2.114 |
| [] | Pallaghy P K, Norton R S, Nielsen K J, et al. 1994. A common structural motif incorporating a cystine knot and a triple-stranded β-sheet in toxic and inhibitory polypeptides. Protein Science, 3(10): 1833–1839. DOI:10.1002/pro.v3:10 |
| [] | Pinon J, Frey P. 1997. Structure of Melamposora larici-populina populations on wild and cultivated poplar. European Journal of Plant Pathology, 103(2): 159–173. DOI:10.1023/A:1008650128568 |
| [] | Rafiqi M, Gan P H, Ravensdale M, et al. 2010. Internalization of flax rust avirulence proteins into flax and tobacco cells can occur in the absence of the pathogen. Plant Cell, 22(6): 2017–2032. DOI:10.1105/tpc.109.072983 |
| [] | Steenackers M, Steenackers V, De Cuyper B, et al.1998. Breeding and seleetion of poplars for durable resistance to Melampsora larici-populina//Jalkanen, Crane P E, Walla J, et al. Proc First IUFRO Rust of Forest Tree WP Conf Finland:Rovaniemi Research Station, 97-104. |
| [] | van den Hooven H W, van den Burg H A, Vossen P, et al. 2001. Disulfide bond structure of AVR9 elicitor of the fungal tomato pathogen Cladosporium fulvum:Evidence for a cystine knot. Biochemistry, 40(12): 3458–3466. DOI:10.1021/bi0023089 |
| [] | van Kan J A L, van Den G F, Ackerve K, et al. 1991. Cloning and characterization of cDNA of avirulence gene avr9 of the fungal pathogen Cladosporium fulvum, causal agent of tomato leaf mold. Molecular Plant-Microbe Interaction, 4(1): 52–59. DOI:10.1094/MPMI-4-052 |
| [] | Vivian A, Arnold D L. 2002. Bacterial elicitor genes and their role in host-pathogen interaction. Journal of Plant Pathology, 4(3): 52–59. |
| [] | Yu Z D, Liang J, Cao Z M, et al. 2009. Nuclear behavior in the life cycle of Melampsora larici-populina Kleb. Journal of Food, Agriculture & Environment, 7(3/4): 791–794. |
| [] | Zambino P J, Kubelik A R, Szabo L J. 2000. Gene action and linkage of avirulence genes to DNA markers in the rust fungus Puccinia graminis. Phytopathology, 90(8): 819–828. DOI:10.1094/PHYTO.2000.90.8.819 |
 2017, Vol. 53
2017, Vol. 53


