文章信息
- 孙骊珠, 罗兰, 袁忠林
- Sun Lizhu, Luo Lan, Yuan Zhonglin
- 马缨丹提取物对黄胸散白蚁体内酶活性的影响
- Effects of Extracts of Lantana camara (Verbenaceae) Leaves on Cellulose and Detoxifying Enzymes Activities of Reticulitermes flaviceps (Isoptera: Rhinotermitidae)
- 林业科学, 2017, 53(5): 107-115.
- Scientia Silvae Sinicae, 2017, 53(5): 107-115.
- DOI: 10.11707/j.1001-7488.20170513
-
文章历史
- 收稿日期:2016-02-01
- 修回日期:2016-10-09
-
作者相关文章
白蚁是地球上最为古老的社会性昆虫之一,是热带、亚热带重要的经济和生态昆虫,它们能协助分解纤维素使得营养物质得以循环,但它们能损坏建筑物、堤坝、作物和树木等, 造成很大的经济损失(Verma et al., 2009;Quarcoo et al., 2010)。目前白蚁的防治仍以化学农药为主(Forschler et al., 2000; Sukartana et al., 2009),化学农药的大量使用带来的“3R”问题引起人们的高度重视。随着人们的环保意识不断提高,寻找能替代化学农药的方法进行有害生物综合防治成为当今各国科研工作者关注的热门领域(Meepagala et al., 2006; Isman,2008)。例如,在美国应用对昆虫具有拒避作用的植物茎叶组织粉碎物与建筑物周围土壤混合防治白蚁已成为人们最感兴趣的方法之一(Chamchalow, 2003; Nix et al., 2006)。国内外有关植物源农药生物活性的研究已做了大量的工作,为进一步开发对环境安全的新农药奠定了基础(张兴等,2015)。
马缨丹(Lantana camara) (马鞭草科Verbenaceae)提取物对昆虫的杀虫活性研究已有一些报道,其杀虫作用主要有毒杀、拒食、拒避、抑制生长发育等。如马缨丹石油醚和甲醇提取物对绿豆象(Callosobrachus chinensis)有拒食、致死和抑制繁殖作用(Saxena et al., 1992);马缨丹花的椰子油提取物对2种伊蚊(Ades alboptctus和A. aegypti)有驱避作用(Dua et al., 2010);马缨丹石油醚和丙酮提取物对谷蠹(Rhizopertha dominica)、玉米象(Sitophtlus zeamais)有致死活性(El-Lakwah et al., 1996; Bouda et al., 2001);马缨丹提取物对黄曲条跳甲(Phyllotreta stridata)成虫具有取食忌避、拒食和触杀作用(颜振敏等,2005);马缨丹总岩茨烯对小菜蛾(Plutella xyllostella)和斜纹夜蛾(Prodenia litura)幼虫有拒食作用(董易之等,2005);马缨丹氯仿提取物对白蚁有拒食作用和毒杀作用(Yuan et al., 2012);马缨丹提取物对亚洲玉米螟(Ostrinia furnacalis)的卵有毒杀作用,并能延缓幼虫的发育(申翠翠等,2014)等。虽有上述研究,但马缨丹提取物对昆虫具有生物活性的作用机制目前尚未见报道。杀虫剂对昆虫体内酶活性的影响是其作用机制的重要方面。白蚁像其他昆虫一样,除具有代谢解毒酶系外,更重要的是具有分解纤维素的纤维素酶系(许利霞等,2012)。本文以马缨丹不同溶剂提取物对黄胸散白蚁(Reticulitermes flaviceps)(等翅目Isoptera:鼻白蚁科Rhinotermitidae)体内的纤维素酶体系[包括内切-β-1, 4-葡萄糖酶(EG)、外切-β-1, 4-葡萄糖酶(CBH)、β-葡萄糖苷酶(BG)]、解毒酶系[包括羧酸酯酶(CarE)、谷胱甘肽S-转移酶(GSTs)和多功能氧化酶(MFO)]的酶活性影响进行研究,初步探讨提取物的作用机制,为进一步深入研究其作用机制提供科学依据。
1 材料与方法 1.1 供试材料黄胸散白蚁于2014年8月20日采于福建省南平市延平区,用松木在人工气候箱(温度为25 ℃、湿度为80%)黑暗条件下饲养,用成熟健壮工蚁作为试虫。马缨丹叶片于2013年8月采自福建农林大学校园内,阴干粉碎,粉碎过40目筛(孔径0.37 mm)后,装入自封塑料袋中于4 ℃冰箱保存备用。
1.2 试剂及仪器本试验所用的试剂均为国产分析纯试剂;BIO-RAD酶标仪(上海珂淮仪器有限公司);D-37520冷冻离心机(美国赛默飞世尔科技公司产品)。
1.3 方法 1.3.1 马缨丹提取物的制备氯仿提取物的制备:称取马缨丹干粉末50 g,装入500 mL锥形瓶中,加入适量(淹没马缨丹粉末)氯仿,用保鲜膜封口,25 ℃左右室温下避光静置浸提48 h后进行抽滤,上述步骤再重复2次,合并3次滤液。用旋转蒸发仪将滤液浓缩得到浸膏状物质,置于4 ℃冰箱中保存待用。
乙酸乙酯和石油醚萃取物的制备:称取马缨丹干粉末100 g,装入1 000 mL锥形瓶中,加入适量(淹没马缨丹粉末)乙醇,保鲜膜封口,25 ℃左右室温下避光静置浸提48 h后抽滤,上述步骤再重复2次,合并3次滤液。用旋转蒸发仪将滤液浓缩得到浸膏状的乙醇提取物。将乙醇提取物用乙酸乙酯溶解,加入蒸馏水混匀,在分液漏斗中静置12 h,放出下面的水层,再重复加入蒸馏水2次,放出下面水层后,将上面的乙酸乙酯层用旋转蒸发仪进行浓缩, 4 ℃冰箱中保存待用。然后将上述放出的水层中加入石油醚,用同样的方法(每次在放出的下面水层中加入石油醚)重复2次,共3次,合并石油醚萃取液,旋转蒸发仪浓缩后置于4 ℃冰箱中保存待用。
1.3.2 白蚁处理准确称量马缨丹氯仿提取物、乙酸乙酯和石油醚萃取物,用丙酮分别配成亚致死剂量200 mg·mL-1的溶液。每种溶液取0.4 mL分别均匀滴在直径为80 mm的圆形滤纸片上,通风橱放置24 h让溶剂挥发,然后放入直径为90 mm的培养皿中,每张滤纸片上均匀加入0.4 mL的蒸馏水使其湿润。溶剂对照(丙酮处理)采用同样的方法进行处理,并设空白对照(蒸馏水处理),每处理重复3次。
每个培养皿接入白蚁200头,分别于处理后6, 12, 24, 36, 48和72 h从培养皿内取出60头活虫(每个重复取20头),放于指形管中,标记处理及时间,超低温冰箱(-80 ℃)保存,用于酶活性测定。
1.3.3 白蚁纤维素酶酶活性测定纤维素酶酶活性的测定参照Liu等(2008)的方法。1) 白蚁纤维素酶粗酶液制备 每个指形管中取白蚁10头,放入离心管中,用0.1 mol·L-1 HAc-NaAc缓冲液(SAB,pH 5.6) 反复漂洗,加200 μL SAB缓冲液在冰浴条件下用研磨棒研磨,每处理3个重复。磨碎后,4 ℃、12 000 r·min-1离心20 min,上清液转移到新的离心管里,分装保存于-80 ℃冰箱以保持酶活性,测定前用SAB缓冲液(pH5.6) 稀释5倍即为粗酶液。
2) 纤维素酶活性单位 纤维素酶活性单位(U)是每min底物被酶解产生1 μmol还原糖(以葡萄糖计)所需酶量。
3) 内切-β-1, 4-葡聚糖酶(EG)活性的测定 以0.1 mol·L-1 pH 5.6的SAB缓冲液为溶剂,配制1%(m/V)的羧甲基纤维素钠溶液为底物。取950 μL底物与50 μL酶液充分混和,在(35±1) ℃恒温条件下水浴反应,加入1.5 mL 3, 5-二硝基水杨酸(DNS)终止反应,沸水浴5 min,定容到20 mL,用BIO-RAD酶标仪在540 nm下测定吸光值。
4) β-葡萄糖苷酶(BG)活性的测定 以0.1 mol·L-1 pH 5.6的SAB缓冲液为溶剂,配制1%(m/V)水杨素溶液为底物。取900 μL底物与100 μL酶液充分混和反应,其余步骤同3)。
5) 纤维二糖水解酶(即外切-β-1, 4葡聚糖酶,CBH)活性的测定 以0.1 mol·L-1、pH 5.6的SAB缓冲液为溶剂,配制1%(m/V)微晶纤维素溶液为底物。取900 μL底物与100 μL酶液充分混和反应,其余步骤同3)。
1.3.4 白蚁解毒酶酶活性测定1) 白蚁解毒酶粗酶液提取 酶活性均以每mg蛋白质每min分解底物的μmol数表示(μmol·mg-1pro min-1)。
参照龚佑辉(2009)的方法。取处理后白蚁2头放入离心管中,加入50 μL预冷的磷酸缓冲液(pH7.5,0.1 mol·L-1),置于冰盒上用玻璃研磨棒研磨匀浆,再加入450 μL缓冲液冲洗研磨棒。每处理3个重复。匀浆液于4 ℃,10 000 r·min-1离心5 min,取上清液即为酶液,用于测定羧酸酯酶和谷胱甘肽S-转移酶活性。
取处理后白蚁3头放入离心管中,加入500 μL 0.1 mol·L-1 pH 7.8的磷酸缓冲液[含1 mmol·L-1的乙二胺四乙酸(EDTA),1 mmol·L-1的二硫苏糖醇(DTT),1 mmol·L-1的苯硫脲(PTU),1 mmol·L-1的苯甲基磺酰氟(PMSF)],置于冰盒上用玻璃研磨棒研磨匀浆。每处理3个重复。于4 ℃, 12 000 r·min-1离心10 min,取上清液于16 000 r·min-1再次离心30 min作为酶液,用于测定多功能氧化酶活性。
2) 羧酸酯酶(CarE)活性测定 参照Jesen (2000)的方法。在酶标板中依次加入25 μL酶液,75 μL 1.5 mol·L-1的α-乙酸萘酯,反应5 min后,加入50 μL染色液(固蓝B终浓度为0.1%,十二烷基磺酸钠终浓度为1.0%)。终止平衡5 min后于595 nm波长处测吸光值。用α-萘酚制作标准曲线。酯酶比活性单位为μmol·mg-1min-1。
3) 谷胱甘肽S-转移酶(GSTs)活性测定 参照Jesen (2000)的方法。以1-氯-2, 4-二硝基苯(CDNB)为底物,在酶标板中依次加入20 μL酶液,100 μL 2 mmol·L-1的CDNB和80 μL 12.5 mmol·L-1的谷胱甘肽(GSH)(用pH6.5,0.1 mol·L-1磷酸缓冲液稀释);以1, 2-二氯-4-硝基苯(DCNB)为底物,在酶标板中依次加入100 μL酶液,50 μL 4 mmol·L-1的DCNB和50 μL 20 mmol·L-1 GSH (用pH 7.5,0.1 mol·L-1磷酸缓冲液稀释)。将酶标板静置平衡2 min后,于340 nm波长下连续测定吸光值。每处理重复3次。根据CDNB共轭消光系数(9.6 mmol-1·cm-1)和DCNB共轭消光系数(8.5 mmol-1·cm-1),将吸光值转化为共轭形成率。
4) 多功能氧化酶(MFO)活性测定 以对硝基苯甲醚为底物,参照Yu等(1992)的方法测定多功能氧化酶O-脱甲基活性。在酶标板中依次加入90 μL酶液、10 μL 9.6 mmol·L-1的烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、100 μL 2 μmol·L-1的对硝基苯甲醚。30 ℃下静置30 min后在405 nm下测定吸光值。用对硝基苯酚制作标准曲线。酶活性单位为μmol·mg-1min-1。
1.4 数据统计与分析数据的统计和作图在Excel中进行,数据采用DPSv6.55软件进行方差分析和差异性比较。
2 结果与分析 2.1 马缨丹提取物对黄胸散白蚁体内纤维素酶活性的影响 2.1.1 马缨丹提取物对黄胸散白蚁体内内切-β-1, 4葡聚糖酶(EG)活性的影响从图 1可以看出,溶剂对照(丙酮)与空白对照(蒸馏水)相比,对EG酶活性影响差异不显著。对其他5种酶活性测定结果同样表明,溶剂对照与空白对照差异均不显著,由于提取物是以丙酮为溶剂进行配制的,因此,在下面各提取物对酶活性的影响均以溶剂对照进行比较。氯仿提取物除在36 h稍有激活作用(激活率1.37%)外,其余时间均对EG酶有抑制作用,平均抑制率2.13%,但与溶剂对照无显著差异。而乙酸乙酯和石油醚萃取物都对白蚁体内EG酶活性有显著的抑制作用,随着时间推移对酶活性抑制作用越强;乙酸乙酯萃取物在6~72 h对EG酶活性的抑制率为9.23%~27.18%,平均18.95%;石油醚萃取物对酶的抑制率为14.77%~39.89%, 平均为28.95%。石油醚萃取物对EG酶活性有更强的抑制作用。

|
图 1 马缨丹提取物对黄胸散白蚁体内内切-β-1, 4-葡聚糖酶(EG)活性的影响 Fig.1 Effects of extracts from L. camara leaves on EG activity in R. flaviceps workers 同一时间段柱形图上不同字母表示差异显著(P<0.05) Different letters on the bars of same time indicate significant difference at 0.05 levels. DMK:丙酮Acetone; TCM:氯仿Chloroform; EAC:乙酸乙酯Ethyl acetate; MSO石油醚Petroleum ether.下同The same below. |
由图 2可以看出,3种溶剂的提(萃)取物在6~72 h与溶剂对照相比,对BG酶活性均具有抑制作用。在6 h时,氯仿提取物、乙酸乙酯萃取物对BG酶抑制率分别为3.82%、5.97%和4.30%,与对照差异不显著,但其余时间与对照均差异显著。氯仿提取物在12~72 h对BG酶活性的抑制率为14.37%~23.18%,平均18.35%;乙酸乙酯和石油醚萃取物的抑制率分别为21.64%~29.28%和13.22%~19.80%,平均分别为24.77%和15.75%。3种溶剂提(萃)取物在24~48 h的抑制作用均较强。总体来看,3种溶剂提取物对白蚁体内BG酶活性抑制作用的强度顺序是乙酸乙酯萃取物>氯仿提取物>石油醚萃取物。
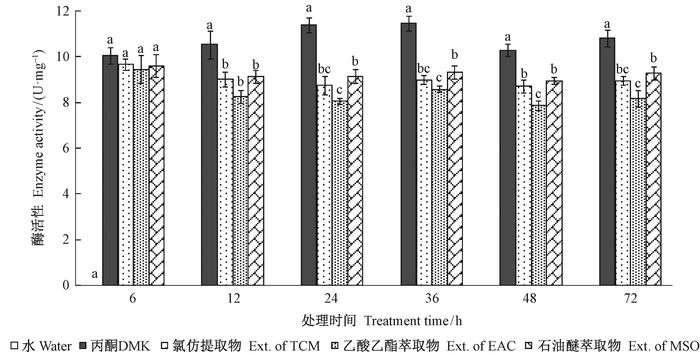
|
图 2 马缨丹提取物对黄胸散白蚁体内β-葡萄糖苷酶(BG)活性的影响 Fig.2 Effects of extracts from L. camara leaves on BG activity in R. flaviceps workers |
从图 3可知,石油醚萃取物对白蚁体内CBH酶活性无影响,与溶剂对照差异均不显著;氯仿提取物和乙酸乙酯萃取物在6~72 h对CBH酶的抑制作用与对照相比均达显著程度。其中氯仿提取物对酶活性的抑制作用最大,为8.35%~17.61%,平均12.54%;乙酸乙酯萃取物抑制作用次之,为4.74%~11.20%,平均8.56%。

|
图 3 马缨丹提取物对黄胸散白蚁体内纤维二糖水解酶(CBH)活性的影响 Fig.3 Effects of extracts from L. camara leaves on CBH activity in R. flaviceps workers |
通过对以上3种纤维素酶活性的测定,氯仿提取物对EG酶活性的影响与对照相比差异不显著,但对BG和CBH2种酶有抑制作用,尤其对CBH酶抑制作用较强;乙酸乙酯萃取物对3种酶均有抑制作用,对EG和BG酶活性抑制作用较强;石油醚萃取物对CBH酶影响与对照差异不显著,但对其他2种酶有抑制作用,其中对EG酶的抑制作用较强。
2.2 马缨丹提取物对白蚁体内解毒酶活性的影响 2.2.1 马缨丹提取物对黄胸散白蚁体内羧酸酯酶(CarE)活性的影响由图 4可以看出,氯仿提取物在6,24和36 h对CarE有抑制作用,12,48和72 h有激活作用,但都与溶剂对照差异不显著;乙酸乙酸和石油醚萃取物对CarE酶均有激活作用,平均激活率分别为5.41%和6.47%,除12 h乙酸乙酯与对照相比有显著差异外,其他时间2种萃取物与对照均无显著差异,说明3种提取物对CarE酶的活性影响不大。

|
图 4 马缨丹提取物对白蚁体内羧酸酯酶(CarE)酶活性的影响 Fig.4 Effect of extract of L. camara leaves on CarE activity in R. flaviceps workers |
由图 5可以看出,氯仿提取物6,48和72 h对GSTs酶的影响与对照相比差异不显著,而在12,24和36 h的抑制作用显著,抑制率分别是12.08%,14.82%和22.93%;乙酸乙酯萃取物在72 h对GSTs抑制作用不显著,其余时间均有显著的抑制作用,尤其是在12~36 h时抑制作用较强,抑制率为27.13%,34.11%和39.54 %;石油醚萃取物在6,72 h对白蚁体内GSTs酶的抑制作用与对照差异不显著外,在12~36 h时抑制作用显著,抑制率分别为19.46%,23.66%和31.68%。乙酸乙酯萃取物对GSTs酶的抑制作用最强。

|
图 5 马缨丹提取物对黄胸散白蚁体内GSTs酶活性的影响 Fig.5 Effects of extracts from L. camara leaves on GSTs activity in R. flavceips workers |
由图 6可知,3种提取物对MFO酶有一定的抑制作用,且抑制作用随着时间的变化而波动变化。氯仿提取物和石油醚萃取物在6,24,48,72 h对白蚁体内MFO酶活性的影响与对照差异不显著;乙酸乙酯萃取物在6,48 h对MFO的抑制与对照相比差异不显著。3种提取物在12 h的抑制作用最强,36 h次之;氯仿提取物在这2个时间对MFO酶的抑制率分别是29.48%和22.92%,乙酸乙酯萃取物分别为35.85%和23.48%,石油醚萃取物分别是23.28%和18.39%。

|
图 6 马缨丹提取物对黄胸散白蚁体内多功能氧化酶(MFO)活性的影响 Fig.6 Effects of extracts from L. camara leaves on MFO activity in R. flaviceps workers |
从3种提取物对黄胸散白蚁体内解毒酶系来看,3种提取物对CarE酶的活性影响不大;对GSTs酶的影响主要在12~48 h,其中乙酸乙酯萃取物的抑制作用最强;对FMO酶的抑制作用呈波动式变化,其中以12,36 h抑制作用较强。
3 讨论白蚁最显著的特征就是其食木性,这就决定了其纤维素酶活性是其消化酶的重要组成部分。白蚁消化纤维素除自身分泌的纤维素酶和木质素酶之外,还需要寄生于后肠的大量共生微生物(如原生动物、鞭毛虫、细菌、真菌)产生大量的纤维素酶共同构成纤维素酶系统消化纤维素(Todaka et al., 2007),以维持白蚁的营养(Martin et al., 1978; Tomme, 1995; Ohkuma, 2003; 杨红等,2006)。张时妙等(2004)用啶虫脒、氰戊菊酯和硼酸的亚致死剂量对黄胸散白蚁工蚁体内纤维素酶活性的影响进行了测定,结果表明啶虫脒处理对黄胸散白蚁工蚁体内的EG和BG酶活性无显著影响,氰戊菊酯处理可显著降低黄胸散白蚁工蚁体内的EG和BG酶活性,硼酸对黄胸散白蚁工蚁体内EG和BG酶活性的影响与处理浓度和处理时间有关。本研究表明,氯仿提取物对EG酶活性没有显著影响,但对BG和CBH酶有抑制作用;乙酸乙酯萃取物对3种酶均有抑制作用,对BG酶和EG酶抑制作用较强;石油醚萃取物对CBH酶没有影响,但对BG和EG酶有抑制作用,其中对EG酶的抑制作用较强。酶的活性降低使白蚁不能有效降解纤维素从而导致白蚁饥饿直至死亡(Ahmed et al., 2007)。
CarE酶、GSTs酶、MFO酶系是昆虫体内重要的解毒酶,在防御外来不利因子方面具有重要的作用(郭晶等,2007)。当外源毒物进入生物体内后,会引起酶活性增高而加强代谢,对其进行分解,保证生命正常活动。但外源毒物的剂量与毒物在生物虫体内的时间不同,对酶的活性影响不同。
有些外源毒物对CarE酶具有激活作用,如细辛(Asarum sieboldii)精油对玉米螟和黏虫(Mythimna separata)幼虫(姬兰柱等,2013)、亚致死浓度多杀菌素对西花蓟马(Frankliniella occidentalis)(龚佑辉等,2009)、杀虫药剂和植物代谢物质对棉蛉虫(Helicoverpa armigera)(高希武等,1998)等;有些外源毒物对昆虫体内CarE酶活性也有抑制作用,如苍耳(Xanthium sibiricum)氯仿萃取物对黏虫(熊正燕等,2010)、高浓度假蒟(Piper sarmentosum)石油醚萃取物对螺旋粉虱(Aleurodicus dispersus)(林江等,2012)等。本研究发现马缨丹氯仿提取物、乙酸乙酯和石油醚萃取物对白蚁体内的CarE酶活性的激活作用,在12 h时激活作用显著,其他时间与对照均无显著差异,这说明3种提取物对CarE酶的活性影响不大。
GSTs是害虫对杀虫剂产生代谢抗性的重要酶系,参与许多分子的解毒机制(任学祥等,2011),GSTs能使有害的亲电物质与内源的还原型谷胱甘肽(GSH)结合,参与转运体内重要的脂类化合物(吕敏等,2003)。GSTs可通过代谢保护组织免受氧化损伤,或通过与杀虫物质螯合而起保护作用(何玉杰等,2013)。有些植物代谢产物可抑制GSTs酶的活性,如旋覆花(Inula japonica)石油醚提取物对朱砂叶螨(Tetranychus cinnabarinus)(段丹丹等,2011),八角茴香(Illicium verum)甲醇、乙酸乙酯、石油醚提取物对长角扁谷盗(Cryptolestes pusillus)(何玉杰等,2013)等;有些则可激活GSTs酶活性,如芸香苷对棉铃虫(董向丽等,1998)等。本研究表明,马缨丹氯仿提取物、乙酸乙酯和石油醚萃取物对白蚁体内的GSTs酶有抑制作用,在12~48 h的抑制作用较强。
MFO系是一类由细胞色素P450、细胞色素b5、NADPH-细胞色素b5还原酶、NADPH-细胞色素c还原酶及磷脂等组成的氧化酶系,能够催化各种结构不同的内源或外源化合物氧化,如脂肪酸、甾体激素、药物、杀虫剂及各种环境有害化合物等(高新菊等,2011)。张君霞等(2014)研究表明苍耳氯仿提取物对萝卜蚜(Lipaphis erysimi)和黏虫MFO酶活性的影响呈波动变化,对萝卜蚜在4, 8和24 h起抑制作用,对黏虫在4 h时起抑制作用。本研究表明,马缨丹3种溶剂的提取物对MFO有抑制作用,且随着时间变化而波动变化,在12, 36 h时抑制作用较强。
4 结论马缨丹提取物对白蚁体内纤维素酶和解毒酶活性有较为显著的影响。纤维素酶活性的降低使得白蚁不能有效分解纤维素而缺乏营养,解毒酶活性的降低使其不能有效解决外来毒物的为害,从而表现出对白蚁的毒杀作用。外源毒物通过熏蒸、触杀、胃毒等作用方式均能引起昆虫体内酶活性的变化,马缨丹叶片3种溶剂提(萃)取物用圆形滤纸片饲喂白蚁可能均具有这几种作用,并引起白蚁体内纤维素酶和保护酶的变化;由于提取物为多种马缨丹代谢物的混合物,究竟哪些成份在起作用,各自的作用是什么,分别对白蚁起到怎样的毒性表现,还需要进一步研究。
| [] |
董易之, 张茂新, 凌冰. 2005. 马缨丹总岩茨烯对小菜蛾和斜纹夜蛾幼虫的拒食作用. 应用生态学报, 16(12): 2316–2364.
(Dong Y Z, Zhang M X, Ling B. 2005. Antifeeding effects of crude lantadene from Lantana camara on Plutella xylostella and Spodoptera litura larvae. Chinese Journal of Applied Ecology, 16(12): 2316–2364. DOI:10.3321/j.issn:1001-9332.2005.12.018[in Chinese]) |
| [] |
董向丽, 高希武, 郑炳宗. 1998. 植物次生物质对棉铃虫谷胱苷肽S-转移酶和乙酰胆碱脂酶的影响. 植物保护学报, 25(1): 72–78.
(Dong X L, Gao X W, Zheng B Z. 1998. Effects of plant allelochemicals on the glutathione -s-transferase and acetylcholinesterase in Helicoverpa armigera. Journal of Plant Protection, 25(1): 72–78. [in Chinese]) |
| [] |
段丹丹, 王有年, 成军, 等. 2011. 旋覆花提取物对朱砂叶螨的生物活性及酶活性的影响. 生态学报, 31(8): 2203–2208.
(Duan D D, Wang Y N, Cheng J, et al. 2011. The toxicity of lupeol of Inula britanica on Tetranychus cinnabarinus and its effects on mite enzyme activity. Acta Ecologica Sinica, 31(8): 2203–2208. [in Chinese]) |
| [] |
高希武, 赵颖, 王旭, 等. 1998. 杀虫药剂和植物次生性物质对棉铃虫羧酸酯酶的诱导作用. 昆虫学报, 41(Suppl.): 5–11.
(Gao X W, Zhao Y, Wang X, et al. 1998. Induction of carboxylesterase in Helicoverpa armigera by insecticides and plant allelochemicals. Acta Entomologica Sinica, 41(Suppl.): 5–11. [in Chinese]) |
| [] |
高新菊, 沈慧敏. 2011. 二斑叶螨对甲氰菊酯的抗性选育及解毒酶活力变化. 昆虫学报, 54(1): 64–69.
(Gao X J, Shen H M. 2011. Resistance selection with fenpropathrin and the change of detoxification enzyme activities in Tetranychus urticae Koch (Acari:Tetranychidae). Acta Entomologica Sinica, 54(1): 64–69. [in Chinese]) |
| [] |
龚佑辉, 吴青君, 张友军, 等. 2009. 亚致死浓度多杀菌素对西花蓟马解毒酶系活力的影响. 农药学学报, 11(4): 427–433.
(Gong Y H, Wu Q J, Zhang Y J, et al. 2009. Effect of sublethal concentration of spinosad on the activity of detoxifying enzymes in the western flower thrips Frankliniella occidentalis (Thysanoptera Thripidae). Chinese Journal of Pesticide Science, 11(4): 427–433. [in Chinese]) |
| [] |
郭晶, 高菊芳, 唐振华. 2007. 羧酸酯酶及其在含酯类化合物代谢中的作用. 农药, 46(6): 365–368.
(Guo J, Gao J F, Tang Z H. 2007. Carboxylesterases:role in metabolism of ester-containing compounds. Agrochemicals, 46(6): 365–368. [in Chinese]) |
| [] |
何玉杰, 花日茂, 李世广, 等. 2013. 八角茴香提取物对长角扁谷盗成虫的熏蒸作用及其酶活性的影响. 激光生物学报, 22(2): 159–165.
(He Y J, Hua R M, Li S G, et al. 2013. Fumigant activity of extracts from Illicium verum Hook. f. and their effects on enzymes activities of Cryptolestes pusillus (Sch nherr) adults. Acta Laser Biology Sinica, 22(2): 159–165. [in Chinese]) |
| [] |
姬兰柱, 王桂清, 刘艳, 等. 2013. 细辛精油对2种农业害虫保护酶和解毒酶活性的影响. 河南农业科学, 42(12): 79–85.
(Ji L Z, Wang G Q, Liu Y, et al. 2013. Effects of asarum essential oils on protection/detoxification enzyme activities of two agricultural pest insects. Journal of Henan Agricultural Sciences, 42(12): 79–85. DOI:10.3969/j.issn.1004-3268.2013.12.019[in Chinese]) |
| [] |
林江, 符悦冠, 黄武仁, 等. 2012. 假蒟石油醚萃取物对螺旋粉虱的生物活性及代谢酶活性的影响. 中国生态农业学报, 20(7): 921–926.
(Lin J, Fu Y G, Huang W R, et al. 2012. Biological activity of Piper sarmentosum Roxb petroleum ether extract and its effects on metabolic enzymes of Aleurodicus disperses Russell. Chinese Journal of Eco-Agriculture, 20(7): 921–926. [in Chinese]) |
| [] |
吕敏, 刘惠霞, 吴文君. 2003. 谷胱甘肽S-转移酶与昆虫抗药性的关系. 昆虫知识, 40(3): 204–207.
(Lü M, Liu H X, Wu W J. 2003. The relationship between of glutathione S-transferases and insect resistance. Entomological Knowledge, 40(3): 204–207. DOI:10.7679/j.issn.2095-1353.2003.053[in Chinese]) |
| [] |
任学祥, 王刚, 左一鸣, 等. 2011. 噻虫胺对桃蚜的毒力及其亚致死剂量对桃蚜解毒酶系活力的影响. 昆虫学报, 54(3): 299–305.
(Ren X X, Wang G, Zuo Y M, et al. 2011. The toxicity and effects of sublethal doses on detoxifying enzymes of clothianidin to Myzus persicae (Sulzer) (Hemiptera:Aphididae). Acta Entomologica Sinica, 54(3): 299–305. [in Chinese]) |
| [] |
申翠翠, 罗兰, 袁忠林. 2014. 马缨丹提取物对亚洲玉米螟的活性研究. 青岛农业大学学报:自然科学版, 31(1): 21–26.
(Shen C C, Luo L, Yuan Z L. 2014. Biological activitities of the extracts of Lantana camara L. against the Ostrinia furnacalis (Guenée). Journal of Qingdao Agricultural University:Natural Science, 31(1): 21–26. [in Chinese]) |
| [] |
熊正燕, 周琼, 苏旭. 2010. 苍耳氯仿萃取物对粘虫的拒食作用及酶活性的影响. 湖南师范大学自然科学学报, 33(1): 120–123.
(Xiong Z Y, Zhou Q, Su X. 2010. The antifeedant effect and enzyme activity of extract from Xanthium sibiricum on Pseudaletia separate. Journal of Natural Science of Hunan Normal University, 33(1): 120–123. [in Chinese]) |
| [] |
许利霞, 徐荣, 赵焕玉, 等. 2012. 黑胸散白蚁纤维素酶的体外酶学特性. 应用与环境生物学报, 18(1): 70–74.
(Xu L X, Xu R, Zhao H Y, et al. 2012. In vitro Characteristics of the Cellulases from Reticulitermes chinensis Snyder. Chinese Journal of Applied & Environmental Biology, 18(1): 70–74. [in Chinese]) |
| [] |
颜振敏, 侯有明, 罗万春. 2005. 马缨丹提取物对黄曲条跳甲成虫的生物活性. 应用昆虫学报, 42(6): 664–668.
(Yan Z M, Hou Y M, Luo W C. 2005. Bio-activities of the extracts from Lantana camara on the adult of striped flea beetles, Phyllotreta striolata. Chinese Bulletin of Entomology, 42(6): 664–668. DOI:10.7679/j.issn.2095-1353.2005.166[in Chinese]) |
| [] |
杨红, 彭建新, 刘凯于, 等. 2006. 低等白蚁肠道共生微生物的多样性及其功能. 微生物学报, 46(3): 496–499.
(Yang H, Peng J X, Liu K Y, et al. 2006. Diversity and function of symbiotic microbes in the gut of lower termites. Acta Microbiologica Sinica, 46(3): 496–499. [in Chinese]) |
| [] |
张君霞, 张新虎, 沈慧敏. 2014. 苍耳提取物对萝卜蚜和粘虫作用方式及解毒酶活性影响的研究. 草业学报, 23(4): 276–284.
(Zhang J X, Zhang X H, Shen H M. 2014. A study on the mode of insecticidal action and the activity of detoxification enzyme in extracts of Xanthium sibiricum against Lipaphis erysimi and Mythimna separata. Acta Prataculturae Sinica, 23(4): 276–284. DOI:10.11686/cyxb20140434[in Chinese]) |
| [] |
张时妙, 莫建初, 杨天赐, 等. 2004. 三种杀虫剂亚致死剂量对黄胸散白蚁工蚁体内纤维素酶活性的影响. 农药学学报(2): 72–75.
(Zhang S M, Mo J C, Yang T C, et al. 2004. Influence of sublethal concentration of acetamiprid, fenvalerate and boric acid on the cellulose activity in the worker termites, Reticulitermes flaviceps (Isoptera:Rhinotermitidae). Chinese Journal of Pesticide Science(2): 72–75. [in Chinese]) |
| [] |
张兴, 马志卿, 冯俊涛, 等. 2015. 植物源农药研究进展. 中国生物防治学报, 31(5): 685–698.
(Zhang X, Ma Z Q, Feng J T, et al. 2015. Review on research and development of botanical pesticides. Chinese Journal of Biological Control, 31(5): 685–698. [in Chinese]) |
| [] | Ahmed S, Riaz M A, Malik A H, et al. 2007. Effect of seed extracts of Withania somnifera, Croton tiglium and Hygrophila auriculata on behavior and physiology of Odontotermes obesus (Isoptera, Termitidae). Biology, 62(62): 770–773. |
| [] | Bouda H, Tapondjou L A, Fontem D A, et al. 2001. Effect of essential oils from leaves of Ageratum conyzoides, Lantana camara, and Chromolaena odorata on the mortality of Sitophilus zeamais (Coleoptera, Curculionidae). Journal of Stored Products Research, 37(2): 103–109. DOI:10.1016/S0022-474X(00)00011-4 |
| [] | Chomchalow N. 2003. Other uses and utilization of vetiver. Prodeedings of the 3rd Conference of Vetiver and Exhibition, 6-9 Oct., Guangzhou, China, 474-485. |
| [] | Dua V K, Pandey A C, Dash A P. 2010. Adulticidal activity of essential oil of Lantana carnara leaves against mosquitoes. Indian Journal of Medical Research, 131(3): 434–439. |
| [] | El-Lakwah F A, Hamed M S, Abdel-Latif A M. 1996. Effectiveness of Lantana camara and Nerium olender extracts alone and in mixtures with two insecticides against Rhizopertha dominica (F.). Annals of Agricultural Science Moshtohor, 34(4): 1879–1905. |
| [] | Forschler B T, Jenkins T M. 2000. Subterranean termites in the urban landscape:understanding their social structure is the key to successfully implementing population management using bait technology. Urban Ecosystems, 4(3): 231–251. DOI:10.1023/A:1012262727738 |
| [] | Isman M B. 2008. Botanical insecticides:for richer, for poorer. Pest Management Science, 64(1): 8–11. DOI:10.1002/(ISSN)1526-4998 |
| [] | Jensen S E. 2000. Mechanisms associated with methiocarb resistance in Frankliniella occidentali (Thysanoptera:Thripidae). Journal of Economic Entomology, 93(2): 464–471. DOI:10.1603/0022-0493-93.2.464 |
| [] | Liu Y T, Xuan S X, Long C N, et al. 2008. Screening, identifying of cellulose-decomposing strain L-06 and its enzyme-producing conditions. Chinese Journal of Biotechnology, 24(6): 1112–1116. DOI:10.1016/S1872-2075(08)60052-7 |
| [] | Martin M M, Martin J S. 1978. Cellulose digestion in the midgut of the fungus-growing termite Macrotermes natalensis:The role of acquired digestive enzymes. Science, 199(199): 1453–14555. |
| [] | Meepagala K M, Osbrink W, Sturtz G, et al. 2006. Plant-derived natural products exhibiting activity against formosan subterranean termites (Coptotermes formosanus). Pest Management Science, 62(6): 565–570. DOI:10.1002/(ISSN)1526-4998 |
| [] | Nix K E, Henderson G, Zhu B C R, et al. 2006. Evaluation of vetiver grass root growth, oil distribution, and repellency against formosan subterranean termites. Hortscience, 41(1): 167–171. |
| [] | Ohkuma M. 2003. Termite symbiotic systems:efficient bio-recycling of lignocellulose. Applied Microbiology & Biotechnology, 61(1): 1–9. |
| [] | Quarcoo F Y, Appel A G, Hu X P. 2010. Descriptive study of non-repellent insecticide-induced behaviors in Reticulitermes flavipes (Isoptera:Rhinotermitidae). Sociobiolog, 55(1): 217–227. |
| [] | Saxena R C, Dixit O P, Harshan V. 1992. Insecticidal action of Lantana camara against Callosobruchus chinensis (Coleoptera:Bruchidae). Journal of Stored Products Research, 28(4): 279–281. DOI:10.1016/0022-474X(92)90009-F |
| [] | Sukartana P, Sumarni G, Broadbent S. 2009. Evaluation of chlorfluazuron in controlling the subterranean termite Coptotermes curvignathus (Isoptera:Rhinotermitidae) in Indonesia. Journal of Tropical Forest Science, 21(1): 13–18. |
| [] | Todaka N, Moriya S, Saita K, et al. 2007. Environmental cDNA analysis of the genes involved in lignocellulose digestion in the symbiotic protist community of Reticulitermes speratus. Fems Microbiology Ecology, 59(3): 592–599. DOI:10.1111/fem.2007.59.issue-3 |
| [] | Tomme P, Warren R A J, Gilkes N R. 1995. Cellulose Hydrolysis by Bacteria and Fungi. Advances in Microbial Physiology, 37(37): 1–81. |
| [] | Verma M, Sharma S, Prasad R. 2009. Biological alternatives for termite control:A review. International Biodeterioration & Biodegradation, 63(8): 959–972. |
| [] | Yu S J, Nguyen S N, Yu S J, et al. 1992. Detection and biochemical characterization of insecticide resistance in the Diamondback Moth. Pesticide Biochemistry and Physiology, 44(92): 74–81. |
| [] | Yuan Z L, Hu X P. 2012. Repellent, antifeedant and toxic activities of Lantana camara leaf extract against Reticulitermes flavipes (Isoptera:Rhinotermitidae). Journal of Economic Entomology, 105(6): 2115–2121. DOI:10.1603/EC12026 |
 2017, Vol. 53
2017, Vol. 53

