文章信息
- 尹吴, 孙伟博, 周燕, 诸葛强
- Yin Wu, Sun Weibo, Zhou Yan, Zhuge Qiang
- 毛果杨Rubisco活化酶基因的克隆与功能分析
- Cloning and Functional Analysis of Rubisco Activase Gene from Populus trichocarpa
- 林业科学, 2017, 53(4): 83-95.
- Scientia Silvae Sinicae, 2017, 53(4): 83-95.
- DOI: 10.11707/j.1001-7488.20170410
-
文章历史
- 收稿日期:2016-09-20
- 修回日期:2016-12-10
-
作者相关文章
光合作用是植物学中最活跃的研究领域,也是地球上最重要的化学反应之一。Calvin循环是高等植物进行光合作用碳固定的最基本途径,其反应共有13步,由RuBP (核酮糖-1,5-二磷酸) 开始到RuBP再生结束,所有反应均在叶绿体基质中进行 (Raines et al., 2006; Smith et al., 2007)。Calvin循环的第1步反应由核酮糖-1,5二磷酸羧化酶 (EC 4.1.1.39, 简称Rubisco) 催化。Rubisco是光合碳固定的关键酶,其催化RuBP羧化反应和加氧反应,并进一步调节2种反应的关系 (Jurczyk et al., 2015)。在植物体内环境中,Rubisco的活性受Rubisco活化酶 (Rubisco activase, RCA) 的调节与控制,即Rubisco必须经过RCA的活化,才能表现出其羧化与加氧活性 (Parry et al., 2012)。因此,RCA的发现为提高植物Rubisco活力,从而提高碳固定的效率提供了新的思路。因此,RCA的生理与分子生物学研究已经成为光合作用领域的热门课题 (李海霞等,2010)。
随着基因工程的发展,克隆、表达、转化RCA基因等相关研究工作已经逐步展开。科学家们成功克隆拟南芥 (Arabidopsis thaliana)、大麦 (Hordeum vulgare)、玉米 (Zea mays)、水稻 (Oryza sativa)、棉花 (Gossypium spp.) 等植物RCA基因的cDNA (Werneke et al., 1989; Rundle et al., 1991; To et al., 1999; Salvucci et al., 2003)。研究发现,RCA基因对短期高温胁迫反应较为敏感,但其表达存在转录后调控,这种机制对于提高植物光合作用,从而应对长期高温胁迫具有重要意义 (DeRidder et al., 2007)。光照强度对RCA活性影响的相关研究表明:RCA活性会随着光量子通量密度的增加而随之增加,而光强达到300 μmol·m-2s-1时迅速趋于饱和状态;然而Rubisco活性要在1 000 μmol·m-2s-1光照强度时才趋于饱和 (姜振升等,2010)。对水稻进行高温胁迫的试验表明,RCA对植物抗高温有调节作用,主要由于面临高温胁迫时,植物体内的RCA能够与热激蛋白等分子伴侣蛋白互作,从而保证高温处理下RCA的活性 (Yamori et al., 2012)。转RCA基因植株在热胁迫时仍具有较高的光合速率 (Bayramov et al., 2014)。另有报道,RCA也是一种能够与赤霉素相结合的磷蛋白,对GA信号的传递有积极作用 (Stotz et al., 2011)。RCA与植物光合作用速率 (Tsai et al., 2015) 和植物产量 (Yin et al., 2014) 具有密切关系。这些研究为使用基因工程技术改良作物及经济林木,提高其光合速率和抗逆性提供了新的思路。
杨树 (Populus) 是一种适应能力强、品种繁多、生长速度快的优良树种,可作为人造板、造纸原料等,基因工程技术对提高杨树抗逆性提供了新途径。本研究选择杨树为研究材料,利用杨树基因组序列信息,克隆毛果杨 (Populus trichocarpa)PtRCA基因,通过农杆菌 (Agrobacterium) 介导遗传转化南林895杨 (P. deltoides × P. euramericana ‘Nanlin895’),获得PtRCA高效表达植株,并进行分子检测及相关功能分析,为培育杨树新型高光效抗逆品种提供依据。
1 材料与方法 1.1 植物材料毛果杨及南林895杨无菌组培苗均于温度22 ℃、光强4 000 lx、日光照16 h的温室内培养,分别用于目的基因克隆以及相关功能分析。
1.2 毛果杨PtRCA基因的克隆及分析采用BIOMIGA公司的EZgeneTM Plant Easy Spin RNA Miniprep Kit (R6611) 试剂盒提取毛果杨总RNA;使用TAKARA公司提供的试剂反转录cDNA。根据已有的PtRCA基因序列的保守区,设计5′端及3′端特异引物 (表 1),扩增PtRCA基因的编码区,并进行D-TOPO PCR反应。将所得PCR产物进行琼脂糖凝胶电泳,切胶回收,连接到PMD 19载体上,转化大肠杆菌 (Escherichia coli) TOP 10,经过蓝白斑筛选得到阳性克隆,挑选单克隆,交金斯瑞公司测序,并进行相关序列比对,利用生物信息学软件对PtRCA基因进行基因功能及其结构分析 (表 2)。
|
|
|
|
用于温度胁迫试验的植物材料为南林895杨温室生长苗 (22 ℃),6周正常生长后进行胁迫处理。第1种处理:胁迫温度梯度设置为10,20,30 ℃,分别在胁迫1,3,5,7,9天后取叶片,进行相关定量分析;第2种处理:37 ℃高温条件下,分别在0,2,4,8,12 h时取叶片;再将温度调回室温22 ℃,分别在2,4,8,12 h时取叶片,对所有叶片样本进行相关定量分析。每次试验相互独立,分别重复3次。
1.4 杨树PtRCA基因表达载体构建PMD 19 T质粒;用于入门载体扩增的TOP 10大肠杆菌菌株;用于表达载体扩增的DB 3.1大肠杆菌菌株;表达载体pGWB 406(日本RIKEN理化研究所赠予)。
按照Gateway反应程序,设计BP反应引物,F端:GGGGACAAGTTTGTACAAAAAAGCAAGGCTCC ATGGCAGCCACCATCTCCAC;R端:GGGGACCAC TTTGTACAAGAAAGCTGGGTCTAACCATAGAAAGTT CCTC。PCR产物回收纯化后进行BP反应和LR反应。将LR反应产物转化到TOP 10感受态细胞,进行菌落PCR验证并测序,提取质粒,得到目的基因植物表达载体,-20 ℃保存。
1.5 杨树PtRCA基因的遗传转化与分子检测将含有sGFP基因的表达载体转入农杆菌EHA 105,通过叶盘法进行遗传转化。侵染浓度OD600值设置为0.6,预培养时间3天,重悬时间60 min。
将预培养后的南林895杨外植体浸入重悬液中轻晃振荡15 min,用无菌滤纸吸去叶片上多余的菌液,平铺于分化培养基 (MS + 6-BA 0.5 mg·L-1+TDZ 0.002 mg·L-1+蔗糖30 g·L-1+琼脂6.5 g·L-1) 上,待分化筛选培养基 (分化培养基+ Kan 40 mg·L-1 +头孢200 mg·L-1 +特美汀200 mg·L-1) 上长出状态较好的抗性芽后,转至芽伸长筛选培养基 (芽伸长培养基+ Kan 20 mg·L-1 +头孢100 mg·L-1 +特美汀100 mg·L-1),最后转移至生根筛选培养基 (生根培养基+ Kan 10 mg·L-1 +头孢100 mg·L-1 +特美汀100 mg·L-1) 上,于22 ℃培养温度、4 000 lx光强、每天16 h光照的条件下温室培养,最后获得完整抗性植株。
利用PCR对初步筛选出来的抗性植株进行再次筛选,以阳性质粒为正对照,未转基因南林895杨为负对照进行分子检测。
1.6 光合速率相关参数的测定在2016年6月采用GFS-3000(便携式气体交换荧光测定仪) 测定转PtRCA基因南林895杨和对照的光合速率相关参数。选择与对照 (3株) 相同时间移栽、长势良好且无病虫害的盆栽转基因植株30株 (每个株系3株) 作为样本,测定时采用树冠中部外围着生于枝条顶端的3~5对生长健壮的叶片。每个株系共测3片,每个处理重复5次。单次测定在15 min内完成。
1.6.1 光合速率 (Pn) 日变化晴朗无云条件下,在7:00—19:00之间,每隔1 h测定1次光合速率值,选用植株顶端的3对叶片,每株测定3片,重复记录5次。
1.6.2 光合作用对光响应晴朗无云条件下,光合有效辐射在0~1 400 μmol·m-2s-1范围内设定若干梯度,测定光合速率值。测定时,叶室温度30 ℃,叶室CO2浓度350 μmol·mol-1 (与大气中CO2浓度相同),相对湿度60%;相关参数通过回归分析获得。
1.6.3 光合作用对CO2响应晴朗无云条件下,CO2浓度在0~1 000 μmol·mol-1范围内设定若干梯度,测定光合速率值。测定时,叶室温度30 ℃,光合有效辐射1 200 μmol·m-2s-1,相对湿度60%;相关参数通过回归分析获得。
1.7 叶绿素荧光参数的测定在2016年8月采用GFS-3000(便携式气体交换荧光测定仪) 测定叶绿素荧光参数,选择与对照 (长势最好的1株) 相同时间移栽、长势良好且无病虫害的转PtRCA基因南林895杨10株 (每个株系中长势最好的1株) 作为样本,测定时采用树冠中部外围着生于枝条顶端的第3对生长健壮的叶片,每个数值均重复测5次。
在光照强度300 μmol·m-2s-1条件下,叶片暗适应20 min后再将光照强度增至1 800 μmol·m-2s-1,在2种光强条件下测定PSⅡ原初光化学效率 (Fv/Fm)、PSⅡ的实际光化学效率 (Fv′/Fm′)、光化学猝灭 (qP)、非光化学猝灭 (qN) 等叶绿素荧光参数。
1.8 数据处理采用Excel软件进行数据处理和图表绘制,采用SAS统计软件的Duncan法进行处理间的差异显著性分析。
2 结果与分析 2.1 杨树PtRCA基因序列分析根据已有的PtRCA基因序列的保守区,设计5′端及3′端特异引物,进行D-TOPO PCR转化,通过蓝白斑筛选挑选白色阳性克隆,经过菌落PCR,所有菌样结果均出现目的条带;将测序结果通过NCBI中BLAST,与克隆的毛果杨PtRCA蛋白序列进行对比,发现克隆片段与杨树预测片段相一致,具完整阅读框。将PtRCA基因序列在GenBank中登录,获得登录号为KY307834。
通过3次独立的测序,PtRCA基因编码序列 (CDS) 长1 323 bp,编码区包含440个氨基酸,利用ProtScale对PtRCA基因编码区CDS结构域分析,发现杨树RCA蛋白N-末端存在1个转运肽结合位点,含有AAA+家族蛋白保守区P-loop NTPase超家族结构域,以及2个ATP结合域、1个ATPase响应结合域 (图 1)。

|
图 1 PtRCA基因编码区推测的核苷酸序列以及氨基酸序列 Fig.1 Nucleic acid sequence and amino acid sequence of PtRCA 粗实线区表示N-末端;箭头表示转运肽结合位点;阴影区表示AAA+家族蛋白保守区;双实线且加框表示ATP结合域;加框表示ATPase sensor 2 motif;左边数字表示核苷酸数字。 Heavy line area refers to N-terminal; The arrow refers to transit peptide binding sites; The shadow area refers to the conservative district of AAA+; Double solid line and framed area refers to ATP domain; Framed area refers to ATPase sensor 2 motif; The number refers to the number of nucleotides. |
利用ExPASy ProtParam在线分析PtRCA的理化特性:PtRCA蛋白分子式为C2135H3367N579O656S21,相对分子质量为48 315.9 Da。共包括440个氨基酸,主要氨基酸为Asp, Glu, Arg, Lys,正电荷残基数为49,负电荷残基数为53,等电点pI为5.57。不稳定指数为33.4,属于稳定性蛋白。脂肪系数为77.55,平均亲水系数为-0.311,为疏水性蛋白。
2.2 杨树PtRCA基因蛋白同源性及系统进化分析利用MAGA 5.0软件结合NCBI同源蛋白序列搜索结果构建进化树以分析杨树PtRCA基因与其他物种RCA基因亲缘关系,选取的物种分别为拟南芥、大豆 (Glycine max)、葡萄 (Vitis vinifera)、菜豆 (Phaseolus vulgaris)、小籽海红豆 (Adenanthera microsperma)、桃 (Amygdalus persica)、荠菜 (Capsella bursa-pastoris)、麻疯树 (Jatropha curcas)、南芥 (Arabis)、水田碎米荠 (Cardamine lyrata),杨树PtRCA蛋白与拟南芥、麻疯树、大豆等具较高同源性,应具备与其相似功能,这为杨树PtRCA蛋白功能分析奠定了良好基础。同时,将杨树PtRCA基因编码的蛋白与杨树中其他蛋白质序列进行同源比对,并分析与PtRCA基因编码的蛋白同源性较高的蛋白,发现其均属于AAA+超级蛋白家族。这些都对PtRCA基因表达模式分析提供了参考依据。
2.3 杨树RCA基因温度梯度胁迫诱导表达利用qRT-PCR检测南林895杨 (非转基因) 的RCA基因温度梯度胁迫诱导表达情况,结果 (图 2) 显示:10 ℃低温处理1天后,RCA基因表达量下降;处理3天表达量极显著提高,随后显著下降;处理9天,表达量也显著提高。20 ℃处理,RCA基因表达量基本呈现稳定上升趋势。30 ℃高温处理1天后,表达量显著升高,3天后显著下降,5天后表达量逐步上升。具较高耐热性的RCA转基因植株,受到中度热胁迫时,仍具有较高的光合速率以及生产量,故提高植物RCA热稳定性可作为改善植物抵御高温胁迫的一种可行性方案 (Kurek et al., 2007)。
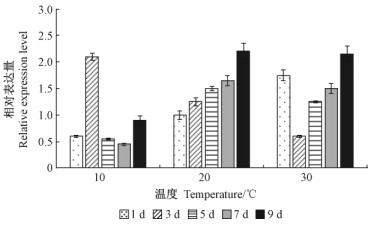
|
图 2 温度胁迫下RCA基因表达模式分析 Fig.2 Real-time PCR results of RCA expression under diverse temperature stresses |
实时定量分析 (图 3) 显示高温 (37 ℃) 处理2 h后,RCA基因表达量显著上调,随后逐步降低,在高温处理12 h后,表达量达到最低,甚至于不表达。而在经过22 ℃室温恢复处理后,RCA基因表达量开始呈线性上升趋势,且在恢复处理12 h时,RCA表达量超过了未经高温处理的初始表达量。这说明适度高温处理可诱导RCA表达 (Wang et al., 2010),这为推测RCA具耐高温能力提供了依据。
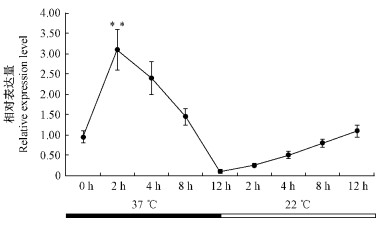
|
图 3 37 ℃高温诱导RCA基因表达模式分析 Fig.3 Real-time PCR results of the expression of RCA induced by 37 ℃ *, P < 0.05; **, P < 0.01. |
目的基因先经过BP反应整合到入门载体,再经过LR反应,整合到表达载体pGWB 406上,通过PCR凝胶电泳,结果显示目的基因成功构入表达载体。
2.5 转PtRCA基因南林895杨的获得待分化筛选培养基上长出状态较好的抗性芽后,需及时转移至芽伸长筛选培养基上,于22 ℃培养温度、4 000 lx光强、每天16 h光照的条件下温室培养。每隔10~15天,更换1次培养基,并实时观察其生长状况。
待抗性芽生长至3 cm高时,需及时转移至生根筛选培养基上,于22 ℃培养温度、4 000 lx光强、每天16 h光照的条件下温室培养,最后获得转PtRCA基因南林895杨 (图 4)。

|
图 4 转PtRCA基因南林895杨的获得 Fig.4 Obtaining of PtRCA transgenic 'Nanlin895' poplar A:叶盘分化;B:抗性芽伸长;C:抗性芽的壮大;D:抗性植株。 A: Leaf differentiation; B: Resistant shoot elongation; C. Resistant shoot growing; D. Transgenic plant. |
利用PCR分子检测对初步筛选出来的抗性植株进行再次筛选,以阳性质粒为正对照,未转化南林895杨为负对照,显示部分结果 (图 5),PCR扩增出的特异条带与阳性对照一致,本试验共筛选出14个株系为阳性。
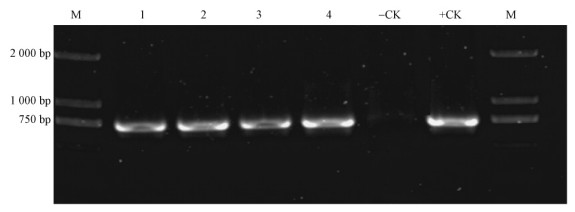
|
图 5 转PtRCA基因南林895杨PCR分子检测电泳结果 Fig.5 Electrophoresis results for PCR molecular detection of PtRCA transgenic 'Nanlin895' poplar M:DL 2000 marker. 1-4:转基因杨树 (sGFP表达载体片段);-CK:野生型;+CK:阳性质粒。 1-4: Transgenic lines; -CK: Negative control; +CK: Positive control. |
以室温 (22 ℃) 正常生长且未转化植株 (南林895杨) 组培苗为对照组,对生长45天的转PtRCA基因南林895杨和未转化植株 (南林895杨) 的组培苗进行高温胁迫处理,每升高5 ℃设置1个处理温度,37 ℃封顶,设置的3个高温胁迫温度为27,32,37 ℃,分别共同处理1,3,5天后,取组培苗顶端第3片叶进行采样分析。
实时定量分析结果 (图 6) 显示:高温处理1天后,27 ℃转基因植株RCA基因表达量显著上升,32,37 ℃处理植株RCA基因表达量均有所下降,未转化植株RCA基因表达量为极显著下降;高温处理3天后,所有处理植株RCA基因表达量均显著上升,27 ℃处理的植株RCA基因表达量为极显著上升,且转基因植株RCA基因表达量是未转化植株RCA基因表达量的2倍左右;高温处理5天后,所有处理植株RCA基因表达量均有所下降,其中27 ℃处理的转基因植株RCA基因表达量极显著高于对照组,32 ℃处理的转基因植株RCA基因表达量也高于对照组,而37 ℃处理的转基因植株RCA基因表达量与对照组持平。此外,任一高温和时间处理下的转基因植株RCA基因表达量均显著高于未转化植株RCA基因表达量。
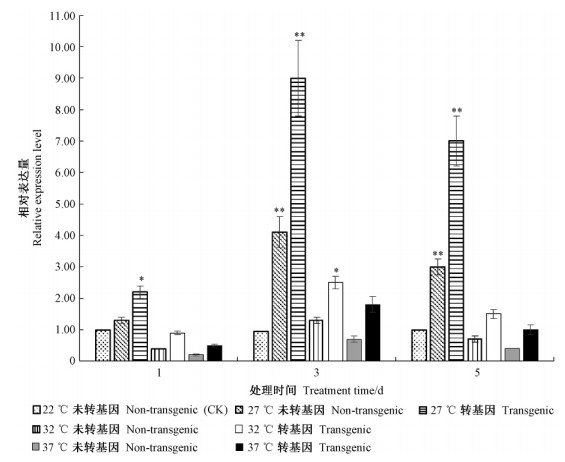
|
图 6 高温胁迫下南林895杨RCA基因表达模式分析 Fig.6 Real-time PCR results of RCA expression in 'Nanlin895' poplar under high temperature stress *, P < 0.05; **, P < 0.01. |
对光合速率日变化测定数据的分析表明 (选取转基因株系RCA1、RCA2、RCA6和对照进行对比分析):1) 日变化曲线形态的不同:对照植株的峰值出现在11:00和14:00,日变化呈双峰曲线,最高净光合速率 (Pn) 为12.7 μmol·m-2s-1左右,其低谷出现在12:00—13:00之间;而3个转PtRCA基因株系的平均峰值出现在12:00,日变化基本呈单峰曲线,最高净光合速率 (Pn) 为14.9 μmol·m-2s-1(RCA6),平均持续1 h左右开始逐渐下降 (图 7)。2) 与对照相比,转PtRCA基因杨树在7:00的净光合速率 (Pn) 并无明显差异,为3.9~4.3 μmol·m-2s-1之间。

|
图 7 转PtRCA基因南林895杨和对照净光合速率 (Pn) 的日变化 Fig.7 Diurnal change of net photosynthetic rate (Pn) between transgenic poplars and control RCA1, RCA2, RCA6:转基因株系Transgenic lines.下同。The same below. |
根据上述分析,推测可能是由于PtRCA基因导入,改善了转PtRCA基因杨树的C3光合循环,并提高了转基因植株利用强光的能力,使其充分利用强光进行光合作用;相比之下,对照则出现明显的光抑制现象。
2.7.2 转PtRCA基因杨树与对照的光合作用对光响应曲线的比较光合作用对光的响应测定数据 (选取转基因株系RCA1、RCA2、RCA6和对照进行对比分析) 表明:光照强度0~400 μmol·m-2s-1时,转PtRCA基因杨树与对照的净光合速率均呈线性增长,并随着光照强度的不断增加逐渐达到饱和状态 (图 8)。因此,依据净光合速率与0~400 μmol·m-2s-1范围内光照强度呈线性关系,建立10个转基因株系和对照的直线回归方程,计算出光饱和点、光补偿点、表观量子效率、暗呼吸速率以及光饱和时的光合速率 (表 3)。结果表明:1) 光饱和点:转PtRCA基因杨树所有株系的光饱和点均比对照高,增加约12.5%~37.5%,其中8号株系的光饱和点最高。这表现出转PtRCA基因杨树能够更好地利用强光进行光合作用。2) 光补偿点:转PtRCA基因杨树 (除3号株系外) 的光补偿点均略低于对照杨树。这表明转PtRCA基因杨树具有较强的利用弱光能力。3) 表观量子效率:转PtRCA基因杨树 (除2号和6号株系外) 的表观量子效率均略高于对照杨树。这表明转PtRCA基因杨树的光合作用更加活跃。4) 暗呼吸速率:转PtRCA基因杨树 (除3号和9号株系外) 的暗呼吸速率均略低于对照杨树。这表明转PtRCA基因杨树在没有光照时消耗的能量偏少。5) 光饱和时的光合速率:转PtRCA基因杨树在光饱和点时的光合速率比对照增高24.6%~55.7%(1号和2号株系的光合速率最高)。这进一步表明高光强能够提高转基因植株的羧化反应能力,使光合速率得到提高。
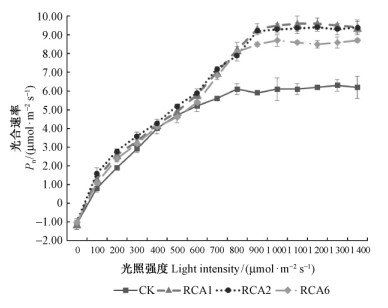
|
图 8 转PtRCA基因杨树和对照的光合响应变化 Fig.8 Changes of photosynthetic response between transgenic poplars and the control 设定条件:叶室温度30 ℃,叶室CO2浓度350 μmol·mol-1,相对湿度60%。 Testing conditions: Hamuro temperature of 30 ℃, Hamuro CO2 concentration of 350 μmol·mol-1, relative humidity of 60%. |
|
|
光合作用对CO2浓度响应测定数据 (选取转基因株系RCA1、RCA2、RCA6和对照进行对比分析) 表明:CO2浓度0~400 μmol·mol-1时,转PtRCA基因杨树和对照的净光合速率呈线性增长,并随着CO2浓度的不断增加逐渐达到饱和状态 (图 9)。因此,依据净光合速率与0~400 μmol·mol-1范围内CO2浓度呈线性关系,建立10个转基因株系和对照的直线回归方程,计算出CO2饱和点、CO2补偿点、羧化效率、光呼吸速率、CO2饱和时的光合速率 (表 4)。结果表明:1) CO2饱和点:转PtRCA基因杨树CO2饱和点除1号和4号株系外,其他均比对照低12.5%~25.0%,在略高于大气CO2浓度下就达到饱和。2) CO2补偿点:转PtRCA基因杨树的CO2补偿点比对照大幅度降低,低53.1%~80.4%。这表明由于PtRCA基因的导入,转基因植株对CO2亲和力较高,这也是转基因植株CO2饱和点低的原因。3) 羧化效率:转PtRCA基因杨树的羧化效率均略高于对照。这表明转PtRCA基因杨树的羧化效率较强,能更好地催化RuBP进行羧化反应。4) 光呼吸速率:转PtRCA基因杨树的光呼吸比对照低37.7%~79.3%。这表明转PtRCA基因杨树有利于光合作用有机物积累,光呼吸消耗较少,其生物量增加。5) CO2饱和时的光合速率:转PtRCA基因杨树在CO2饱和点时的光合速率比对照增加4.4%~26.4%(2号株系的光合速率最高)。转基因植株在CO2饱和点较低的情况下,光合速率却比对照高,这也进一步说明转基因植株有较强的羧化反应能力,光合速率能够得到提高。

|
图 9 转PtRCA基因杨树和对照在不同CO2浓度下的光合响应 Fig.9 Photosynthetic response to CO2 concentration between transgenic poplars and the control 设定条件:叶室温度30 ℃,光照强度1 200 μmol·m-2s-1,相对湿度60%。 Testing conditions: Hamuro temperature of 30 ℃, light intensity of 1 200 μmol·m-2s-1, relative humidity of 60%. |
|
|
由表 5的数据进行对比分析可知:1) PSⅡ原初光化学效率 (Fv/Fm):在低光照强度下,与对照相比,转PtRCA基因杨树的Fv/Fm没有明显差异;而经过光氧化处理后,Fv/Fm均存在不同程度的降低;相比较而言,对照下降得最多,为61.7%,转基因杨树下降45.0%~53.1%(4号株系下降得最少,为45%)。2) PSⅡ实际光化学效率 (Fv′/Fm′):在低光照强度下,转PtRCA基因杨树和对照的Fv′/Fm′没有明显差异;然而经过光氧化处理后,二者的Fv′/Fm′均有不同程度的降低,对照下降得最多,为54.1%,而转PtRCA基因杨树下降38.7%~52.0%(6号株系下降得最少,为38.7%)。这表明转PtRCA基因植株利用吸收的光子的能力较强,吸收的光子供给PSⅡ反应中心的效率较高,推测这可能是由于PtRCA基因的导入,提高植株PSⅡ反应中心的效率。
|
|
由表 6的数据进行对比分析可知:1) 光化学猝灭系数 (qP):在低光照强度下,转PtRCA基因杨树与对照的qP没有明显差异;经过光氧化处理后,二者的qP均下降,对照下降了68.3%,而转基因杨树下降较少,为51.0%~65.8%(2号株系下降的最少,为51.0%)。这表明在强光下,与对照相比,转PtRCA基因杨树的光化学电子传递比较顺畅,用于光化学电子传递的光能份额比较高,而对照出现了明显的受阻现象。2) 非光化学猝灭系数 (qN):在低光照强度下,转PtRCA基因杨树与对照的qN没有明显差异;经过光氧化处理后,对照增加仅为3.0%,而转PtRCA基因杨树增加较多,为6.0%~26.5%(2号株系增加的最多,为26.5%)。这表明PtRCA基因的导入,使得转PtRCA基因杨树的光合机构没有受到破坏,过剩光能得到较好的耗散,表现出较好的耐光氧化能力。
|
|
高光强一直是抑制植物生长、降低光合速率的主要因素,然而,近几年一系列研究表明:Rubisco活化酶 (RCA) 具抵御高光强胁迫的作用,这为培育高产量抗逆植株提供了理论依据。
3.1 转PtRCA基因南林895杨与其他转RCA基因植物的比较分析在研究拟南芥Rubisco活化问题时首先发现RCA,经过对RCA进行一系列抗体研究,发现它存在于高等植物及一些单细胞光合生物中,这说明在光合生物中,RCA对Rubisco活性调节机制普遍存在,RCA与光合作用有着密切关系 (Hasse et al., 2015)。
利用农杆菌遗传介导获得了RCA基因正义拟南芥,结果显示仅表达大亚基的正义植株各项指标与野生型并无明显差异,而只表达小亚基的正义转化苗长势明显优于野生型 (Zhang et al., 2002)。同样,相似正义遗传转化试验结果显示,转小亚基正义植株长势显著优于野生型植株,另外,该研究发现RCA与GA信号传导有密切联系 (Sharma et al., 2002;Wang et al., 2010)。虽然以上试验均表明RCA基因主要是由小亚基表达功能,但对获得的正义水稻研究表明,转大亚基植株的Rubisco活性、光合效率指标均明显高于野生型,作物产量也有所提高 (Wu et al., 2007)。这些研究为通过基因工程,增强植物的抗逆性,进而提高植物光合速率和产量提供了新的思路。研究转基因水稻RCA基因调控时,发现RCA对叶绿体的发育有调节作用,且在水稻发育生长后期,转基因植株叶片中RCA含量一直偏高,随着叶片的衰老,RCA含量逐步降低,光合速率下降,说明植物光合速率受RCA影响,RCA对净光合速率起重要调控作用 (蒋德安等, 2000;翁晓燕等, 2001;张国等, 2005)。
本研究尝试利用转基因技术使毛果杨PtRCA基因在杨树中高效表达,通过PtRCA基因的特性,使Rubisco处于稳定的催化活性状态,让Rubisco更加有效地参与到光合碳同化过程中。本研究结果也表明,克隆得到的PtRCA基因蛋白与拟南芥等RCA蛋白同源性较高,可作为研究杨树PtRCA蛋白功能的参考依据。分析证实了RCA具耐高温耐热能力, 转PtRCA基因杨树能够充分利用中午的强光进行光合作用,利用CO2的能力较强,能更好地催化RuBP进行羧化反应,羧化效率较强。在强光下,转PtRCA基因杨树的光合机构没有受到破坏,过剩光能得到较好的耗散,表现出一定的耐光氧化能力。
上述结果表明具较高耐高温耐热性的RCA转基因植株,受到中度热胁迫时,仍具有较高的光合速率以及生产量。这与在研究拟南芥转基因植株时,发现RCA对净光合速率热恢复具重要作用 (Kurek et al., 2007) 等相关研究结果一致。这为利用转基因手段进行杨树新型高光效抗逆新品种的研究提供了重要依据。
3.2 转PtRCA基因南林895杨与转PEPC基因 (C4植物) 南林895杨的比较分析与C3植物只利用卡尔文循环中1,5-二磷酸核酮糖直接固定CO2相比,C4植物首先利用磷酸烯醇式丙酮酸 (PEP),经PEP羧化酶 (PEPC) 的作用与CO2结合,形成苹果酸或天门冬氨酸。这些四碳双羧酸转移到鞘细胞里,通过脱羧酶的作用释放CO2,后者在鞘细胞叶绿体内经核酮糖1,5-二磷酸 (RuBP) 羧化酶作用,进入卡尔文循环。因为PEP与CO2的结合能力远远大于RuBP,这使得C4植物即使在CO2浓度比较低的时候,依然可以通过这一点源源不断为光合作用提供充足的CO2,使得C4植物光合作用也较强。因此,通过分子技术让C3植物与C4植物一样,具有更加高效的光合作用已成为现今研究的热门课题 (Leegood, 2013)。
据报导,水生植物Egeria densa和Hydrilla verticilata体内也发现有C4光合途径,这一发现很大程度上预示着,或许可以通过C4光合酶基因向C3植物的遗传转化从而提高C3植物光合作用的可操作性 (Teng et al., 2001;Li et al., 2005)。作者利用农杆菌介导法,将光合作用C4途径关键酶基因PEPC导入杨树并进行相关特性的分析,其研究结果 (尹吴等,2012) 与本研究相比:转PEPC基因杨树具有C4植物的某些高光效特性,在光合速率、光能利用效率、羧化效率等方面的表现与其对照相比具有一定的优势,这些表现在一定程度上优于本试验中转PtRCA基因株系对应的数据;然而,在耐光氧化方面,转PtRCA基因杨树比转PEPC基因杨树具有更加明显的优势。上述对比说明PEPC基因能够更好地固定CO2,对CO2的亲合力较强,从而促使磷酸烯醇式丙酮酸 (PEP) 固定大气中浓度较低的CO2,供C3途径利用,因此转PEPC基因杨树的羧化效率更高,利用CO2的能力更强,而RCA基因具有很强的耐高温抗高光强的特性。
4 结论转PtRCA基因杨树具有较高的净光合速率,推测是由于PtRCA基因的导入,提高了转PtRCA基因杨树利用强光的能力,使其能够充分利用中午的强光进行光合作用。转PtRCA基因杨树所有株系的光饱和点较高,且在光饱和点时的光合速率较高。这说明转PtRCA基因杨树能够较好地利用强光进行光合作用。转PtRCA基因杨树CO2饱和点较低 (除1号和4号株系外);而在CO2饱和点时的光合速率,转PtRCA基因杨树较高;此外,转PtRCA基因杨树的羧化效率较高。这些均表明转PtRCA基因杨树利用CO2的能力较强,能够更好地催化RuBP进行羧化反应,羧化效率较强。
转PtRCA基因杨树利用吸收的光子的能力较强,吸收的光子供给PSⅡ反应中心的效率较高,推测这可能是由于PtRCA基因的导入提高了PSⅡ反应中心的效率。在高光照强度下,与未转基因对照相比,转PtRCA基因杨树的光化学电子传递比较顺畅,其PSⅡ天线色素吸收的光能用于光化学电子传递的份额较高,且转PtRCA基因杨树表现出耐光氧化的能力,其过剩光能量得到较好的耗散。
| [] |
蒋德安, 陆庆, 翁晓燕, 等. 2000. 水稻剑叶衰老期Rubisco活化酶对Rubisco活力和光合速率的调节. 浙江大学学报:农业与生命科学版, 26(2): 119–124.
( Jiang D A, Lu Q, Weng X Y, et al. 2000. Regulation of Rubisco carboxylation activity and photosynthetic rate by Rubisco activase during leaf senescence in rice. Journal of Zhejiang University: Agriculture and Life Sciences, 26(2): 119–124. [in Chinese] ) |
| [] |
姜振升, 孙晓琦, 艾希珍, 等. 2010. 低温弱光对黄瓜幼苗Rubisco与Rubisco活化酶的影响. 应用生态学报, 21(8): 2045–2050.
( Jiang Z S, Sun X Q, Ai X Z, et al. 2010. Responses of Rubisco and Rubisco activase in cucumber seedlings to low temperature and weak light. Chinese Journal of Applied Ecology, 21(8): 2045–2050. [in Chinese] ) |
| [] |
李海霞, 王真梅, 曾汉来. 2010. 植物Rubisco活化酶的研究进展. 植物生理学报(11): 1092–1100.
( Li H X, Wang Z M, Zeng H L. 2010. The research progresses in Rubisco activase in plant. Plant Physiology Journal(11): 1092–1100. [in Chinese] ) |
| [] |
翁晓燕, 陆庆, 蒋德安. 2001. 水稻Rubisco活化酶在调节Rubisco活性和光合日变化中的作用. 中国水稻科学, 15(1): 35–40.
( Weng X Y, Lu Q, Jiang D A. 2001. Rubisco activase and its regulation on diurnal changes of photosynthetic rate and the activity of ribulose 1, 5-bisphosphate carboxyase/oxygenase (Rubisco). Chinese Journal of Rice Science, 15(1): 35–40. [in Chinese] ) |
| [] |
尹吴, 李丽莎, 王立科, 等. 2012. 转玉米PEPC基因杨树的光合生理特性分析. 林业科学, 48(6): 63–71.
( Yin W, Li L S, Wang L K, et al. 2012. Analysis of photosynthetic characteristics of transgenic poplars with maize PEPC gene. Scientia Silvae Sinicae, 48(6): 63–71. DOI:10.11707/j.1001-7488.20120610 [in Chinese] ) |
| [] |
张国, 李滨, 邹琦. 2005. 小麦Rubisco活化酶基因的克隆和表达特性. 植物学通报, 22(3): 313–319.
( Zhang G, Li B, Zou Q. 2005. Cloning and expression of Rubisco activase gene in wheat. Chinese Bulletin of Botany, 22(3): 313–319. [in Chinese] ) |
| [] | Bayramov S, Guliyev N. 2014. Changes in Rubisco activase gene expression and polypeptide content in Brachypodium distachyon. Plant Physiol Biochem, 81: 61–66. DOI:10.1016/j.plaphy.2014.01.013 |
| [] | DeRidder B P, Salvucci M E. 2007. Modulation of Rubisco activase gene expression during heat stress in cotton (Gossypium hirsutum L. ) involves post-transcriptional mechanisms. Plant Science, 172: 246–254. |
| [] | Hasse D, Larsson A M, Andersson I. 2015. Structure of Arabidopsis thaliana Rubisco activase. Acta Crystallographica, 71(4): 800–808. |
| [] | Jurczyk B, Hura K, Trzemecka A, et al. 2015. Evidence for alternative splicing mechanisms in meadow fescue (Festuca pratensis) and perennial ryegrass (Lolium perenne) Rubisco activase gene. J Plant Physiol, 176: 61–64. DOI:10.1016/j.jplph.2014.11.011 |
| [] | Kurek I, Chang T K, Bertain S M, et al. 2007. Enhanced thermostability of Arabidopsis Rubisco activase improves photosynthesis and growth rates under moderate heat stress. Plant Cell, 19(10): 3230–3241. DOI:10.1105/tpc.107.054171 |
| [] | Leegood R C. 2013. Strategies for engineering C4 photosynthesis. J Plant Physiol, 170(4): 378–388. DOI:10.1016/j.jplph.2012.10.011 |
| [] | Li X, Jiao D. 2005. Transgenic rice overexpressing C4 photosynthetic genes and their application in breeding. Mol Plant Breed, 3(4): 550–556. |
| [] | Mahmoud S S, Wang S L, Moloney M M, et al. 1998. Production of a biologically active novel goldfish growth hormone in Escherichia coli. Comp Biochem Physiol B, 120: 657–663. DOI:10.1016/S0305-0491(98)10059-7 |
| [] | Motohashi K, Kondoh A, Stumpp M T, et al. 2001. Comprehensive survey of proteins targeted by chloroplast thioredoxin. Proc Natl Acad Sci USA, 98(20): 11224–11229. DOI:10.1073/pnas.191282098 |
| [] | Parry M A, Andralojc P J, Scales J C, et al. 2012. Rubisco activity and regulation as targets for crop improvement. J Exp Bot, 64(3): 717–730. |
| [] | Raines C A, Paul M J. 2006. Products of leaf primary carbon metabolism modulate the developmental programme determining plant morphology. Journal of Experimental Botany, 57: 1857–1862. DOI:10.1093/jxb/erl011 |
| [] | Rundle S J, Zielinski R E. 1991. Organization and expression of two tandemly oriented genes encoding ribulose bisphosphate carboxylase/oxygenase activase in barley. Journal of Biological Chemistry, 266: 4677–4685. |
| [] | Salvucci M E, van de Loo F J, Stecher D. 2003. Two isoforms of Rubisco activase in cotton, the products of separate genes not alternative splicing. Planta, 216: 736–744. |
| [] | Sharma A, Komatsu S. 2002. Involvement of a Ca2+-dependent protein kinase component downstream to the gibberellin-binding phosphoprotein, Rubisco activase, in rice. Biochemical and Biophysical Resarch Communications, 290: 690–695. DOI:10.1006/bbrc.2001.6269 |
| [] | Smith A M, Stitt M. 2007. Coordination of carbon supply and plant growth. Plant Cell Environment, 30: 1126–1149. DOI:10.1111/pce.2007.30.issue-9 |
| [] | Stotz M, Mueller O, Ciniawsky S, et al. 2011. Structure of green-type Rubisco activase from tobacco. Nat Strut Mol Biol, 18(12): 1366–1370. DOI:10.1038/nsmb.2171 |
| [] | Teng S, Qian Q, Huang D N. 2001. Advance in molecular biology and genetic engineering of C4 photosynthesis pathway. J Agric Biotechnol, 9(2): 198–201. |
| [] | To K Y, Suen D F, Grace-Chen S C. 1999. Molecular characterization of ribulose-l, 5-bisphosphate carboxylase/oxygenase activase in rice leaves. Planta, 209(1): 66–76. DOI:10.1007/s004250050607 |
| [] | Tsai Y C C, Lapina M C, Bhushan S, et al. 2015. Identification and characterization of multiple rubisco activases in chemoautotrophic bacteria. Nat Commun, 6(3): 8883. |
| [] | Wang D, Li X F, Zhou Z J, et al. 2010. Two Rubisco activase isoforms may play different roles in photosynthetic heat acclimation in the rice plant. Physiol Plantarum, 139(1): 55–67. DOI:10.1111/ppl.2010.139.issue-1 |
| [] | Werneke J M, Chatfield J M, Ogren W L. 1989. Alternative mRNA splicing generates the two ribulose bisphosphate carboxylase/oxygenase activase polypeptides in spinach and arabidopsis. Plant Cell, 1(8): 815–825. DOI:10.1105/tpc.1.8.815 |
| [] | Wu H R, Li L B, Jing Y X, et al. 2007. Over-and anti-sense expressions of the large isoform of ribulose-1, 5-bisphosphate carboxylase/oxygenase activase gene in Oryza sativa affect the photosynthetic capacity. Photosynthetica, 45(2): 194–201. DOI:10.1007/s11099-007-0032-2 |
| [] | Yamori W, Masumoto C, Fukayama H, et al. 2012. Rubisco activase is a key regulator of non-steady-state photosynthesis at any leaf temperature and, to a lesser extent, of steady-state photosynthesis at high temperature. Plant J, 71(6): 871–880. DOI:10.1111/tpj.2012.71.issue-6 |
| [] | Yin Z T, Zhang Z L, Deng D X, et al. 2014. Characterization of Rubisco activase genes in maize: an α-isoform gene functions alongside a β-isoform gene. Plant Physiol, 164(4): 2096–2106. DOI:10.1104/pp.113.230854 |
| [] | Zhang N, Kallis R P, Ewy R G, et al. 2002. Light modulation of Rubisco in Arabidopsis requires a capacity for redox regulation of the larger Rubisco activase isoform. Proceeding of the National Academy of Sciences of the USA, 99(5): 3330–3334. DOI:10.1073/pnas.042529999 |
 2017, Vol. 53
2017, Vol. 53

