文章信息
- 乔沙沙, 周永娜, 刘晋仙, 景炬辉, 贾彤, 李毳, 杨欣, 柴宝峰
- Qiao Shasha, Zhou Yongna, Liu Jinxian, Jing Juhui, Jia Tong, Li Cui, Yang Xin, Chai Baofeng
- 关帝山针叶林土壤细菌群落结构特征
- Characteristics of Soil Bacterial Community Structure in Coniferous Forests of Guandi Mountains, Shanxi Province
- 林业科学, 2017, 53(2): 89-99.
- Scientia Silvae Sinicae, 2017, 53(2): 89-99.
- DOI: 10.11707/j.1001-7488.20170211
-
文章历史
- 收稿日期:2016-09-17
- 修回日期:2016-10-26
-
作者相关文章
2. 山西大学生物技术研究所 太原 030006;
3. 山西财经大学环境经济学院 太原 030006
2. Institute of Biotechnology, Shanxi University Taiyuan 030006;
3. College of Environment and Economics, Shanxi University of Finance and Economics Taiyuan 030006
随着全球生物多样性的逐渐丧失,生物群落多样性形成和维持机制成为生态学研究的热点。通过对动植物的研究,生态学家提出了一些共有模式及其背后生态学过程的假说。大型生物群落构建的基本过程包括扩散、选择、成种和漂变。由于微生物具有世代周期短、种群数量巨大以及横向基因转移等特点,微生物的生态过程和进化过程更多发生在相同的时空尺度,所以微生物群落的构建机制与大型生物相比可能存在一定的差异。同时由于微生物鉴定比较困难,比较难以培养等原因 (Ward et al., 1990),对于微生物群落多样性的研究非常有限。近年来,分子生物学、组学技术和生物信息学的应用,推动了微生物生态学前所未有的发展,人们开始利用微生物系统验证生态学中的一些基本理论,如中性理论、生态位理论等,丰富和发展生态学的理论体系。
关于微生物群落构建机制的争论始于1934年Bass-Becking提出的“Everything is everywhere, but environment selects”的观点,其认为微生物具有极强的扩散能力,不存在扩散限制,选择对于微生物群落的构建起主导性作用,不同的非生物环境因子决定了微生物群落的结构和多样性。近年来的研究结果不断挑战这一观点 (Guo et al., 2015;Lindström et al., 2012),认为环境选择 (生物因子和非生物因子) 和扩散限制是生态系统中生物群落结构形成的2个主要过程 (Cottenie,2005),同样适合于微生物群落。在温带森林中的研究显示,环境生物因子对根际微生物群落的影响主要表现在诸如植物群落的组成 (Roy et al., 2013)、生产力 (Kranabetter et al., 2009)、根系密度 (Peay et al., 2011) 等方面。森林生态系统中真菌群落的分布与非生物因子,如土壤pH (Polme et al., 2013)、土壤营养 (Cox et al., 2010) 和海拔 (Bahram et al., 2012) 等密切相关,支持微生物群落形成过程中环境选择的作用。群落β多样性随地理距离的增加而降低 (distance-decay relationship) 是生物地理学的主要模型,适合于不同的动植物类型、地理梯度和环境,甚至在生态位过程 (环境差异) 和中性过程 (扩散限制) 中也存在这样的模式。最近对微生物群落的研究显示,群落的相似度也表现出随地理距离增加而衰减的模式。土壤真菌群落呈现出高度的局域 (local scale) 的生物多样性,如丛枝菌根 (arbuscular mycorrhizal fungi,AM)、子囊真菌 (ascomyceteous fungi)(Bahram et al., 2013)。对全球尺度 (Polme et al., 2013) 和区域尺度 (regional scale) 的4个热带森林和3个温带森林的外生菌根菌 (ectomycorrhizalfungal) 的研究表明,扩散过程影响了真菌群落的构建 (Tedersoo et al., 2011)。但也有研究显示,外生菌根菌群落不受扩散限制的影响 (Bahram et al., 2012)。对于盐沼湿地原核微生物细菌的研究发现,氨氧化细菌的群落结构,地理尺度从厘米级到大洲之间,群落的相似性在局域和区域尺度上都随地理距离的增加而下降。对于寒温带针叶林土壤微生物群落的研究较少,其中细菌群落多样性及其维持机制的研究未见报道。
山西省庞泉沟自然保护区位于吕梁山脉的关帝山腹地,是以保护世界珍禽褐马鸡 (Crossoptilon mantchuricum) 及其栖息地华北落叶松 (Larix gmeliniivar. principis-rupprechtii)、白杄 (Picea meyeri)、青杄 (Picea wilsonii) 天然次生林为主的森林和野生动物类型的自然保护区。森林群落类型多样、结构差异明显,可以在小尺度范围忽略气候因子的差异,研究森林植被类型和土壤因子对微生物群落结构和功能的影响,又可以利用不同的海拔研究气候因子的影响,是研究微生物群落结构和功能的理想地。本文基于16S rRNA的高通量测序技术研究了该区常绿针叶林[青杄和油松 (Pinus tabulaeformis)]和落叶针叶林 (华北落叶松) 土壤细菌群落的结构,旨在揭示微生物群落结构和功能受气候、环境因子和植物群落的调控机制。
1 材料与方法 1.1 研究区概况庞泉沟自然保护区位于山西省交城、文水、方山、娄烦等县的交界处。地理位置111°22′—111°33′E,37°45′—37°55′N。南北长15 km,东西长14.5 km,总面积10 443.5 hm2,海拔1 600~2 831 m,主要森林类型是由针叶林华北落叶松、白杄、青杄、油松以及山杨 (Populus davidiana)、白桦 (Betula platyphylla)、红桦 (Betula albosinensis) 和辽东栎 (Quercus liaotungensis) 等树种组成的纯林和混交林。气候为暖温带大陆性山地气候,年平均气温4.2 ℃,年平均降水量822.6 mm。成土母质以花岗岩、片麻岩、石英岩和角闪岩为主。土壤属于山地土壤类型,从低到高垂直带谱为山地褐土、山地淋溶褐土、山地棕壤和亚高山草甸土。
试验地设在保护区的神尾沟和八道沟。4个微生物群落 (LpMC1、LpMC2、PwMC、PtMC) 样品分别取自阴坡高海拔华北落叶松林 (111°32′22.81″E,37°53′13.93″N;2 709 m)、阴坡低海拔华北落叶松林 (111°30′33.77″E,37°53′06.30″N;1 950 m)、阴坡青杄林 (111°27′9.12″E,37°51′56.22″N;1 888 m) 和阳坡油松林 (111°27′39.16″E,37°50′54.30″N;1 894 m)。
1.2 样品采集于2015年7月采样。运用5点混合取样法采集土壤,即在每个采样地点设置10 m×10 m的样方,利用对角线法选取5个点。首先去除地表约5 cm厚的地表植被和覆盖物,再用土钻钻取0~20 cm深的土壤样品,放入无菌塑料袋内,冰盒内保存,尽快带回实验室,并于-20 ℃下保存。在24 h之内,将每个样地的5个土壤样品混合均匀并过直径为2 mm的网筛,除去根系、石块等杂物,其中一部分风干用于土壤理化性质的测定,一部分放入-80 ℃冰箱保存,用于高通量测序。
1.3 分析方法 1.3.1 土壤环境因子分析1) 土壤理化性质分析自然风干的土样用于土壤理化性质测定。土壤含水量用烘干法测定,将盛有新鲜土样的铝盒置于105 ℃的烘箱中过夜烘干至恒质量;用容量瓶法测定土壤密度,并计算土壤孔隙度;土壤粒径用马尔文mastersizer 2000测定;土壤pH (土水比为1:2.5) 用电位法测定,称取10 g风干土样加入25 mL无CO2蒸馏水,搅拌均匀,静置30 min后测定;土壤温度 (T10) 用LI-6400的温度探针测定;土壤全氮 (TN)、全碳 (TC)、全硫 (TS) 用vario MACRO cube元素分析仪 (德国) 测定。
2) 土壤酶活性分析脲酶采用苯酚钠-次氯酸钠比色法,其活性以37 ℃下培养24 h后1 g土壤产生的NH3-N的毫克数表示;蔗糖酶采用3,5-二硝基水杨酸比色法,其活性以37 ℃培养24 h后1 g土壤产生的葡萄糖的毫克数表示;H2O2酶采用KMnO4滴定法,其活性以20 min内1 g土壤分解的过氧化氢的毫克数表示 (关松荫,1986)。
1.3.2 土壤细菌群落高通量测序分析4个样地的土壤样品分别称取0.5 g,各3次重复,用E.Z.N.A.Soil DNA Kit试剂盒 (Sangon公司,中国) 提取土壤微生物基因组总DNA,详细步骤参考试剂盒说明书。将提取到的土壤微生物总DNA溶解于100 μL无菌水后,通过微量紫外分光光度计 (NanoDrop ND-1000 UV-Vis) 测定DNA的浓度和纯度 (OD260 /OD280和OD260/OD230)。此外,利用1.2%的琼脂糖凝胶电泳分离5 μL的DNA (0.5 ×TAE缓冲液),分析DNA的完整性和相对浓度。最后将每个土样提取出的3个DNA样品充分混合后送往上海生物工程有限公司进行高通量测序。通过Illumina Hiseq测序平台,利用引物341(CCCTACACGACG CTCTTCCGATCTG (barcode) CCTACGGGNGGCWG CAG) 和805R (GACTGGAGTTCCTTGGCACCCGAG AATTCCAGACTACHVGGGTATCTAATCC) 对16S rDNA高变区V3-V4区进行测序。PCR扩增体系主要包括: 0.5 μL的PlantiumTaq (5 U·μL-1),5.0 μL的10×EasyTaq Buffer (Mg2 +Plus),4.0 μL的dNTPs,0.5 μL的引物50 μmol·L-1,加入5.0 μL的DNA模板和无菌水至50 μL反应体系。PCR扩增的反应条件:94 ℃,3.0 min; 5 × (94 ℃,30 s; 45 ℃,20 s; 65 ℃,30 s); 20 × (94 ℃,20 s; 55 ℃,20 s; 72 ℃,30 s); 72 ℃,5 min。
1.4 数据分析各样地变量之间的显著性差异均采用单因素方差分析 (one-way analysis) 和多重比较分析 (LSD),土壤环境因子和细菌群落结构之间的相关性采用Pearson相关性分析。所有分析采用SPSS 19.0软件和Excel 2013软件进行,显著性水平设为P < 0.05。利用Mothur软件计算土壤细菌群落的Alpha多样性值,包括Shannon指数、Chao1指数、Simpson指数和ACE指数等,用以评估样品中的物种丰富度和物种多样性。基于β多样性计算中的Unifrac metric距离计算结果作距离热图,来衡量样本间物种组成的相似度。使用Canoco 4.5软件对土壤环境因子和细菌群落进行冗余分析 (redundancy analysis, RDA),为保证数据满足正态分布及减小异常值对分析结果的影响,对数据进行log (x+1) 转换,显著性水平为α=0.05。
2 结果与分析 2.1 不同森林类型的土壤环境因子 2.1.1 土壤理化性质本研究调查了3种针叶林4个样地土壤理化性质 (表 1)。土壤pH在4个样地间差异显著,阳坡生长的温带针叶林油松林土壤偏碱性,而阴坡生长的寒温性针叶林华北落叶松和青杄林样地土壤均呈弱酸性。土壤碳氮含量及其比值在4个样地间差异显著,高海拔华北落叶松样地的碳氮含量最大,而低海拔华北落叶松样地中碳含量以及碳氮比最小,说明气候条件 (温度、降水) 对土壤碳氮含量具有一定的影响。油松林样地中碳氮比最大、氮含量最小,说明温性常绿针叶林和寒温性落叶针叶林土壤碳氮代谢过程和效率存在差异性。4个样地土壤含水率介于8.55%~47.93%之间,高海拔落叶松林样地中土壤含水率最高,阳坡油松林样地中最低,低海拔落叶松林和云杉林样地之间无显著性差异。高海拔落叶松林样地的土壤粒径显著大于其他3个样地,而土壤温度小于其他3个样地,较低海拔的落叶松林、云杉林和油松林样地之间无显著差异。云杉林样地中土壤孔隙度最大,其他3个样地之间无显著性差异。高海拔落叶松林样地土壤的总硫含量最多,而低海拔落叶松林和油松林样地中较少,且无显著差异。
|
|
土壤酶主要来源于动植物和微生物细胞的分泌及其残体的腐解 (关松荫,1986)。植物种类和组成不同,根系分秘物和枯落物的质和量就不同,导致土壤酶活性的差异。本研究中4个样地土壤酶活性差异显著 (表 1)。油松林土壤过氧化氢酶和脲酶活性显著大于其他3个样地,低海拔华北落叶松林土壤中这2种酶的活性均为最小;高海拔和低海拔落叶松林样地之间2种酶的活性无显著差异。蔗糖酶活性在4个样地间差异显著,高海拔华北落叶松林的土壤蔗糖酶活性最高 (6.07±0.373) mg·g-1(24 h)-1,油松林样地土壤蔗糖酶活性最低 (0.58±0.041) mg·g-1(24 h)-1。
2.1.3 土壤酶活性与土壤理化性质的关系土壤酶在土壤生态系统物质循环和能量流动过程中扮演着重要角色 (周礼恺,1987),可以作为土壤质量的生物活性指标。对土壤酶活性和土壤理化性质进行相关性分析 (表 2),结果显示,针叶林土壤过氧化氢酶和脲酶活性与土壤pH呈显著或极显著正相关,蔗糖酶活性与土壤含水率、碳氮硫含量均呈极显著正相关,与pH呈显著负相关。
|
|
利用Illumina高通量测序方法分析土壤细菌群落的多样性和结构,测序结果经优化后得到各样地土壤16S序列数共58 904条,总碱基数24 504 064 bp,平均长度416 bp。样品稀释曲线如图 1,曲线虽未达到平缓,但文库的覆盖率已超过0.70(表 3),因此本次测序深度可以反映土壤细菌群落的真实情况。

|
图 1 4个细菌群落高通量测序16S rDNA稀释性曲线 Fig.1 Rarefaction curves of 16S rDNA for high throughput sequencing of four bacteria communities |
|
|
物种多样性与生态系统的功能密切相关。本研究中4种土壤细菌群落的多样性如表 3所示。依据细菌OTU数量计算出的α多样性指数中,Chao1指数和ACE指数在LpMC1中最大,PtMC中最小;Shannon指数在PtMC中最大,LpMC1中最小;而Simpson指数则在LpMC1中最大,PtMC中最小。因此,样地LpMC1中群落丰富度最大,多样性最小,而PtMC中群落多样性最大,丰富度最小。2个样地间土壤因子的差异可能是导致细菌群落结构差异的主要原因,如PtMC所在的油松林土壤pH (8.13±0.038)、过氧化氢酶活性 (1.05±0.223) mg·g-1 (20 min)-1和脲酶活性 (4.45±0.148) mg·g-1 (24 h)-1最大,含水率 (8.55±0.99)%、氮含量 (0.124±0.002)%和蔗糖酶活性 (0.58±0.041) mg·g-1 (24 h)-1最小,而LpMC1所在的高海拔落叶松样地正好相反,因此,土壤pH、含水率、氮含量以及土壤酶活性是影响细菌群落丰富度和多样性的主要环境因素。
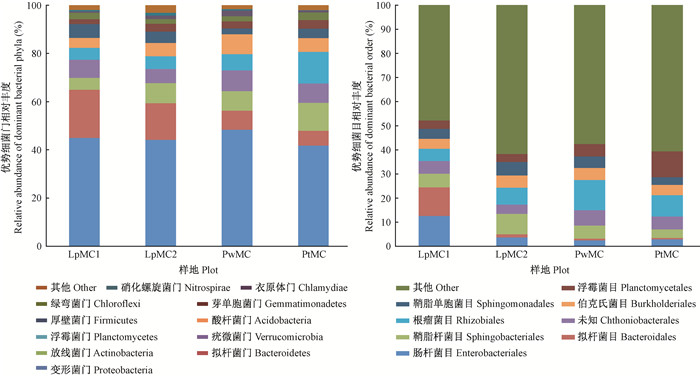
2.2.2 土壤细菌群落β多样性基于样本间unifrac距离矩阵绘制的距离热图 (图 2) 可以看出,PwMC和PtMC以及LpMC1和LpMC2分别聚为一类,说明PwMC和PtMC之间以及LpMC1和LpMC2之间细菌群落组成具有相似性。4个样地土壤细菌群落 (LpMC1、LpMC2、PwMC、PtMC) 中共有31个细菌门,丰度大于1%的细菌门共有11个 (图 3A),其中变形菌门 (Proteobacteria)(44.93%,44.19%,48.40%,41.77%)、拟杆菌门 (Bacteroidetes)(20.05%,15.18%,7.87%,6.21%)、放线菌门 (Actinobacteria)(4.89%,8.31%,8.15%,11.53%)、疣微菌门 (Verrucomicrobia)(7.56%,5.92%,8.56%,8.01%)、浮霉菌门 (Planctomycetes)(4.92%,5.20%,6.72%,13.21%)、酸杆菌门 (Acidobacteria)(4.14%,5.60%,8.31%,5.63%) 丰度较大,这些门的细菌主要执行有机质分解功能 (Li et al., 2016;Stursova et al., 2012)。厚壁菌门 (Firmicutes)(5.68%,4.65%,2.41%,3.93%)、芽单胞菌门 (Gemmatimonadetes)(2.07%,3.28%,2.90%,3.57%)、绿弯菌门 (Chloroflexi)(2.60%,1.98%,2.09%,3.16%)、衣原体门 (Chlamydiae)(0.68%,1.44%,2.42%,0.78%) 和硝化螺旋菌门 (Nitrospirae)(0.53%,1.19%,0.57%,0.20%) 丰度较小,这些门的细菌主要作用是固氮和固碳 (Debruyn et al., 2011;Huang et al., 2011;Zhang et al., 2016)。

|
图 2 目水平样本距离热图 Fig.2 Heatmap of distance at order level |
|
图 3 优势细菌门 (A) 和优势细菌目相对丰度 (B) Fig.3 Relative abundance of dominant bacteria phyla (A) and dominant bacteria order (B) |
LpMC1、LpMC2、PwMC、PtMC群落中丰度大于5%的细菌目共有8个 (图 3B),分别是γ-变形菌纲 (γ-proteobacteria) 中的肠杆菌目 (Enterobacteriales)(12.57%,3.66%,2.46%,2.90%)、α-变形菌纲 (α-proteobacteria) 中的鞘脂单胞菌目 (Sphingobacteriales)(5.67%,8.45%,5.44%,3.60%) 和根瘤菌目 (Rhizobiales)(5.08%,6.98%,12.50%,8.91%)、β-变形菌纲 (β-proteobacteria) 中的伯克氏菌目 (Burkholderiales)(4.13%,5.13%,5.07%,4.20%)、拟杆菌门的拟杆菌目 (Bacteroidales)(11.93%,1.37%,0.72%,0.54%) 和鞘脂杆菌目 (Sphingobacteriales)(5.67%,8.45%,5.44%,3.60%)、浮霉菌门的浮霉菌目 (Planctomycetales)(3.50%,3.29%,5.10%,10.71%) 以及Chthoniobacterales (5.21%,3.83%,6.33%,5.28%)。其中,肠杆菌目 (12.57%) 和拟杆菌目 (11.93%) 在样地LpMC1中占优势,鞘脂杆菌目 (8.45%)、根瘤菌目 (12.50%) 和浮霉菌目 (10.71%) 分别是样地LpMC2、PwMC和PtMC中的优势细菌目。
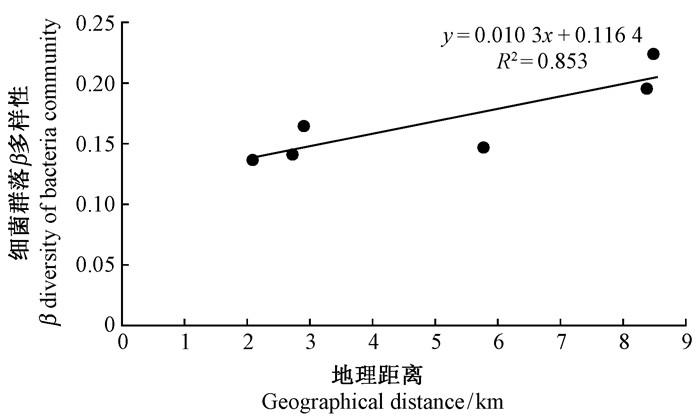
样地PwMC和PtMC海拔接近,分别为1 888 m和1 894 m,地理距离相对较近 (2.11 km)。LpMC1和LpMC2样地海拔较高,与PwMC和PtMC样地的地理距离较远,而且之间有山梁间隔。研究区细菌群落β多样性与地理距离的关系如图 4所示,二者之间具有一定的相关性 (R2=0.853),说明一定程度上地理距离和阻隔影响森林土壤细菌群落的β多样性,扩散限制可能是研究区细菌群落多样性的一个影响因素。
|
图 4 细菌群落β多样性与地理距离相关性 Fig.4 Relationship between bacterial community β diversity and geographic distance |
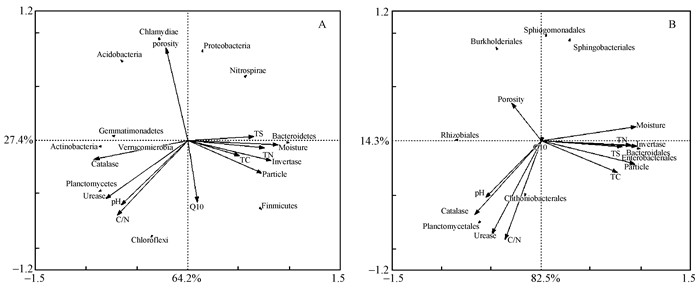
对优势细菌门和优势细菌目相对丰度和土壤环境因子进行冗余分析 (图 5),结果显示第1轴和第2轴累计解释变异量分别达到91.6%和96.8%,说明土壤环境因子对细菌群落结构具有很大的影响。在门水平上 (图 5A),土壤过氧化氢酶活性 (r=-0.924 8)、含水率 (r=0.889 5)、蔗糖酶活性 (r=0.822 1)、脲酶活性 (r=-0.811 8)、碳氮比 (r=-0.697 8) 以及pH (r=-0.658 9) 与轴1的相关性较大,第1轴解释率达到了64.2%。在目水平上 (图 5B),土壤含水率 (r=0.957 4)、蔗糖酶活性 (r=-0.697 8)、过氧化氢酶活性 (r=-0.697 8) 和脲酶活性 (r=-0.697 8) 与轴1相关性较大,pH (r=-0.697 8) 和碳氢比 (r=-0.697 8) 与轴2相关性较大,第1轴解释率达到了82.5%。由此可见,土壤含水率、碳氮比、pH、过氧化氢酶活性、脲酶活性以及蔗糖酶活性对细菌群落结构影响显著。
|
图 5 优势细菌门 (A) 和优势细菌目 (B) 与土壤环境因子冗余分析 Fig.5 Redundancy analysis (RDA) on soil dominant bacteria phyla (A) and soil dominant bacteria order (B) constrained by soil variables |
对优势细菌类群和土壤环境因子进行Pearson相关性分析,结果如表 4所示。在门水平上,变形菌门和拟杆菌门丰度与pH呈显著负相关,放线菌门、疣微菌门、浮霉菌门以及绿弯菌门则呈显著或极显著正相关;拟杆菌门和厚壁菌门与土壤含水率呈显著或极显著正相关,放线菌门和浮霉菌门呈显著或极显著负相关;放线菌门、浮霉菌门和绿弯菌门与土壤碳氮比呈显著或极显著正相关,变形菌门和拟杆菌门呈显著或极显著负相关;拟杆菌门与过氧化氢酶活性呈显著或极显著负相关,疣微菌门和浮霉菌门与过氧化氢酶活性呈显著正相关;拟杆菌门与脲酶活性呈显著或极显著负相关,放线菌门、疣微菌门、浮霉菌门和绿弯菌门呈显著或极显著正相关;放线菌门和浮霉菌门与蔗糖酶活性呈显著或极显著负相关,拟杆菌门和厚壁菌门呈显著或极显著正相关。
|
|
在目水平上,浮霉菌目与土壤pH呈显著或极显著正相关;肠杆菌目和拟杆菌目与土壤含水率呈显著或极显著正相关,根瘤菌目和浮霉菌目显著或极显著负相关;浮霉菌目与土壤碳氮比呈显著或极显著正相关,鞘脂杆菌目、伯克氏菌目和鞘脂单胞菌目呈显著或极显著负相关;鞘脂杆菌目与过氧化氢酶活性呈显著或极显著负相关,浮霉菌目呈显著正相关;鞘脂杆菌目和鞘脂单胞菌目与脲酶活性呈显著或极显著负相关,浮霉菌目呈显著或极显著正相关;根瘤菌目和浮霉菌目与蔗糖酶活性呈显著或极显著负相关,肠杆菌目和拟杆菌目呈显著或极显著正相关。
3 讨论土壤微生物参与土壤碳、氮等元素的循环及养分的转化过程,调控土壤碳截获能力、碳矿化过程以及生态系统生产力 (Han et al., 2007)。北方森林生态系统中储存有大量的凋落物,土壤营养丰富,因此相比于固碳、固氮微生物,土壤中分解有机质的微生物更占优势,本研究中变形菌门 (41.77%~48.40%)、拟杆菌门 (6.21%~20.05%)、放线菌门 (4.89%~11.53%) 在寒温性针叶林土壤细菌群落中占绝对优势。土壤含水率、pH以及碳氮比是本区寒温性针叶林细菌群落结构的主要影响因子,这一观点与前人的研究 (Lauber et al., 2009;Logue et al., 2011) 基本一致。细菌群落对土壤含水率的变化敏感,Schimel等 (1999)研究发现,长时间干燥能够导致土壤微生物呼吸和生物量降低,微生物群落结构发生变化,尤其是潮湿和干燥的时间长度对土壤微生物影响较大。pH在土壤生物地球化学循环过程中具有重要作用,与植被类型、土壤类型、管理措施等有关 (Lauber et al., 2008),对土壤中的物理颗粒之间的相互吸附、水溶液解吸、土壤颗粒溶解沉淀、化学配合反应都具有调节作用,是细菌在大尺度范围内分布的首要影响因子 (Chu et al., 2010;Shen et al., 2013;Yuan et al., 2014)。本研究小尺度范围的生境中,pH可以通过改变土壤理化性质,进而影响细菌群落的结构。土壤碳氮比通常被认为是土壤质量的敏感指标,可衡量土壤C、N营养平衡状况,低的碳氮比可以加快微生物的分解和氮的矿化速率 (Högberg et al., 2006)。根据对碳矿化潜力和生长速率的不同,一些学者将土壤细菌分为富营养型和贫营养型2种 (Fierer et al., 2007)。富营养型细菌生活在营养丰富的环境中,主要分解土壤表层不稳定C库,包括拟杆菌门和α、γ变形菌纲;相反,贫营养型细菌主要分解土壤深层难降解C库,包括放线菌门、酸杆菌和δ变形菌 (Bastian et al., 2009;Fierer et al., 2007)。本研究表明,拟杆菌门和变形菌门与土壤碳氮比呈显著负相关,而放线菌门、浮霉菌门和绿弯菌门呈正相关,且本研究中营养状况良好的样地的细菌群落,如LpMC1中肠杆菌目 (γ-变形菌纲) 和拟杆菌目 (拟杆菌门) 占优势,鞘脂杆菌目 (拟杆菌门) 和根瘤菌目 (α-变形菌纲) 分别是LpMC2和PwMC中的优势类群,而营养贫瘠的样地的细菌群落,如PtMC中浮霉菌目为优势类群,进一步印证了上述学者的观点。Zeng等 (2016)研究发现,在酸性表层土壤中,β-变形菌和拟杆菌门占优势,主要分解纤维素 (Stursova et al., 2012),而放线菌门丰度与土壤pH和碳氮比呈正相关,与水分呈负相关,与本研究结果一致 (表 4),说明在森林生态系统中,变形菌门中的大部分类群和拟杆菌门更适于生活在酸性、湿度大、营养状况良好的土壤中,主要碳源是易分解性碳;放线菌门、浮霉菌门和绿弯菌门则在碱性、干旱、营养贫瘠的土壤中更占优势,主要分解顽固性碳。由表 1和表 4可知,LpMC1样地的土壤环境更适于变形菌门和拟杆菌门的生存,因此细菌的均匀度最小,多样性最小,而PtMC样地的土壤环境适于多数细菌的生存,因此细菌的多样性最大。本研究结果说明,环境选择对土壤细菌群落组成具有显著作用。
β多样性分析结果表明,PwMC和PtMC之间以及LpMC1和LpMC2之间细菌群落结构分别具有更高的相似性 (图 2),说明土壤细菌群落除受土壤环境因子影响外,还受其他环境因子如植被类型和地理距离的影响。陆地生态系统中的土壤微生物绝大多数为异养微生物,主要以植物分泌物或植物残体为食,因此,植被对土壤微生物的组成和功能有很大影响 (Hooper et al., 2000)。目前关于植被类型对土壤细菌群落的影响机制没有统一结论。有研究认为,植被可能通过凋落物影响土壤微生物群落组成,因为树种对森林凋落物的性质和分解状况有较大的影响,云杉林和油松林凋落物质地较硬,木质类物质含量较高 (常雅军等,2009),而木质类物质会抑制微生物的分解作用 (Taylor et al., 1989),因此不同的树种会对微生物产生不同的影响。另外,植被类型可以通过植物根系分泌物对细菌群落产生影响。根系分泌物可为土壤微生物提供碳源和能源,植物通过向土壤中输入氨基酸、有机酸、糖类、酚类和次生代谢产物等低分子量化合物以及黏液和蛋白质等高分子质量化合物 (刘欣宇等,2015) 对微生物数量、种类、代谢及生长发育产生积极或消极的影响 (Martinez-Toledo et al., 1988),其中酚酸类物质对土壤微生物生长起抑制作用 (朱丽霞等,2003)。土壤酶是植物根际分泌物中的一类重要物质,过氧化氢酶主要由植物根系分泌,脲酶和蔗糖酶主要由植物根系和土壤微生物共同分泌 (关松荫,1986)。土壤酶可以通过改变土壤的理化性质间接对土壤微生物群落结构产生一定影响。本研究表明,过氧化氢酶活性与放线菌门、绿弯菌门及浮霉菌目等细菌丰度呈正相关,与鞘脂杆菌目和鞘脂单胞菌目等细菌呈正相关,蔗糖酶活性呈相反趋势。这可能是由于土壤酶的释放改变了土壤pH、碳氮含量等土壤理化性质,如过氧化氢酶和脲酶的释放提高了土壤的pH,更有利于放线菌门、浮霉菌门和绿弯菌门的生存;蔗糖酶的释放降低了土壤pH,增加了土壤营养元素的含量,更有利于变形菌门和拟杆菌门的生存。因此,植被类型通过凋落物和根系分泌物对土壤微生物群落结构产生一定影响。
最近对微生物群落的相关研究证实,群落相似度表现出随地理距离的增加而衰减的模式 (徐冰等,2014)。尽管有些物种全球分布,但局域水平上的β多样性是扩散限制导致的 (Martiny et al., 2011)。对本研究中的细菌群落β多样性和样地之间的地理距离进行相关性分析发现,两者之间呈显著正相关 (R2=0.853)(图 4),说明细菌群落之间的差异在一定程度上受扩散限制的影响。
4 结论1) 关帝山庞泉沟自然保护区针叶林土壤细菌群落中,具有分解功能的变形菌门、拟杆菌门、放线菌门、疣微菌门、浮霉菌门和酸杆菌门占优势;其中,变形菌门中的大部分类群和拟杆菌门在酸性、湿度大、营养状况良好的土壤中更占优势,主要碳源是易分解碳;放线菌门、浮霉菌门和绿弯菌门在碱性、干旱、营养贫瘠的土壤中更占优势,主要分解顽固性碳。通过人为管理措施,降低这些细菌的丰度有利于提高森林土壤的碳汇。
2) 土壤细菌群落多样性在4个样地间均有差异,在营养贫瘠的油松林土壤中PtMC丰富度低,多样性高;在营养丰富的高海拔华北落叶松林LpMC1中丰富度高,多样性低。
3) 青杄林样地PwMC和油松林样地PtMC以及高海拔华北落叶松样地LpMC1和低海拔华北落叶松样地LpMC2中的细菌群落结构分别具有相似性,说明环境选择 (含水率、碳氮比、pH、土壤酶活性、森林类型) 和扩散限制对土壤细菌群落结构均有显著影响,而环境选择作用更为明显。
本研究结果不仅有助于了解局域细菌群落的构建机制,也为预测微生物群落对环境条件变化的响应、适应和反馈提供理论依据。据此,通过制定不同的育林措施,可改变林下土壤环境因子,进而优化土壤细菌群落结构,提高土壤碳汇,促进土壤氮、硫、磷等营养物质的循环,提高土壤肥力。
| [] |
常雅军, 曹靖, 李建建, 等. 2009. 秦岭西部山地针叶林凋落物层的化学性质. 生态学杂志, 28(07): 1308–1315.
( Chang Y J, Cao J, Li J J, et al. 2009. Chemical properties of litter layers in coniferous forests of western Qinling Mountains. Chinese Journal of Ecology, 28(07): 1308–1315. [in Chinese] ) |
| [] |
关松荫. 1986. 土壤酶及其研究法. 北京: 中国农业出版社.
( Guan S Y. 1986. Soil enzymes and research method. Beijing: China Agriculture Press. [in Chinese] ) |
| [] |
刘欣宇, 霍姗姗, 陈歆, 等. 2015. 植物根系分泌物的组成及分析方法研究进展. 中国热带农业(3): 100–106.
( Liu X Y, Huo S S, Chen X, et al. 2015. The research development of composition and analysis methods of plant root secretion. China Tropical Agriculture(3): 100–106. [in Chinese] ) |
| [] |
徐冰, 张大勇. 2014. 微生物多样性及其分布的研究进展:模式与过程. 生命科学, 26(2): 144–152.
( Xu B, Zhang D Y. 2014. Progress on the biodiversity of microorganisms:patterns and processes. Chinese Bulletin of Life Sciences, 26(2): 144–152. [in Chinese] ) |
| [] |
周礼恺. 1987. 土壤酶学. 北京: 科学出版社.
( Zhou L K. 1987. Soil Enzymology. Beijing: Science Press. [in Chinese] ) |
| [] |
朱丽霞, 章家恩, 刘文高. 2003. 根系分泌物与根际微生物相互作用研究综述. 生态环境, 12(1): 102–105.
( Zhu L X, Zhang J E, Liu W G. 2003. Review of studies on interactions between root exudatesand rhizopheric microorganisms. Ecology and Environment, 12(1): 102–105. [in Chinese] ) |
| [] | Bahram M, Kõljalg U, Courty P, et al. 2013. The distance decay of similarity in communities of ectomycorrhizal fungi in different ecosystems and scales. Journal of Ecology, 101(5): 1335–1344. DOI:10.1111/jec.2013.101.issue-5 |
| [] | Bahram M, Polme S, Koljalg U, et al. 2012. Regional and local patterns of ectomycorrhizal fungal diversity and community structure along an altitudinal gradient in the Hyrcanian forests of northern Iran. New Phytologist, 193(2): 465–473. DOI:10.1111/j.1469-8137.2011.03927.x |
| [] | Bastian F, Bouziri L, Nicolardot B, et al. 2009. Impact of wheat straw decomposition on successional patterns of soil microbial community structure. Soil Biology and Biochemistry, 41(2): 262–275. DOI:10.1016/j.soilbio.2008.10.024 |
| [] | Chu H, Fierer N, Lauber C L, et al. 2010. Soil bacterial diversity in the Arctic is not fundamentally different from that found in other biomes. Environmental Microbiology, 12(11): 2998–3006. DOI:10.1111/emi.2010.12.issue-11 |
| [] | Cottenie K. 2005. Integrating environmental and spatial processes in ecological community dynamics. Ecology Letters, 8(11): 1175–1182. DOI:10.1111/j.1461-0248.2005.00820.x |
| [] | Cox F, Barsoum N, Lilleskov E A, et al. 2010. Nitrogen availability is a primary determinant of conifer mycorrhizas across complex environmental gradients. Ecology Letters, 13(9): 1103–1113. DOI:10.1111/j.1461-0248.2010.01494.x |
| [] | Debruyn J M, Nixon L T, Fawaz M N, et al. 2011. Global biogeography and quantitative seasonal dynamics of gemmatimonadetes in soil. Applied and Environmental Microbiology, 77(17): 6295–6300. DOI:10.1128/AEM.05005-11 |
| [] | Fierer N, Bradford M A, Jackson R B. 2007. Toward an ecological classification of soil bacteria. Ecology, 88(6): 1354–1364. DOI:10.1890/05-1839 |
| [] | Guo G, Kong W, Liu J, et al. 2015. Diversity and distribution of autotrophic microbial community along environmental gradients in grassland soils on the Tibetan Plateau. Applied Microbiology and Biotechnology, 99(20): 8765–8776. DOI:10.1007/s00253-015-6723-x |
| [] | Han W, Kemmitt S J, Brookes P C. 2007. Soil microbial biomass and activity in Chinese tea gardens of varying stand age and productivity. Soil Biology and Biochemistry, 39(7): 1468–1478. DOI:10.1016/j.soilbio.2006.12.029 |
| [] | Högberg M N, Högberg P, Myrold D D. 2006. Is microbial community composition in boreal forest soils determined by pH, C-to-N ratio, the trees, or all three?. Oecologia, 150(4): 590–601. DOI:10.1007/s00442-006-0562-5 |
| [] | Hooper D U, Bignell D E, Brown V K, et al. 2000. Interactions between aboveground and belowground biodiversity in terrestrial ecosystems:Patterns, mechanisms, and feedbacks. BioScience, 50(12): 1049–1061. DOI:10.1641/0006-3568(2000)050[1049:IBAABB]2.0.CO;2 |
| [] | Huang L N, Tang F Z, Song Y S, et al. 2011. Biodiversity, abundance, and activity of nitrogen-fixing bacteria during primary succession on a copper mine tailings. FEMS Microbiology Ecology, 78(3): 439–450. DOI:10.1111/fem.2011.78.issue-3 |
| [] | Kranabetter J M, Durall D M, Mackenzie W H. 2009. Diversity and species distribution of ectomycorrhizal fungi along productivity gradients of a southern boreal forest. Mycorrhiza, 19(2): 99–111. DOI:10.1007/s00572-008-0208-z |
| [] | Lauber C L, Hamady M, Knight R, et al. 2009. Pyrosequencing-Based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale. Applied and Environmental Microbiology, 75(15): 5111–5120. DOI:10.1128/AEM.00335-09 |
| [] | Lauber C L, Strickland M S, Bradford M A, et al. 2008. The influence of soil properties on the structure of bacterial and fungal communities across land-use types. Soil Biology and Biochemistry, 40(9): 2407–2415. DOI:10.1016/j.soilbio.2008.05.021 |
| [] | Li X, Sun M, Zhang H, et al. 2016. Use of mulberry-soybean intercropping in salt-alkali soil impacts the diversity of the soil bacterial community. Microbial Biotechnology, 9(3): 293–304. DOI:10.1111/mbt2.2016.9.issue-3 |
| [] | Lindström E S, Langenheder S. 2012. Local and regional factors influencing bacterial community assembly. Environmental Microbiology Reports, 4(1): 1–9. DOI:10.1111/j.1758-2229.2011.00257.x |
| [] | Logue J B, Lindström E S. 2011. Species sorting affects bacterioplankton community composition as determined by 16S rDNA and 16S rRNA fingerprints. ISME Journal, 4: 729–738. |
| [] | Martinez-Toledo M V, De La Rubia T. 1988. Root exudates of Zea mays and production of auxins, gibberellins and cytokinins by Azotobacter chroococcum. Plant and Soil, 110: 149–152. DOI:10.1007/BF02143553 |
| [] | Martiny J B H, Eisen J A, Penn K, et al. 2011. Drivers of bacterial-diversity depend on spatial scale. Proceedings of the National Academy of Sciences, 108(19): 7850–7854. DOI:10.1073/pnas.1016308108 |
| [] | Peay K G, Kennedy P G, Bruns T D. 2011. Rethinking ectomycorrhizal succession:are root density and hyphal exploration types drivers of spatial and temporal zonation?. Fungal Ecology, 4(3): 233–240. DOI:10.1016/j.funeco.2010.09.010 |
| [] | Polme S, Bahram M, Yamanaka T, et al. 2013. Biogeography of ectomycorrhizal fungi associated with alders (Alnus spp.) in relation to biotic and abiotic variables at the global scale. New Phytologist, 198(4): 1239–1249. DOI:10.1111/nph.12170 |
| [] | Roy M, Rochet J, Manzi S, et al. 2013. What determines Alnus-associated ectomycorrhizal community diversity and specificity? A comparison of host and habitat effects at a regional scale. New Phytologist, 198(4): 1228–1238. DOI:10.1111/nph.12212 |
| [] | Schimel J P, Gulledge J M, Clein-Curley J S, et al. 1999. Moisture effects on microbial activity and community structure in decomposing birch litter in the Alaskan taiga. Soil Biology& Biochemistry, 31(6): 831–838. |
| [] | Shen C, Xiong J, Zhang H, et al. 2013. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain. Soil Biology and Biochemistry, 57: 204–211. DOI:10.1016/j.soilbio.2012.07.013 |
| [] | Stursova M, Zifcakova L, Leigh M B, et al. 2012. Cellulose utilization in forest litter and soil:identification of bacterial and fungal decomposers. FEMS Microbiology Ecology, 80(3): 735–746. DOI:10.1111/fem.2012.80.issue-3 |
| [] | Taylor B R, Parkinson D, Parsons W F J. 1989. Nitrogen and lignin content as predictors of litter decay rates:A microcosm test. Ecology, 70(1): 97–104. DOI:10.2307/1938416 |
| [] | Tedersoo L, Bahram M, Jairus T, et al. 2011. Spatial structure and the effects of host and soil environments on communities of ectomycorrhizal fungi in wooded savannas and rain forests of Continental Africa and Madagascar. Molecular Ecology, 20(14): 3071–3080. DOI:10.1111/mec.2011.20.issue-14 |
| [] | Ward D M, Weller R, Bateson M M. 1990. 16S rRNA sequences reveal numerous uncultured microorganisms in a natural community. Nature, 345(6270): 63–65. DOI:10.1038/345063a0 |
| [] | Yuan Y, Si G, Wang J, et al. 2014. Bacterial community in alpine grasslands along an altitudinal gradient on the Tibetan Plateau. FEMS Microbiology Ecology, 87(2014): 121–132. |
| [] | Zeng Q, Dong Y, An S. 2016. Bacterial community responses to soils along a latitudinal and vegetation gradient on the Loess Plateau, China. PLoS ONE, 11(4): e152894. |
| [] | Zhang B, Kong W, Wu N, et al. 2016. Bacterial diversity and community along the succession of biological soil crusts in the Gurbantunggut Desert, Northern China. Journal of Basic Microbiology, 56(6): 670–679. DOI:10.1002/jobm.v56.6 |
 2017, Vol. 53
2017, Vol. 53

