文章信息
- 董虹妤, 刘青华, 周志春, 金国庆, 沈丹玉, 宋新回
- Dong Hongyu, Liu Qinghua, Zhou Zhichun, Jin Guoqing, Shen Danyu, Song Xinhui
- 马尾松子代生长杂种优势与亲本配合力、遗传距离的相关性
- Correlation between Heterosis in the Growth of Progeny and Combining Ability and Genetic Distance of the Parents for Pinus massoniana
- 林业科学, 2017, 53(2): 65-75.
- Scientia Silvae Sinicae, 2017, 53(2): 65-75.
- DOI: 10.11707/j.1001-7488.20170208
-
文章历史
- 收稿日期:2016-03-07
- 修回日期:2016-07-29
-
作者相关文章
2. 浙江省淳安县姥山林场 淳安 311700
2. Laoshan Forest Farm of Chun'an Country, Zhejiang Province Chun'an 311700
杂种优势是指2个遗传组成不同的亲本通过杂交产生的后代在生活力、生长势、适应性、繁殖力、抗逆性等方面表现出优于亲本的现象,这种现象在自然界中普遍存在 (李义良等,2012)。自1914年Shull首次提出杂种优势的概念以来,杂种优势在杨属 (Populus)、松属 (Pinus)、柳属 (Salix)、桉属 (Eucalyptus)、榉属 (Zelkova) 等树种的育种和生产实践中得到了广泛应用。如湿地松 (P. elliottii) 与洪都拉斯加勒比松 (P. caribaeavar. hondurensis) 的杂交后代杂种优势明显,产生的杂交组合平均材积比对照高221.36%,筛选出适用于推广的优良杂交组合材积生长较对照的现实增益可达216.19%~379.15%(赵奋成等,2006)。
在杂交育种过程中,如何实现优良亲本的选配,进而选择强优势组合,是关系到杂种优势能否有效利用的关键问题。目前,育种中常用于选配亲本和预测杂种优势的方法主要有2种,即配合力测定和遗传距离分析。在配合力测定方面,国内外育种家已开展大量研究,发现亲本配合力与杂种优势密切相关,一般配合力 (general combining ability, GCA) 和特殊配合力 (specific combining ability, SCA) 可以作为评判子代杂种优势的重要标准 (Huang et al., 2015; Gopal et al., 2008; Ahangar et al., 2008),并已应用到杂交育种的实践中 (金国庆等,2008)。但也有研究发现,GCA、SCA对杂种优势的预测能力并不一致,如龚光明等 (1993)对水稻 (Oryza sativa) 配合力的研究认为,GCA与杂种优势密切相关,而SCA与杂种优势的强弱并不一致,对预测杂种优势的作用不强;Rao等 (1996)研究发现,SCA对杂种优势的影响要高于GCA。由此可见,配合力对杂种优势的预测能力仍有待进一步明确。近年来,随着分子技术的发展,分子标记辅助育种不断被证实是一种有效缩短育种周期、提高亲本选配效率和杂种优势利用程度的方法 (Teklewold et al., 2006; Yu et al., 2002; 罗小金等,2006),并逐渐得到育种家们的重视。在林木中,已有研究表明,杉木 (Cunninghamia lanceolata)(李梅等,2001)、杨树(Populus)(李善文等,2008)、旱柳 (Salix matsudana)(Kopp et al., 2002)、鹅掌楸 (Liriodendron chinense) (李周岐等,2002) 等树种亲本遗传距离与子代杂种优势间呈不同程度的相关关系,揭示了亲本遗传距离对子代杂种优势的预测潜力。但也有部分植物杂种优势的研究显示,遗传距离与杂种优势呈弱度相关或无关,不能以此作为选配亲本、预测子代杂种优势的依据 (Beattie et al., 2003; Dreisigacker et al., 2005; 王晓阳等,2011)。因此,进一步深入研究亲本遗传距离与子代杂种优势的相关关系,对科学指导杂种优势在生产上的有效利用具有重要意义。
马尾松 (Pinus massoniana) 是我国南方针叶树种中主要的材用和脂用树种,具有速生、优质、适应性强等特点。研究表明,马尾松种源间杂交可产生显著杂种优势,在材积和干物质积累方面的超亲优势可达28.05%和30.17%,且一般配合力高的亲本进行交配将会提高得到杂种优势的概率 (周志春等,2004)。Zhang等 (2013)利用SSR标记的研究发现,马尾松亲本遗传距离与子代生长性状杂种优势在一定范围内呈较显著的相关关系。因此,本文在前人研究的基础上,利用设置在浙江省淳安县姥山林场的2份马尾松第3代6×6半双列杂交材料,研究马尾松杂交子代杂种优势和亲本配合力效应,并通过SSR分子标记,检测杂交亲本间遗传距离,分析子代杂种优势与亲本配合力、遗传距离的相关关系,以期为科学选配亲本和预测子代杂种优势提供更为有效的理论依据。
1 材料与方法 1.1 试验材料2007年从浙江省淳安县姥山林场马尾松第2代育种群体中选择12个无性系亲本,其中,亲本33号 (1145×1126)、20号 (1103×3412)、40号 (5163× 5907)、22号 (6627×3412)、56号 (3412×5907)、36号 (6627×1003)、42号 (3412×1003)、61号 (1305×1121)、57号 (1217×1121)、27号 (1201×1121)、29号 (1134×abcd) 为第1代亲本杂交后代即双亲子代林中优良单株 (优树) 采穗嫁接的无性系,亲本44号为种源1123子代中优良单株嫁接形成的无性系。分别利用33号、20号、40号、22号、56号、44号和36号、42号、61号、57号、27号、29号无性系按6×6半双列遗传交配设计Ⅰ(表 1) 和6×6半双列遗传交配设计Ⅱ(表 2) 配制杂交组合,2008年底收获种子,2009年播种育苗,2010年春在浙江省淳安县姥山林场营建2片子代测定林。2片试验林地处于中亚热带北缘 (119°03′E,29°37′N),海拔250~300 m,年平均气温17 ℃,≥10 ℃的年积温为5 410 ℃,年降水量1 430 mm,全年日照时数1 951 h,土壤为山地黄土,立地条件中等。试验林采用完全随机区组设计,10株小区,重复5次。
|
|
|
|
于2015年5月采集上述2份遗传交配设计所用12个亲本无性系的当年新生针叶,采样完毕后将所有样品用液氮速冻并保存在-70 ℃冰箱内备用。再于2015年11月对2片试验林进行每木调查,调查内容包括树高和胸径。
1.3 SSR标记基因组DNA提取采用试剂盒法,再利用1%琼脂糖凝胶电泳检测DNA完整性,利用紫外分光光度计检测DNA的浓度和纯度。PCR扩增反应程序为:94 ℃预变性3 min,然后进入45个循环,每个循环94 ℃变性30 s,53~61 ℃退火60 s (退火温度随引物而定),72 ℃延伸1 min,循环结束后72 ℃后延伸6 min,最后于4 ℃下保存 (Zhang et al., 2013)。PCR扩增反应为20 μL体系:DNA10 ng,引物0.2 μmol·L-1,2×Taq Master Mix 10 μL。扩增产物变性后经6%的聚丙烯酰胺凝胶电泳分离片段,银染显色,拍照记录。
本试验利用已公开发表文献中的马尾松SSR引物 (Zhang et al., 2013; 刘公秉等,2009),共合成78对引物。对其进行初筛,获得有产物、主带明显的引物42对,复筛后,选出清晰稳定、多态性高的13对引物 (表 3) 用于遗传分析。
|
|
本试验利用材积指数 (VI/m3) 说明材积生长量,利用树高 (H/m) 和胸径 (D/cm) 计算单株材积指数,公式为VI=D2×H。杂种优势程度 (He) 计算公式为He=(Fi-OP)/OP×100%,式中:Fi为任一个杂交组合的平均值,OP为与Fi同母本或父本的所有杂交组合子代平均值。以小区单株测定值为单元,对各性状进行方差分析以检验不同杂交组合遗传差异的显著性。方差分析线性模型为:Yijk=μ+Bi+Fj+BFij+eijk,式中:Yijk为第i区组第j家系第k单株的观测值,μ为总平均,Bi为第i区组效应,Fj为第j家系效应,BFij为第i区组和第j家系的互作效应,eijk为机误。若杂交组合效应显著,则按Griffing双列杂交方法Ⅳ(随机模型) 进行配合力方差分析,并按随机模型估算一般配合力/特殊配合力方差分量 (σg2/σs2) 及遗传力等参数 (续九如,2006)。本试验利用的马尾松第3代种质林,其部分亲本有亲缘关系,试验林近交系数 (F) 介于0~1/8之间。为便于统计分析,文中假设近交系数为1/8,上位效应不存在,则加性/显性方差分量 (VA/VD) 计算公式分别为:VA≈[4/(1+F)] σg2; VD≈[4/(1+F)2 ]σs2(孔繁玲,2006)。各性状方差分析、配合力方差分析在SAS/STAT软件中完成。
本试验统计SSR标记采用人工读带法,根据条带迁移对其进行判读,采用a, b, c, d…记录条带数据,获取SSR数据矩阵。利用SSR数据矩阵,用POPGENE软件计算多态位点百分率 (PPL)、Nei’s基因多样度指数 (HE) 和Shannon信息多样性指数 (I) 等,用NTsys2.01软件计算亲本间遗传距离 (GD)。利用SAS/STAT软件检测马尾松子代生长性状表型值及杂种优势与亲本配合力、遗传距离的相关系数。在Microsoft Office Excel中构建马尾松子代材积指数杂种优势随亲本配合力、遗传距离变化的散点图,通过SAS/STAT软件检测子代材积指数杂种优势与亲本配合力、遗传距离一元线性回归模型的拟合程度,并建立相应的一元线性回归方程。
2 结果与分析 2.1 马尾松生长性状遗传差异与杂种优势方差分析 (表 4) 显示,半双列Ⅰ和半双列Ⅱ树高平均值分别为5.66 m和5.90 m,胸径平均值分别为10.16 cm和10.09 cm,材积指数平均值分别为0.065 3 m3和0.064 7 m3,半双列Ⅰ和半双列Ⅱ的树高、胸径和材积指数在杂交组合间均达到1%的极显著差异,说明2份试验材料通过亲本间杂交可为下一世代的育种创造变异丰富的基本群体,杂交产生的后代易获得较高的杂种优势。
|
|
马尾松生长性状表现和杂种优势分析 (表 5) 结果显示,半双列Ⅰ中,22×44在树高和材积指数上的表现最好,表型值分别为6.35 m和0.093 3 m3;40×44在胸径上的表现最好,表型值为12.14 cm。半双列Ⅱ中,42×29在胸径和材积指数上的表现最好,表型值分别为11.64 cm和0.088 1 m3;27×29在树高上的表现最好,表型值为6.53 m。2份试验材料不同杂交组合间的杂种优势差异较大,半双列Ⅰ和半双列Ⅱ生长性状中材积指数的杂种优势变异幅度最大,分别为-39.49%~37.60%和-19.57%~32.85%。半双列Ⅰ中,40×44在树高、胸径和材积指数上的杂种优势最高,分别为7.76%,15.91%和37.60%。半双列Ⅱ中,42×29在树高、胸径和材积指数上的杂种优势最高,分别为6.70%,11.92%和32.85%。比较子代生长性状表型值与杂种优势发现,杂种优势高低与子代生长性状表型值的大小并不完全一致,但杂种优势高的杂交组合子代生长表现普遍较好,获得优良性状的概率会大大增加。
|
|
根据全同胞的遗传方差理论,性状的一般配合力 (GCA) 和特殊配合力 (SCA) 方差分别主要由加性基因效应和显性效应控制,进行性状的GCA、SCA相对重要性分析,可有效衡量其遗传控制方式 (李力等,2000)。对马尾松生长性状配合力进行方差分析 (表 6) 发现:2份试验材料中,除半双列Ⅱ胸径的GCA在不同杂交组合间差异不显著外,其余生长性状的GCA和SCA在杂交组合间的差异均达到显著或极显著水平。进一步分析配合力方差分量发现:除半双列Ⅱ的胸径外,其余生长性状的一般配合力方差分量 (σg2) 普遍高于特殊配合力方差分量 (σs2),估算各性状的加性方差分量 (VA) 和显性方差分量 (VD) 得出,半双列Ⅰ中的树高、胸径、材积指数以及半双列Ⅱ中的树高、材积指数均是以加性基因效应控制为主。其中,半双列Ⅱ的树高加性方差分量百分数最高,为95.28%,几乎完全受加性基因效应控制;而半双列Ⅱ中的胸径主要是受显性基因效应控制,显性方差分量百分数较高,为90.50%。2份试验材料各生长性状家系遗传力 (hf2) 为0.884~0.966,处于较高水平,受较强的遗传控制。
|
|
各亲本无性系生长性状的GCA和SCA效应值见表 7。在半双列Ⅰ的6个亲本无性系中,33号和44号亲本的树高、胸径和材积指数GCA皆为正效应值,其余亲本生长性状GCA皆为负效应值;6个亲本中,44号亲本在树高、胸径、材积指数的GCA效应值表现皆为最高,分别为0.603 3,1.521 2和2.50E-02。在半双列Ⅱ的6个亲本无性系中,27号和29号的树高、57号和29号的胸径以及42号和29号的材积指数的GCA为正效应值,其余亲本生长性状GCA皆为负效应值;6个亲本中,29号在树高和胸径的GCA效应值最高,分别为0.510 4和0.438 3,27号材积指数的GCA效应值最高,为4.66E-04。对于亲本的SCA效应值,在半双列Ⅰ的15个杂交组合中,40×44在树高、胸径的SCA效应值最高,分别为0.419 4和1.434 2,22×44在材积指数的SCA效应值最高,为9.55E-03。在半双列Ⅱ的15个杂交组合中,36×27在树高和胸径的SCA效应值最高,分别为0.294 1和1.084 0,36×61在材积指数的SCA效应值最高,为7.16E-03。比较马尾松GCA、SCA效应值与生长性状表型值、杂种优势 (表 5) 发现,GCA、SCA效应值高的亲本和亲本组合杂交产生的后代其生长表现较为优良,杂种优势较为明显。
|
|
利用筛选出的13对SSR引物对2份半双列杂交试验材料12个亲本进行PCR扩增,每对SSR引物扩增出的位点数为2~6个不等,13对SSR引物在亲本群体中共扩增出38个位点,平均每对引物3.17个位点,其中,32个位点是多态的,多态位点百分率 (PPL) 为84.21%,Nei’s基因多样度指数 (HE) 为0.301 2,Shannon信息多样性指数 (I) 为0.467 8,亲本间遗传多样性处于中等水平。利用NTsys2.01软件分别计算2个半双列杂交亲本距离 (GD)(表 8) 显示:半双列Ⅰ中15个杂交组合亲本间的GD变异幅度为0.152 0~0.351 6,平均GD为0.270 6,其中,40×44的GD最大,为0.351 6。半双列Ⅱ中15个杂交组合亲本间的GD变异幅度为0.142 1~0.339 7,平均GD为0.242 1,其中,36×27的GD最大,为0.339 7。比较亲本间GD与其子代生长性状表型值、杂种优势 (表 5) 发现,GD较大的亲本杂交较易获得生长表现优良和杂种优势明显的子代。
|
|
进一步分析马尾松子代生长性状表型值、杂种优势与亲本配合力、遗传距离 (GD) 的相关性 (表 9),结果表明:2份马尾松半双列杂交试验材料中多数子代生长性状表型值、杂种优势与亲本配合力、GD之间呈较高的正相关关系,相关系数介于0.066~0.923之间。对3种亲本GCA (双亲一般配合力之和GCAP1+P2、母本一般配合力GCAP1、父本一般配合力GCAP2) 与子代生长性状表型值、杂种优势的相关性进行分析发现:除半双列Ⅱ中的胸径、材积指数杂种优势与GCAP1+P2相关性不显著,半双列Ⅰ中的树高、胸径、材积指数表型值和杂种优势以及半双列Ⅱ中的树高、胸径、材积指数杂种优势与GCAP1相关性不显著,半双列Ⅰ中的胸径杂种优势以及半双列Ⅱ中的胸径、材积指数表型值和杂种优势与GCAP2相关性不显著外,其余的GCA与生长性状表型值、杂种优势间均呈显著或极显著的正相关关系,相关系数介于0.521~0.899之间。比较2份试验材料中3种一般配合力与子代表型值和杂种优势相关程度发现存在这样趋势:多数性状亲本GCAP1+P2与子代表型值和杂种优势的相关系数最高,GCAP2次之,而GCAP1与子代表型值和杂种优势的相关程度最弱。对SCA与子代生长性状表型值、杂种优势的相关性进行分析发现:除半双列Ⅰ中的树高、胸径和材积指数表型值以及半双列Ⅱ中的树高表型值外,其余的生长性状表型值、杂种优势与SCA均呈显著或极显著的正相关关系,相关系数为0.638~0.923。对GD (≤0.351 6) 与子代生长性状表型值、杂种优势的相关性进行分析发现:除半双列Ⅱ中的胸径表型值和胸径杂种优势外,其余的生长性状表型值、杂种优势与GD均呈显著或极显著的正相关关系,相关系数介于0.536~0.618之间。从表 9中的数据可以看出,GCAP1+P2、SCA、GD中,多数GCAP1+P2与子代表型值的相关系数要高于SCA和GD,多数SCA与子代生长性状杂种优势的相关系数要高于GCAP1+P2和GD,而相对于GCAP1+P2和SCA,亲本间GD与子代生长性状表型值和杂种优势的相关关系普遍较弱。
|
|
通过回归分析 (图 1) 发现,半双列Ⅰ和半双列Ⅱ子代材积指数的杂种优势与亲本GCAP1+P2、SCA、GD均呈线性相关关系。由线性回归方程的显著性检验表明,除半双列Ⅱ材积指数杂种优势与GCAP1+P2相关性不显著外,其他线性方程检验均达到显著或极显著水平。由散点图可以看出,半双列Ⅱ的亲本SCA与材积指数杂种优势的散点图和回归直线最为吻合,决定系数 (r2) 最大,为0.696;半双列Ⅰ的子代材积指数杂种优势与亲本SCA的相关水平随SCA的增大呈显著性增强趋势,而其余子代材积指数杂种优势与亲本GCAP1+P2、SCA、GD相关性不显著。
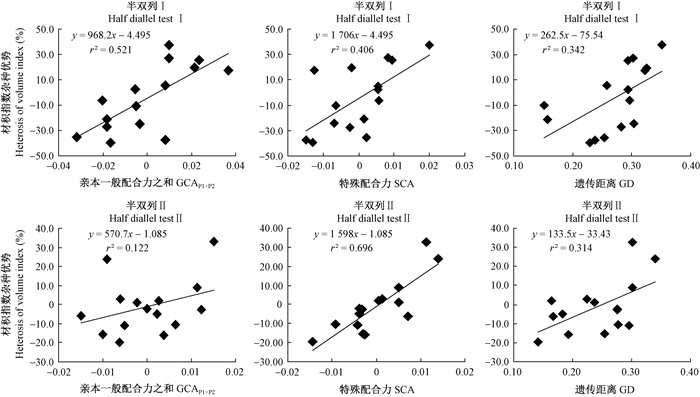
|
图 1 马尾松子代材积指数杂种优势与亲本配合力、遗传距离的线性相关 Fig.1 Linear correlation between heterosis for volume index (Ⅵ) and combining ability, genetic distance (GD) of Pinus massoniana |
本文利用设置在浙江省淳安县姥山林场的2份马尾松第3代半双列杂交试验材料的研究发现,马尾松生长性状及其杂种优势在不同杂交组合间存在较大差异,大部分杂交组合子代生长性状表现优良,杂种优势突出,但也有少数杂交组合子代生长性状表现一般甚至较差,因此,有必要对马尾松杂交子代生长性状和杂种优势进行有效的分析和预测,以提高杂种优势的利用效率。2份试验材料中的12个亲本选自马尾松第2代育种群体,其Nei’s基因多样度指数和Shannon信息多样性指数分别为0.301 2和0.467 8,遗传多样性处于中等水平,较低于张一等 (2009)对马尾松第1代育种群体和谭小梅等 (2012)对马尾松第2代无性系种子园遗传多样性的研究结果,这可能与个别亲本的近亲关系有关。由于保持育种群体遗传多样性是林木高世代育种的关键问题,关系到能否稳定持续地获得高水平遗传增益,因此,有必要采取一定措施对马尾松第2代育种群体的遗传多样性进行保护,以保证马尾松高世代遗传改良的顺利进行。
性状的GCA、SCA相对重要性与测定材料、性状及年龄等因素有关 (齐明,1996)。Sprague等 (1942)有关玉米配合力育种的研究认为,经过GCA测定的材料,需要进行SCA的选择与测定;而未经GCA选择与测定的材料,其GCA选择比SCA选择更具重要性。本研究利用的马尾松第3代种质林只经过第1代亲本的GCA初筛,而第2代亲本未经GCA筛选,研究发现,2份试验材料中除半双列Ⅱ的胸径主要受显性基因效应控制外,其余生长性状均是以加性基因效应控制为主,具有较高的遗传稳定性。2份试验材料各生长性状家系遗传力水平较高,介于0.884~0.966之间,受较强的遗传控制。
大量研究表明,配合力、遗传距离 (GD) 与子代生长、抗逆性等性状表现和杂种优势紧密相关,可用于预测性状表现和杂种优势 (Huang et al., 2015; Worku et al., 2008; Yanchuk, 1996),特别是基于分子水平的GD分析,其无须营建子代测定林即可实现对亲本的选配,可极大地缩短林木育种周期。本研究对2份试验材料的研究也显示,马尾松亲本的GCAP1+P2(双亲一般配合力之和)、GCAP1(母本一般配合力)、GCAP2(父本一般配合力)、SCA、GD (≤0.351 6) 与多数子代生长性状表型值、杂种优势呈较显著的正相关,亲本配合力以及一定水平的遗传距离对子代生长性状表现和杂种优势的预测能力较强,可以作为选配亲本、预测子代杂种优势的重要依据。研究还显示,在亲本GCA中,GCAP1+P2与子代表型值和杂种优势的相关性最强,GCAP2次之,GCAP1最弱,因此,选择育种时用GCAP1+P2对子代表型值和杂种优势进行预测应较GCAP1和GCAP2更具准确性。研究中进一步比较GCAP1+P2、SCA、GD发现,GCAP1+P2对多数子代生长性状表型值的预测能力最强,SCA对多数子代生长性状杂种优势的预测能力最强,而GD对子代生长性状表型值和杂种优势的预测能力要普遍弱于GCAP1+P2和SCA。因此,在育种时,对于已营建测定林的亲本选配可以优先采用GCAP1+P2来预测子代生长性状的表型值,采用SCA来预测子代生长性状的杂种优势;而对于未营建测定林的亲本选配,基于一定水平的GD分析也可以较准确地实现对子代生长性状表型值和杂种优势的预测。
Pooja等 (2011)发现杂交亲本SCA与子代性状杂种优势呈极显著线性相关。李义良等 (2012)对湿加松 (Pinus elliottii×P. caribaea) 的研究表明亲本间GD与子代生长性状杂种优势呈线性相关,并且随GD的增加线性相关有显著加强趋势。张一等 (2010)对马尾松遗传距离的研究也指出亲本间GD与子代生长性状杂种优势在一定范围呈线性相关,当亲本间GD处于0.158~0.657时,GD与子代生长性状表型值的相关性较低,而当亲本间GD处于0.264~0.529时,GD与子代生长性状表型值表现显著的正相关关系。本研究结果显示,马尾松杂交亲本GCAP1+P2、SCA、GD (≤0.351 6) 与子代材积指数表型值、杂种优势均呈较显著的线性相关,与Pooja等 (2011)、张一等 (2010)、李义良等 (2012)的结果相似,而在本研究的GD区间内并未表现出随亲本GD增加GD与材积指数杂种优势的线性相关有显著加强趋势。由此可见,不同水平的亲本GCAP1+P2、SCA以及较低水平的亲本GD对马尾松子代材积指数杂种优势均具有较好的预测效果,通过对GCAP1+P2、SCA以及较低水平的GD选择有利于提高马尾松子代材积指数杂种优势的利用效率。本研究所利用的马尾松6年生测定林生长性状表现虽已相对稳定,但依然处于幼林期,所以本研究为阶段性研究结果,下一步将继续跟踪研究马尾松子代在成熟龄时生长杂种优势与亲本配合力、遗传距离的相关性,以验证前期研究结果,从而为马尾松遗传改良策略制定提供有力的理论依据。
4 结论2份马尾松第3代半双列杂交试验材料生长性状表型值及杂种优势在不同杂交组合间表现较显著差异,除半双列Ⅱ胸径的一般配合力 (GCA) 外,其余生长性状配合力在杂交组合间的差异均达显著水平。除半双列Ⅱ的胸径外,其余马尾松生长性状均是以加性基因效应控制为主。
2份马尾松试验材料12个亲本的Nei’s基因多样度指数和Shannon信息多样性指数分别为0.301 2和0.467 8,遗传多样性处于中等水平。
马尾松子代生长性状表型值、杂种优势与多数亲本一般配合力 (GCA)、特殊配合力 (SCA)、遗传距离 (GD)(≤0.351 6) 呈较显著的正相关关系。亲本GCA中,双亲一般配合力之和 (GCAP1+P2) 对子代表型值和杂种优势的预测能力最强,父本一般配合力 (GCAP2) 次之,母本一般配合力 (GCAP1) 最弱。亲本GCAP1+P2、SCA、GD中,GCAP1+P2对马尾松子代生长性状表型值的预测能力最强,SCA对马尾松子代生长性状杂种优势的预测能力最强,而GD对子代生长性状表型值和杂种优势的预测能力要普遍弱于GCAP1+P2和SCA。
| [] |
龚光明, 周国锋, 尹楚球, 等. 1993. 籼型两用核不育系主要农艺性状的配合力分析. 中国水稻科学, 7(3): 137–142.
( Gong G M, Zhou G F, Yi C Q, et al. 1993. Analysis on the combining ability of main agronomic traits of indica double-functional genic male-sterile lines. Chinese Journal of Rice Science, 7(3): 137–142. [in Chinese] ) |
| [] |
金国庆, 秦国锋, 刘伟宏, 等. 2008. 马尾松生长性状交配效应的遗传分析及杂交组合选择. 林业科学, 44(6): 28–33.
( Jin G Q, Qin G F, Liu W H, et al. 2008. Effects of mating manners on growth traits of Pinus massoniana and selection of cross combinations. Scientia Silvae Sinicae, 44(6): 28–33. [in Chinese] ) |
| [] |
孔繁玲. 2006. 植物数量遗传学. 北京: 中国农业大学出版社.
( Kong F L. 2006. Quantitative genetics in plants. Beijing: China Agricultural University Press. [in Chinese] ) |
| [] |
李力, 陈孝丑, 曹汉洋, 等. 2000. 杉木分组群状多系杂交子代测定林的遗传分析. 江西农业大学学报, 22(3): 388–393.
( Li L, Chen X C, Cao H Y, et al. 2000. Genetic analysis of progeny tests of nested polycross designs of Chinese fir. Journal of Jiangxi Agricultural University, 22(3): 388–393. [in Chinese] ) |
| [] |
李梅, 施季森, 甘四明, 等. 2001. 杉木杂交亲本分子遗传变异与子代生长相关的研究. 林业科学研究, 14(1): 35–40.
( Li M, Shi J S, Gan S M, et al. 2001. Correlation between RAPD-based parental genetic distance and filial performance of Chinese fir. Forest Research, 14(1): 35–40. [in Chinese] ) |
| [] |
李善文, 张志毅, 于志水, 等. 2008. 杨树杂交亲本分子遗传距离与子代生长性状的相关性. 林业科学, 44(5): 150–154.
( Li S W, Zhang Z Y, Yu Z S, et al. 2008. Correlation between molecular genetic distances among parents and growth traits of progenies in Populus. Scientia Silvae Sinicae, 44(5): 150–154. [in Chinese] ) |
| [] |
李义良, 赵奋成, 吴惠姗, 等. 2012. 湿加松亲本间遗传距离与杂种优势的相关性分析. 林业科学研究, 25(2): 138–143.
( Li Y L, Zhao F C, Wu H S, et al. 2012. Relationship between growth traits heterosis and genetic distance among parents of Pinus elliottii×P. caribaea based on SSR molecular markers. Forest Research, 25(2): 138–143. [in Chinese] ) |
| [] |
李周岐, 王章荣. 2002. 用RAPD标记进行鹅掌楸杂种识别和亲本选配. 林业科学, 38(5): 169–174.
( Li Z Q, Wang Z R. 2002. RAPD markers used for the hybrid identification and parents choice in Liriodendron. Scientia Silvae Sinicae, 38(5): 169–174. [in Chinese] ) |
| [] |
刘公秉, 季孔庶. 2009. 基于松树EST序列的马尾松SSR引物开发. 分子植物育种, 7(4): 833–838.
( Liu G B, Ji K S. 2009. Designing Pinus massoniana SSR primers from Pinus EST sequences. Molecular Plant Breeding, 7(4): 833–838. [in Chinese] ) |
| [] |
罗小金, 贺浩华, 彭小松, 等. 2006. 利用SSR标记分析水稻亲本间遗传距离与杂种优势的关系. 植物遗传资源学报, 7(2): 209–214.
( Luo X J, He H H, Peng X S, et al. 2006. Analysis on correlation between genetic distance of rice parents and heterosis with SSR molecular marker. Journal of Plant Genetic Resources, 7(2): 209–214. [in Chinese] ) |
| [] |
齐明. 1996. 杉木育种中GCA与SCA的相对重要性. 林业科学研究, 9(5): 498–503.
( Qi M. 1996. Relative importance of GCA and SCA in genstic breeding of Chinese fir. Forest Research, 9(5): 498–503. [in Chinese] ) |
| [] | Tan X M, Zhou Z C, Jin G Q, et al. 2012. Genetic diversity and mating system analysis of Pinus massoniana in a second-generation clonal seed orchard. Scientia Silvae Sinicae, 48(2): 69–74. |
| [] |
王晓阳, 李火根. 2011. 鹅掌楸苗期生长杂种优势的SSR分析. 林业科学, 47(4): 57–62.
( Wang X Y, Li H G. 2011. Possible mechanism analysis for heterosis of hybrid Liriodendron based on seedling growth and SSR markers. Scientia Silvae Sinicae, 47(4): 57–62. [in Chinese] ) |
| [] |
续九如. 2006. 林木数量遗传学. 北京: 高等教育出版社.
( Xu J R. 2006. Quantitative genetics in forestry. Beijing: Higher Education Press. [in Chinese] ) |
| [] |
张一, 储德裕, 金国庆, 等. 2010. 马尾松亲本遗传距离与子代生长性状相关性分析. 林业科学研究, 23(2): 215–220.
( Zhang Y, Chu D Y, Jin G Q, et al. 2010. Relationship between hybrid performance and genetic distances among Pinus massoniana clones based on ISSR molecular marker. Forest Research, 23(2): 215–220. [in Chinese] ) |
| [] |
张一, 储德裕, 金国庆, 等. 2009. 马尾松1代育种群体遗传多样性的ISSR分析. 林业科学研究, 22(6): 772–778.
( Zhang Y, Chu D Y, Jin G Q, et al. 2009. Molecular characterization of elite genotypes within a first generation breeding population of Pinus massoniana using ISSR. Forest Research, 22(6): 772–778. [in Chinese] ) |
| [] |
赵奋成, 李宪政, 张应中, 等. 2006. 湿地松与洪都拉斯加勒比松的杂交效果分析. 林业科学研究, 19(4): 409–415.
( Zhao F C, Li X Z, Zhang Y Z, et al. 2006. Hybridizing effect analysis between Pinus elliottii var. elliottii and Pinus caribaea var. hondurensis. Forest Research, 19(4): 409–415. [in Chinese] ) |
| [] |
周志春, 金国庆, 秦国峰, 等. 2004. 马尾松纸浆材重要经济性状配合力及杂种优势分析. 林业科学, 40(4): 52–57.
( Zhou Z C, Jin G Q, Qin G F, et al. 2004. Analysis on combining ability and heterosis of main economic traits of Pinus massoniana for pulp production. Scientia Silvae Sinicae, 40(4): 52–57. [in Chinese] ) |
| [] | Ahangar L, Ranjbar G A, Nouroozi M. 2008. Estimation of combining ability for yield and yield components in rice (Oryza sative L.) cultivars using diallel cross. Pak J Biol Sci, 11(9): 1178–1281. |
| [] | Beattie A D, Michaels T E, Pauls K P, et al. 2003. Predicting progeny performance in common bean (Phaseolus vulgaris L.) using molecular marker-based cluster analysis. Genome, 46(2): 259–267. DOI:10.1139/g03-002 |
| [] | Dreisigacker S, Melchinger A E, Zhang P, et al. 2005. Hybrid performance and hetrosis in spring bread wheat, and their relations to SSR-based genetic distances and coefficients of parentage. Euphytica, 144(1): 51–59. |
| [] | Gopal J, Kumar V, Luthra S K. 2008. Top-cross vs. poly-cross as alternative to test-cross for estimating the general combining ability in potato. Plant Breeding, 127(5): 441–445. |
| [] | Huang M, Chen L Y, Chen Z Q. 2015. Diallel analysis of combining ability and heterosis for yield and yield components in rice by using positive loci. Euphytica, 205(1): 1–14. DOI:10.1007/s10681-015-1372-9 |
| [] | Kopp R F, Smart L B, Maynard C A, et al. 2002. Predicting within-family variability in juvenile height growth of Salix based upon similarity among parental AFLP fingerprints. Theor Appl Genet, 105(1): 106–112. DOI:10.1007/s00122-001-0855-3 |
| [] | Pooja D, Singh N K. 2011. Heterosis, molecular diversity, combining ability and their interrelationships in short duration maize (Zea mays L.) across the environments. Euphytica, 178(1): 71–81. DOI:10.1007/s10681-010-0271-3 |
| [] | Rao A M, Ramesh S, Kulkarni R S. 1996. Heterosis and combining ability in rice. Crop Improv, 23(1): 53–56. |
| [] | Sprague G F, Tatum L A. 1942. General and specific combining ability in single crosses of corn. Journal of American Society of Agronomy, 34(4): 923–932. |
| [] | Teklewold A, Becker H C. 2006. Comparison of phenotypic and molecular distances to predict heterosis and F1 performance in Ethiopian mustard (Brassica carnata A. Braun). Theor Appl Genet, 112(4): 752–759. DOI:10.1007/s00122-005-0180-3 |
| [] | Worku M, Banziger M, Friesen D, et al. 2008. Relative importance of general combining ability and specific combining ability among tropical maize (Zea mays L.) inbreds under contrasting nitrogen environments. Maydica, 53(3/4): 279–288. |
| [] | Yanchuk A D. 1996. General and specific combining ability from disconnected partial diallels of coastal Douglas-firs. Silvae Genet, 45(1): 37–45. |
| [] | Yu S B, Li J X, Xu C G, et al. 2002. Identification of quantitative trait loci and epistatic interactions for plant height and heading data in rice. Theor Appl Genet, 104(4): 619–625. DOI:10.1007/s00122-001-0772-5 |
| [] | Zhang Y, Jing G Q, Zhou Z C, et al. 2013. Divergence among Masson pine parents revealed by geographical origins and SSR markers and their relationships with progeny performance. New Forests, 44(3): 341–355. DOI:10.1007/s11056-012-9340-x |
 2017, Vol. 53
2017, Vol. 53

