文章信息
- 李真, 王留强, 卢孟柱
- Li Zhen, Wang Liuqiang, Lu Mengzhu
- 毛白杨PtoWOX11/12a对杨树扦插苗生长发育的影响
- Effects of PtoWOX11/12a Gene from Populus tomentosa on the Growth and Development of Cutting Seedlings in Poplar
- 林业科学, 2017, 53(11): 69-76.
- Scientia Silvae Sinicae, 2017, 53(11): 69-76.
- DOI: 10.11707/j.1001-7488.20171108
-
文章历史
- 收稿日期:2017-03-02
- 修回日期:2017-04-28
-
作者相关文章
WUSCHEL related homeobox(WOX)是真核生物同源异型盒(homeobox,HB)转录因子超家族中植物特有的1个亚支,含有1个由65个氨基酸残基组成的、保守的同源异型结构域(homedomain, HD)(Zhang et al., 2015)。这类转录因子在植物发育关键时期发挥重要作用,如参与胚的形成、调控干细胞分裂分化动态平衡和器官的形成等(van der Graaff et al., 2009)。
在模式植物拟南芥(Arabidopsis thaliana)中,WOX转录因子家族包含15个成员(WUS以及WOX1-WOX14),它们主要在茎和根顶端分生区干细胞的维持、侧生器官的发育、花器官的形成和胚发育等方面发挥着重要的作用(Aichinger et al., 2012; Ueda et al., 2011)。AtWUS基因是WOX家族中最早发现的基因,主要在维持根和茎顶端分生组织(shoot apical meristem,SAM)中干细胞特性、促进干细胞的增殖和抑制干细胞的分化等过程中发挥重要作用(吴锦斌等,2013)。AtWOX5作为AtWUS基因的同系物,在调控茎尖和根部干细胞稳定以维持未分化状态时,二者可以相互补偿(Sarkar et al., 2007)。在水稻(Oryza sativa)中,leaf2和leaf3基因位点编码OsWOX3A蛋白,双突变体产生窄而卷曲叶片、增多的分蘖、减少的侧根和窄小的种子,说明OsWOX3A参与横轴器官向外侧的生长发育及分蘖与侧根的发育,同时调控叶片的维管模式(Cho et al., 2013)。AtWOX4基因主要在维管原形成层和形成层中表达,参与次生生长过程中维管形成层干细胞增殖(Hirakawa et al., 2010; Ji et al., 2010)。AtWOX11和AtWOX12共同参与叶片原形成层细胞或薄壁细胞向根源基细胞转变的过程(Liu et al., 2014a)。在模式植物水稻基因组中,WOX转录因子家族有13个成员,部分成员的生物学功能和作用机制已得到详细的研究和阐述。例如,OsWOX7参与调控水稻居间分生组织(Wang et al., 2014);OsWOX11受外源生长素和细胞分裂素的诱导后主要在根尖和根分生组织的形成区中表达,并参与激活冠状根的发生,促进其生长(Zhao et al., 2009)。
目前,关于该家族成员的研究,主要集中于拟南芥、水稻、矮牵牛(Petunia hybrida)、番茄(Lycopersicon esculentum)等草本植物中,木本植物中WOX基因的研究较少。在杨树中,根据毛果杨(Populus trichocarpa)基因组信息,本课题组前期鉴定了18个毛白杨(Populus tomentosa)WOX转录因子家族成员,对它们的序列结构、进化关系以及在不同组织(根、茎、叶和未成熟木质部等)中的表达模式等进行了分析和比较,发现PtoWOX11/12a主要在根部表达,过表达该基因能够影响杨树根的发育,增加不定根的数量(Liu et al., 2014b),该研究也是关于杨树WOX基因的首次报道;此外分析不定根形成过程中的转录组数据发现,生长素合成基因YUCCA1和YUCCA8的表达发生显著变化。随后,Xu等(2015)发现南林895杨(Populus×euramericana ‘Nanlin 895’)PeWOX11a和PeWOX11b基因主要在根中表达,过表达PeWOX11a或者PeWOX11b不仅能够增加转基因杨树不定根的数量,还能诱导地上部分茎段产生异位根。
为进一步了解毛白杨PtoWOX11/12a基因是否参与调控杨树其他组织或者器官的生长和发育,并探讨其参与调控的作用机制,本研究分析了PtWOX11/12a基因对杨树叶片、茎生长发育的影响,同时还利用所建立的该基因对不定根的诱导试验体系(Liu et al., 2014c),探讨了该基因与生长素合成基因YUCCA1和YUCCA8在杨树组培苗茎段扦插生根过程中各个时期的相对表达情况,以了解它们互作的机制。上述结果为进一步阐明PtoWOX11/12a基因调控杨树生长发育作用机制奠定了基础。
1 材料与方法 1.1 植物材料及生长条件毛白杨用于基因表达分析,银腺杨无性系84K杨(P. alba × P. glandulosa cl. 84K)用于遗传转化,本课题组前期已获得的过表达PtoWOX11/12a转基因84K杨(Liu et al., 2014b)用于表型和不定根中生长素合成相关基因的表达分析。所有植物材料均由本实验室(中国林业科学研究院林木遗传育种国家重点实验室)保存并繁殖。将转基因和非转基因84K杨带有顶端的组培苗嫩茎(约2.5 cm)扦插到生根培养基(1/2MS基础培养基+0.05 mg·L-1 IBA+0.02 mg·L-1 NAA,pH5.8~6.0)中,置于人工气候室培养,培养条件为16 h光照/8 h黑暗,23~25 ℃,光照强度50 μmol·m-2s-1。生长20天后,将其移栽到人工土中,随后转入温室中继续培养,生长条件同上。
选取生长状态良好且长势一致的毛白杨组培苗,截取带有顶端的组培苗茎段(约2.5 cm)扦插到新鲜的生根培养基中,依据前期不定根诱导过程(Liu et al., 2014c),分别在培养0,2,3,4,6,8天后,收集每个时间点的植株最底端约0.5 cm长茎段,每个样品至少含10株扦插苗,液氮速冻置于-80 ℃保存用于RNA提取。
1.2 总RNA的提取和实时荧光定量PCR采用传统的CTAB法(Chang et al., 1993)提取上述毛白杨茎段各时间点样品以及不同转基因和非转基因84K杨幼嫩叶片的总RNA。利用RQ1 RNase-free DNase(Promega,Madison,WI,USA)对其进行处理以去除DNA污染。使用PrimeScriptTM RT reagent Kit试剂盒(TaKaRa,Dalian,China)合成cDNA第1链,具体方法参见试剂盒使用说明。
实时荧光定量PCR使用SYBR Premix Ex TaqTMⅡ试剂盒(TaKaRa,Dalian,China),在Roche 480实时荧光定量PCR仪(Roche Applied Science,Penzberg,Upper Bavaria,Germany)上进行操作,以84K杨α-actin基因作为内参。为了确保试验结果真实可靠,每个试验均设有3次生物学重复和4次技术重复。用于实时荧光定量PCR的基因特异性引物使用Primer 5软件设计,其序列见表 1。
|
|
EAR(ERF-associated amphiphilic repression)抑制结构域作为显性抑制子能够抑制转录因子下游基因的表达(Hiratsu et al., 2003)。本试验以毛白杨cDNA为模板,扩增PtoWOX11/12a基因编码区序列,并融合EAR抑制结构域(SRDX序列),通过Gateway BP反应重组进入pDNOR222(Invitrogen)载体后送公司测序,测序正确后通过LR反应亚克隆至终载体pMDC32,电击转化农杆菌(Agrobacterium tumefaciens)GV3101,以农杆菌介导的叶盘法转化84K杨(Liu et al., 2014b)。在含有200 mg·L-1特美汀和3 mg·L-1潮霉素的芽分化培养基(1/2MS基础培养基+0.5 mg·L-1 6-BA+0.05 mg·L-1 NAA)上筛选抗性叶芽,随后在含有同样浓度抗生素的生根培养基上诱导生根。摘取幼苗叶片,提取总RNA,利用qPCR技术对其进行分子鉴定。
1.4 转基因84K杨的表型变化将20天左右的生长状态良好且长势一致的转基因和非转基因对照84K杨组培苗移栽至装有人工土的塑料盆中,置于温室中继续培养,每隔1个月对各个植株的株高和地径进行测定。同时,摘取苗木顶端至基部的所有叶片,观察其叶形变化,并对第4片展开叶的长、宽以及长宽比进行连续测量和计算。为了减少植株的个体差异,每次试验至少3次生物学重复,每组数据至少测量12株材料。结果进行t检验。
1.5 茎段切片分析截取3月龄转基因和非转基因对照84K杨顶端向下的第5、9、13节间,进行切片分析。首先,取每个茎段中部位置约2~3 mm厚度的材料放入2.5%的戊二醛固定液中过夜固定。固定的材料经过70%、85%、95%和100%的酒精脱水后用Spurr树脂包埋。用Leica EMUC7超薄切片机(Leica 283 Microsystems GmbHWetzlar,Germany)按厚度为2 000 nm的标准进行切片,经甲苯胺蓝O(Toluidine blue O,TBO)染色后,使用蔡司Zeiss Axio Imager A1(Carl Zeiss)显微镜进行拍照观察,通过Axiovision Rel 4.8对木质部宽度进行测定。
2 结果与分析 2.1 过表达和抑制表达PtoWOX11/12a转基因84K杨的鉴定为了获得抑制表达PtoWOX11/12a转基因材料,构建了PtoWOX11/12a基因的显性抑制载体,转化84K杨获得转基因株系,经qPCR检测筛选出表达量明显降低的2个转基因株系DR19和DR31(图 1);同时,对已有的过表达PtoWOX11/12a转基因84K杨2个株系(OE6和OE12)进行了分子检测(图 1),结果显示过表达转基因株系成熟叶片中的PtoWOX11/12a基因的表达量分别高于非转基因84K杨(对照)约400、600倍。过表达转基因株系(OE6和OE12)和抑制表达转基因株系(DR19和DR31)用于后续的表型比较和功能分析试验。

|
图 1 实时荧光定量PCR分析过表达和抑制表达PtoWOX11/12a转基因84K杨 Figure 1 qPCR analysis of PtoWOX11/12a-overexpression and -suppressed expression transgenic 84K poplars CK:非转基因84K杨;OE6, OE18:过表达转基因84K杨6号和18号株系;DR19, DR31:显性抑制转基因84K杨19号和31号株系。下同。 CK: Non-transgenic 84K poplar; OE6, OE18: Over-expression transgenic poplar lines 6 and 18; DR19, DR31: Suppressed expression transgenic poplar lines 19 and 31. The same below. |
将20天的生长状态良好且长势一致的过表达(OE6和OE18)、抑制表达(DR19和DR31)PtoWOX11/12a转基因和非转基因(对照)84K杨组培苗移栽至装有人工土的塑料盆中,置于温室培养2个月后,对其顶端至基部的所有叶片依次进行比较,结果发现,与对照相比,过表达PtoWOX11/12a转基因植株的叶片趋近于卵圆形,而抑制表达PtoWOX11/12a转基因植株叶片趋近于狭长型,且叶片边缘呈现锯齿状缺刻(图 2)。同时,比较了栽植于温室1、2和3个月后的转基因和对照植株第4片展开叶的长、宽以及长宽比发现,过表达PtoWOX11/12a转基因植株的叶片长度与对照类似,没有显著差异,但宽度明显大于对照,且二者叶片的长宽比存在显著差异;抑制表达PtoWOX11/12a转基因植株叶片的长度和宽度显著低于对照叶片,长宽比却显著大于对照(表 2)。以上结果表明,PtoWOX11/12a基因参与了84K杨叶片的生长和发育。

|
图 2 PtoWOX11/12a转基因和非转基因(对照)84K杨的叶形分析 Figure 2 Analysis of leaf shape of PtoWOX11/12a transgenic and non-transgenic (control) 84K poplars 1-11:自植株顶端至基部的所有叶片排序 The serial number of leaves from the top to the base of plant. |
|
|
为了进一步研究PtoWOX11/12a对转基因84K杨生长发育的影响,对过表达(OE6和OE18)、抑制表达(DR19和DR31)PtoWOX11/12a转基因以及非转基因(对照)84K杨的地上部分(株高和地径)进行了连续统计。株高统计结果显示,过表达PtoWOX11/12a转基因植株的株高均显著低于对照,且差异随着植株生长更加明显;而抑制表达PtoWOX11/12a转基因植株的株高又显著低于过表达转基因植株,表现为植株矮小、生长迟缓。地径统计结果显示,过表达和抑制表达PtoWOX11/12a转基因植株的地径均小于对照,且存在显著差异,其中抑制表达PtoWOX11/12a转基因植株的地径最小(图 3,表 3)。

|
图 3 2月龄PtoWOX11/12a转基因和非转基因(对照)84K杨表型 Figure 3 Phenotypes of two-month-old PtoWOX11/12a transgenic and non-transgenic (control) 84K poplars |
|
|
对3月龄转基因和非转基因84K杨茎段的第5、9和13节间进行解剖分析并统计木质部宽度。结果显示,过表达转基因植株的第5、9和13节间木质部宽度明显低于对照,但形成层细胞层数增多;而抑制表达转基因植株的木质部宽度低于对照但却高于过表达植株,但形成层区域变窄。木质部的宽度为:对照>抑制表达植株>过表达植株;形成层区域大小为:过表达植株>对照>抑制表达植株(图 4,表 4)。以上结果表明过表达或者抑制表达PtoWOX11/12a基因不仅引起叶形发生变化,同时也影响了植株次生生长,表现为影响株高、地径以及茎木质部发育。
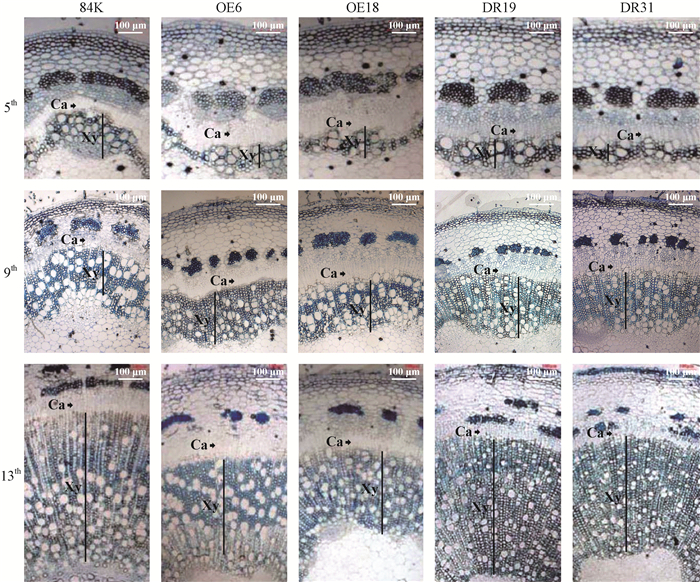
|
图 4 3月龄PtoWOX11/12a转基因和非转基因(对照)84K杨茎段不同节间横切面 Figure 4 Cross-section of different internodes of three-month-old PtoWOX11/12a transgenic and non-transgenic (control) 84K poplars 标尺Bar:100 μm.箭头所指位置为形成层(Ca),竖线表示木质部(Xy)区域。 The arrows point to cambium (Ca) and vertical lines represent xylem (Xy). |
|
|
利用毛白杨不定根诱导体系,进一步分析了PtoWOX11/12a是否通过影响生长素合成来调控分生组织的活性。通过qPCR分析了毛白杨PtoWOX11/12a基因和生长素合成基因YUCCA1和YUCCA8在毛白杨不定根产生和伸长过程中各个时期的表达,同时对PtoWOX11/12a基因在84K杨叶片中过表达或抑制表达后对生长素合成基因的影响做了进一步分析。结果发现,当茎段插入培养基后,PtoWOX11/12a被诱导表达,随后其表达量均上调,且在第2天时表达量最高,说明该基因在不定根发生的起始阶段发挥着重要作用(图 5A)。在不定根产生的过程中,生长素合成基因YUCCA1和YUCCA8在不定根发育的前期表达量较低,但是在第4天(即不定根形成之后)时出现显著的上调表达(图 5B,C)。过表达PtoWOX11/12a基因促进生长素合成基因的表达,而抑制表达PtoWOX11/12a基因生长素合成基因YUCCA1和YUCCA8表达量下调(图 5D)。表明生长素合成基因YUCCA1和YUCCA8受到PtoWOX11/12a的影响,在不定根形成后期(伸长过程)中发挥作用。
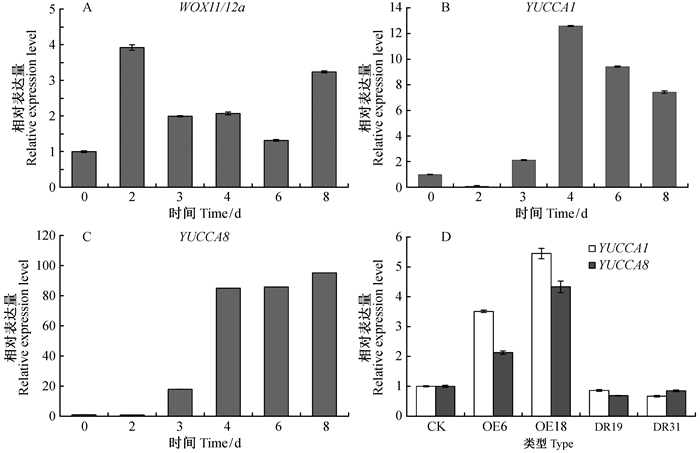
|
图 5 利用实时荧光定量PCR分析PtoWOX11/12a和生长素合成基因YUCCA1、YUCCA8的表达模式 Figure 5 Expression analysis of PtoWOX11/12a and auxin genes (YUCCA1 and YUCCA8) using qPCR A-C:诱导不同天数的毛白杨茎段;D:PtoWOX11/12a转基因和非转基因(对照)84K杨叶片。 A-C: Induction of stem segments of Populus tomentosa with different induction days; D: Leaves from different PtoWOX11/12a-and non-transgenic (control) 84K poplars. |
WOX家族基因除了参与茎尖分生组织干细胞的维持, 还参与高等植物根尖分生组织和维管分生组织中干细胞的维持(于燕杰等,2016)。目前,对于WOX基因家族中WOX11/12a基因的研究多集中在不定根发育方面,例如,Liu等(2014b)发现毛白杨WOX11/12a基因能够促进不定根的生长,增加不定根数量;Xu等(2015)发现过表达 PeWOX11a和PeWOX11b增加杨树的不定根数目同时还诱导出异位不定根,此外在过表达PeWOX11b转基因杨树的叶腋中诱导产生不定根。但是目前对 WOX11/12a基因对植株地上部分生长量的影响还未见报道。
本研究发现,过表达或者抑制PtoWOX11/12a基因能够影响转基因84K杨的根系生物量,这与前人的研究结果(Xu et al., 2015)一致,但是过表达或者抑制PtoWOX11/12a基因均影响了植株的叶形、株高、地径以及茎木质部的发育。过表达PtoWOX11/12a转基因植株叶片的长度与非转基因对照84K杨没有显著差异,但宽度稍微大于对照;抑制表达PtoWOX11/12a转基因植株叶片长度和宽度都显著低于对照,这表明叶芽基形成后分生组织的分裂和分化受到了PtoWOX11/12a的调控(图 2)。解剖分析发现,过表达植株的木质部宽度远远小于对照,同时抑制表达植株的木质部宽度也小于对照,但是较过表达植株略宽,说明PtoWOX11/12a基因能够影响茎的纵向及横向生长(次生木质部发育),导致转基因植株株高、地径均低于对照杨树(图 3)。木质部发育是由形成层活动决定的,过表达PtoWOX11/12a基因可能使转基因杨树形成层分裂活动增强,形成层细胞层数增多,但分化程度相对对照杨树较弱,致使木质部宽度低于对照杨树,而当PtoWOX11/12a表达受到抑制后,形成层分裂活动降低,形成层细胞层数减少,但是分化程度介于过表达转基因杨树和对照杨之间(图 4,表 4),说明PtoWOX11/12a影响了形成层干细胞的活动和木质部的分化。在拟南芥中,WOX5和WOX11在根顶端分生组织中发挥作用,WUS和WOX4主要参与茎顶端分生组织和形成层中的活动,但在调控茎尖和根部干细胞稳定以维持未分化状态时,WOX和WUS可以相互补偿(Sarkar et al., 2007; Hirakawa et al., 2010; Liu et al., 2014a)。由此推测,在本研究中当PtoWOX11/12a基因过表达后,叶片和茎部该基因的表达量显著上调,可能干扰或替代了原有的该家族其他成员在叶片或者茎中的功能,因而出现上面所述的表型变化。本文主要研究了PtoWOX11/12a基因对温室84K杨扦插苗生长发育的影响,今后工作还应进一步分析该基因对多年生植株生长发育的影响,例如发达的根系在田间是否最终会促进地上部分的增长等问题,进而全面揭示该基因的调控作用。
根据前人研究发现,杨树茎段插入基本培养基后第2~3天出现愈伤组织,4天后产生侧根,随后侧根进入伸长阶段(Liu et al., 2014c)。因此,在本研究中,为了解释PtoWOX11/12a对分生组织的影响,利用杨树不定根诱导系统分析了PtoWOX11/12a在茎段产生不定根的各个时期中的表达情况,特别是对生长素合成的影响。当茎段插入培养基后,PtoWOX11/12a基因被诱导表达,在愈伤组织形成时期(第2~3天)一直处于较高的表达水平,说明PtoWOX11/12a基因参与不定根形成起始过程(图 5),而这个时期生长素合成基因YUCCA1和YUCCA8表达量很少,但在不定根形成后的伸长期(4天后)表达量急剧增加,推测在生根过程中,PtoWOX11/12a基因及生长素合成基因YUCCA1和YUCCA8在表达时间上存在时间间隔。高水平的PtoWOX11/12a 抑制了生长素合成相关基因的表达,导致过表达PtoWOX11/12a转基因杨树更容易形成分生组织,因而促进了根原基的形成,产生了较多的不定根(Liu et al., 2014b)。不定根生长过程中,YUCCA1及YUCCA8基因上调表达,促进了生长素合成和根部分生组织细胞的分裂。在茎中表现为形成层活动增强,继而影响木质部的分化,木质部变窄。
4 结论本研究发现PtoWOX11/12a基因影响杨树扦插苗的生长发育。过表达PtoWOX11/12a转基因84K杨的叶片宽度增加,株高、地径降低,木质部宽度变小,但是形成层细胞层数增加;抑制表达PtoWOX11/12a转基因84K杨的叶长、宽都明显变小,且叶边缘呈现锯齿状缺刻,株高和地径也显著降低,木质部宽度与过表达植株相比相对变大,但形成层细胞层数变少。这种变化是由于PtoWOX11/12a影响了生长素合成基因YUCCA1和YUCCA8的表达,从而导致形成层活动和木质部形成的变化。本研究为深入探索WOX基因在植物不同组织生长发育调控机制提供了参考。
吴锦斌, 宋银, 乔睿, 等. 2013. CLE多肽参与植物分生组织维持与分化平衡的信号转导研究[J]. 生命科学, 25(4): 421-426. (Wu J B, Song Y, Qiao R, et al. 2013. CLE peptide signaling in balancing the maintenance and differentiation of meristems[J]. Chinese Bulletin Life Sciences, 25(4): 421-426. [in Chinese]) |
于燕杰, 张大兵, 袁政. 2016. WOX蛋白家族调控干细胞发育分子机制的研究进展[J]. 植物学报, 51(4): 565-574. (Yu Y J, Zhang D B, Yuan Z. 2016. The updated functional study of WOX protein family in regulating stem cell development[J]. Chinese Bulletin of Botany, 51(4): 565-574. DOI:10.11983/CBB15137 [in Chinese]) |
Aichinger E, Kornet N, Friedrich T, et al. 2012. Plant stem cell niches[J]. Annual Review of Plant Biology, 63: 615-636. DOI:10.1146/annurev-arplant-042811-105555 |
Chang S, Puryear J, Cairney J. 1993. A simple and efficient method for isolating RNA from pine trees[J]. Plant Molecular Biology Reporter, 11(2): 113-116. DOI:10.1007/BF02670468 |
Cho S H, Yoo S C, Zhang H, et al. 2013. The rice narrow leaf2 and narrow leaf3 loci encode WUSCHEL-related homeobox 3A (OsWOX3A) and function in leaf, spikelet, tiller and lateral root development[J]. New Phytologist, 198(4): 1071-1084. DOI:10.1111/nph.12231 |
Hirakawa Y, Kondo Y, Fukuda H. 2010. TDIF peptide signaling regulates vascular stem cell proliferation via the WOX4 homeobox gene in Arabidopsis[J]. The Plant Cell, 22(8): 2618-2629. DOI:10.1105/tpc.110.076083 |
Hiratsu K, Matsui K, Koyama T, et al. 2003. Dominant repression of target genes by chimeric repressors that include the EAR motif, a repression domain, in Arabidopsis[J]. The Plant Journal, 34(5): 733-739. DOI:10.1046/j.1365-313X.2003.01759.x |
Ji J, Strable J, Shimizu R, et al. 2010. WOX4 promotes procambial development[J]. Plant Physiology, 152(3): 1346-1356. DOI:10.1104/pp.109.149641 |
Liu J, Sheng L, Xu Y, et al. 2014a. WOX11 and 12 are involved in the first-step cell fate transition during de novo root organogenesis in Arabidopsis[J]. The Plant Cell, 26(3): 1081-1093. DOI:10.1105/tpc.114.122887 |
Liu B, Wang L, Zhang J, et al. 2014b. WUSCHEL-related Homeobox genes in Populus tomentosa: diversified expression patterns and a functional similarity in adventitious root formation[J]. BMC Genomics, 15(1): 296. DOI:10.1186/1471-2164-15-296 |
Liu B, Zhang J, Wang L, et al. 2014c. A survey of Populus PIN-FORMED family genes reveals their diversified expression patterns[J]. Journal of Experimental Botany, 65(9): 2437-2448. DOI:10.1093/jxb/eru129 |
Sarkar A K, Luijten M, Miyashima S, et al. 2007. Conserved factors regulate signalling in Arabidopsis thaliana shoot and root stem cell organizers[J]. Nature, 446(7137): 811-814. DOI:10.1038/nature05703 |
Ueda M, Zhang Z, Laux T. 2011. Transcriptional activation of Arabidopsis axis patterning genes WOX8/9 links zygote polarity to embryo development[J]. Developmental Cell, 20(2): 264-270. DOI:10.1016/j.devcel.2011.01.009 |
van der Graaff E, Laux T, Rensing S A. 2009. The WUS homeobox-containing (WOX) protein family[J]. Genome Biology, 10(12): 248. DOI:10.1186/gb-2009-10-12-248 |
Wang W, Li G, Zhao J, et al. 2014. DWARF TILLER1, a WUSCHEL-related homeobox transcription factor, is required for tiller growth in rice[J]. PLoS Genetics, 10(3): e1004154. DOI:10.1371/journal.pgen.1004154 |
Xu M, Xie W, Huang M. 2015. Two WUSCHEL-related HOMEOBOX genes, PeWOX11a and PeWOX11b, are involved in adventitious root formation of poplar[J]. Physiologia Plantarum, 155(4): 446-456. DOI:10.1111/ppl.12349 |
Zhang Y, Jiao Y, Liu Z, et al. 2015. ROW1 maintains quiescent centre identity by confining WOX5 expression to specific cells[J]. Nature Communications, 6: 6003. DOI:10.1038/ncomms7003 |
Zhao Y, Hu Y, Dai M, et al. 2009. The WUSCHEL-related homeobox gene WOX11 is required to activate shoot-borne crown root development in rice[J]. The Plant Cell, 21(3): 736-748. DOI:10.1105/tpc.108.061655 |
 2017, Vol. 53
2017, Vol. 53

