文章信息
- 王晓荣, 程龙军, 徐凤华, 倪晓祥, 陆军
- Wang Xiaorong, Cheng Longjun, Xu Fenghua, Ni Xiaoxiang, Lu Jun
- 巨桉EgrZFP6基因在非生物逆境胁迫响应中的功能
- Function of ZFP6 Gene from Eucalyptus grandis in Response to Abiotic Stresses
- 林业科学, 2017, 53(11): 60-68.
- Scientia Silvae Sinicae, 2017, 53(11): 60-68.
- DOI: 10.11707/j.1001-7488.20171107
-
文章历史
- 收稿日期:2017-03-22
- 修回日期:2017-04-20
-
作者相关文章
低温、干旱等非生物胁迫会制约植物生长和发育,对农林业生产有严重影响。研究植物抗逆生理和分子机制对提高植物非生物逆境胁迫抗性具有重要意义(Dos Reis et al., 2012; Roychoudhury et al., 2015)。为了应对逆境胁迫,植物在长期进化过程中形成了一定的响应机制,植物感受到逆境信号后,通过相应基因调控,改变一系列代谢过程,产生应对胁迫的响应,如提高可溶性糖含量,增加抗渗透胁迫物质如脯氨酸、甜菜碱等,进而提高植物抗逆性(Takabe, 2012)。在植物抗逆分子响应机制中,作为基因开关的转录因子(transcription factor, TF)发挥重要作用。植物中转录因子数量庞大,相当一部分成员与逆境调控相关,如bZIP、WRKY、AP2/EREBP、MYB和NAC等,近年来锌指类转录因子(Zinc Finger Protein: ZFP)也被证明在植物逆境胁迫响应中发挥重要作用(Gujjar et al., 2014; Reddy et al., 2013)。
根据ZFP转录因子具有的半胱氨酸(C)和组氨酸(H)残基数量和位置,可将锌指蛋白转录因子分为C2H2,C2H,C2C2,C2HCC2C2,C2C2C2等类型。其中C2H2型锌指蛋白是植物中研究较多、功能较为明确的一类锌指蛋白。其锌指结构域由约30个氨基酸组成,包含2个半胱氨酸和2个组氨酸,以及一段植物所特有的高度保守序列(QALGGH)(Kubo et al., 1998; 黄骥等, 2014)。
C2H2型锌指蛋白在植物中成员众多,拟南芥(Arabidopsis thaliana)中发现176个成员(Englbrecht et al., 2004),水稻(Oryza sativa)基因组数据显示水稻上有182个(Agarwal et al., 2007)。C2H2型锌指蛋白广泛参与植物生长、发育和代谢,以及植物对低温、高盐和干旱等非生物逆境响应(Kiełbowicz-Matuk et al., 2012)。水稻OsZFP1作为负调控因子,能抑制盐胁迫相关基因表达,转基因植株对盐胁迫抗性降低;同时,OsZFP1的逆境响应还受脱落酸(ABA)影响,暗示其可能参与ABA依赖的逆境响应过程(Kong et al., 2004)。水稻另外1个C2H2型锌指蛋白转录因子基因OsZFP245的超表达则能够提高植株对低温、干旱和氧化逆境的抗性(Huang et al., 2009)。矮牵牛(Petunia hybrida)基因ZPT2-3也可被低温、干旱和重金属等非生物胁迫诱导表达,其转基因植株干旱耐受力有效提高(Sugano et al., 2003)。这些表明C2H2型锌指蛋白转录因子能够在植物非生物逆境胁迫响应中发挥作用。
目前植物C2H2型锌指蛋白在林木中研究较少。巨桉(Eucalyptus grandis)作为世界三大用材树种之一,在我国南方各省栽培广泛,为我国林业产业发展做出重要贡献。但其对低温敏感,不耐干旱、盐渍,这严重限制其栽培范围的扩大;低温、干旱等不良天气条件还经常对桉树生产造成损失。因此,研究巨桉非生物逆境胁迫响应分子机制对桉树抗逆分子育种具有重要意义。作者所在实验室前期研究中发现,EgrZFP6表达受低温、盐胁迫诱导,极有可能参与巨桉非生物胁迫响应过程(Wang et al., 2014),本研究利用遗传转化和酵母(Saccharomyces cerevisiae)双杂交等手段,对该基因在低温、干旱和高盐等非生物逆境胁迫下的功能进行了初步研究。
1 材料与方法 1.1 材料巨桉幼苗生长在浙江农林大学苗圃地。所选试验材料为长势一致的6个月苗龄组培无性系幼苗。拟南芥野生型为COL。试验处理均在Snijders微气候控制生长箱(MC1000,荷兰)中进行。拟南芥培养条件:白天24 ℃ 15 h,夜间22 ℃ 9 h;巨桉培养条件:白天25 ℃ 12 h,夜间22 ℃ 12 h。光照强度150 μmol·m-2s-1, 相对湿度(RH)70%。
1.2 EgrZFP6蛋白序列分析在巨桉数据库phytozome(http://www.phytozome.net/search.php)下载EgrZFP6全长序列,设计引物,进行全长序列测序验证后,将其编码蛋白序列在https://blast.ncbi.nlm.nih.gov/Blast.cgi进行Blast比对,选择5个与该蛋白序列相似程度比较高的不同物种蛋白序列,利用Clastalx1.83进行多重比对。同时,用CDD在线软件(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析蛋白序列保守域。
1.3 EgrZFP6亚细胞定位设计引物(表 1),PCR扩增去掉终止密码子的EgrZFP6开放阅读框序列,以pCAMBIA1300为载体骨架,利用多克隆位点处的Kpn Ⅰ和Xba Ⅰ酶切位点,构建EgrZFP6-GFP融合蛋白表达载体。提取质粒,金粉包埋后轰击洋葱(Allium cepa)表皮细胞。激光共聚焦显微镜扫描成像。
|
|
超表达载体骨架为含35S启动子的pCAMBIA1301,EgrZFP6全长序列扩增引物见表 1,利用多克隆位点处的Kpn Ⅰ和Xba Ⅰ酶切位点,双酶切法构建35S∷EgrZFP6超表达载体。提取质粒,选取健壮盛花期拟南芥采用农杆菌(Agrobacterium)蘸花法转化拟南芥(许红梅等, 2010)。收获侵染植株种子,于含20 mg·L-1潮霉素(hygromycin)的1/4MS培养基上进行筛选,阳性植株继续繁殖,收获,筛选,PCR检测,直到获得T3代转基因纯合株系。提取10天苗龄的野生型和2个超表达EgrZFP6拟南芥纯合株系RNA,逆转录后,设计引物(表 1)以AtActin为内参基因进行半定量RT-PCR,鉴定EgrZFP6在转基因株系中的表达情况。
野生型和超表达EgrZFP6拟南芥种子均匀播种在1/2MS培养基上,4 ℃暗处理24 h后置于生长箱中生长。1周后,比较和分析野生型和超表达株系表型变化;参考Zhao等(2016)方法,将10天苗龄幼苗于-8 ℃低温处理3天,然后正常培养条件下缓苗3天,拍照观察表型,统计植株死亡率;盐(NaCl)处理梯度为0,50,100 mmol·L-1,使用PEG6000模拟干旱处理,处理梯度为1,5,9 g·L-1,种子发芽后,于生长箱中生长1周,观察表型并拍照(Nikon, D7000)。
1.5 巨桉低温、干旱和盐胁迫处理选取6个月苗龄生长一致的巨桉幼苗,在植物低温生长箱(MC1000,Snijders,荷兰)中进行不同低温(-8,-4,0,4 ℃,2 h)处理以及4 ℃低温不同时间(0.5,2,6,12,24,48 h)处理,低温处理均以正常生长温度(25 ℃)为对照(CK)。将处理苗的栽培盆置于200 mmol·L-1NaCl水溶液中,保持液面位于栽培盆高度的1/3处,以清水为对照(CK)进行高盐处理。干旱处理则以5,3,2,1天不浇水的苗作为处理组,正常浇水的(每天每盆苗浇水200 mL)为对照(CK)。每个处理3株苗,进行3次重复。试验处理结束后同时收获叶片,提取RNA置于-70 ℃冰箱(SANYO,日本)备用。
1.6 EgrZFP6互作蛋白筛选利用Clontech公司酵母双杂交试剂盒(Cat.630489), 构建巨桉酵母杂交文库。同时,构建pGADT7-EgrZFP6和pGBKT7-EgrZFP6共转化Y2H gold酵母菌株进行自激活检测,然后抽提文库质粒与诱饵载体pGBKT7-EgrZFP6共转化Y2H gold进行文库筛选。具体操作步骤按照试剂盒说明进行。最后,对筛选到的与EgrZFP6互作的蛋白EgrERF4进行酵母双杂交一对一验证。
EgrZFP6和EgrERF4基因全长序列扩增引物见表 1。利用多克隆位点EcoR Ⅰ和BamH Ⅰ酶切位点,双酶切法构建pGBKT7-EgrZFP6和pGADT7-EgrERF4,pGBKT7-Lam为阴性对照,pGBKT7-53为阳性对照。
1.7 RNA提取、cDNA合成及基因定量表达分析巨桉RNA提取参考CTAB+Trizol法(王亚红等, 2010),拟南芥RNA提取参照Trizol法(金美芳,2007)。cDNA反转录试剂盒由康为世纪公司提供,定量荧光染料SYBR由TAKARA公司(大连,中国)提供。设计引物(表 1)用BIO-Rad CFX96实时荧光定量RT-PCR系统(BioRad, 美国)以及系统自带的Bio-Rad CFX Manager(Ver 1.5.5.34)软件进行试验和结果分析。
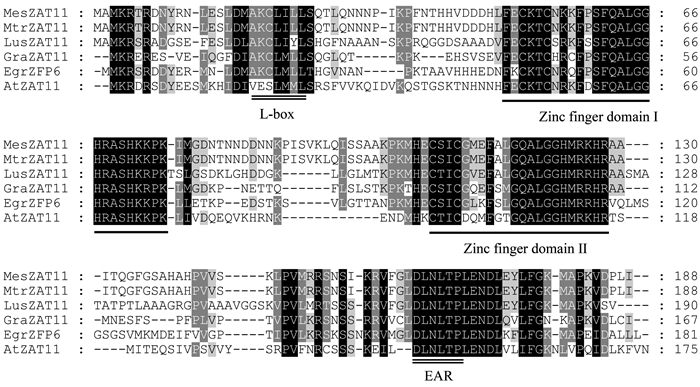
2 结果与分析 2.1 EgrZFP6编码蛋白结构分析EgrZFP6编码蛋白含有2个锌指结构域,对该基因蛋白序列进行保守结构域搜索,并将其与其他不同植物中的同源蛋白比对分析,结果表明该基因编码蛋白含有2个高度保守的锌指蛋白结构域,且2个锌指结构域核心序列均为QALGGH,该序列是植物锌指蛋白所特有的(Takatsuji, 1999)。另外,EgrZFP6蛋白序列还分别含有1个乙烯响应元件结合因子相关双性抑制子(ERF associated amphiphilic repression:EAR)基序:DLNLTP和1个L-box基序(图 1)。
|
图 1 巨桉EgrZFP6蛋白序列与其他植物同源蛋白序列比对 Figure 1 Multiple alignments of homologus proteins with high similarity sequences to EgrZFP6 in Eucalyptus grandis MesZAT11:木薯Manihot esculenta(OAY41302.1);MtrZAT11:蒺藜苜蓿Medicago truncatula(XP_013468307.1);LusZAT11:亚麻Linum usitatissimum(XP_002533000);GraZAT11:雷蒙德氏棉Gossypium raimondii(XP_012483278.1); AtZAT11:拟南芥Arabidopsis thaliana (AEC09397.1).锌指结构域用加粗黑线标示,L-box和EAR基序用双实线表示。The zinc finger domain is marked with thicken black line, L-box and EAR motif are showed with double lines. |
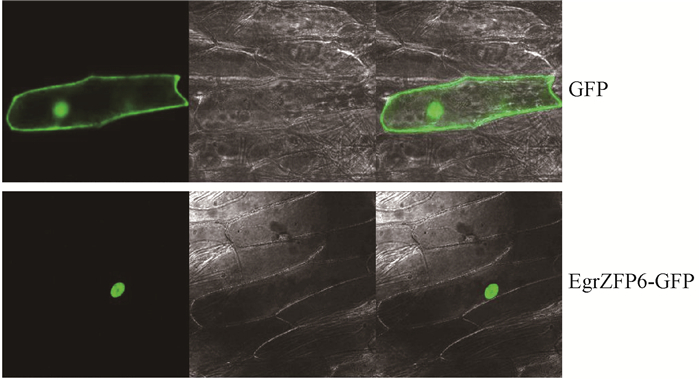
构建EgrZFP6-GFP表达载体,利用基因枪轰击洋葱表皮的方法对EgrZFP6蛋白进行亚细胞定位分析,结果表明该蛋白定位于细胞核中(图 2)。其可能是作为转录因子在细胞核内发挥基因表达调控作用。
|
图 2 EgrZFP6的亚细胞定位 Figure 2 Subcellular localization of EgrZFP6 |
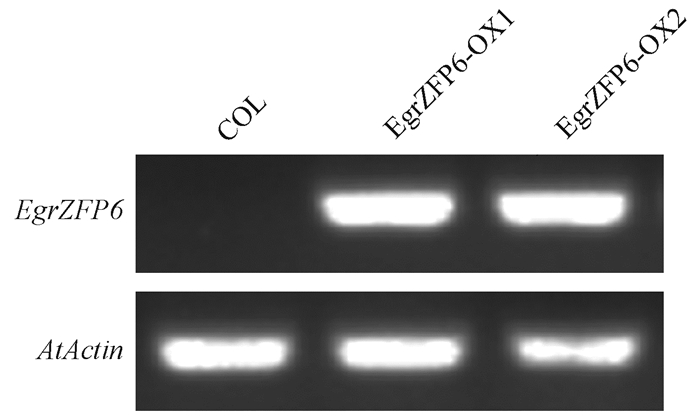
半定量RT-PCR分析结果(图 3)表明,野生型COL中没有检测到EgrZFP6表达,在2个转基因纯合株系EgrZFP6-OX1和EgrZFP6-OX2中EgrZFP6具有明显表达(图 3)。
|
图 3 野生型和超表达EgrZFP6拟南芥转基因株系鉴定 Figure 3 Identification of EgrZFP6 expression in wild type and two EgrZFP6 over-expression lines in Arabidopsis thaliana COL:野生型; EgrZFP6-OX1, EgrZFP6-OX2:超表达株系。下同。 COL: Wild type; EgrZFP6-OX1, EgrZFP6-OX2: Over-expression lines. The same below. |
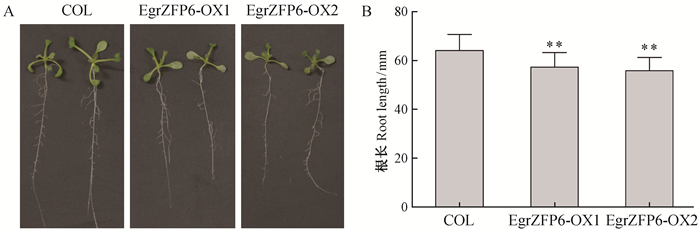
超表达EgrZFP6拟南芥2个纯合株系EgrZFP6-OX1和EgrZFP6-OX2,播种7天后与对照(COL)相比,根长生长明显受到抑制(图 4A),2个转基因株系的根长分别为野生型的89.4%和87.0%(图 4B)。
|
图 4 野生型和超表达EgrZFP6拟南芥转基因株系生长7天后表型(A)和根长差异(B) Figure 4 Phenotype(A) of wild type and EgrZFP6 over-expression lines after 7 days growth and difference of the primary root length(B) t检验 t test: **,P < 0.01. |
盐处理下,EgrZFP6超表达拟南芥株系与野生型拟南芥随盐浓度提高,主根、侧根生长都表现为受盐抑制,但受抑制程度EgrZFP6超表达株系相对于野生型有所减弱,暗示超表达EgrZFP6在一定程度上能够提高植株对盐胁迫的耐受性(图 5)。

|
图 5 盐胁迫下野生型和超表达EgrZFP6拟南芥的表型 Figure 5 Phenotype of wild type and EgrZFP6 over-expression Arabidopsis thaliana lines under salt treatments |
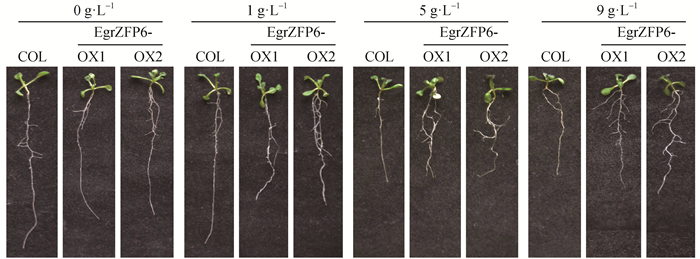
在PEG处理中,1 g·L-1以上的浓度即能诱导EgrZFP6超表达拟南芥株系侧根大量发生,同时侧根伸长作用也明显被促进。但主根伸长与对照相比,在PEG处理下受抑制作用减弱,表示超表达EgrZFP6株系主根伸长生长对渗透胁迫的抑制作用敏感性下降(图 6)。
|
图 6 模拟干旱胁迫下野生型和超表达EgrZFP6拟南芥的表型 Figure 6 Phenotype of wild type and EgrZFP6 over-expression Arabidopsis thaliana lines under PEG treatments |
超表达EgrZFP6转基因株系,-8 ℃低温处理3天,然后于正常温度下(24 ℃)恢复生长3天,转基因株系生长恢复速度很慢;同时,野生型死亡率为16%,而转基因株系的植株死亡率分别达到了40%和48%。表明EgrZFP6超表达提高了转基因株系对低温的敏感性(图 7)。

|
图 7 -8 ℃处理后野生型和超表达EgrZFP6拟南芥的表型 Figure 7 Phenotype of wild type and EgrZFP6 over-expression Arabidopsis thaliana lines after treatment at -8 ℃ |
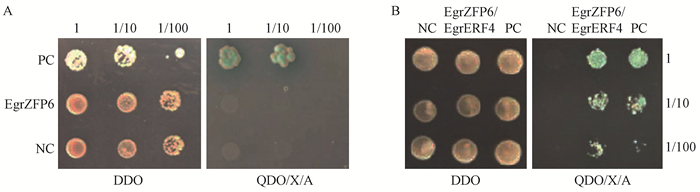
酵母双杂交文库中筛选到1个与EgrZFP6互作的蛋白EgrERF4,对该基因编码蛋白与EgrZFP6的互作情况进行了一对一验证。pGADT7/pGBKT7-EgrZFP6转化后融合菌株在双缺平板DDO(SD/-Trp/-Leu)和四缺平板QDO(SD/-Trp/-Leu/ -His/-Ade)没有菌斑生长,阴性对照(pGADT7-T/ pGBKT7-Lam)也没有菌斑生长,阳性对照(pGADT7-T/pGBKT7-53)菌斑生长正常并且显蓝色(图 8 A),表明其没有自激活活性。而pGBKT7-EgrZFP6与pGADT7-EgrERF4转化后的融合菌株双杂交在双缺平板DDO(SD/-Trp/-Leu)上可正常生长,在四缺平板QDO(SD/-Trp/-Leu/-His/-Ade)上正常生长且菌斑为蓝色(图 8B),这些结果表明EgrZFP6和EgrERF4两个蛋白存在互作现象。
|
图 8 EgrZFP6自激活检测(A)及EgrZFP6与EgrERF4酵母双杂结果(B) Figure 8 The self-activation detection of EgrZFP6(A) and the result of yeast two-hybrid of EgrERF4 and EgrZFP6(B) DDO:双缺平板(SD/-Trp/-Leu); QDO:四缺平板(SD/-Trp/-Leu/-His/-Ade); X:酵母半乳糖苷酶; A:金担子素A; NC:阴性对照; PC:阳性对照; 1, 1/10, 1/100:稀释倍数。 DDO: SD/-Trp/-Leu; QDO: SD/-Trp/-Leu/-His/-Ade; X: X-α-Gal; A: Aureobasidin A; NC: Negative control; PC: Positive control; 1, 1/10, 1/100: Dilution multiple. |
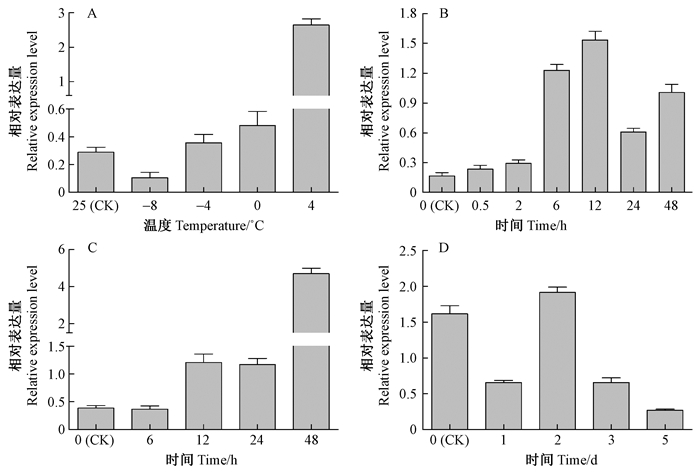
对正常巨桉幼苗低温、干旱和盐胁迫条件下,叶片中EgrERF4表达进行分析,结果表明,不同低温(-8,-4,0,4 ℃)2 h处理下,除了-8 ℃处理下EgrERF4表达受到抑制外,其他低温条件都对基因表达呈诱导趋势,其中4 ℃处理对基因的诱导作用最强,表达量为对照(25 ℃)的8.6倍(图 9A)。-8 ℃时的抑制作用可能是由于过低温度造成冻害,引起细胞调控紊乱所致。4 ℃不同时间(0.5,2,6,12,24,48 h)处理定量结果表明,处理0.5 h后,表达量即明显上调,达到对照的1.5倍,处理6 h时基因相对表达量已是对照的7.6倍,12 h后诱导作用达到最大,上调至对照的9.6倍,之后表达量有所下降,但仍处于高度诱导水平(图 9B)。
|
图 9 EgrERF4在不同低温(A)、4 ℃不同时间(B)、盐胁迫(C)和干旱胁迫(D)处理下相对表达量 Figure 9 Relative expression of EgrERF4 under different temperature treatment(A)、different time treatment at 4 ℃(B)、salt treatment(C) and drought stress(D) |
巨桉植株在200 mmol·L-1NaCl处理12 h后,EgrERF4表达量即开始受到明显诱导,至48 h时表达量达到对照组的12.6倍(图 9C),表明EgrERF4表达受到高盐胁迫诱导。而干旱胁迫下,处理1天后EgrERF4表达即受到抑制,第2天恢复对照水平,随后又表现出强烈的抑制效应,干旱处理5天时,表达量仅为对照的0.17倍(图 9D)。
3 讨论作为典型C2H2型锌指结构蛋白,EgrZFP6不仅有2个极为保守的锌指结构域,同时还含有1个EAR基序,该基序是1个转录抑制基序,含有它的转录因子往往作为负调控因子起作用。拟南芥中同样含有EAR基序的锌指结构转录因子基因AtERF7超表达能够通过降低保卫细胞对ABA的敏感性,导致由于水分过度蒸发而负调控植株对干旱逆境的响应(Song et al., 2005);拟南芥AtZAT11基因超表达能够下调液泡镍转运蛋白表达,进一步降低植株中镍含量,致使超表达AtZAT11植株对镍的耐受性降低(Liu et al., 2014)。小麦(Triticum aestivum)基因TaZFP34可以被低温、高盐和干旱等非生物逆境因子诱导表达,且干旱诱导时产生对根发育相关的B类响应调节因子基因SHY2表达的抑制作用,提高植株根冠比(Chang et al., 2016)。本研究中超表达EgrZFP6基因的2个拟南芥株系中,植株表现出根长生长受抑制现象,这极有可能是因为EgrZFP6作为负调控因子,下调了根伸长相关分子途径中重要基因表达而导致的。另外,转基因株系对低温敏感性的提高也可能与EgrZFP6对基因表达的负调控特性有关,其可能抑制了植株中一些响应低温胁迫基因的表达,提高了植株对低温的敏感性。
另外,也有研究表明,C2H2型锌指结构蛋白即使含有转录抑制基序EAR,其仍可以作为激活因子发挥正调控作用,在非生物逆境胁迫中发挥重要作用(Ohta et al., 2001)。番茄(Lycopersicon esculentum)中含有EAR基序的C2H2型锌指结构蛋白基因SIZF2在拟南芥中超表达参与ABA信号传导,下调激素特别是ABA相关基因的表达,增强其对盐胁迫的耐受性(Hichri et al., 2014)。拟南芥基因 ZFP3超表达可增强植株对盐和渗透胁迫的耐受能力(Zhang et al., 2016a);玉米(Zea mays)ZmZF 1和野大豆(Glycine soja)GsZFP1超表达拟南芥抗旱性都得到明显增强(Huai et al., 2009;Luo et al., 2011);水稻基因 ZFP252和OsMSR15则能够在水稻干旱胁迫调控中发挥重要作用,其超表达植株干旱耐受性提高(Xu et al., 2008;Zhang et al., 2016b)。本研究在模拟干旱PEG处理下,EgrZFP6拟南芥转基因株系相对于对照根伸长不受影响,而侧根数量和长度都明显增加,这是干旱适应性的表现,暗示EgrZFP6的超表达能够形成一定的抗旱性植株表型特征。高盐胁迫下,EgrZFP6转基因植株对盐胁迫耐受性有一定程度提高。这应该都与EgrZFP6对相应逆境响应相关基因的正向调控作用密不可分。EgrZFP6在低温和干旱、高盐不同逆境下所发挥的截然不同调控机制,表明了该基因在植物逆境调控中的复杂性。
EgrZFP6蛋白序列中还含有1个L-box基序,该基序参与蛋白与蛋白之间的互作效应(Kagale et al., 2011)。酵母双杂交筛选结果表明,EgrZFP6能够与EgrERF4互作,EgrERF4是乙烯应答因子ERF转录因子基因家族中的1个成员,该家族成员编码蛋白序列以含有1个AP2/ERF结构域为重要特征,在低温、干旱和高盐等非生物逆境胁迫响应过程中发挥重要调控作用(Xu et al., 2011; Mizoi et al., 2012)。非生物逆境响应中,该家族转录因子和C2H2型锌指结构蛋白因子类似,发挥的作用也有两面性,既可以是负调控因子,也可以是正调控因子。水稻OsERF 109的超表达使转基因植株的干旱耐受能力降低(Yu et al., 2016),超表达OsAP 23则会提高转基因植株对盐的敏感性(Zhuang et al., 2013),这些ERF类转录因子都是作为负调控因子而存在的。而另外一些ERF基因家族成员则可以促进非生物逆境抗性的提高。大豆(Glycine max)中GmERF 3和水稻中JERF 3、JERF1和TERF1的超表达都能使转基因植株有效增强对干旱和高盐的抗性(Zhang et al., 2009; 2010a; 2010b; Gao et al., 2008)。酵母双杂交结果表明EgrZFP6蛋白能够与EgrERF4蛋白互作。表达层面上,巨桉EgrERF4基因表达在低温和盐胁迫下都被不同程度诱导,但受干旱逆境条件抑制。这与EgrZFP6的表达结果相似(Wang et al., 2014),二者表达具有一定协同性。这暗示它们在功能发挥方面可能也存在较大相似性,EgrZFP6与EgrERF4的互作效应在非生物逆境胁迫响应中的具体作用,尚需进一步的研究进行揭示。
4 结论巨桉C2H2型锌指结构蛋白转录因子EgrZFP6,参与低温逆境胁迫响应的负调控作用,提高植物对低温的敏感性。但在干旱和高盐等渗透胁迫下,其过表达能够改变植株根构型,使其向适应胁迫的方向发展。同时EgrZFP6可与乙烯响应因子蛋白EgrERF4互作,二者可能通过这种互作效应协同参与巨桉低温、干旱和高盐等逆境胁迫响应过程。
黄骥, 王建飞, 张红生. 2004. 植物C2H2型锌指蛋白的结构与功能[J]. 遗传, 26(3): 414-418. (Huang J, Wang J F, Zhang H S. 2004. Structure and function of plant C2H2 zinc finger protein[J]. Hereditas, 26(3): 414-418. [in Chinese]) |
金美芳. 2007. 拟南芥总RNA的简便提取与效果分析[J]. 福建师范大学福清分校学报, 79(2): 16-18. (Jin M F. 2007. A simple method for Arabidopsis thaliana total RNA isolation and its advantage[J]. Journal of Fuqing Branch of Fujian Normal University, 79(2): 16-18. [in Chinese]) |
许红梅, 张立军, 刘淳. 2010. 农杆菌蘸花法侵染拟南芥的研究[J]. 北方园艺, (14): 143-146. (Xu H M, Zhang L J, Liu C. 2010. Study of infection of Arabidopsis thaliana by Agrobacterium dipping flower method[J]. Northern Horticulture, (14): 143-146. [in Chinese]) |
王亚红, 刘缙, 王玉国. 2010. 高质量提取银杏种仁总RNA的改良方法[J]. 中国农学通报, 26(15): 48-52. (Wang Y H, Liu J, Wang Y G. 2010. An improved method for RNA isolation from seeds of Ginkgo biloba L.[J]. Chinese Agricultural Science Bulletin, 26(15): 48-52. [in Chinese]) |
Agarwal P, Arora R, Ray S, et al. 2007. Genome-wide identification of C2H2 zinc-finger gene family in rice and their phylogeny and expression analysis[J]. Plant Molecular Biology, 65(4): 467-485. DOI:10.1007/s11103-007-9199-y |
Chang H, Chen D, Kam J, et al. 2016. Abiotic stress upregulated TaZFP34 represses the expression of type-B response regulator and SHY2 genes and enhances root to shoot ratio in wheat[J]. Plant Science, 252: 88-102. DOI:10.1016/j.plantsci.2016.07.011 |
Dos Reis S P, Lima A M, de Souza C R. 2012. Recent molecular advances on downstream plant responses to abiotic stress[J]. International Journal of Molecular Sciences, 13(7): 8628-8647. |
Englbrecht C C, Heiko S, Siegfried B. 2004. Conservation, diversification and expansion of C2H2 zinc finger proteins in the Arabidopsis thaliana genome[J]. BMC Genomics, 5(1): 39. DOI:10.1186/1471-2164-5-39 |
Gao S M, Zhang H W, Tian Y, et al. 2008. Expression of TERF1 in rice regulates expression of stress-responsive genes and enhances tolerance to drought and high-salinity[J]. Plant Cell Reports, 27(11): 1787-1795. DOI:10.1007/s00299-008-0602-1 |
Gujjar R S, Akhtar M, Singh M. 2014. Transcription factors in abiotic stress tolerance[J]. Indian Journal of Plant Physiology, 19(4): 306-316. DOI:10.1007/s40502-014-0121-8 |
Hichri I, Muhovski Y, Žižková E, et al. 2014. The Solanum lycopersicum Zinc Finger2 cysteine-2/histidine-2 repressor-like transcription factor regulates development and tolerance to salinity in tomato and Arabidopsis[J]. Plant Physiology, 164(4): 1967-1990. DOI:10.1104/pp.113.225920 |
Huai J L, Zheng J, Wang G Y. 2009. Overexpression of a new Cys2/His2 zinc finger protein ZmZF1 from maize confers salt and drought tolerance in transgenic Arabidopsis[J]. Plant Cell, Tissue and Organ Culture, 99(2): 117-124. DOI:10.1007/s11240-009-9582-2 |
Huang J, Sun S J, Xu D Q, et al. 2009. Increased tolerance of rice to cold, drought and oxidative stresses mediated by the overexpression of a gene that encodes the zinc finger protein ZFP245[J]. Biochemical and Biophysical Research Communications, 389(3): 556-561. DOI:10.1016/j.bbrc.2009.09.032 |
Kagale S, Rozwadowski K. 2011. EAR motif-mediated transcriptional repression in plants:an underlying mechanism for epigenetic regulation of gene expression[J]. Epigenetics, 6(2): 141-146. DOI:10.4161/epi.6.2.13627 |
Kiełbowicz-Matuk Agnieszka. 2012. Involvement of plant C2H2-type zinc finger transcription factors in stress responses[J]. Plant Science, 185(4): 78-85. |
Kong J, Cao W H, Zhang J S, et al. 2004. Transgenic analysis of a salt-inhibited OsZFP1 gene from rice[J]. Acta Botanica Sinica, 46(5): 573-577. |
Kubo K I, Sakamoto A, Kobayashi A, et al. 1998. Cys2/His2 zinc-finger protein family of petunia:evolution and general mechanism of target-sequence recognition[J]. Nucleic Acids Research, 26(2): 608-615. DOI:10.1093/nar/26.2.608 |
Liu X M, An J, Han H J, et al. 2014. ZAT11, a zinc finger transcription factor, is a negative regulator of nickel ion tolerance in Arabidopsis[J]. Plant Cell Reports, 33(12): 2015-2021. DOI:10.1007/s00299-014-1675-7 |
Luo X, Bai X, Zhu D, et al. 2011. GsZFP1, a new Cys2/His2-type zinc-finger protein, is a positive regulator of plant tolerance to cold and drought stress[J]. Planta, 235(6): 1141-1155. |
Mizoi J, Shinozaki K, Yamaguchi-Shinozaki K. 2012. AP2/ERF family transcription factors in plant abiotic stress responses[J]. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, 1819(2): 86-96. DOI:10.1016/j.bbagrm.2011.08.004 |
Ohta M, Matsui K, Hiratsu K, et al. 2001. Repression domains of class Ⅱ ERF transcriptional repressors share an essential motif for active repression[J]. Plant Cell, 13(8): 1959-1968. DOI:10.1105/tpc.13.8.1959 |
Reddy D S, Mathur P B, Sharma K K. 2013. Regulatory role of transcription factors in abiotic stress responses in plants//Climate change and plant abiotic stress tolerance. Wiley-VCH Verlag GmbH & Co. KGaA, 555-588. )
|
Roychoudhury A, Banerjee A, Lahiri V. 2015. Metabolic and molecular-genetic regulation of proline signaling and its cross-talk with major effectors mediates abiotic stress tolerance in plants[J]. Turkish Journal of Botany, 39(6): 887-910. |
Song C P, Agarwal M, Ohta M, et al. 2005. Role of an Arabidopsis AP2/EREBP-type transcriptional repressor in abscisic acid and drought stress responses[J]. Plant Cell, 17(8): 2384-2396. DOI:10.1105/tpc.105.033043 |
Sugano S, Kaminaka H, Rybka Z, et al. 2003. Stress-responsive zinc finger gene ZPT2-3 plays a role in drought tolerance in petunia[J]. The Plant Journal, 36(6): 830-841. DOI:10.1046/j.1365-313X.2003.01924.x |
Takabe T. 2012. Engineering of betaine biosynthesis and transport for abiotic stress tolerance in plants[J]. Journal of Plant Biochemistry and Biotechnology, 21(1): 58-62. |
Takatsuji H. 1999. Zinc-finger proteins:the classical zinc finger emerges in contemporary plant science[J]. Plant Molecular Biology, 39(6): 1073-1078. DOI:10.1023/A:1006184519697 |
Wang S, Wei X L, Cheng L J, et al. 2014. Identification of a C2H2-type zinc finger gene family from Eucalyptus grandis and its response to various abiotic stresses[J]. Biologia Plantarum, 58(2): 385-390. DOI:10.1007/s10535-014-0399-4 |
Xu Z S, Chen M, Li L C, et al. 2011. Functions and application of the AP2/ERF transcription factor family in crop improvement[J]. Journal of Integrative Plant Biology, 53(7): 570-585. |
Xu D Q, Huang J, Guo S Q, et al. 2008. Overexpression of a TFⅢA-type zinc finger protein gene ZFP252 enhances drought and salt tolerance in rice (Oryza sativa L.)[J]. FEBS Letters, 582(7): 1037-1043. DOI:10.1016/j.febslet.2008.02.052 |
Yu Y, Yang D, Zhou S, et al. 2016. The ethylene response factor OsERF109 negatively affects ethylene biosynthesis and drought tolerance in rice[J]. Protoplasma, 254: 401-408. |
Zhang G, Chen M, Li L, et al. 2009. Overexpression of the soybean GmERF3 gene, an AP2/ERF type transcription factor for increased tolerances to salt, drought, and diseases in transgenic tobacco[J]. Journal of Experimental Botany, 60(13): 3781-3796. DOI:10.1093/jxb/erp214 |
Zhang H, Wu L, Wan L, et al. 2010a. Functional analyses of ethylene response factor JERF3 with the aim of improving tolerance to drought and osmotic stress in transgenic rice[J]. Transgenic Research, 19(5): 809-818. DOI:10.1007/s11248-009-9357-x |
Zhang Z, Li F, Li D, et al. 2010b. Expression of ethylene response factor JERF1 in rice improves tolerance to drought[J]. Planta, 232(3): 765-774. DOI:10.1007/s00425-010-1208-8 |
Zhang A, Liu D, Hua C, et al. 2016a. The Arabidopsis gene zinc finger protein 3(ZFP3) is involved in salt stress and osmotic stress response[J]. PLoS One, 11(12): e0168367. DOI:10.1371/journal.pone.0168367 |
Zhang X, Zhang B, Li M J, et al. 2016b. OsMSR15 encoding a rice C2H2-type zinc finger protein confers enhanced drought tolerance in transgenic Arabidopsis[J]. Journal of Plant Biology, 59(3): 271-281. DOI:10.1007/s12374-016-0539-9 |
Zhao C, Zhang Z, Xie S, et al. 2016. Mutational evidence for the critical role of CBF transcription factors in cold acclimation in Arabidopsis[J]. Plant Physiology, 171(4): 2744-2759. |
Zhuang J, Jiang H H, Wang F, et al. 2013. A rice OsAP23, functioning as an AP2/ERF transcription factor, reduces salt tolerance in transgenic Arabidopsis[J]. Plant Molecular Biology Reporter, 31(6): 1336-1345. DOI:10.1007/s11105-013-0610-3 |
 2017, Vol. 53
2017, Vol. 53

