文章信息
- 付宁宁, 刘佳, 渠成, 王然, 许奕华, 罗晨, 李峰奇
- Fu Ningning, Liu Jia, Qu Cheng, Wang Ran, Xu Yihua, Luo Chen, Li Fengqi
- 悬铃木方翅网蝽化学感受蛋白CcilCSP1的结构及其结合寄主挥发物的预测分析
- Analysis of Corythucha ciliata CcilCSP1 Structure and Prediction of Its Binding to Host-Plant Volatiles
- 林业科学, 2017, 53(10): 109-117.
- Scientia Silvae Sinicae, 2017, 53(10): 109-117.
- DOI: 10.11707/j.1001-7488.20171012
-
文章历史
- 收稿日期:2016-10-12
- 修回日期:2017-02-05
-
作者相关文章
悬铃木(Platanus spp.)在我国是引进栽培种,包括一球悬铃木(P. occidentalis)、二球悬铃木(P. acerifolia)和三球悬铃木(P. orientalis)3个种。我国广泛栽培的是二球悬铃木,其具有树势优美、繁殖生长快、抗逆性强、降噪和抗污染等优点,享有“行道树之王”的美誉。悬铃木方翅网蝽(Corythucha ciliata)属于半翅目(Hemiptera)网蝽科(Tingidae)方翅网蝽属(Corythucha),原产于美国中东部地区(Halbert et al., 1983),在20世纪60年代入侵到意大利,随后相继传入欧洲、南美洲、亚洲和非洲等地(Maceljski, 1986; Picker et al., 2015; Prado, 1990; Chung et al., 1996),并造成了严重危害。2002年我国长沙首次发现悬铃木方翅网蝽危害(Streito, 2006; 鞠瑞亭等, 2010),2006年该虫在武汉普遍发生(王福莲等, 2008)。目前悬铃木方翅网蝽在我国入侵扩散范围较广,已入侵到湖南、湖北、上海、山东、河南和北京等地(鞠瑞亭等, 2010; 王福莲等, 2008; 虞国跃等, 2014),在我国多地呈暴发态势。
寄主植物在受到昆虫危害后,会释放出一系列的挥发性化合物,这些挥发物对植食性昆虫行为有着重要的调控作用。它一方面可影响昆虫的寄主选择,另一方面也可在被昆虫危害后大量释放,趋避昆虫或吸引天敌,形成寄主防御(Dicke et al., 1990; Turlings et al., 1990)。从寄主植物挥发物中可以筛选到对昆虫具有显著引诱或驱避活性的挥发物,用于进一步研发昆虫行为调节剂。昆虫化学感受蛋白(chemosensory proteins, CSPs)是一种小分子蛋白,成熟的蛋白约有120个氨基酸组成,含有4个保守的半胱氨酸位点。化学感受蛋白与昆虫的取食、交配、产卵点的选择和自身防御等有着密切的关系(Field et al., 2000; Kaissling, 2001; Ozaki et al., 2008; Pelosi et al., 2005; Steinbrecht, 1998; 滑金锋等, 2012)。在本研究中,笔者从悬铃木方翅网蝽中克隆到一个化学感受蛋白基因CcilCSP1,对其开展序列分析和表达模式研究,模拟该蛋白的三维结构,将其与9种二球悬铃木植物挥发物成分进行了分子对接和分子动力学研究,筛选与CcilCSP1具有稳定强结合作用的化合物,并通过昆虫行为学来验证结果的可靠性,为悬铃木方翅网蝽化学感受蛋白CcilCSP1的功能研究提供基础,为计算机反向筛选获得悬铃木方翅网蝽的行为调节剂提供依据。
1 材料与方法 1.1 试验材料供试昆虫悬铃木方翅网蝽采自中国农业科学院植物环境保护保护研究所院内二球悬铃木叶片上,在北京市农林科学院建立种群,用悬铃木叶片进行饲养,繁衍2代后用于试验。
1.2 试验方法 1.2.1 CcilCSP1基因的克隆与序列研究悬铃木方翅网蝽RNA的提取与cDNA的合成参考笔者实验室前期建立的方法进行(Li et al., 2016)。CcilCSP1的克隆采用基因特异性引物,上下游引物分别为:5′-ATGAAAGTTTTCGCGATTCTCG-3′,5′-TTAAATTTTAATTCCTCTTTTCTCAGCTT-3′。以悬铃木方翅网蝽cDNA为模板,利用PrimeSTAR HS DNA polymerase(TakaRa)试剂盒进行PCR扩增。PCR扩增体系为50 μL:10 μL 5× PrimeSTAR Buffer (Mg2+ plus),4 μL dNTP Mixture,0.5 μL PrimeSTAR HS DNA Polymerase,10μmol·L-1上下游引物各1 μL,cDNA模板2 μL,dd H2O 31.5 μL。PCR反应条件为98 ℃预变性1 min,随后进行98 ℃,10 s、58 ℃,15 s、72 ℃,1 min共30个热循环,然后进行72 ℃ 10 min的最后延伸。PCR产物由EasyPure Quick Gel Extraction Kit试剂盒(Trans Gen)进行回收,PCR产物经胶回收后按照pEASY-Blunt Cloning Kit试剂盒说明克隆于pEASY-Blunt Cloning Vector载体上,重组载体转化Trans-T1感受态细胞,然后涂在LB平板(含Ampicillin /X-gal/IPTG)上,37 ℃过夜培养。经蓝白斑筛选后,挑取白色单克隆进行菌落PCR鉴定后,选取3个独立的克隆送至北京三博远志生物公司测序。
用生物信息学软件对悬铃木方翅网蝽化学感受蛋白测序结果进行分析,序列分析通过DNAMAN完成,通过BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)进行同源序列查找,基因结构由ORF Finder (http://www.ncbi.nlm.nih.gov/projects/gorf/)进行预测。利用MEGA 6.0对悬铃木方翅网蝽CcilCSP1与其他37个昆虫CSP蛋白序列进行多序列比对并构建Neighbor-Joining(NJ)系统发育树,Boot strip值设为1 000,cut-off value设为50%,其他昆虫的CSP分别为:绿盲蝽(Apolygus lucorum)(AlucCSP1: AGD80081.1; AlucCSP2: AEP95756.1; AlucCSP3: AEP95757.1; AlucCSP4: AEP95758.1; AlucCSP5: AGD80085.1; AlucCSP6: AGD80086.1; AlucCSP7: AGD80087.1; AlucCSP8: AGD80088.1),苜蓿盲蝽(Adelphocoris lineolatus) (AlinCSP1: ACZ58019.1; AlinCSP2: ACZ58021.1; AlinCSP3: ACZ58020.1; AlinCSP4: ACZ58022.1; AlinCSP5: ACZ58023.1; AlinCSP6: ACZ58024.1; AlinCSP7: ACZ58025.1; AlinCSP8: ACZ58026.1),豌豆蚜(Acyrthosiphon pisum)(ApisCSP1: ACYPI000094; ApisCSP2: ACYPI000096; ApisCSP3: ACYPI000095; ApisCSP4: ACYPI000097; ApisCSP5: ACYPI000093; ApisCSP6: ACYPI009116; ApisCSP7: ACYPI005842; ApisCSP8: ACYPI000345; ApisCSP9: ACYPI003368; ApisCSP10: ACYPI002311; ApisCSP11: ACYPI39275; ApisCSP13: ACYPI53869),腐食酪螨(Tyrophagus putrescentiae) (TputCSP1: KP776981; TputCSP2: KP776982),肩突硬蜱(ixodes scapularis) (IscaCSP1: DQ855478)。蛋白性质分析采用ExPASy服务器(http://web.expasy.org/protparam/)进行分析,信号肽预测由SignalP V4.1程序(http://www.cbs.dtu.dk/serbices/SignalP/)完成。
利用RT-qPCR检测CcilCSP1在雌成虫、雄成虫及幼虫中的表达量。荧光定量PCR所需特异性引物由IDT (https://www.idtdna.com/pages/support/international/)进行设计,CcilCSP1的正反向引物分别为:5′-GCAAGAAGTGCACTGAGAAAC-3;5′-TTGGCCAGTTCATCG-TAGTC-3′,内参基因选择β-actin (KX108734)基因,其上下游引物为:5′-GGGTATGGAATCTTGCGGTATC-3′;5′-TGTTGG CGTACAGGTC-TTTC-3′。荧光定量PCR在ABI PRISM 7500荧光定量PCR仪(Applied Biosystems)上进行,每20 μL的RT-qPCR反应体系含有GoTaq Probe qPCR Master Mix (2×) 10 μL, 正、反向引物(10 μmol·L-1)各2 μL,cDNA模板2.0 μL,ddH2O 4 μL。PCR程序为:95 ℃预变性2 min,随后95 ℃,15 s、60 ℃,1 min共40个热循环,每个样品进行3次重复。反应结束后采集CT值,采用2-△△Ct法进行数据分析(王思豹等, 2015)。样品间的差异比较采用SPSS单因素方差分析SNK检验。
1.2.2 悬铃木方翅网蝽CcilCSP1的同源建模及模型评价通过Blast在Protein Date Back中搜索与悬铃木方翅网蝽CcilCSP1序列一致性最佳(同源性大于30%)的蛋白序列作为建模的模板(Qu et al., 2015),通过Swiss-model (Peitsch, 1996) (http://swiss-model.expasy.org/),对去掉信号肽的CcilCSP1进行同源建模,获得该蛋白的三维结构。用Procheck、Verify_3D、ERRAT方法(http://nihserver.mbi.ucla.edu/SAVES_4/) (Laskowski et al., 1993)对模型的主链键长、键角的合理性,三维结构与一级结构的关系及不同原子间非键相互作用等特性进行评价。用PROSA(Wiederstein and Sippl, 2007)(http://prosa.services.came.sbg.ac.at/)来判断CcilCSP1蛋白模型的质量。
1.2.3 悬铃木方翅网蝽CcilCSP1蛋白的分子对接选择笔者实验室前期鉴定到的二球悬铃木9种植物挥发物成份,用于CcilCSP1的分子对接研究,用Chemoffice 2010模拟这9种植物挥发物的三维结构。用Autodock4.2(Morris et al., 2009)编辑化合物及CcilCSP1的三维结构,设定网格参数为40点×40点×40点,格点间距为0.037 5 nm,格点盒子中心位于CcilCSP1蛋白活性位点中心,用Lamarckian遗传算法(LGA)进行对接,设置遗传算法参数maximum number of energy evaluations为2 500 000(庄绪静等, 2013),对接计算通过Autodock4.2进行,用PyMOL显示对接结果。
1.2.4 悬铃木方翅网蝽CcilCSP1与反式-β-石竹烯的分子动力学模拟为了检测对接结果的可靠性,笔者选用CcilCSP1与反式-β-石竹烯对接的复合物进行分子动力学(MD)模拟。用AMBER14(Case et al., 2005)软件中的Xleap模块对对接复合物进行初始化处理,包括加氢、加电荷、加水等处理以生成拓扑文件和原子坐标文件,用Sander模块进行对接复合物的优化和10 000 ps的分子动力学模拟,MD模拟的质量由主链原子的均方根位移(RMSD)评价(扈国栋, 等. 2009)。
1.2.5 反式-β-石竹烯对悬铃木方翅网蝽成虫的行为学研究用“Y”型嗅觉仪来判断0.1 μg反式-β-石竹烯对雌、雄悬铃木方翅网蝽成虫行为的影响。“Y”型嗅觉仪的两臂及直管长度均为10 cm,直径为1.5 cm,气流为250 mL·min-1。采用初羽化的成虫进行试验。试验中,每次接入1头成虫,观察10 min内该虫对反式-β-石竹烯的行为反应,并记录结果,10头虫后,将“Y”型嗅觉仪左右颠倒,以消除试验环境的影响。反式-β-石竹烯标准品购买自Sigma-Aldrich公司, 使用液体石蜡将其稀释至终浓度为0.01 μg·μL-1。用移液器每次取10 μL样品加到滤纸块上,以液体石蜡做对照,放在“Y”型嗅觉仪两端,进行行为反应测试,试验重复6次,每次10头昆虫。测试结果由卡方检验进行处理,统计分析采用IBM SPSS Statistics 22。
2 结果与分析 2.1 悬铃木方翅网蝽CcilCSP1的基因克隆和序列分析通过分子克隆技术,克隆到悬铃木方翅网蝽的CcilCSP1全长基因。其开放阅读框为393 bp,编码130个氨基酸,其基因序列已提交到GeneBank(编号:KY354042)。与其他半翅目昆虫的化学感受蛋白氨基酸序列比对显示,CcilCSP1具有CSPs家族的典型特征,含有4个保守的半胱氨酸位点(图 1)。通过CcilCSP1和其他37个昆虫化学感受蛋白序列系统发育分析显示(图 2),CcilCSP1与绿盲蝽的AlucCSP1,AlucCSP3,AlucCSP8以及苜蓿盲蝽的AlinCSP1具有较近的亲缘关系。此外,Nr注释结果显示,CcilCSP1与AlucCSP1同源性为55% (E-value为1E-41)、与AlucCSP3同源性为52% (E-value为3E-31)、与AlucCSP8同源性为52% (E-value为3E-29),与AlinCSP1的同源性为55% (E-value为2E-41),综合以上序列分析结果,暂将其命名为CcilCSP1。

|
图 1 悬铃木方翅网蝽化学感受蛋白CcilCSP1与其他昆虫CSP的序列比对 Figure 1 Alignment of deduced amino acid sequence of CcilCSP1 with CSPs from other insect species “C”表示保守的半胱氨酸序列,其他昆虫化学感受蛋白的GenBank登录号如下。绿盲蝽(Apolygus lucorum)AlucCSP1:AGD80081.1;AlucCSP2:AGD80082.1;AlucCSP3:AGD80083.1;AlucCSP8:AGD80088.1;苜蓿盲蝽(Adelphocoris lineolatus)AlinCSP1:ACZ58019.1;AlinCSP2:ACZ58021.1;AlinCSP3:ACZ58020.1。“C” represents conserved cysteines. The GenBank of the other chemosensory proteins is as below. Apolygus lucorum AlucCSP1: AGD80081.1; AlucCSP2: AGD80082.1; AlucCSP3: AGD80083.1; AlucCSP8: AGD80088.1; Adelphocoris lineolatus AlinCSP1: ACZ58019.1; AlinCSP2: ACZ58021.1; AlinCSP3: ACZ58020.1. |

|
图 2 悬铃木方翅网蝽化学感受蛋白CcilCSP1与其他昆虫CSP蛋白的系统发育树 Figure 2 Phylogenetic tree of CcilCSP1 and CSPs from other insects 虚线表示本研究的化学感受蛋白CcilCSP1及与其具有较近亲缘关系的其他化学感受蛋白。The dottedline indicate the chemosensory protein CcilCSP1 and other ones that hovea close relationship with this study. Aluc:绿盲蝽(Apolygus lucorum);Alin:苜蓿盲蝽(Adelphocoris lineolatus);Apis:豌豆蚜(Acyrthosiphon pisum);Amel:意大利蜜蜂(Apis mellifera);Tupt:腐食酪螨(Tyrophagus putrescentiae);Isca:肩突硬蜱(Ixodes scapularis)。使用MEGA 6.0构建NJ系统发育树,Bootstrip值设为1 000。The NJ phylogenetic tree was constructed using MEGA60, and the Bootstrip value was set to 1 000. |
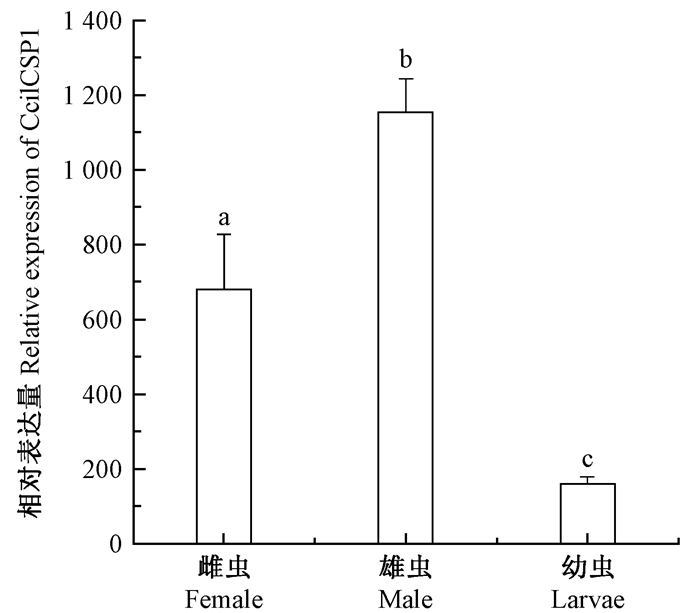
用RT-qPCR技术对CcilCSP1基因在悬铃木方翅网蝽雌成虫、雄成虫及幼虫中的转录水平进行检测,结果显示:CcilCSP1基因在雌雄成虫中的表达量极显著高于在幼虫中的表达量(雌成虫/幼虫P < 0.01,雄成虫/幼虫P < 0.01),CcilCSP1在雄成虫的表达量显著高于雌成虫(P=0.015) (图 3)。
|
图 3 RT-qPCR鉴定CcilCSP1的表达模式 Figure 3 Relative expression levels of CcilCSP1 measured by real-time quantitative PCR |
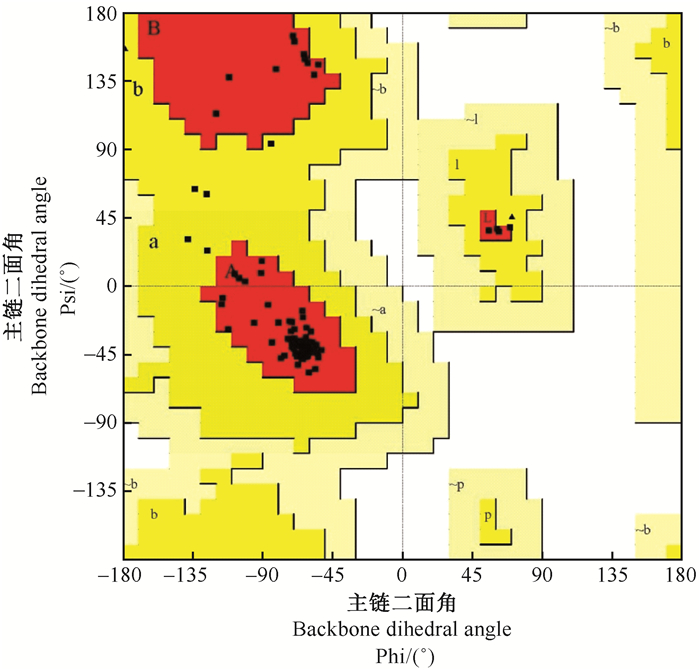
在PDB库中对CcilCSP1序列进行同源性搜索,找到4种已知结构的昆虫CSP蛋白,得分从高到低分别为MbraCSPA6、MbraCSP2、BmorCSP1、SgreCSP4,在这些序列中选择得分最高的MbraCSPA6(score=79.0,同源性为45%)作为同源建模的模板进行模型构建。通过Procheck评估结果的Ramachandran图(图 4),可以看出模建蛋白94.7%的残基落在最佳区域(红色A、B、L区域),5.3%的残基落在其他较合适区(亮黄色a、b、l、p区域),没有残基落在勉强许可区和不合理区已达到高质量建模标准(>90%)。此外,G-factor的各值(表 1)均大于-0.5,说明模型蛋白共价键及键角构象是合理的。用Verify_3D对模建蛋白的三维结构与一级结构的关系进行评价发现,CcilCSP1蛋白所有残基(100%)三维结构模型与一级结构的平均得分均大于0.2(表 1),表明模建蛋白的所有残基都是合理的。用ERRAT法对模建蛋白评价得分为95.789,表明模建蛋白不同原子间的非键相互作用是合理的。用PROSA评价得到的Z-score打分为-6.26,落在了较好结构蛋白的Z-score分布范围。以上各评价参数结果表明,同源建模得到的蛋白模型是优质合理的。
|
图 4 CcilCSP1三维结构拉氏构象图 Figure 4 The Ramachandran plot of CcilCSP1 图中红色A, B, L区域为蛋白残基的最佳区域,亮黄色a, b, l, p区域为蛋白残基的较合适区域,土黄色~a、~b、~l、~p区域为蛋白残基的勉强许可区和不合理区。 In the figure, the red A, B, and L regions are the best regions of the protein residues; The bright yellow a, b, l, p regions are the appropriate regions of the protein residues; The soil yellow ~a, ~b, ~l, ~p regions are the barely permitted and irrational area for protein residues. |
|
|
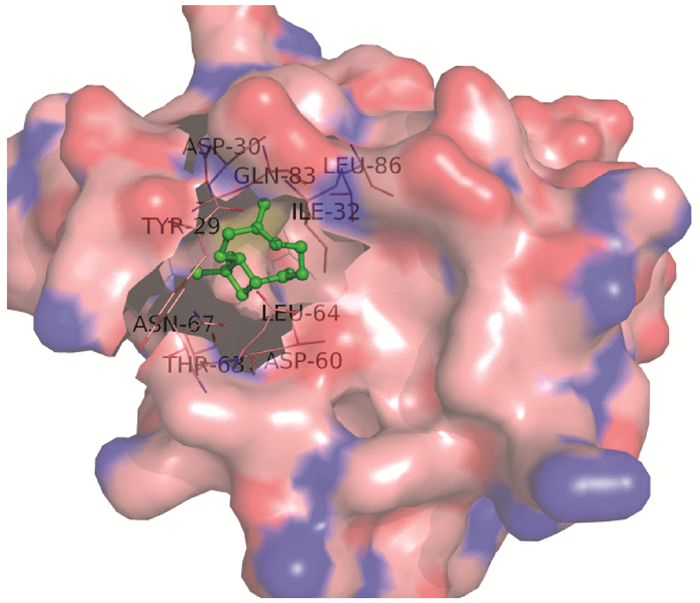
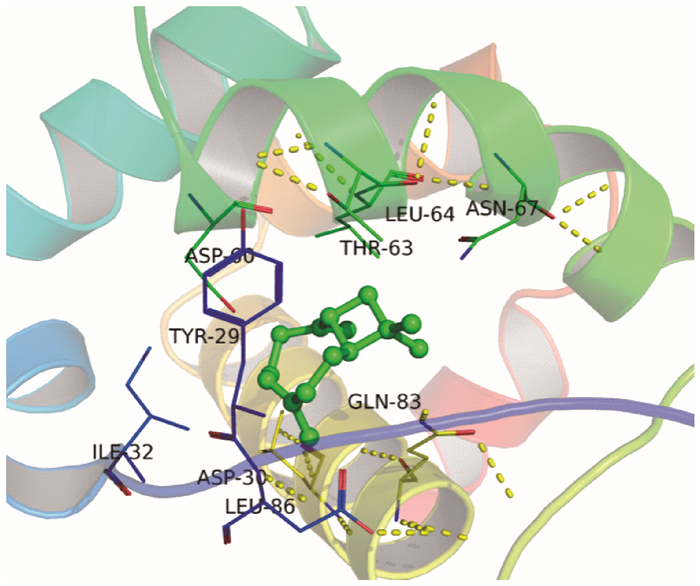
用Autodock 4.2计算CcilCSP1与9种二球悬铃木寄主植物挥发物成份的结合能量及抑制常数(表 2),CcilCSP1与这些挥发物的结合能量由低到高为:反式-β-石竹烯、(E)-4, 8-二甲基-1, 3, 7-壬三烯、1, 8-桉叶素、α-侧柏烯、桧烯、γ-松油烯、月桂烯、顺-3-己烯醇乙酸酯、顺-3-己烯醇。反式-β-石竹烯与CcilCSP1有较低的抑制常数(kl < 10)和结合能量,分别为2.63 μm和34.09 kJ·mol-1,认为该挥发物可通过分子间作用力与CcilCSP1蛋白形成稳定的结构。进一步分析发现,CcilCSP1与反式-β-石竹烯之间主要是通过范德华力和疏水作用相互作用的(图 5),在CcilCSP1蛋白结合活性区域,与反式-β-石竹烯分子距离小于4Å的残基有:THR-63、LEU-64、ASN-67、ASP-60、TYR-29、ILE-32、LEU-86、ASP-30、GLN-83(图 6)。其中TYR-29与植物挥发物反式-β-石竹烯的范德华力最大,而GLN-83、LEU-64、ASP-30在反式-β-石竹烯周围形成氢键结构将其包裹在其中。TYR-29、GLN-83、LEU-64、ASP-30可能是反式-β-石竹烯与CcilCSP1结合的关键位点。
|
|
|
图 5 反式-β-石竹烯与CcilCSP1蛋白活性结构域的结合 Figure 5 Trans-β-caryophyllene docked into the active-site of CcilCSP1 protein |
|
图 6 反式-β-石竹烯与CcilCSP1蛋白结合关键氨基酸位点及相互作用 Figure 6 Diagram of the key amino acid sites and interaction of trans-β-caryophyllene with CcilCSP1 protein |
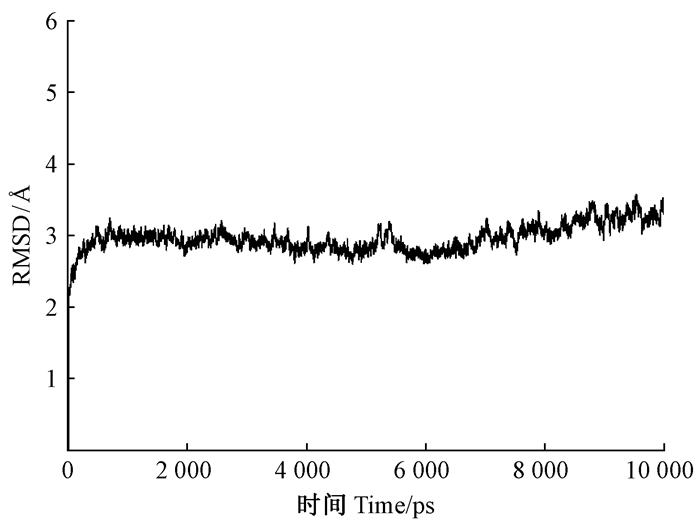
为了验证分子对接结果,进一步通过10 000 ps分子动力学研究,计算了CcilCSP1与反式-β-石竹烯复合物的主链原子RMSD值,RMSD值是指在分子动力学模拟过程中,复合物体系主链碳原子的均方根偏差,其变化是用来衡量复合物体系是否稳定的重要依据之一。从悬铃木方翅网蝽CcilCSP1蛋白与反式-β-石竹烯复合物的RMSD值变化曲线(图 7)可以看出,前50 ps为升温过程,体系从0 K加热到300 K,RMSD变化很大。接下来50 ps是动力学平衡过程,复合物内部结构进行优化,RMSD值上升至2.5Å。最后10 000 ps是稳定过程,复合物的RMSD值基本趋于平衡,RMSD值为3.0Å,振幅仅为0.3Å,证明悬铃木方翅网蝽CcilCSP1蛋白与反式-β-石竹烯能够稳定结合。
|
图 7 MD过程中复合物主链碳原子均方根偏差(RMSD) Figure 7 Root-Mean-Square Deviation(RMSD) of backbone atoms in MD simulation |
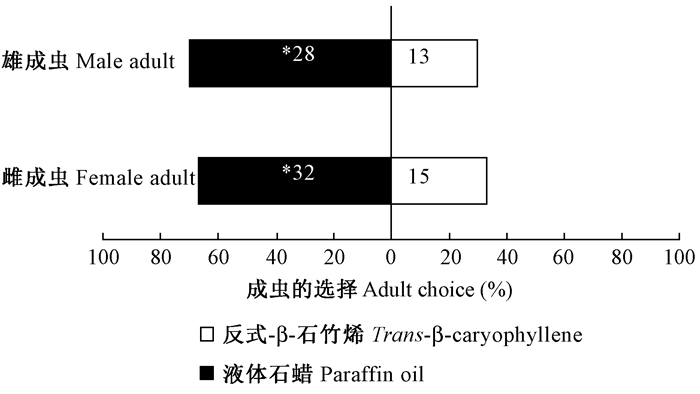
结合分子对接和分子动力学的结果表明,反式-β-石竹烯能与CcilCSP1活性部位结合,形成稳定的结构。结合RT-qPCR结果,推测反式-β-石竹烯可能影响悬铃木方翅网蝽成虫的行为反应。为证实上述研究结果,进一步用“Y”型嗅觉仪检测了反式-β-石竹烯对悬铃木方翅网蝽成虫的行为影响,经卡方检验发现(图 9),反式-β-石竹烯对雌成虫和雄成虫均有显著的驱避作用(雌成虫:χ2= 6.4,P < 0.05;雄成虫:χ2=5.488,P < 0.05)。
|
图 8 反式-β-石竹烯对悬铃木方翅网蝽成虫行为的影响 Figure 8 Responses of C. ciliata to trans-β-caryophyllene |
笔者报道了悬铃木方翅网蝽化学感受蛋白编码基因CcilCSP1,序列分析表明,CcilCSP1与绿盲蝽的AlucCSP1、AlucCSP3、AlucCSP8以及苜蓿盲蝽的AlinCSP1具有较近的亲缘关系,推测它们具有相似的功能。前人的研究发现,AlinCSP1和AlucCSP1对寄主植物挥发物具有较高的结合能力(滑金锋等, 2012)。其中,苜蓿盲蝽AlinCSP1能够结合植物活性物质(Z)-3-hexen-1-ol, (E)-2-hexen-1-al和valeraldehyde (Gu et al., 2012)。在本研究中通过分子对接和动力学研究,表明CcilCSP1其能够结合二球悬铃木寄主植物挥发物成分,该结果与其同源基因在苜蓿盲蝽和绿盲蝽中的报道相一致(Gu et al., 2012;滑金锋等, 2012)。CcilCSP1的表达模式研究表明,CcilCSP1在雌雄成虫中显著高表达,这与后续的行为学结果相一致。此外,CcilCSP1基因在雄虫中的表达量显著高于雌虫中的表达量,这可能是因为CcilCSP1的功能具有多样性,可能参与了对悬铃木方翅网蝽性信息素物质的结合,由于悬铃木方翅网蝽的性信息素成份尚未报道,在未来对CcilCSP1的功能尚需进一步的深入研究。
通过分子对接和分子动力学分析发现,CcilCSP1与寄主挥发物反式-β-石竹烯的结合能力最强。反式-β-石竹烯是一种常见的植物挥发物,能够影响多种昆虫的行为。通过“Y”型嗅觉仪研究发现,反式-β-石竹烯对悬铃木方翅网蝽成虫具有显著地驱避效果,前期研究发现反式-β-石竹烯对烟粉虱(赵艳群等,2012)和草地夜蛾(Spodoptera frugiperda) (Smith et al., 2012)等均有显著驱避作用,与本研究结果相类似。此外,本研究发现TYR-29、GLN-83、LEU-64、ASP-30可能是反式-β-石竹烯与CcilCSP1蛋白结合的关键位点,该结果还需要进一步通过定点突变技术和嗅觉蛋白荧光结合试验来验证。
4 结论本研究克隆到悬铃木方翅网蝽的化学感受蛋白基因CcilCSP1,该基因具有化学感受蛋白的典型特征并在成虫中显著高表达。通过分子对接和分子动力学方研究,发现CcilCSP1能与二球悬铃木寄主植物成份反式-β-石竹烯稳定结合,行为学试验发现反式-β-石竹烯能显著驱避悬铃木方翅网蝽成虫。该研究为今后的悬铃木方翅网蝽化学感受蛋白CcilCSP1的功能研究奠定了基础,也为通过计算机发现筛选悬铃木方翅网蝽信息素物质提供了依据。
扈国栋, 张少龙, 张庆刚. 2009. FKBP12蛋白与其抑制剂结合的分子动力学模拟和结合自由能计算[J]. 化学学报, 67(9): 1019-1025. (Hu G D, Zhang S L, Zhang Q G. 2009. Molecular dynamics simulations and free energy calculation of FKBP12 protein and its inhibitors[J]. Acta Chimica Sinica, 67(9): 1019-1025. [in Chinese]) |
滑金锋, 张帅, 崔金杰, 等. 2012. 绿盲蝽化学感受蛋白基因AlucCSP1的克隆, 表达谱分析及结合特征[J]. 中国农业科学, 45(20): 4187-4196. (Hua J F, Zhang S, Cui J J, et al. 2012. Cloning, expression analysis and binding characteristics of chemosensory protein gene Aluc CSP1 in Apolygus lucorum (Meyer-Dür)[J]. Scientia Agricultura Sinica, 45(20): 4187-4196. DOI:10.3864/j.issn.0578-1752.2012.20.008 [in Chinese]) |
鞠瑞亭, 李博. 2010. 悬铃木方翅网蝽:一种正在迅速扩张的城市外来入侵害虫[J]. 生物多样性, 18(6): 638-646. (Ju R T, Li B. 2010. Sycamore lace bug, Corythucha ciliata, an invasive alien pest rapidly spreading in urban China[J]. Biodiversity Science, 18(6): 638-646. [in Chinese]) |
鞠瑞亭, 肖娱玉, 薛贵收, 等. 2010. 悬铃木方翅网蝽寄主范围的测定[J]. 昆虫知识, 47(3): 558-562. (Ju R T, Xiao Y Y, Xue G S, et al. 2010. Host range test of Corythucha ciliata[J]. Chinese Bulletin of Entomology, 47(3): 558-562. DOI:10.7679/j.issn.2095-1353.2010.102 [in Chinese]) |
李峰奇, 杨世勇, 付宁宁, 等. 2017. 二球悬铃木叶片挥发物与悬铃木方翅网蝽的相互作用研究[J]. 应用昆虫学报, 54(2): 207-213. (Li F Q, Yang S Y, Fu N N, et al. 2017. Volatile profiles of platanus acerifolia leaves and their behavioral effects on Corythucha ciliata (Hemiptera:Tingidae)[J]. Chinese Journal of Applied Entomology, 54(2): 207-213. [in Chinese]) |
王福莲, 李传仁, 刘万学, 等. 2008. 新入侵物种悬铃木方翅网蝽的生物学特性与防治技术研究进展[J]. 林业科学, 44(6): 137-142. (Wang F L, Li C R, Liu W X, et al. 2008. Advance in biological characteristics and control techniques of the new invasive sycamore Lace Bug(Corythucha ciliata)[J]. Scientia Silvae Sinicae, 44(6): 137-142. DOI:10.11707/j.1001-7488.20080622 [in Chinese]) |
王思豹, 张帅, 雒珺瑜, 等. 2015. 大草蛉化学感受蛋白基因CpalCSP3组织表达谱及气味结合特性分析[J]. 棉花学报, 27(3): 260-267. (Wang S B, Zhang S, Luo J Y, et al. 2015. Tissue expression profile and ligand binding affinity of the chemosensory protein gene Cpal CSP3 in Chrysopa pallens(Rambur)[J]. Cotton Science, 27(3): 260-267. DOI:10.11963/issn.1002-7807.201503010 [in Chinese]) |
虞国跃, 王合, 朱晓清, 等. 2014. 北京发现悬铃木方翅网蝽为害[J]. 植物保护, 40(5): 045. (Yu G Y, Wang H, Zhu X Q, et al. 2014. The first discovery of the sycamore lace bug Corythucha ciliata in Beijing, China[J]. Plant Protection, 40(5): 45. [in Chinese]) |
赵艳群, 赵金瑞, 毛黎娟, 等. 2012. 不同番茄品种挥发物对B型烟粉虱寄主选择行为的影响[J]. 应用生态学报, 23(9): 2509-2514. (Zhao Y Q, Zhao J R, Mao L J, et al. 2012. Effects of the volatiles from different tomato varieties on host selection behavior of B-biotype Bemisia tabaci[J]. Chinese Journal of Applied Ecology, 23(9): 2509-2514. [in Chinese]) |
庄绪静, 尹姣, 李克斌, 等. 2013. 华北大黑鳃金龟气味结合蛋白HoblOBP2的生物信息学分析[J]. 植物保护, 39(1): 50-55. (Zhuang X J, Yin J, Li K B, et al. 2013. Bioinformatics analysis of the odorant-binding protein HoblOBP2 in olfactory sensilla of the scarab beetle Holotrichia oblita[J]. Plant Protection, 39(1): 50-55. [in Chinese]) |
(Case D A, Cheatham T E, Darden T, et al. 2005. The amber biomolecular simulation programs[J]. Journal of Computational Chemistry, 26(16): 1668-1688. DOI:10.1002/(ISSN)1096-987X)
|
(Dicke M, Sabelis M W, Takabayashi J, et al. 1990. Plant strategies of manipulating predatorprey interactions through allelochemicals:prospects for application in pest control[J]. Journal of Chemical Ecology, 16(11): 3091-3118. DOI:10.1007/BF00979614)
|
(Field L, Pickett J, Wadhams L. 2000. Molecular studies in insect olfaction[J]. Insect Molec Biol, 9(6): 545-551. DOI:10.1046/j.1365-2583.2000.00221.x)
|
(Gu S H, Wang S Y, Zhang X Y, et al. 2012. Functional characterizations of chemosensory proteins of the alfalfa plant bug Adelphocoris lineolatus indicate their involvement in host recognition[J]. Plos One, 7(8): e42871. DOI:10.1371/journal.pone.0042871)
|
(Halbert S E, Meeker J R. 1983. The Sycamore Lace Bug, Corythucha Ciliata (Say):(Hemiptera:Tingidae)[J]. Annals of the Entomological Society of America, 76(2): 262-265. DOI:10.1093/aesa/76.2.262)
|
(Hufnagel L, Ladányi M, Öszi B. 2006. Population dynamics of the Sycamore Lace Bug (Corythucha ciliata Say, Heteroptera:Tingidae) in Hungary[J]. Appl Ecol Environ Res, 4(1): 135-150. DOI:10.15666/aeer)
|
(Jacquin-Joly E, Vogt R G, François M C, et al. 2001. Functional and expression pattern analysis of chemosensory proteins expressed in antennae and pheromonal gland of Mamestra brassicae[J]. Chem Senses, 26(7): 833-844. DOI:10.1093/chemse/26.7.833)
|
(Kaissling K E. 2001. Olfactory perireceptor and receptor events in moths:a kinetic model[J]. Chem Senses, 26(2): 125-150. DOI:10.1093/chemse/26.2.125)
|
(Laskowski R A, MacArthur M W, Moss D S, et al. 1993. PROCHECK:a program to check the stereochemical quality of protein structures[J]. J Appl Crystal, 26(2): 283-291. DOI:10.1107/S0021889892009944)
|
(Li F Q, Wang R, Qu C, et al. 2016. Sequencing and Characterization of the invasive Sycamore Lace Bug Corythucha ciliata (Hemiptera:Tingidae) Transcriptome[J]. PloS One, 11(8): e0160609. DOI:10.1371/journal.pone.0160609)
|
(Maceljski M. 1986. Current status of Corythuca ciliata in Europe[J]. EPPO Bull, 16(4): 621-624. DOI:10.1111/j.1365-2338.1986.tb00332.x)
|
(Morris G M, Huey R, Lindstrom W, et al. 2009. AutoDock4 and AutoDockTools4:Automated docking with selective receptor flexibility[J]. J Comput Chem, 30(16): 2785-2791. DOI:10.1002/jcc.v30:16)
|
(Ozaki K, Utoguchi A, Yamada A, et al. 2008. Identification and genomic structure of chemosensory proteins (CSP) and odorant binding proteins (OBP) genes expressed in foreleg tarsi of the swallowtail butterfly Papilio xuthus[J]. Insect Biochem Molec Biol, 38(11): 969-976. DOI:10.1016/j.ibmb.2008.07.010)
|
(Peitsch M C. 1996. ProMod and Swiss-Model:internet-based tools for automated comparative protein modelling[J]. Chem Design Automation News, 1(11): 13-14.)
|
(Pelosi P, Calvello M, Ban L. 2005. Diversity of odorant-binding proteins and chemosensory proteins in insects[J]. Chem Senses, 30: i291-i292. DOI:10.1093/chemse/bjh229)
|
(Picker M, Griffiths C. 2015. Sycamore Tree Lace Bug (Corythucha ciliata Say)(Hemiptera:Tingidae) Reaches Africa[J]. Afr Entomol, 23(1): 247-249. DOI:10.4001/003.023.0125)
|
(Prado C. 1990. Presencia en Chile de Corythucha ciliata (Say)(Hemiptera:Heteroptera:Tingidae)[J]. Revista Chilena de Entomol, 18: 53-55.)
|
(Qu S X, Ma L, Li H P, et al. 2016. Chemosensory proteins involved in host recognition in the stored-food mite Tyrophagus putrescentiae[J]. Pest Manage Sci, 72(8): 1508-1516. DOI:10.1002/ps.2016.72.issue-8)
|
(Smith W E C, Shivaji R, Williams W P, et al. 2012. A maize line resistant to herbivory constitutively releases (E)-β-caryophyllene[J]. Journal of Economic Entomology, 105(1): 120-128. DOI:10.1603/EC11107)
|
(Steinbrecht R A. 1998. Odorant-Binding Proteins:Expression and Function[J]. Ann New York Acad Sci, 855(1): 323-332.)
|
(Streito J C. 2006. Note sur quelques espèces envahissantes de Tingidae:Corythucha ciliata (Say, 1932), Stephanitis pyrioides (Scott, 1874) Stephanitis takeyai Drake & Maa, 1955 (Hemiptera Tingidae)[J]. L'Entomol, 62(1/2): 31-36.)
|
(Turlings T C, Tumlinson J H, Lewis W J. 1990. Exploitation of herbivore-induced plant odors by host-seeking parasitic wasps[J]. Science, 250(4985): 1251-1253. DOI:10.1126/science.250.4985.1251)
|
(Wiederstein M, Sippl M J. 2007. ProSA-web:interactive web service for the recognition of errors in three-dimensional structures of proteins[J]. Nucl Acids Res, 35(2): 407-410.)
|
(Wu H, Liu H. 2016. Movement behavior and host location ability of Corythucha ciliata[J]. Plos One, 11(3): e0152205. DOI:10.1371/journal.pone.0152205)
|
(Chung Yeongjin, Kwon Taesung, Yeo Woonhong, et al. 1996. Occurrence of the sycamore lace bug, Corythucha ciliata (Say)(Hemiptera:Tingidae) in Korea[J]. Korean J Appl Entomol, 35(2): 137-139.)
|
 2017, Vol. 53
2017, Vol. 53

