文章信息
- 马莉, 牟长城, 王彪, 张妍, 李娜
- Ma Li, Mu Changcheng, Wang Biao, Zhang Yan, Li Na
- 排水造林对温带小兴安岭沼泽湿地碳源/汇的影响
- Effects of Wetland Drainage for Forestation on Carbon Source or Sink of Temperate Marshes Wetlands in Xiaoxing'an Mountains of China
- 林业科学, 2017, 53(10): 1-12.
- Scientia Silvae Sinicae, 2017, 53(10): 1-12.
- DOI: 10.11707/j.1001-7488.20171001
-
文章历史
- 收稿日期:2015-12-31
- 修回日期:2017-08-30
-
作者相关文章
湿地仅占全球陆地面积的4%~6% (Matthews et al., 1987; Aselmann et al., 1989),而其碳储量却占全球陆地碳储量的12%~24%(IPCC, 2001),巨大的碳储存能力使湿地成为全球碳循环研究热点(胡启武等, 2009)。天然湿地每年向大气排放大约1.45亿t CH4-C,占全球人为和自然甲烷排放总量的25% (Whalen, 2005),故天然湿地被认为是大气温室气体的排放源(Carroll et al., 1997; Whitting et al., 2001; Whalen, 2005)。同时,天然湿地具有丰厚的土壤泥炭层,伴随着泥炭层形成、沉积物堆积和植物生物量累积等过程,能够吸收固定大气中的CO2,因此,湿地又被认为是大气温室气体的吸收汇(Krogh et al., 2003; Brevik et al., 2004; Bedard-Haughn et al., 2006; Euliss et al., 2006; Alongi et al., 2007)。天然湿地究竟是碳源还是碳汇目前仍有争议,有学者认为湿地对温室气体的总贡献应取决于CO2和CH4源/汇这两种作用的综合影响(Makiranta et al., 2010)。
排水造林是人类对天然湿地利用的主要方式(Hooijer et al., 2010)。近200多年来,全球农林业排水和泥炭开采导致300亿t CO2排放,折合碳损失量为81.9亿t (Lappalainen, 1996),说明湿地排水造林、垦殖等人为活动对湿地碳源/汇功能可产生实质性影响,探讨排水造林对湿地碳源/汇的影响规律及其影响机制在全球碳循环研究中具有重要意义。
目前国内外有关排水造林对北方泥炭地生态系统碳平衡、土壤碳储量及动态影响方面的研究表明,湿地排水和机械化筑垄、整地改变了湿地微地形,引起湿地生境变化,如土壤水位下降,致使土壤有氧层增加(Silins et al., 1999; Murphy et al., 2009)、温度升高(Arnold et al., 2005),一方面导致排水湿地CO2排放量增大(Oberbauer et al., 1992; Hooijer et al., 2010)、CH4源/汇功能发生转变(Roulet et al., 1995; Melling et al., 2005; 孙晓新等, 2009)及泥炭层碳库大量消耗(Minkkinen et al., 1998; Page et al., 2011; 崔巍等, 2013)等碳释放过程有所增强, 另一方面,泥炭地排水造林能够促进林木生长,并提高林分生产力(牟长城等, 2007),进而又可能增强系统固碳能力。即排水造林后,如湿地系统的净碳排放大于净碳固定则转化为碳源,反之系统净碳固定大于净碳排放则维持其碳汇。排水造林后,泥炭地转化为碳源还是保持碳汇状态,不仅依赖于生境类型与气候条件(Silvola et al., 1996; Minkkinen et al., 1998; 2002; Laiho et al., 2004; Byrne et al., 2005),而且也依赖于林分生长、碳吸纳及其凋落物输入对碳损失的补偿作用。但现有研究多侧重于排水造林、林业经营对泥炭地或生境碳平衡的影响(Makiranta et al., 2010),而考虑整个系统的碳收支特征,故尚难以揭示排水造林对沼泽湿地系统碳源/汇的影响程度及影响机制。
我国东北林区自20世纪80年代以来相继开展了湿地排水造林,目前形成的湿地兴安落叶松(Larix gmelinii)人工林面积约数十万公顷(李文华等, 2007),为开展排水造林对沼泽湿地系统碳源/汇的影响研究提供了理想试验场所。本研究以小兴安岭沼泽湿地排水造林形成的人工兴安落叶松沼泽林为对象,采用静态箱-气象色谱法、碳/氮分析与相对生长方程法,通过野外原位同步测定不同时期沼泽湿地排水造林形成的10,30年生人工兴安落叶松林及对照天然草丛沼泽湿地的土壤CO2、CH4排放通量、植被净初级生产力与年净固碳量,依据生态系统净碳收支平衡,揭示排水造林对温带沼泽湿地碳源/汇的影响规律,并结合环境因子探讨其影响机制,以期为我国东北林区湿地资源经营管理实践提供科学依据。
1 研究区概况研究区位于小兴安岭中段,黑龙江省伊春市友好林业局永青林场(128°30′36″—128°45′00″E,48°03′53″—48°17′11″N),海拔260~500 m。受海洋气团和西伯利亚寒流影响,气温波动较大,属温带大陆湿润季风气候。年均气温0.4 ℃,≥10 ℃年积温2 000~2 500 ℃。年均降水量630 mm,全年有2个降水高峰期:冬季的降雪和7—8月间的降雨,高峰期降水占全年降水量的70%,全年无霜期110天,最早霜期在9月上旬,最晚霜期在次年的5月中旬结束,霜期长达6个月。地带性植被为温带红松(Pinus koraiensis)阔叶混交林。地带性土壤是暗棕壤,占所有土壤类型的71%,其他土壤类型有草甸土、沼泽土和泥炭土,草甸土和沼泽土占27%,泥炭土占2%。主要湿地类型有草丛沼泽、灌丛沼泽、森林沼泽、藓类沼泽和浅水沼泽等多种类型,但以森林沼泽为主(郎惠卿, 1999)。
2 研究方法 2.1 样地设置在伊春市友好林业局永青林场选择排水造林后不同时期形成的10,30年生人工兴安落叶松林与相应立地上的天然草丛沼泽作为研究对象(表 1)。在10,30年生人工兴安林湿地与天然对照草丛沼泽湿地中各设置3块20 m×30 m样地,共设置9块样地。由于排水垄和排水渠的土壤呼吸存在差异性,故在10,30年生人工落叶松林样地的排水垄和排水渠及对照草丛沼泽分别设置3个静态箱,共计设置15个静态箱,并对其进行同步气体通量观测。人工林株行距均为1 m×2 m,垄宽120~140 cm,排水渠宽60~80 cm,因雨水侵蚀和坍塌,10年生人工林垄台高50 cm,30年生人工林垄台高25 cm。为准确估测CO2和CH4气体通量,依据排水垄和排水渠所占的单位面积比例(65%和35%)分别估算,将两者加和得到单位面积土壤异氧呼吸碳排放通量。
|
|
分别于2014年春季生长开始期(5月上旬)和秋季生长停止期(10月下旬),对10和30年生人工兴安落叶松林样地中胸径≥2 cm的952株(10年生人工林508株,30年生人工林444株)林木使用胸径尺在树干1.3 m处进行每木检尺,获得各标准地生长开始期与生长结束期的林木胸径数据,借助现有本地区兴安落叶松苔草(Carex schmidtii)沼泽林的落叶松胸径与生物量的回归方程(表 2)(周文昌等, 2012)分别计算生长开始期与结束期乔木层生物量,取两者的差值估算乔木层净初级生产力。
|
|
在2014夏季(8月中旬)生物量达到最大时,于每块样地中心与四角共设置5个2 m×2 m灌木样方,随机设置10个1 m×1 m草本样方,采用收获法获取灌木层与草本层地上与地下的生物量鲜质量,并对其进行取样;在70 ℃下烘干至恒质量,计算含水率,得到生物量干质量;灌木层净初级生产力为其生物量除以平均年龄(3年),草本层净初级生产力为其地上部分与地下部分当年生物量的加和(地上部分全部视为当年生,地下部分选取靠近茎干、颜色较浅部分作为当年生新根)。
2.2.3 植物有机碳浓度测定利用碳/氮分析仪Multi N /C 3100和HT 1300 Solids Module (Analytik Jena AG,Germany)通过1 300 ℃干烧法测定乔木层(干、根、枝、叶)、灌木层(根、茎、叶)和草本层(地上茎叶、地下根系)有机碳浓度。
2.2.4 植被年净固碳量测定乔木层、灌木层、草本层的年净固碳量可通过各自净初级生产力与其相应碳浓度的乘积获得,植被层的年净固碳量为三者之和(牟长城等, 2013)。
2.3 气体采集与分析气体采集采用静态暗箱-气象色谱法。暗箱由不锈钢顶箱(规格为50 cm×50 cm×50 cm)和不锈钢底座(规格为50 cm×50 cm×10 cm)组成。采样前,把底座插入采样点土壤中10 cm (为避免土壤扰动剧烈),在安装完毕后底座放在样地不动直至全年取样结束,以保证对底座内部的土壤干扰最小。采样时,先将底座上部四周的凹槽注水密封,再安放顶箱(每次安放顶箱前需去除底座内植物及其根系,以排除植物自养呼吸碳排放)。顶箱内部安有直径10 cm的小风扇,取样时保持风扇转动,避免箱内出现气体浓度差,风扇用12 V蓄电池供电。在箱顶部开设2个直径1 cm的小孔,其一作为取样口,内置橡胶塞,其二用于带橡胶塞的数字温度计探头通过。风扇电源线也穿过箱顶部,后用硅胶将小孔密封。顶箱外粘贴泡沫保温材料,以减少箱内温度波动。取样时间为2014年5月8日—2015年4月28日。每隔10天观测1次,每次时间为8:00~11:00,每个静态箱重复取4次(分别在静态箱封闭后0,10,20和30 min进行)。用60 mL聚氯乙烯医用注射器经三通阀连接铁针头通过箱顶部橡胶塞取样。气体样品用注射器取出后转移进100 mL气体采集袋保存并带回实验室,在1周内利用HP5890Ⅱ气象色谱仪完成浓度分析工作(李兆富等, 2002; Wang et al., 2003)。最后计算各沼泽湿地类型的土壤异养呼吸年碳排放量。
按下式计算CH4和CO2排放通量(王跃思, 2004):
| $ F=\frac{{{d}_{c}}}{{{d}_{t}}}\frac{M}{{{V}_{0}}}\frac{P}{{{P}_{0}}}\frac{{{T}_{0}}}{T}H。$ |
式中:F为CH4或CO2的气体通量(mg·m-2h-1),dc/dt为采样时气体浓度随时间变化的直线斜率;M为被测气体的摩尔质量;P0,V0和T0分别为标准状态下的标准大气压、气体摩尔体积和绝对温度(分别为1 013.25 hPa、22.41 L·mol-1和273.15 K);P和T分别为采样点的实际大气压和温度;H为采样箱高度(cm)。F为正值时表示排放,为负值时表示吸收(孙晓新, 2009)。
为揭示CH4和CO2通量季节变化规律,进行季节划分,春季为3月下旬至6月中旬,夏季为6月下旬至9月中旬;秋季为9月下旬至12月中旬,冬季为12月下旬至翌年3月中旬,生长季为5月上旬至10月下旬,非生长季为11月上旬至次年4月下旬。
2.4 环境因子测定气体采样时,对各样地取样点的气温、土壤温度(0,5,10,15,20,30和40 cm深处)以及观测点水位(于采样箱附近挖井进行测定)进行同步测定(气温、箱温、0~40 cm土壤温度在每次气体观测开始前和结束后各观测1次,水位在每次气体采样开始前观测1次)。使用JM便携式数字温度计和相应长度的探针测定温度。在采集箱附近挖井,用钢卷尺测量沼泽水位。本研究仅进行生长季环境因子与土壤气体(CO2,CH4)排放的相关性分析。
2.5 数据处理采用SPSS19.0和Microsoft Office Excel 2010软件进行数据分析。采用单因素方差分析(one-way ANOVA)分析不同数据组建的差异性,显著性水平设置为α=0.05。采用Pearson相关系数评价不同因子间的相关关系,相关性水平设置为α=0.05。
3 结果与分析 3.1 排水造林对沼泽湿地CH4排放通量的影响由图 1可知,草丛沼泽CH4排放通量为0.06~13.55 mg·m-2h-1,均为排放CH4,且呈近似单峰型季节变化趋势,即冬末春初开始波动升高,至夏季达到排放高峰值(13.55 mg·m-2h-1),夏末秋初开始波动下降,至整个冬季均维持在较低排放水平。10年生林地CH4排放通量为-0.08~0.09 mg·m-2h-1,30年生林地为-0.07~0.08 mg·m-2h-1,不仅排放峰值远低于草丛沼泽(仅相当于后者0.5%~0.6%),而且均呈CH4排放与吸收交替出现的季节变化趋势。

|
图 1 草丛沼泽湿地与排水造林10和30年生人工兴安落叶松林土壤CH4排放通量的季节变化 Figure 1 Seasonal dynamics of soil methane emission flux from natural marsh wetlands and drainage of 10 or 30 years old plantations by wetlands draining for forestation |
由表 3可知,排水造林使草丛沼泽CH4源/汇功能发生了转化。草丛沼泽CH4排放年通量为1.780 mg·m-2h-1,表现为CH4强排放源,而10,30年生人工林CH4排放年通量均为-0.006 mg·m-2h-1,均为CH4的弱吸收汇。草丛沼泽在春、夏、秋、冬四季及生长季和非生长季均排放CH4,呈现夏>春≈秋≈冬、生长季>非生长季的分布格局,10年生人工林在春、夏季及生长季为CH4弱吸收汇,秋、冬季及非生长季为CH4弱排放源,呈秋≈冬≥夏≥春、生长季≈非生长季的分布格局;30年生人工林在春、秋季及生长季与非生长季为CH4弱吸收汇,夏、冬季为CH4弱排放源,呈春≈夏≈秋≈冬及生长季≈非生长季的分布格局。因此,排水造林干扰10和30年后各季节均已转化为CH4的弱吸收汇或弱排放源,进而改变了CH4排放的季节分布格局
3.2 排水造林对沼泽湿地CO2排放通量的影响。由图 2可知,排水造林对草丛沼泽土壤CO2排放季节动态有影响。草丛沼泽与排水造林样地土壤CO2排放季节变化趋势基本一致,即自初春开始波动升高,至夏季达到排放高峰值,夏末秋初开始降低,直至整个冬季维持较低水平。但各处理土壤CO2排放峰值个数及形成时间却有所不同,草丛沼泽在6月上旬、7月中旬、8月上旬和下旬出现4个排放峰值(482.36,682.86,574.96和807.12 mg·m-2h-1),10年生人工林在6月中旬、7月下旬和8月下旬出现3个排放峰值(403.41,592.98和568.38 mg·m-2h-1),30年生人工林仅在6月中旬和8月中旬出现2个排放峰值(520.56和568.38 mg·m-2h-1)。可见,草丛沼泽土壤CO2排放随季节变化的波动性相对较大,排水造林样地土壤CO2排放季节波动性相对较小。
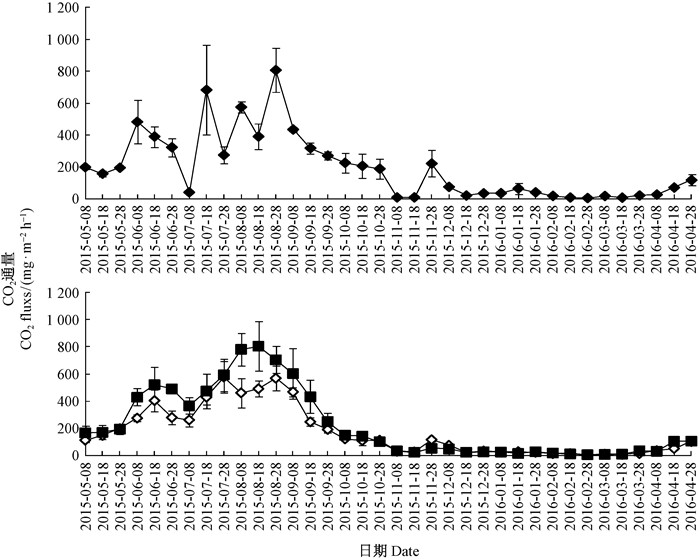
|
图 2 草丛沼泽湿地与排水造林10和30年生人工兴安落叶松林土壤CO2排放通量的季节变化 Figure 2 Seasonal dynamics of soil carbon dioxide emission flux from natural marsh wetlands and drainage of 10 or 30 year-old-plantation by wetlands draining for forestation |
由表 3可知,排水造林对草丛沼泽土壤CO2排放年通量具有影响。各处理土壤CO2排放年通量为168.07~220.43 mg·m-2h-1,10年生人工林较草丛沼泽降低12.8% (P>0.05),30年生人工林较草丛沼泽提高14.3% (P>0.05),且30年生人工林较10年生人工林显著提高31.2% (P < 0.05)。因此,10年生人工林降低了土壤CO2排放量,30年生人工林提高了土壤CO2排放量。此外,排水造林对草丛沼泽土壤CO2排放季节变化也有影响,草丛沼泽土壤CO2通量表现为夏>春≈秋>冬的近似单峰型分布格局;而10,30年生人工林土壤CO2通量却表现为夏>春>秋>冬或夏>春≥秋≥冬的偏态型分布格局。主要源于排水造林显著降低了沼泽湿地秋、冬季的土壤CO2排放通量(P < 0.05),10年生人工林春季土壤CO2排放通量较对照降低幅度也较大(P>0.05),30年生人工林夏季土壤CO2排放通量较对照提高幅度较大(P>0.05)。10年生人工林土壤CO2年排放通量低于草丛沼泽主要源于春、秋、冬3个季节排放通量的减少,30年生人工林土壤CO2年排放通量高于草丛沼泽主要源于夏季排放通量的提高。
|
|
由表 4可知,排水造林对沼泽湿地土壤CH4和CO2排放的主控因子具有影响。草丛沼泽CH4排放与30 cm(P < 0.05)及40 cm(P < 0.01)深处土壤温度显著正相关,而10,30年生人工林排水垄、排水渠的CH4排放与各深处土壤温度均不存在显著相关性。
|
|
草丛沼泽土壤CO2排放与气温及0~30 cm各深处土壤温度显著(P < 0.05)或极显著正相关(P < 0.01),而10,30年生林地排水垄土壤CO2排放与气温及各深处土壤温度极显著正相关(P < 0.01),但10年生林地排水渠土壤CO2排放与气温及各深处土壤温度相关性均不显著,30年生林地排水渠与气温极显著正相关(P < 0.01),与地表温度显著正相关(P < 0.05)。可见,排水造林改变了草丛沼泽土壤CO2和CH4排放与环境因子的相关关系。
3.4 排水造林对沼泽湿地植被固碳能力的影响由表 5可知,排水造林对小兴安岭沼泽湿地植被固碳能力具有显著影响。草丛沼泽及10,30年生人工林的植被净初级生产力和年净固碳量分别为10.51~15.44 t·hm-2a-1和4.68~6.74 t C·hm-2a-1,10年生人工林净初级生产力和年净固碳量显著低于草丛沼泽31.9%和30.6%(P < 0.05),30年生人工林仅略低于草丛沼泽(6.7%和5.2%,P>0.05),但显著高于10年生人工林37.0%和36.5%(P < 0.05)。因此,10年生人工林显著降低了草丛沼泽的植被固碳能力,而30年生人工林其植被固碳能力显著高于10年生人工林且与草丛沼泽相近。
|
|
排水造林对各植被层固碳能力的影响规律也有所不同。草丛沼泽仅由草本层所组成,而排水造林形成的人工林则由乔木层、灌木层和草本层组成,草本层净初级生产力和年净固碳量以草丛沼泽最高,10和30年生人工林草本层显著低于草丛沼泽96.7%~96.9%和89.2%~89.8%(P < 0.05),且30年生人工林草本层显著高于10年生人工林草本层225.5%~228.6%(P < 0.05);乔木层净初级生产力和年净固碳量表现为30年生人工林显著高于10年生人工林31.4%~31.7%(P < 0.05);灌木层净初级生产力和年净固碳量表现为10年生人工林高于30年生人工林33.3%~35.9%,但差异性不显著(P >0.05)。因此,30年生人工林植被固碳能力显著高于10年生人工林主要是源于30年生林地乔木层与草本层固碳能力显著提高。
3.5 排水造林对小兴安岭天然沼泽湿地碳源/汇的影响由表 6可知,排水造林干扰对小兴安岭草丛沼泽碳源/汇具有显著影响。草丛沼泽及10,30年生人工落叶松林的生态系统净碳收支均为正值(0.72~ 2.08 tC·hm-2a-1),故均为碳的吸收汇。但二者碳汇强度却存在较大差异,10年生人工林的碳汇强度较草丛沼泽显著降低65.4%(P < 0.05),30年生人工林较草丛沼泽降低42.3%(P>0.05),且较10年生人工林提高66.7%(P >0.05)。因此,10年生人工林显著降低了小兴安岭草丛沼泽的碳汇功能(约降低2/3),30年生人工林碳汇功能正得到恢复(约降低2/5)。
|
|
此外,排水造林干扰对沼泽湿地碳源/汇功能的影响与干扰后恢复时间有关。10年生人工林的植被固碳能力显著低于草丛沼泽(P < 0.05),但其土壤呼吸碳排放能力却与草丛沼泽差异不显著(P>0.05);而30年生人工林植被固碳能力与草丛沼泽相近(-5.2%,P>0.05),其土壤呼吸碳排放能力与草丛沼泽差异也不显著(P>0.05)。因此,10年生人工林碳汇功能降低主要是源于植被固碳能力的降低,30年生人工林随着植被固碳能力的恢复,其碳汇功能也正得到恢复。
4 讨论 4.1 排水造林干扰对沼泽湿地CH4排放的影响湿地排水造林或排水转化草地等人为干扰可导致CH4排放与吸收交替出现(Roulet et al., 1995; Melling et al., 2005; 孙晓新等, 2009)及排放降低或使其源/汇功能发生转化(Nykänen et al., 1995; Arnold et al., 2005; 孙晓新等, 2009; Kayranli et al., 2010; Slam et al., 2012)。原因在于湿地排水和筑垄改变微地形,引起生境变化,如水位下降(Silins et al., 1999; Murphy et al., 2009)、温度升高(Arnold et al., 2005),进而使湿地CH4源/汇功能发生转变(Roulet et al., 1995; Melling et al., 2005)。本研究中,排水垄和排水渠生长季平均水位较草丛沼泽降低50.4~77 cm和35.9~48.7 cm,且水位经常随降水上、下浮动,使得厌氧环境与有氧环境频繁转化,限制了CH4产生菌的活性,进而导致人工落叶松林CH4通量呈现排放与吸收交替发生,年均通量均表现为CH4的弱吸收汇。
4.2 排水造林干扰对沼泽湿地CO2排放的影响湿地排水和筑垄能改变微地形(排水垄和排水渠),增加生境异质性,进而对土壤呼吸产生不同的影响,如排水垄水位下降,致使土壤有氧层增加(Silins et al., 1999; Murphy et al., 2009)、温度升高(Arnold et al., 2005),促进微生物有氧分解活动,进而增大土壤CO2排放量(Oberbauer et al., 1992; Hooijer et al., 2010),本研究中排水垄生长季平均水位较草丛沼泽下降50.4~77 cm,0~40 cm土壤温度较草丛沼泽升高1.8~4.2 ℃,故使其土壤CO2排放量较草丛沼泽提高9.8%~41.1%,与排水引起土壤呼吸作用增强的结论(Oberbauer et al., 1992; Raich et al., 1992; 江长胜等, 2010)相一致;而排水渠水位相对较高(生长季平均水位较排水垄高14.4~28.5 cm),温度相对较低(生长季0~40 cm土壤温度较排水垄低0.7~2.7 ℃),排水渠内微生物活动减弱,故排水渠土壤CO2排放量较草丛沼泽降低35.4%~54.8%,这与排水渠土壤呼吸作用降低的结论(Arnold et al., 2005)相一致。正是由于这两方面的综合作用最终导致排水造林干扰对草丛沼泽土壤CO2排放量并无显著影响。
4.3 排水造林干扰对沼泽湿地CO2和CH4排放主控因子的影响温度是影响沼泽湿地CH4通量的重要因子(Macdonalda et al., 1998; Dasselaar et al., 1999; 石兰英等, 2010)。本研究中,草丛沼泽处于水淹厌氧环境(生长季平均水位9.9 cm),水分已不是其限制因子,但深层土壤温度较低(生长季30~40 cm土壤层温度为3.4~5.5 ℃),可能限制CH4产生菌的活性,故CH4排放与深层土壤温度显著正相关。而排水造林后,排水垄和排水渠的CH4排放与水位及0~40 cm各深处土壤温度相关性均不显著,这可能是由于两者水位过低(排水垄和排水渠生长季平均水位较草丛沼泽降低50.4~77 cm和35.9~48.7 cm),一方面难以形成CH4产生菌所需充足厌氧环境,另一方面,水位往往处于土壤有机层以下,也可能减少CH4产生菌所需有机底物供应,故两者CH4排放与水位及土壤温度相关性均不显著。
草丛沼泽土壤CO2排放与气温及0~30 cm各深处土壤温度显著正相关,而排水垄土壤CO2排放却与气温及0~40 cm各深处土壤温度显著正相关,这与现有结论土壤温度是影响土壤呼吸速率和土壤微生物活性的重要因素(Zogg et al., 1997; Andrews et al., 2000; 宋长春等, 2006; 江长胜等, 2010)相一致;但10年林地排水渠土壤CO2排放与0~40 cm各深处土壤温度相关性均不显著,30年林地排水渠土壤CO2排放仅与气温及地表温度极显著或显著正相关与上述结论有所不同,这可能是由于排水渠水淹环境抑制了微生物有氧分解活动所致。
4.4 排水造林干扰对沼泽湿地植被固碳能力的影响10年生人工林显著降低温带小兴安岭草丛沼泽植被固碳能力近1/3,30年生人工林其植被固碳能力与草丛沼泽相近(-5.2%)。前者与崔巍等(2013)的排水造林降低寒温带大兴安岭沼泽湿地植被固碳能力近1/2的研究结论相一致,而后者与其则不同。原因在于草丛沼泽具有较高固碳能力,排水造林改变其生境条件,如微地形及水文发生变化(Silins et al., 1999; Murphy et al., 2009),使排水垄生境趋于旱生化,不利于湿生草本植物生存及生长,加之排水造林初期落叶松生长缓慢,难以弥补草本层固碳损失,进而降低其植被固碳能力;而30年生人工林,落叶松已进入快速生长阶段,乔木层固碳能力显著提高,进而提高了其植被固碳能力(较10年生人工林提高近1/3)。
小兴安岭草丛沼泽与30年生人工落叶松林的植被净初级生产力(1.54和1.44 kg·m-2a-1)已达到或接近现有中国东北植被净初级生产力(0.6~1.4 kg·m-2a-1)(张宪洲, 1993; 周广胜等, 1996; 毛德华等, 2012)及温带森林沼泽植被净初级生产力(1.0~1.5 kg·m-2a-1)(Trettin et al., 1995)的上限;两者的植被固碳能力(0.67和0.64 kgC·m-2a-1)已超过现有中国陆地植被平均固碳能力(0.49 kgC·m-2a-1)(何浩等, 2005)和全球平均植被固碳能力(0.41 kgC·m-2a-1) (李银鹏等, 2001)30.6%~36.7%和56.1%~63.4%。说明两者均属高生产力及高固碳能力的湿地植被类型,亦即草丛沼泽排水造林30年后的植被固碳能力正得到恢复。
4.5 排水造林干扰对沼泽湿地碳源/汇影响排水造林降低温带小兴安岭草丛沼泽湿地碳汇0.9~1.4 t C·hm-2a-1(降低2/5~2/3),这与现有研究结论中的排水造林降低北方、温带湿地碳汇0.3~2.8 tC·hm-2a-1(Armentano et al., 1986)与热带湿地碳汇0.4~1.9 tC·hm-2a-1(Maltby et al., 1993)一致,但低于北方泥炭地排水碳汇损失2.5~5.5 tC·hm-2a-1的结论(Leifeld et al., 2011)。这可能与区域气候及湿地类型不同有关,本区地处温带,水热条件好,排水造林形成的人工林固碳能力高,碳汇损失相对较少,而北方泥炭地处寒温带,水热条件差,泥炭地植被固碳能力低,难以补偿排水所引起的土壤呼吸碳损失,故北方泥炭地排水后碳汇损失相对较大。
至于温带草丛沼泽排水造林10年生人工林碳汇降低显著及30年生人工林碳汇降低不显著的原因则在于10年生人工林植被固碳能力较草丛沼泽降低近1/3,但土壤呼吸碳排放却与草丛沼泽相近(-1/7,P>0.05),导致10年生人工林碳汇降低显著;30年生人工林固碳能力与草丛沼泽相近(-1/20,P>0.05),且土壤呼吸碳排放与草丛沼泽也相近(1/9,P>0.05)(表 6),故导致其30年生林地碳汇与草丛沼泽无显著差异。
5 结论1) 温带小兴安岭草丛沼泽湿地排水造林(兴安落叶松人工林)干扰10与30年后CH4源/汇功能发生了转化(即由CH4强排放源转化为弱吸收汇),CH4排放季节动态趋势由单峰型转化为排放与吸收交替型;排水造林对土壤CO2排放量影响并不显著(10年生兴安落叶松人工林较沼泽湿地降低12.8%,30年生兴安落叶松人工林较沼泽湿地提高14.3%)。
2) 排水造林对温带小兴安岭草丛沼泽湿地植被固碳能力具有显著影响。10年生兴安落叶松人工林显著降低植被固碳能力,30年生兴安落叶松人工林植被固碳能力正得到恢复。
3) 10年生兴安落叶松人工林显著降低了温带小兴安岭沼泽湿地碳汇功能(约降低2/3),30年兴安落叶松生人工林亦未恢复至干扰前的碳汇量(约降低2/5)。因此,从维持湿地碳汇角度考虑,应避免对湿地进行排水造林。
崔巍, 牟长城, 卢慧翠, 等. 2013. 排水造林对大兴安岭沼泽湿地生态系统碳储量的影响[J]. 北京林业大学学报, 35(5): 28-36. (Cui W, Mu C C, Lu H C, et al. 2013. Effects of draining for forestation on carbon storage of wetland ecosystem in Daxing'an Mountains of northeastern China[J]. Journal of Beijing Forestry University, 35(5): 28-36. [in Chinese]) |
何浩, 潘耀忠, 朱文泉, 等. 2005. 中国陆地生态系统服务价值测量[J]. 应用生态学报, 16(6): 1122-1127. (He H, Pan Y Z, Zhu W Q, et al. 2005. Measurement of terrestrial ecosystem service value in China[J]. Chinese Journal of Applied Ecology, 16(6): 1122-1127. [in Chinese]) |
胡启武, 吴琴, 刘影, 等. 2009. 湿地碳循环研究综述[J]. 生态环境学报, 18(6): 2381-2386. (Hu Q W, Wu Q, Liu Y, et al. 2009. A summary of wetland carbon cycle research[J]. Ecology and Environment Sciences, 18(6): 2381-2386. [in Chinese]) |
江长胜, 郝庆菊, 宋长春, 等. 2010. 垦殖对沼泽湿地土壤呼吸速率的影响[J]. 生态学报, 30(17): 4539-4548. (Jiang C S, Hao Q J, Song C C, et al. 2010. Effects of marsh reclamation on soil respiration in the Sanjiang Plain[J]. Acta Ecological Sinica, 30(17): 4539-4548. [in Chinese]) |
郎惠卿. 1999. 中国湿地植被[M]. 北京: 科学出版社: 271-291. (Lang H Q. 1999. Wetland vegetation in China[M]. Beijing: Science Press: 271-291. [in Chinese]) |
李文华, 周晓峰, 刘兴土. 2007. 东北森林湿地保育与可持续发展战略研究[M]. 北京: 科学出版. (Li W H, Zhou X F, Liu X T. 2007. Conservation and the sustainable development strategy research of the northeastern forest wetland in China[M]. Beijing: Science Press. [in Chinese]) |
李银鹏, 季劲钧. 2001. 全球陆地生态系统与大气之间碳交换的模拟研究[J]. 地理学报, 56(4): 379-389. (Li Y P, Ji J J. 2001. Simulations of carbon exchange between global terrestrial ecosystem and the atmosphere[J]. Acta Geographica Sinica, 56(4): 379-389. DOI:10.11821/xb200104001 [in Chinese]) |
李兆富, 吕宪国, 杨青. 2002. 湿地土壤CO2通量研究进展[J]. 生态学杂志, 21(6): 47-50. (Li Z F, Lü X G, Yang Q. 2002. A review on wetland soil CO2 flux[J]. Chinese Journal of Ecology, 21(6): 47-50. [in Chinese]) |
毛德华, 王宗明, 罗玲, 等. 2012. 1982-2009年东北多年冻土区植被净初级生产力动态及其对全球变化的响应[J]. 应用生态学报, 23(6): 1511-1519. (Mao D H, Wang Z M, Luo L, et al. 2012. Dynamic changes of vegetation net primary productivity in permafrost zone of Northeast China in 1982-2009 in response to global change[J]. Chinese Journal of Applied Ecology, 23(6): 1511-1519. [in Chinese]) |
牟长城, 孙晓新, 倪志英, 等. 2007. 大兴安岭林区沼泽-森林人工造林效果综合评估[J]. 林业科学, 43(10): 51-58. (Mu C C, Sun X X, Ni Z Y, et al. 2007. Comprehensive evaluation of the effects planting in swamp forest in Daxing'an Mountains[J]. Scientia Silvae Sinicae, 43(10): 51-58. DOI:10.3321/j.issn:1001-7488.2007.10.009 [in Chinese]) |
牟长城, 王彪, 卢慧翠, 等. 2013. 大兴安岭天然沼泽湿地生态系统碳储量研究[J]. 生态学报, 33(16): 4956-4965. (Mu C C, Wang B, Lu H C, et al. 2013. Carbon storage of natural wetland ecosystem in Daxing'anling of China[J]. Acta Ecological Sinica, 33(16): 4956-4965. [in Chinese]) |
石兰英, 牟长城, 田新民, 等. 2010. 小兴安岭不同沼泽甲烷排放及其影响因子[J]. 生态学报, 30(19): 5289-5295. (Shi L Y, Mu C C, Tian X M, et al. 2010. CH4 emission and it's driving factors from different marshes in Xiaoxing'an Mountains, China[J]. Acta Ecological Sinica, 30(19): 5289-5295. [in Chinese]) |
宋长春, 王毅勇. 2006. 湿地生态系统土壤温度对气温的响应特征及对CO2排放的影响[J]. 应用生态学报, 17(4): 625-629. (Song C C, Wang Y Y. 2006. Responses of soil temperature in wetland ecosystem to air temperature and their effect on CO2 emission[J]. Chinese Journal of Applied Ecology, 17(4): 625-629. [in Chinese]) |
孙晓新, 牟长城, 冯登军, 等. 2009. 排水造林对小兴安岭沼泽甲烷排放的影响[J]. 生态学报, 29(8): 4251-4259. (Sun X X, Mu C C, Feng D J, et al. 2009. Effect of wetland draining for forestation on methane emission in Xiaoxing'an Mountains, China[J]. Acta Ecological Sinica, 29(8): 4251-4259. [in Chinese]) |
王跃思. 2004. 碳交换的箱法测定//陈泮勤. 地球系统碳循环. 北京: 科学出版社, 130-145. (Wang Y S. 2004.Chamber methods for measuring carbon exchange//Chen P Q. Carbon circling in earth system. Beijing:Science Press, 130-145. ) |
张宪洲. 1993. 我国自然植被净第一性生产力的估算与分布[J]. 自然资源, 18(1): 15-21. (Zhang X Z. 1993. Estimating and distribution of the vegetation net primary productivity[J]. China Resources Science, 18(1): 15-21. [in Chinese]) |
周广胜, 张新时. 1996. 全球气候变化的中国自然植被的净第一性生产力研究[J]. 植物生态学报, 20(1): 11-19. (Zhou G S, Zhang X S. 1996. Study on NPP of natural vegetation in China under global climate change[J]. Acta Phytoecologica Sinica, 20(1): 11-19. [in Chinese]) |
周文昌, 牟长城, 刘夏, 等. 2012. 小兴安岭天然森林沼泽生态系统碳汇功能[J]. 东北林业大学学报, 40(7): 71-75. (Zhou W C, Mu C C, Liu X, et al. 2012. Carbon sink in natural swamp forest ecosystems in lesser Xiaoxing'an Mountains[J]. Journal of Northeast Forestry University, 40(7): 71-75. [in Chinese]) |
(Alongi D M, Trott L A, Pfitzner J. 2007. Deposition, mineralization and storage of carbon and nitrogen in sediments of the far northern Great Barrier Reef shelf[J]. Continental Shelf Research, 27(20): 2595-2622. DOI:10.1016/j.csr.2007.07.002)
|
(Andrews J A, Matamala R, Westover K M, et al. 2000. Temperature effects on the diversity of soil heterotrophs and the δ13 C of soil-respired CO2[J]. Soil Biology and Biochemistry, 32(5): 699-706. DOI:10.1016/S0038-0717(99)00206-0)
|
(Armentano T V, Menges E S. 1986. Patterns of change in the carbon balance of organic soil-wetlands of the temperate zone[J]. Journal of Ecology, 74(3): 755-774. DOI:10.2307/2260396)
|
(Arnold K Von, Weslien P, Nilsson M, et al. 2005. Fluxes of CO2, CH4 and N2O from drained coniferous forests on organic soils[J]. Forest Ecology and Management, 210(1/3): 239-254.)
|
(Aselmann I, Crutzen P J. 1989. Global distribution of natural freshwater wetlands and rice paddies, their net primary productivity, seasonality and possible methane emissions[J]. Journal of Atmospheric Chemistry, 8(4): 307-358. DOI:10.1007/BF00052709)
|
(Bedard-Haughn A, Jongbloed F, Akkerman J, et al. 2006. The effects of erosional and management history on soil organic carbon stores in ephemeral wetlands of hummocky agricultural landscapes[J]. Geoderma, 135: 296-306. DOI:10.1016/j.geoderma.2006.01.004)
|
(Brevik E C, Homburg J A A. 2004. 5000 year record of carbon sequestration from a coastal lagoon and wetland complex, southern California, USA[J]. Catena, 57(3): 221-232. DOI:10.1016/j.catena.2003.12.001)
|
(Byrne K A, Farrell E P. 2005. The effect of afforestation on soil carbon dioxide emissions in blanket peatland in Ireland[J]. Forestry, 78(3): 217-227. DOI:10.1093/forestry/cpi020)
|
(Carroll P, Crill P. 1997. Carbon balance of a temperate poor fen[J]. Global Biogeochemical Cycles, 11(3): 349-356. DOI:10.1029/97GB01365)
|
(Dasselaar A V, Marinus L. Beusichem V, et al. 1999. Methane emissions from wet grasslands on peat soil in a nature preserve[J]. Biogeochemistry, 44(2): 205-220.)
|
(Euliss N H Jr, Gleason R A, Olness A, et al. 2006. North American prairie wetlands are important nonforested land-based carbon storage sites[J]. Science of the Total Environment, 361(1/3): 179-188.)
|
(Hooijer A, Page S, Canadell J G, et al. 2010. Current and future CO2 emissions from drained peatlands in Southeast Asia[J]. Biogeosciences, 7(5): 1505-1514. DOI:10.5194/bg-7-1505-2010)
|
(Kayranli B, Scholz M, Mustafa A, et al. 2010. Carbon storage and fluxes within freshwater wetlands:a critical review[J]. Wetlands, 30(1): 111-124. DOI:10.1007/s13157-009-0003-4)
|
(Krogh L, Noergaard A, Hermansen M, et al. 2003. Preliminary estimates of contemporary soil organic carbon stocks in Denmark using multiple datasets and four scaling-up methods[J]. Agriculture, Ecosystems and Environment, 96(1/3): 19-28.)
|
(Laiho R, Laine J, Trettin C, et al. 2004. Scots pine litter decomposition along drainage succession and soil nutrient gradients in peatland forests, and the effects of inter-annual weather variation[J]. Soil Biology and Biochemistry, 36(7): 1095-1109. DOI:10.1016/j.soilbio.2004.02.020)
|
(Lappalainen E. 1996. Global peat resources[J]. Finland:International Peat Society and Geological Survey of Finland: 5-358.)
|
(Leifeld J, Muller M, Fuhrer J. 2011. Peatland subsidence and carbon loss from draines temperate fens[J]. Soil Use and Management, 27(2): 170-176. DOI:10.1111/j.1475-2743.2011.00327.x)
|
(Macdonalda J A, Fowlera D, Hargreavesa K J, et al. 1998. Methane emission rates from a northern wetland; response to temperature, water table and transport[J]. Atmospheric Environment, 32(19): 3219-3227. DOI:10.1016/S1352-2310(97)00464-0)
|
(Makiranta P, Riutta T, Penttila T, et al. 2010. Dynamics of net ecosystem CO2 exchange and heterotrophic soil respiration following clearfelling in a drained peatland forest[J]. Agricultural and Forest Meteorology, 150(12): 1585-1596. DOI:10.1016/j.agrformet.2010.08.010)
|
(Maltby E, Immirzi P. 1993. Carbon dynamics in peatlands and other wetland soils regional and global perspectives[J]. Chemopher, 27(6): 999-1023. DOI:10.1016/0045-6535(93)90065-D)
|
(Matthews E, Fung I. 1987. Methane emission from natural wetlands:global distributuion, area, and environmental characteristics of sources[J]. Global Biogeochemical Cycles, 1(1): 61-86. DOI:10.1029/GB001i001p00061)
|
(Melling L, Hatano R, Goh K J. 2005. Methane fluxes from three ecosystems in tropical peatland of Sarawak, Malaysia[J]. Soil Biology & Biochemistry, 37(8): 1445-1453.)
|
(Minkkinen K, Korhonen R, Savolainen I, et al. 2002. Carbon balance and radiative forcing of Finnish peatlands 1900-2100-the impact of forestry drainage[J]. Global Change Biology, 8(8): 785-799. DOI:10.1046/j.1365-2486.2002.00504.x)
|
(Minkkinen K, Laine J. 1998. Long-term effect of forest drainage on the peat carbon stores of pine mires in Finland[J]. Canadian Journal of Forest Research, 28(9): 1267-1275. DOI:10.1139/x98-104)
|
(Murphy M, Laiho R, Moore T R. 2009. Effects of water table drawdown on root production and aboveground biomass in a boreal bog[J]. Ecosystems, 12(8): 1268-1282. DOI:10.1007/s10021-009-9283-z)
|
(Nykänen H, Alm J, Lang K, et al. 1995. Emission of CH4, N2O and CO2 from a virgin fen and a fen drained for grassland in Finland[J]. Journal of Biogeography, 22: 351-375. DOI:10.2307/2845930)
|
(Oberbauer S F, Gillespie C T, W Cheng, et al. 1992. Environmental effects on CO2 efflux from riparian tundra in the northern foothills of the Brooks Range, Alaska, USA[J]. Oecologia, 92: 568-577. DOI:10.1007/BF00317851)
|
(Page S E, Rieley J O, Banks C J. 2011. Global and regional importance of the tropical peatland carbon pool[J]. Global Change Biology, 17(2): 798-818. DOI:10.1111/gcb.2010.17.issue-2)
|
(Raich J W, Schlesinger W H. 1992. The global carbon dioxide fluxes in soil respiration and its relationship to vegetation and climate[J]. Tellus, 44(2): 81-99. DOI:10.3402/tellusb.v44i2.15428)
|
(Roulet N T, Moore T R. 1995. The effect of forestry drainage practices on the emission of methane from northern peatlands[J]. Canada Journal of Forest Research, 25(3): 491-499. DOI:10.1139/x95-055)
|
(Silins U, Rothwell R L. 1999. Spatial pattern of aerobic limit depth and oxygen diffusion rate at two peatlands drained for forestry in Alberta[J]. Canadian Journal of Forest Research, 29(1): 53-61. DOI:10.1139/x98-179)
|
(Silvola J, Alm J, Ahlholm U, et al. 1996. CO2 fluxes from peat in boreal mires under varying temperature and moisture conditions[J]. Journal of Ecology, 84(2): 219-228. DOI:10.2307/2261357)
|
(Slam J O, Maddison M, Tammik S, et al. 2012. Emissions of CO2, CH4 and N2O from undisturbed, drained and mined peatlands in Estonia[J]. Hydrobiologia, 692(1): 41-55. DOI:10.1007/s10750-011-0934-7)
|
Trettin C C, Jurgensen M F, Gale M R, et al. 1995. Soil carbon in northern forested wetlands:impacts of silvicultural practices//Mcfee W W, Kelly J M. Carbon forms and functions in forest. Madison:Soils Soil Science Society of America, 437-461. )
|
(Wang Y S, Wang Y H. 2003. Quick measurement of CO2, CH4 and N2O emissions from a short-plant ecosystem[J]. Advances in Atmospheric Sciences, 20(5): 842-844. DOI:10.1007/BF02915410)
|
(Whalen S C. 2005. Biogeochemistry of methane exchange between natural wetlands and the atmosphere[J]. Environmental Engineering Science, 22(1): 73-94. DOI:10.1089/ees.2005.22.73)
|
(Whitting G J, Chanton J P. 2001. Greenhouse carbon balance of wetlands:methane emission versus carbon sequestration[J]. Tellus, 53(5): 521-528.)
|
(Zogg G P, Zap D R, Ringelberg D B, et al. 1997. Compositional and functional shifts in microbial communities due to soil warming[J]. Soil Science Society of America Journal, 61(2): 475-481. DOI:10.2136/sssaj1997.03615995006100020015x)
|
 2017, Vol. 53
2017, Vol. 53

