文章信息
- 徐沁怡, 王标, 赵建文, 吴建峰, 曹亦润, 杨先有, 夏国华, 王正加, 黄坚钦, 胡渊渊
- Xu Qinyi, Wang Biao, Zhao Jianwen, Wu Jianfeng, Cao Yirun, Yang Xianyou, Xia Guohua, Wang Zhengjia, Huang Jianqin, Hu Yuanyuan
- 2种花粉授粉山核桃果皮光合特性的差异比较
- Variation in Photosynthetic Characteristics of Exocarp of Carya cathayensis Fruits Pollinated with Different Pollens
- 林业科学, 2017, 53(1): 38-46
- Scientia Silvae Sinicae, 2017, 53(1): 38-46.
- DOI: 10.11707/j.1001-7488.20170105
-
文章历史
- 收稿日期:2016-02-05
- 修回日期:2016-05-30
-
作者相关文章
胡桃科(Juglandaceae) 山核桃属(Carya) 有2种普遍栽培的经济树种:山核桃(Carya cathayensis) 和薄壳山核桃(C. illinoensis)。前者我国特有,味香壳厚;而后者原产美国,壳薄味浓。通过不同的授粉试验,山核桃具有明显的花粉直感现象(叶茂富等,1965;王正加等,2010;叶浩然等,2013)。授薄壳山核桃花粉的山核桃果实外果皮变绿,果实、种仁明显增大,但分子标记显示授粉子代与母本遗传基础无明显差异(王正加等,2010),这表明果实变异不是由于遗传物质变化引起的,果实的大小和发育主要受从叶片及其他非叶光合器官(如绿色果皮) 运输而来的光合产物影响(Cocaliadis et al., 2014)。虽然叶片是植物主要的光合器官,但许多植物的果实也含有叶绿素,能进行光合作用,且对果实或种子的形成具有重要贡献(Lytovchenko et al., 2011;Hu et al., 2012),是对叶片光合物质生产能力的有效补充(Pavel et al., 1993;Marcelis et al., 1995;Hetherington et al., 1998)。
本研究设置2种授粉组合:山核桃×山核桃(hp) 和山核桃×薄壳山核桃(pp),研究授不同花粉的山核桃果实发育期间外果皮光合速率、光合色素及叶绿素荧光特性的变化,探讨花粉授粉对山核桃外果皮光合特性的影响,以及其与果实干物质形成的关系,初步揭示花粉直感使山核桃果实增大的光合生理机制。通过研究山核桃外果皮的光合增产潜力和优势,为探寻进一步提高山核桃产量的技术途径提供参考依据。
1 材料与方法 1.1 试验地概况试验地位于浙江农林大学山核桃试验林基地(30°14′10.68″E,119°43′11.63″N)。该基地地势平缓,2008年采用嫁接苗造林,砧木为2年生湖南山核桃,穗条为1年生山核桃品种,2012年开始结果。每年4月花期时施少量复合肥,9月果实采收后施有机肥,田间栽培技术措施基本相同。
1.2 试验材料选择无性系山核桃结果树8~10株为母本样株,4月下旬套袋,父本分别为山核桃花粉(记作hp) 和薄壳山核桃花粉(记作pp),进行人工授粉。授粉5~7天后除去纸袋,挂牌标记。授粉后30天开始疏果(每个结果枝只留1个果,便于气体交换的测定),分别在山核桃果实发育关键时期(解红恩等, 2008) 采集相同高度的山核桃果实,并进行分析。
1.3 试验方法 1.3.1 果实形态和干质量的测定果实成熟后每处理随机选取120个果实,采用四分法分为4份,作为4个重复。果长(L)、果径(T)、果厚(W) 用游标卡尺测量,精确到0.01 mm。参照Baryeh (2001)和宋慧芝等(2011)的方法积计算果实表面积。公式如下:
| $ {D_{\rm{g}}} = {\left( {LWT} \right)^{1/3}}, $ | (1) |
| $ S = \pi \cdot{D_{\rm{g}}}^2。 $ | (2) |
式中:Dg为几何平均径(mm);S为表面积(cm2)。
然后将果实105 ℃杀青30 min,之后在60 ℃的烘箱烘干至恒质量,果干物质量用电子天平称取,精确到0.01 g。
1.3.2 气体交换参数的测定选择晴天光强稳定在1 200~1 400 μmol·m-2s-1 (8:00-11:00,14:00-17:00) 时,采用Li6400-02标准叶室(LI-COR Inc,Lincoln,USA) 测定不同花粉授粉的山核桃相应叶片的气体交换参数,以内置红蓝光源02为光源;采用Li6400-22簇状叶室测定不同花粉授粉的山核桃果实的气体交换参数,以18-RGB为光源。每株树作为1个重复,4次重复,每次重复3个独立叶片、果实。
进行气体交换参数测定时,设定叶室内气体流速为500 μmol·s-1,温度为28 ℃,CO2浓度为400 μmol·mol-1,光强为1 300 μmol·m-2s-1。叶片光合速率为净光合速率和呼吸速率之和;果实光合速率为光下的光合速率和黑暗下的呼吸速率之和。山核桃果实外果皮单位面积的光合速率通过代入山核桃果实的表面积/2(与叶片光合速率的计算方法一致,只有上表面积接受光强,所用的面积只是一面) 进行校准重新计算。
1.3.3 叶绿素含量的测定将采回的不同花粉授粉的山核桃果实对半切开,用自制陶瓷双刀片(厚度为3 mm) 取果实中部果皮2~3片(每片约为1 cm×0.5 cm),称鲜质量后快速切碎放入装有8 mL 95%乙醇的离心管中,置于暗处浸提24 h,定时振荡。同时取相同果实上的中部果皮,称鲜质量后在方格纸上记下面积。采用UV-2550型分光光度计(日本岛津),于665,649和470 nm波长下测定OD值。计算方法参照Lichtenthaler (1987)。
1.3.4 叶绿素荧光参数的测定采用Dual PAM-2500荧光仪(WALZ,德国) 测定果实的叶绿素荧光参数,测定前进行充足的暗适应。先测定初始荧光产量(Fo) 和最大荧光产量(Fm),随后打开光化光,强度为1 265 μmol·m-2s-1,待荧光信号达稳态(4~5 min) 后打开饱和脉冲光,测定任意时间的实际荧光产量(Ft) 和光适应下的最大荧光产量(F′m)。
叶绿素荧光参数按下列公式计算: Fv/Fm=(Fm-Fo)/Fm (Genty et al., 1989);Y=(F′m-Ft)/F′m(Genty et al., 1989);qP=(F′m-Ft)/(F′m-F′o),其中F′o=Fo/(Fv/Fm +Fo/F′m) (Oxborough et al., 1997);ETR=Y×PFD×0.5×0.84,其中,0.5表示假设吸收的光被2个光系统均分得到的参数,0.84为吸光系数(Schreiber et al., 1995)。式中:Fv/Fm为最大光化学效率;Y为实际光化学效率;ETR为表观电子传递速率;qP为光化学猝灭系数。
然后测定快速光曲线,共12个光强梯度,从低到高为5,51,91,151.5,193,375.5,623.5,737,1 059.3,1 272.3,1 521.7和1 800.3 μmol·m-2s-1。每个光强度照射样品20 s后打开饱和脉冲光进行荧光猝灭分析,记录快速光响应曲线。荧光参数计算公式如下:Y (Ⅱ)=(F′m-Ft)/F′m (Genty et al., 1989);Y(NO)=Ft/Fm;Y(NPQ)=(Ft/F′m)-(Ft/Fm) (Hendrickson et al., 2004);Y(Ⅱ)+Y(NPQ)+Y(NO)=1(Klughammer et al., 1994)。式中:Y(Ⅱ) 为PSⅡ的实际光化学量子效率;Y(NO) 为PSⅡ中荧光和不依赖光的基础热耗散量子效率;Y(NPQ) 为PSⅡ中ΔpH和叶黄素调节的热耗散量子效率。
1.4 数据处理方法数据采用Excel 2007软件进行计算和分析,其独立样本t检验和方差分析处理均采用SPSS18.0软件进行统计学分析处理,多重比较采用LSD法分析,利用sigmaplot12.0版专业绘图和数据分析软件进行相关性分析及作图。
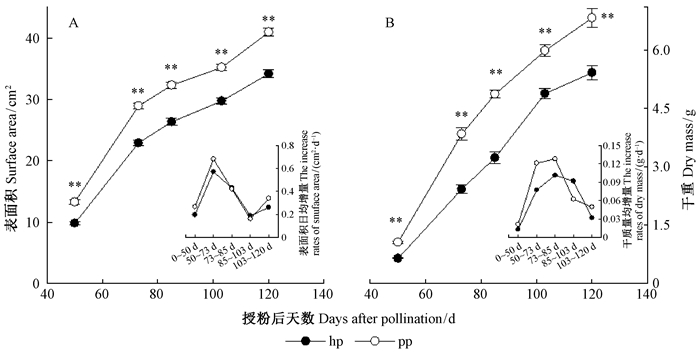
2 结果与分析 2.1 2种花粉授粉山核桃果实的外观形态、干质量和表面积的变化pp授粉的山核桃果实明显大于hp花粉授粉的果实,且外果皮更绿(图 1)。2种花粉授粉山核桃果实的表面积日均增量随果实发育呈先升高后降低然后再缓慢升高的趋势(图 2A),其干质量日均增量随果实发育呈先增加后下降的趋势(图 2B)。授粉后50~73天,pp授粉的果实表面积日均增量为0.68 cm2·d-1,而hp授粉处理为0.57 cm2·d-1;授粉后103~120天,hp授粉的果实表面积日均增量为0.26 cm2·d-1,而pp授粉处理为0.34 cm2·d-1。果实发育前期(授粉后50~73天),pp授粉的山核桃果实干质量日均增量(0.12 gDW·d-1) 高于hp授粉的果实(0.07 gDW·d-1);果实发育后期(授粉后103~120天),pp授粉的山核桃果实日均干质量增量(0.05 gDW·d-1) 均高于hp授粉的果实(0.03 gDW·d-1)。在果实发育的各个时期,pp授粉的山核桃果实表面积和干质量均显著高于hp授粉的果实,其中50,73,85,103和120天时pp授粉山核桃果实的表面积分别是hp授粉果实的1.35,1.26,1.23,1.18和1.2倍;pp授粉山核桃果实的干质量分别是hp授粉果实的1.64,1.59,1.51,1.23和1.26倍。

|
图 1 果实发育过程中不同花粉授粉山核桃果实外形的变化 Fig.1 Changes in shape of hickory fruits pollinated with two different pollens during the fruit growth stages |
|
图 2 果实发育过程中2种花粉授粉山核桃果实表面积(A) 和干质量(B) 的变化 Fig.2 Changes in surface area (A) and mass (B) of hickory fruits pollinated with two different pollens during the fruit growth stages 图中数据为均值±标准误差, **表示相同时期2种花粉授粉的山核桃果实之间在0.01水平达显著差异, *表示在0.05水平达显著差异, ns表示在0.05水平无显著差异。图A和B中的小图分别为不同发育时期内的表面积日均增量和干质量日均增量。Date are presented as the means±standard error. Significant differences in hickory fruits pollinated with two different pollens :**: P<0.01;*:P<0.05;ns: P>0.05. The small figures in the Fig. 2 A and B showed the increase rates of surface area and dry mass in fruits pollinated with two different pollens during the different growth stages.下同The same below. |
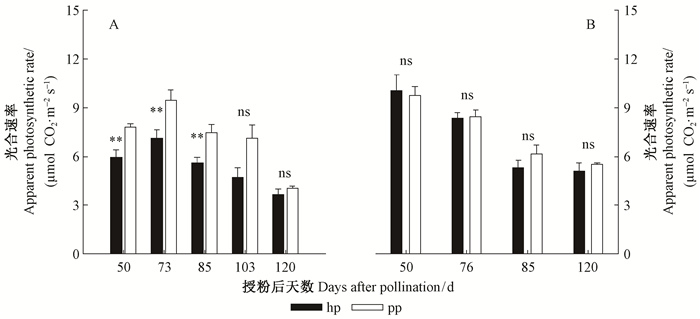
随着果实发育,2种花粉授粉山核桃外果皮单位面积的光合速率均呈先升高后降低的趋势(图 3A)。在授粉后73天,hp和pp授粉山核桃外果皮的光合速率均达到最大值,分别7.15和9.54 μmol CO2·m-2s-1。果实发育的前中期(授粉后50~85天),pp授粉山核桃果实外果皮单位面积的光合速率均显著高于hp授粉的果实(P<0.05),且在授粉后50,73,85天,前者分别为后者的1.31,1.32,1.33倍。
|
图 3 果实发育过程中2种花粉授粉山核桃果实外果皮(A) 及其对应叶片(B) 单位面积上光合速率的变化 Fig.3 Changes in apparent photosynthetic rate in exocarp and their corresponding leaves of the hickory fruits pollinated with two different pollens during the fruit growth stages |
随着果实发育,2种花粉授粉山核桃果实的对应叶片光合速率均呈逐渐降低的趋势。与授粉后50天相比,授粉后85天2种花粉授粉的叶片光合速率降低37%~47%。在整个果实发育过程中,2种花粉授粉山核桃果实相应叶片的光合速率之间无显著差异(图 3B)。
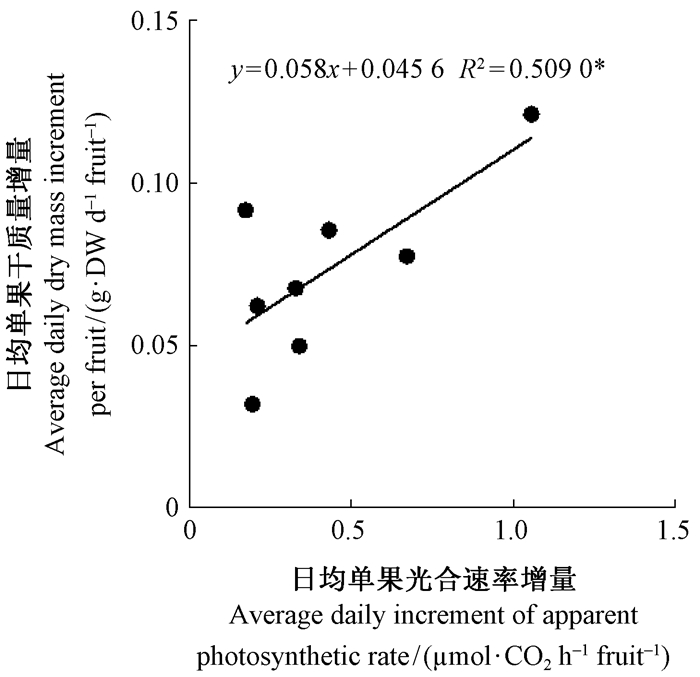
2.3 2种花粉授粉的山核桃果实单果日均干质量增量与单果日均光合速度率增量之间的相关性在果实发育过程中,分别计算一段时间内的日平均单果干质量和日均单果光合速率。由图 4可以看出,山核桃果实的日均单果光合速率增量与日均单果干质量增量之间显著相关。
|
图 4 山核桃果实单果日均干质量增量与其单果光合速率日均增量的相关性 Fig.4 Relationship between average daily dry mass increment and average daily apparent photosynthesis rate increment expressed on per fruit of hickory fruits 日均单果干质量增量=相邻2个时期的干质量增量/间隔天数;日均单果光合速率增量=日均表面积增量(相邻2个时期的表面积增量/间隔天数)×平均光合速率(相邻2个时期的光合速率之和/2)。Average daily dry mass increment per fruit=dry mass increment of adjacent periods / intervallic days; Daily photosynthetic rate per day=daily surface area increment/2 (surface area increment of adjacent periods / intervallic days/2)×average photosynthetic rate (the sum of adjacent two photosynthesis rate /2). |
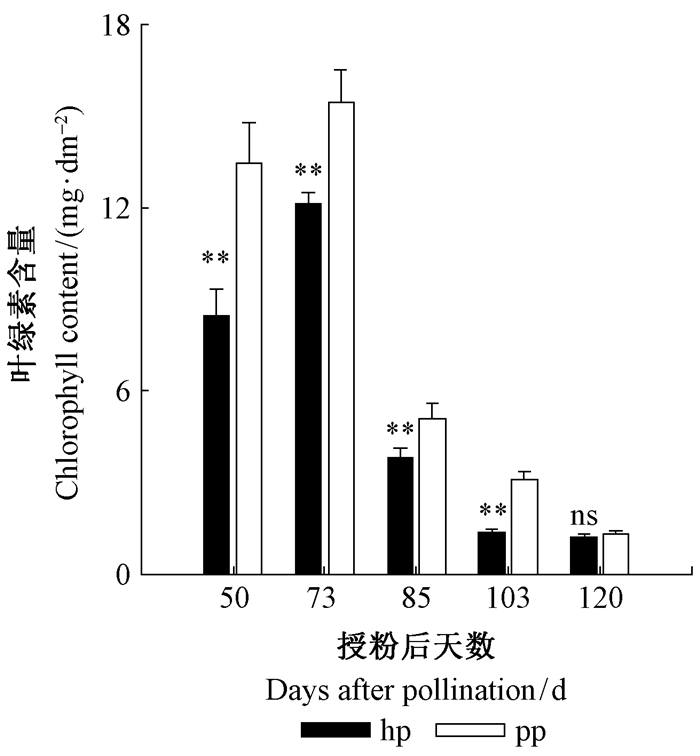
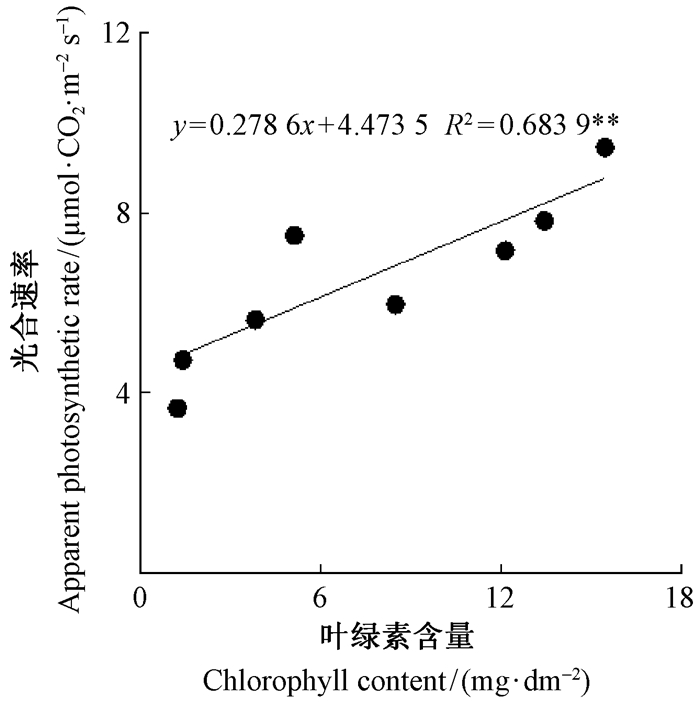
由图 5可以看出,在果实发育过程中,除授粉后120天外,pp授粉的山核桃果实外果皮叶绿素含量均显著高于hp授粉的果实,均在授粉后73天达到最大值,此后开始快速下降。随果实外果皮叶绿素含量的增加,果实外果皮平均光合速率也升高,且二者极显著相关(图 6)。
|
图 5 果实发育过程中2种花粉授粉山核桃果实外果皮叶绿素含量的变化 Fig.5 Changes in chlorophyll content in exocarp of hickory fruits pollinated with two different pollens during the fruit growth stages |
|
图 6 2种花粉授粉山核桃果实外果皮的叶绿素含量与光合速率之间的相关性 Fig.6 Relationship between chlorophyll content and photosynthetic rate in exocarp of hickory fruits pollinated with two different pollens |
在果实发育过程中,不同花粉授粉山核桃果实外果皮之间的Fv/Fm之间不存在显著差异。随着果实发育,pp授粉山核桃果实外果皮的实际光化学效率(Y) 显著高于hp授粉的果实。授粉后103~120天,hp授粉的山核桃外果皮Y下降54.7%,而pp授粉的山核桃外果皮下降30.4%。ETR代表光合作用的表观电子传递速率,当光强恒定时,其变化决定Y的变化,不同授粉处理间的ETR变化与Y的变化趋势相似(表 1)。qP是光合机构光系统Ⅱ的光化学猝灭系数,表示PS Ⅱ中处于开放状态的反应中心所占的比例。由表 1可知,随着果实发育,pp授粉山核桃果实外果皮的qP值均显著高于hp授粉的果实。
|
|
快速光曲线是一种新的快速测定光合机构光合作用活性的有力工具,可以反映光系统Ⅱ电子传递的饱和特性和光合活性(Ralph et al., 2005)。从图 7可以看出,光强从0~200 μmol·m-2s-1,不同花粉授粉山核桃果实外果皮的ETR均快速增加。授粉后50天,hp授粉山核桃果实外果皮的ETR在光强为770 μmol·m-2s-1达到最高值,而pp授粉山核桃果实外果皮的ETR在光强为1 710 μmol·m-2s-1达到最高值;授粉后103天,hp授粉山核桃果实外果皮的ETR在光强710 μmol m-2s-1达到最高值,而pp授粉山核桃果实外果皮的ETR在光强958 μmol·m-2s-1达到最高值;授粉后120天,hp授粉山核桃果实外果皮的ETR在光强为356 μmol·m-2s-1达到最高值,而pp授粉的山核桃果实外果皮的ETR在光强为717 μmol·m-2s-1达到最高值。

|
图 7 2种花粉授粉处理后山核桃果实的快速光曲线 Fig.7 Rapid light curves of of hickory fruit pollinated with two different pollens during the fruit growth stages A.授粉后50天50 d after pollination; B.授粉后103d 103 d after pollination; C.授粉后120天120 d after pollination. |
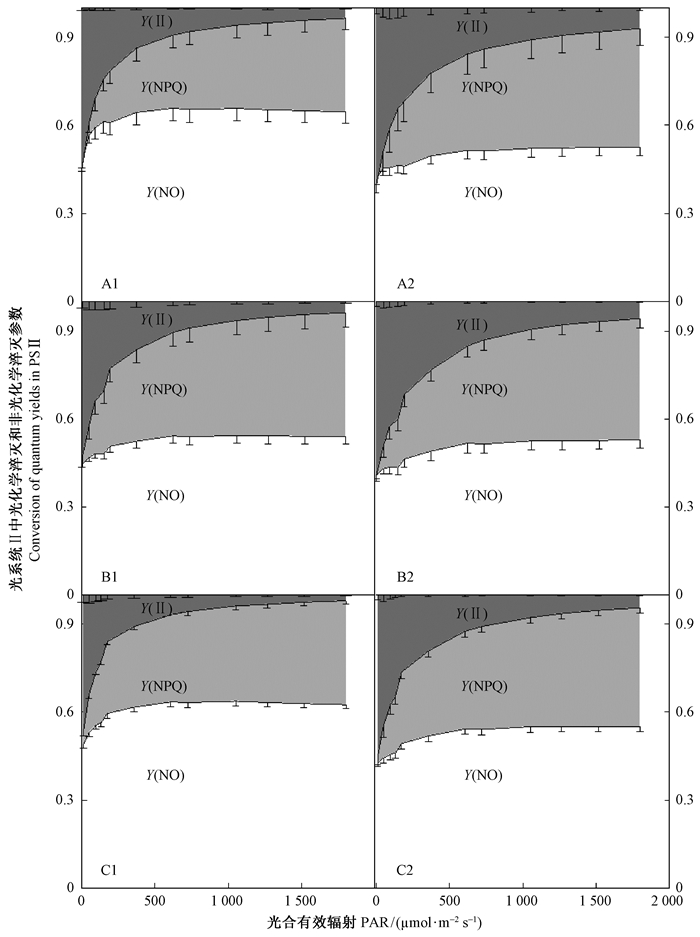
在果实发育过程中,pp授粉山核桃果实的Y(Ⅱ) 显著高于hp授粉的山核桃果实;但2种花粉授粉处理间的Y(NPQ) 无显著差异。果实发育前期(授粉后50天) 和后期(授粉后120天),pp授粉山核桃果实外果皮的Y(NO) 显著低于hp授粉的果实(图 8A1,A2,C1和C2)。授粉后103~120天,hp和pp授粉山核桃果实外果皮的Y(Ⅱ) 均显著降低。非调节性能量耗散的量子产量[Y(NO)]代表荧光和不依赖光的基础热耗散比例。果实发育后期(授粉后103~120天),hp授粉山核桃果实外果皮的Y(NO) 显著增加,而pp授粉山核桃果实外果皮Y(NO) 却无显著变化。Y(NPQ) 是调节性能量耗散的量子产量,其值是光保护的重要指标。随着果实发育,pp授粉山核桃果实外果皮的Y(NPQ) 未发生显著变化;然而,授粉后50~103天,hp授粉山核桃果实外果皮的Y(NPQ) 显著增加(图 8)。
|
图 8 果实发育过程中不同花粉授粉山核桃果实的Y(Ⅱ)、Y(NPQ)、Y(NO) 随光合有效辐射(PAR) 升高的变化 Fig.8 Estimated fraction of Y(Ⅱ), Y(NPQ), and Y(NO) in exocarp of hickory fruits pollinated with two different pollens with increasing photosynthetic active radiation (PAR) during the fruit growth stages A1:山核桃花粉授粉后50天; B1:山核桃花粉授粉后103天; C1:山核桃花粉授粉后120天; A2:薄壳山核桃花粉授粉后50天; B2:薄壳山核桃花粉授粉后103天; C2:薄壳山核桃花粉授粉后120天. A1:pollinated with hickory pollen at 50 d after pollination; B1:pollinated with hickory pollen at 103 d after pollination; C1:pollinated with hickory pollen at 120 d after pollination; A2:pollinated with pecan pollen at 50 d after pollination; B2:pollinated with pecan pollen at 103 d after pollination; C2:pollinated with pecan pollen at 120 d after pollination. |
本研究结果显示,pp授粉的山核桃果实显著大于hp授粉的果实,且外果皮颜色更绿(图 1),这与黎章矩等(1982)、叶茂富等(1965)、王正加等(2010)、叶浩然等(2013)的研究结果一致,存在明显的花粉直感现象。AFLP和SSR分子标记显示子代与母本间不存在差异,表明以薄壳山核桃为父本授粉的山核桃果实变异不是由于遗传物质的变化引起的(王正加等,2010)。本研究结果显示,在果实发育过程中,pp授粉山核桃果实的外果皮表面积、干质量均显著高于hp授粉的果实(图 2)。许多植物的果实具有光合能力,且具有向种子运输距离短的特点,对其果实、种子的生长和发育具有重要的作用(Blanke et al., 1989;Birkhold et al., 1992;Pavel et al., 1993;Hieke et al., 2002;Hu et al., 2012)。pp授粉的山核桃果实外果皮光合速率显著高于hp授粉的果实,而2种花粉授粉山核桃果实对应叶片之间的光合速率是一致的(图 3),因此,笔者推测造成2种花粉授粉山核桃果实干质量差异的原因可能是不同花粉对山核桃外果皮光合作用的差异。植物光合生产能力与其光合面积、光合能力、光合时间和光照强度均密切相关。本研究结果显示,果实发育早期(授粉后50~73天) 和后期(授粉103~120天),pp授粉山核桃果实表面积的增加速率均大于hp授粉的果实(图 2),且在授粉后50~85天,pp授粉山核桃果实外果皮单位面积的光合速率约为hp授粉果实的1.3倍(图 3),说明pp授粉山核桃果实干质量增量与其较大的光合面积和较高的光合能力密切有关,这可以从山核桃果实日均单果干质量与其日均单果光合速率增量的相关性分析中得到进一步证实(图 4)。
叶绿素在光能吸收和转化中起着重要作用,是光合作用的基础。本研究结果显示,pp授粉山核桃果实外果皮叶绿素含量显著高于hp授粉的果实(图 5),且山核桃果实外果皮叶绿素含量与光合速率呈极显著相关(图 6)。这表明pp授粉山核桃果实外果皮积累较多的叶绿素是其具有较高外果皮光合速率的重要原因(孙山,2009),为提高果实自身的物质生产及积累能力奠定基础。
本研究表明,2种花粉授粉山核桃果实的最大光化学效率(Fv/Fm) 之间无明显差异,均在0.713~0.771之间(表 1),说明2种花粉授粉山核桃外果皮对光能利用的能力是一致的。在一定强度光化学(1 265 μmol·m-2s-1) 存在的条件下,pp授粉山核桃果实的实际光化学效率(Y)、电子传递速率(ETR)、光合机构PSⅡ反应中心的比例(qP) 均显著高于hp授粉的果实,这表明具有较高光合电子传递能力的pp授粉的山核桃果实外果皮可能是与其具有较高的qP有关。
陆地棉花(Gossypium hirsutum) 盛铃期,‘杂交棉石杂2号’和‘新陆早43号’非叶器官(铃壳和茎秆) 的实际光化学效率显著高于常规棉是其产量高的主要原因(张亚黎等,2010)。因此,笔者推测pp授粉山核桃果实外果皮光合速率高与其具有较高的Y有关。
在果实发育过程中,不同花粉授粉山核桃果实外果皮ETR达到峰值的光强强度显著降低,且pp授粉山核桃果实外果皮ETR达到峰值的光强强度显著高于hp授粉的果实(图 7)。这表明,在相同的光强下,hp授粉的山核桃果实外果皮更易受到光抑制(Bertamini et al., 2003)。Y(NO) 是光损伤的重要指标(Ralph et al., 2005),如果Y(NO) 较高,则表明此时入射光可能超过了植物能接受的程度,受到光损伤。果实发育前期(授粉后50天) 和后期(授粉后120天),与hp授粉的果实相比,pp授粉果实具有较高的Y(Ⅱ) 和较低的Y(NO)(图 8)。这表明在相同辐射的强光照射下,pp授粉的核桃果实外果皮具有较强的抗光抑制能力。越来越多的研究认为,增强植物光合机构的抗光抑制能力与其生物量的提高密切相关(Wang et al., 2002;Long et al., 2006)。张亚黎等(2010)研究认为,陆地棉非叶绿色器官光合生产能力的提高与其较好的抗光抑制能力有关。因此,果实发育后期,pp授粉山核桃果实具有较高抗光抑制能力可能是其果实干质量增加的重要原因。
4 结论综上所述,薄壳山核桃授粉山核桃果实干质量增加与其外果皮的光合作用密切相关。果实发育前期(授粉后50~73天),薄壳山核桃授粉山核桃果实干质量快速增加是由于其果实具有较大的光合面积和较高的光合速率;果实发育后期(授粉后103~120天),果实干质量快速增加主要是由于其果实具有较大的光合面积。果实发育后期(授粉后120天),薄壳山核桃授粉山核桃果实具有较强的抗光抑制能力可能也是其干质量增加的重要原因。
| [] |
黎章矩, 夏逍鸿, 施拱生. 1982. 山核桃种间杂交试验研究. 浙江林学院科技通讯(1): 44–53.
( Li Z J, Xia X H, Shi G S. 1982. Hickory interspecific hybridization experiment research. Journal of Zhejiang Forestry College(1): 44–53. [in Chinese] ) |
| [] |
宋慧芝, 张京平, 何勇. 2011. 香榧青果的物理特性和其坚果力学特性研究. 农机化研究, 33(11): 170–173.
( Song H Z, Zhang J P, He Y. 2011. Research on physical and mechanical property of Chinese torreya. Journal of Agricultural Mechanization Research, 33(11): 170–173. [in Chinese] ) |
| [] |
孙山. 2009.苹果绿色果皮光合生理特性及果皮灼伤机制的研究.泰安:山东农业大学博士学位论文, 50-53. ( Sun S. 2009. Study on photosynthetic characteristics and mechanism of sunburn in green peel of apple fruit. Tai'an:PhD thesis of Shandong Agricultural University, 50-53. [in Chinese][in Chinese]) |
| [] |
王正加, 张斌, 夏国华, 等. 2010. 山核桃×薄壳山核桃花粉直感效应与后代分析. 果树学报, 27(6): 908–913.
( Wang Z J, Zhang J, Xia G H, et al. 2010. Analysis of the progeny of Carya cathayensis×C. illinoensis and the xenia effect. Journal of of Fruit Science, 27(6): 908–913. [in Chinese] ) |
| [] |
解红恩, 黄有军, 薛霞铭, 等. 2008. 山核桃果实生长发育规律. 浙江农林大学学报, 25(4): 527–531.
( Xie H E, Huang Y J, Xue X M, et al. 2008. Growth and development of the Carya cathayensis nut. Journal of Zhejiang Forestry & Agricultural University, 25(4): 527–531. [in Chinese] ) |
| [] |
叶浩然, 邵慰忠, 常君, 等. 2013. 山核桃与薄壳山核桃的杂交优势在山核桃生产中的应用试验. 浙江林业科技, 33(4): 83–85.
( Ye H R, Shao W Z, Chang J, et al. 2013. Experiment on artificial pollination of Carya cathayensis by C. illinoensis. Journal of Zhejiang Forestry Science & Technology, 33(4): 83–85. [in Chinese] ) |
| [] |
叶茂富, 吴厚钧. 1965. 山核桃与薄壳山核桃杂交的研究. 林业科学, 10(1): 50–56.
( Ye M F, Wu H J. 1965. Study of artificial pollination of Carya cathayensis by C. illinoensis. Scientia Silvae Sinicae, 10(1): 50–56. [in Chinese] ) |
| [] |
张亚黎, 冯国艺, 胡渊渊, 等. 2010. 棉花非叶绿色器官光合能力的差异及与物质生产的关系. 作物学报, 36(4): 701–708.
( Zhang Y L, Feng G Y, Hu Y Y, et al. 2010. Photosynthetic activity and its correlation with matter production in non-foliar green organs of cotton. Acta Agronomica Sinica, 36(4): 701–708. DOI:10.3724/SP.J.1006.2010.00701 [in Chinese] ) |
| [] | Baryeh E A. 2001. Physical properties of bambara groundnuts. Journal of Food Engineering, 47(4): 321–326. DOI:10.1016/S0260-8774(00)00136-9 |
| [] | Bertamini M, Nedunchezhian N. 2003. Photoinhibition of photosynthesis in mature and young leaves of grapevine (Vitis vinifera L.). Plant Science, 164(4): 635–644. DOI:10.1016/S0168-9452(03)00018-9 |
| [] | Birkhold K T, Koch K E, Darnell R L, et al. 1992. Carbon and nitrogen economy of developing rabbiteye blueberry fruit. Journal of the American Society for Horticulturalence, 117(1): 139–145. |
| [] | Blanke M M, Lenz F. 1989. Fruit photosynthesis. Plant Cell & Environment, 12(1): 31–46. |
| [] | Cocaliadis M F, Fernández-Muñoz R, Pons C, et al. 2014. Increasing tomato fruit quality by enhancing fruit chloroplast function. A double-edged sword? Journal of Experimental Botany, 65(16): 4589–4598. |
| [] | Genty B, Briantais J M, Baker N R. 1989. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochimica et Biophysica Acta, 990(1): 87–92. DOI:10.1016/S0304-4165(89)80016-9 |
| [] | Hendrickson L, Furbank R T, Chow W S. 2004. A simple alternative approach to assessing the fate of absorbed light energy using chlorophyll fluorescence. Photosynthesis Research, 82(1): 73–81. DOI:10.1023/B:PRES.0000040446.87305.f4 |
| [] | Hetherington S E, Smillie R M, Davies W J. 1998. Photosynthetic activities of vegetative and fruiting tissues of tomato. Journal of Experimental Botany, 49(324): 1173–1181. DOI:10.1093/jxb/49.324.1173 |
| [] | Hieke S, Menzel C M, Lüdders P. 2002. Effects of leaf, shoot and fruit development on photosynthesis of lychee trees (Litchi chinensis). Tree Physiology, 22(13): 955–961. DOI:10.1093/treephys/22.13.955 |
| [] | Hu Y Y, Zhang Y L, Luo H H, et al. 2012. Important photosynthetic contribution from the non-foliar green organs in cotton at the late growth stage. Planta, 235(2): 325–336. DOI:10.1007/s00425-011-1511-z |
| [] | Klughammer C, Schreiber U. 1994. An improved method, using saturating light pulses, for the determination of photosystem I quantum yield via P700+-absorbance changes at 830 nm. Planta, 192(2): 261–268. DOI:10.1007/BF01089043 |
| [] | Lichtenthaler H K. 1987. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes. Methods Enzymol, 148(1): 350–382. |
| [] | Long S P, Zhu X G, Naidu S L, et al. 2006. Can improvement in photosynthesis increase crop yields?. Plant, Cell & Environment, 29(3): 315–330. |
| [] | Lytovchenko A, Eickmeier I, Pons C, et al. 2011. Tomato fruit photosynthesis is seemingly unimportant in primary metabolism and ripening but plays a considerable role in seed development. Plant Physiology, 157(4): 1650–1663. DOI:10.1104/pp.111.186874 |
| [] | Marcelis L F M, Hofman-Eijer L R B. 1995. The contribution of fruit photosynthesis to the carbon requirement of cucumber fruits as affected by irradiance, temperature and ontogeny. Physiologia Plantarum, 93(3): 476–483. DOI:10.1111/ppl.1995.93.issue-3 |
| [] | Oxborough K, Baker N R. 1997. Resolving chlorophyll a fluorescence images of photosynthetic efficiency into photochemical and non-photochemical components-calculation of qP and Fv'/Fm'; Without measuring Fo'. Photosynthesis Research, 54(2): 135–142. DOI:10.1023/A:1005936823310 |
| [] | Pavel E W, Dejong T M. 1993. Seasonal CO2 exchange patterns of developing peach (Prunus persica) fruits in response to temperature, light and CO2 concentration. Physiologia Plantarum, 88(2): 322–330. DOI:10.1111/ppl.1993.88.issue-2 |
| [] | Ralph P J, Gademann R. 2005. Rapid light curves: a powerful tool to assess photosynthetic activity. Aquatic Botany, 82(3): 222–237. DOI:10.1016/j.aquabot.2005.02.006 |
| [] | Schreiber U, Bilger W, Neubauer C. 1995. Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis//Schulze E D, Caldwell M M. Ecophysiology of photosynthesis. Germany: Springer Berlin Heidelberg, 49-70. |
| [] | Wang Q, Zhang Q D, Zhu X G, et al. 2002. PSⅡ photochemistry and xanthophyll cycle in two superhigh-yield rice hybrids, liangyoupeijiu and hua-an 3 during photoinhibition and subsequent restoration. Acta Botanica Sinica, 44(11): 1297–1302. |
 2017, Vol. 53
2017, Vol. 53

