文章信息
- 曹庆杰, 迟德富
- Cao Qingjie, Chi Defu
- 感染杨干象幼虫的高致病力虫生真菌菌株筛选
- Screening of High Virulent Entomopathogenic Fungal Strains to Infect Larvae of Cryptorrhynchus lapathi (Coleoptera: Curculionidae)
- 林业科学, 2017, 53(1): 119-127
- Scientia Silvae Sinicae, 2017, 53(1): 119-127.
- DOI: 10.11707/j.1001-7488.20170115
-
文章历史
- 收稿日期:2015-01-27
- 修回日期:2015-03-28
-
作者相关文章
杨干象 (Cryptorrhynchus lapathi) 是杨树的主要蛀干害虫,生活隐蔽, 主要危害3~6年生幼树,曾在1984, 1996和2005年3次被列为全国林业检疫性有害生物 (高瑞桐,2003)。近年来,杨干象在全国范围内发生频率明显升高,对林木造成严重危害,但目前生产上仍然主要靠化学农药来控制杨干象的危害 (李国伟等,2011;胡秀芝等,2001;蔡建文等,2000)。化学防治杨干象虽然效果较好 (孙向文等,1999;苗建才等,1990;1994;蔡建文等,2000),但会对环境产生很多不利影响,长期施用也使杨干象产生了较强的抗药性 (Chung,1982)。
病原真菌是环境友好型杀虫剂 (Goettel et al., 1992),其中白僵菌 (Beauveria bassiana) 与绿僵菌 (Metarhizium anisopliae) 已成为广泛使用的农林害虫病原真菌 (蒲蜇龙等,1996;Roberts et al., 2004)。国内外用白僵菌 (Shimazu,2004;王素英等,2000;Dubois et al., 2004;李林青等,2005;王四宝等,2004;Shimazu et al., 2003;Dubois,2003) 与绿僵菌 (童应华等,2010;何学友等,2005;李建庆等,2006) 来防治天牛、萧氏松茎象 (Hylobitelus xiaoi) 等蛀干类害虫,均取得了良好效果;但用病原真菌防治杨干象的报道还较少,且防治效果不理想 (Cavalcaselle,1975)。为了高效安全地控制杨干象危害,本研究选用7株虫生真菌菌株对杨干象幼虫进行室内致病力测定和林间防治试验。
1 材料与方法 1.1 供试菌株与供试昆虫杨干象幼虫人工饲养采用双层玻璃板饲养法,上层玻璃板为9 cm×9 cm,下层玻璃板为15 cm×15 cm,2层玻璃板中间夹厚度约1 cm的人工饲料。人工饲料配方质量比为玉米面:黄豆粉:水=5:1:5。经高压灭菌锅蒸熟灭菌冷却后,在上层玻璃板下的饲料上用镊子戳小洞,以便将杨干象幼虫放入饲料中。
供试杨干象幼虫采自辽宁省北票市辽杨 (Populus maximowiczii) 林。采伐带有杨干象幼虫的杨树, 将其锯成50~80 cm长的木段。木段顶端封以石蜡,下端放入水深1 cm的水槽中进行保湿,置于自然条件下,待杨干象幼虫长到4~5龄时集中采集。为了使杨干象幼虫适应室内饲养环境,利用上述人工饲料饲养杨干象幼虫约1周后,挑取健康杨干象幼虫用于试验。
供试白僵菌菌株ACCC30821、ACCC30830、ACCC30831、CFCC87323、CFCC87327、ACCC30749与绿僵菌菌株GIM3346均来源于北京北纳创联生物技术研究院,各菌株基本情况见表 1。
|
|
1) 孢子悬浮液的制备 将PDA斜面培养基上各菌株产的孢子接种于液体培养基中培养,250 mL锥形瓶内加入150 mL培养液,培养温度为28 ℃,摇床摇速为140 r·min-1,待液体培养基中各菌株充分产孢后, 用血球计数板计数, 配制成浓度为108 conidia·mL-1的孢子悬液备用。
2) 不同菌株对杨干象幼虫的致病力测定 采用浸渍法将杨干象幼虫浸入配制好的108 conidia·mL-1孢子悬浮液中,10 s后, 接入到提前准备好的人工饲料中饲养,2天更换1次饲料。以0.05%吐温-80无菌水为对照,每天观察记录杨干象幼虫死亡情况,并将虫尸置于恒温培养箱中保湿培养 (湿度为80%,温度为26 ℃),以虫体表面长出菌丝为有效致死。统计各处理的死亡虫数,筛选出对杨干象幼虫致病力强的菌株。每处理设3次重复,每次重复测定18头幼虫,共测定54头幼虫。
3) 高致病力菌株对杨干象幼虫致死中浓度LC50测定 以0.05%吐温-80无菌水为对照组,以致病力最强的菌株为试验组,分别以1.57×103,1.57×104,1.57×105,1.57×106,1.57×107和1.57×108 conidia·mL-1 6个梯度浓度的孢子悬浮液接菌,接菌及接菌后的幼虫饲养和观察方法同上。每处理设3次重复,每次重复测定18头幼虫,共测定54头幼虫。
4) 真菌对杨干象幼虫致病特点观察 选用高致病力菌株,以108 conidia·mL-1的孢子悬浮液浸渍法处理杨干象幼虫后,接入到准备好的人工饲料中,每处理设3次重复,每次重复测定3头幼虫,每12 h观察杨干象幼虫感染后的变化。
5) 林间防治试验 试验地设在辽宁省北票市青山林场,属于半湿润大陆性季风气候区,该林分占地面积66.7 hm2。试验林为2011年营造的杨树人工林,杨树受杨干象危害株率为100%,每株虫口密度在10头以上。
本试验于2014年5月上旬进行,选取室内测定对杨干象幼虫校正死亡率超过50%的菌株作为林间生防使用的菌株,以浓度为106,107,108 conidia·mL-1孢子悬浮液,采用涂干法处理受杨干象幼虫危害较严重的杨树。设3次重复,每次重复选取5~7株树 (共约100头幼虫),以0.05%吐温-80无菌水为对照。处理后根据室内试验幼虫死亡时间和长出菌丝时间,10天后将杨树分段劈开检查杨干象幼虫存活情况,并将虫尸带回室内保湿培养,以虫尸体表面长出菌丝为有效致死,统计死亡率。
1.3 数据分析应用SPSS19.0统计软件对试验数据进行统计分析。
2 结果与分析 2.1 不同菌株对杨干象幼虫的致病力1) 不同菌株对杨干象幼虫的累积死亡率 不同菌株对杨干象幼虫的累积死亡率动态变化见图 1。杨干象幼虫接种108 conidia·mL-1的孢子悬浮液后,7株供试菌株对杨干象幼虫均表现出一定的致病力。菌株CFCC87323处理后,杨干象幼虫的累积死亡率上升比较快,第3至第7天均显著 (P < 0.05) 或极显著 (P < 0.01) 高于其他菌株;菌株ACCC30830处理后,在第4,6,7天杨干象幼虫的累积死亡率均显著 (P < 0.05) 或极显著 (P < 0.01) 高于菌株ACCC30831、CFCC87327、GIM3346、ACCC30749和ACCC30821;菌株ACCC30830、ACCC30831和CFCC87327处理后,第3至第7天杨干象幼虫的累积死亡率均显著 (P < 0.05) 或极显著 (P < 0.01) 高于菌株GIM3346、ACCC30749和ACCC30821。其他3株菌株处理后,杨干象幼虫的累积死亡率上升比较缓,7天内均低于35%。由此可见,对杨干象幼虫致病效果最好的是菌株CFCC87323,菌株ACCC30830次之。
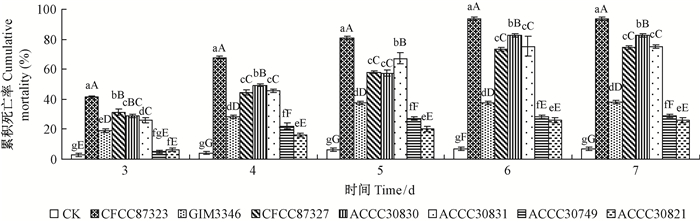
|
图 1 不同菌株处理杨干象幼虫累积死亡率的动态变化 Fig.1 Dynamic changes of cumulative mortality ofC. lapathi larvae treated by different fungal strains 大写字母差异极显著 (P < 0.01),小写字母差异显著 (P < 0.05), 下同。Capital letters indicate a very significant difference (P < 0.01), lowercase letters indicate a significant difference (P < 0.05), the same below. |
2) 不同菌株对杨干象幼虫的致死中时LT50 如表 2所示,杨干象幼虫用108 conidia·mL-1孢子悬浮液处理后,LT50小于4天的只有菌株CFCC87323,致死中时LT50为3.536天,说明该菌株对杨干象幼虫的致病速度最快。菌株ACCC30830、ACCC30831和CFCC87327对杨干象幼虫致死中时LT50依次为4.248,4.393,4.482天。
|
|
经菌株CFCC87323处理后,杨干象幼虫的校正死亡率达93.38%;菌株ACCC30830、ACCC30831和CFCC87327对杨干象幼虫的校正死亡率依次为81.46%,73.51%,72.85%;菌株GIM3346、ACCC30749和ACCC30821对杨干象幼虫的校正死亡率均低于35%。
综合不同菌株处理杨干象幼虫累积死亡率动态变化、校正死亡率与致死中时LT50,说明在本研究的菌株中,菌株CFCC87323对杨干象幼虫的致病效果最好,其次是菌株ACCC30830。
2.2 不同浓度高致病力菌株对杨干象幼虫致病力与致死中浓度LC50上述试验表明,菌株CFCC87323、ACCC30830、ACCC30831和CFCC87327对杨干象幼虫的校正死亡率均高于70%,因此,应用这4株白僵菌不同浓度孢子悬浮液处理杨干象幼虫。
1) 不同浓度菌株CFCC87323处理杨干象幼虫的累积死亡率及致死中浓度LC50 不同浓度菌株CFCC87323处理杨干象幼虫, 累积死亡率的动态变化见图 2。除在处理后第7天1.57×107与1.57×108 conidia·mL-1、1.57×106与1.57×107 conidia·mL-1处理间的累积死亡率差异不显著外,其他不同时间段、不同浓度处理间其累积死亡率均达到了差异显著性水平 (P < 0.05) 或极显著性水平 (P < 0.01)。

|
图 2 不同浓度菌株CFCC87323处理杨干象幼虫累积死亡率的动态变化 Fig.2 Dynamic changes of cumulative mortality ofC. lapathi larvae treated by different concentrations of strain CFCC87323 |
该菌株对杨干象幼虫的致死中浓度LC50在第7,6,5,4天分别为7.0×103, 5.5×104, 6.7×105, 1.0×107 conidia·mL-1(表 3)。
|
|
2) 不同浓度菌株ACCC30830处理杨干象幼虫的累积死亡率及致死中浓度LC50 不同浓度菌株ACCC30830处理杨干象幼虫累积死亡率的动态变化见图 3。除了在处理后第6天1.57×103与1.57×104 conidia·mL-1、第7天1.57×107与1.57×108 conidia·mL-1处理间累计死亡率差异不显著外,其他不同时间段、不同浓度处理间其累积死亡率均达到了差异显著性水平 (P < 0.05) 或极显著性水平 (P < 0.01)。
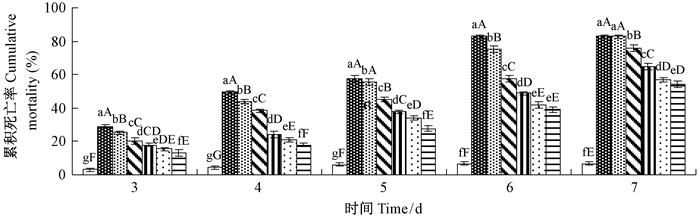
|
图 3 不同浓度菌株ACCC30830处理杨干象幼虫累积死亡率的动态变化 Fig.3 Dynamic changes of cumulative mortality ofC. lapathi larvae treated by different concentrations of strain ACCC30830 |
该菌株对杨干象幼虫的致死中浓度LC50在第7,6,5天分别为5.43×103,4.71×105,4.3×107 conidia·mL-1(表 4)。
|
|
3) 不同浓度菌株ACCC30831处理杨干象幼虫的累积死亡率及致死中浓度LC50 不同浓度菌株ACCC30831处理杨干象幼虫累积死亡率的动态变化见图 4。除了在处理后第3天1.57×104与1.57×103 conidia·mL-1处理间累积死亡率差异不显著外,其他不同时间段、不同浓度处理间其累积死亡率均达到了差异显著性水平 (P < 0.05) 或极显著性水平 (P < 0.01)。
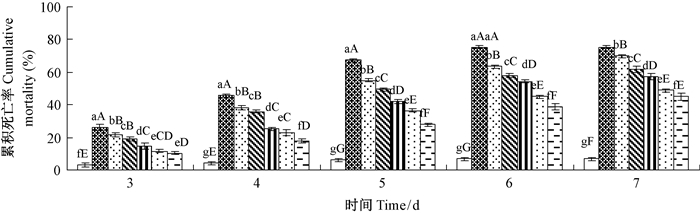
|
图 4 不同浓度菌株ACCC30831处理杨干象幼虫累积死亡率的动态变化 Fig.4 Dynamic changes of cumulative mortality ofC. lapathi larvae treated by different concentrations of strains ACCC30831 |
该菌株对杨干象幼虫的致死中浓度LC50d第7, 6, 5天分别为9.1×104, 4.4×105, 1.0×107 conidia· mL-1(表 5)。
|
|
4) 不同浓度菌株CFCC87327处理杨干象幼虫的累积死亡率及致死中浓度LC50 不同浓度菌株CFCC87327处理杨干象幼虫累积死亡率的动态变化见图 5。除了处理后第5天1.57×103和1.57×104 conidia·mL-1处理间的累积死亡率差异显著 (P < 0.05) 外,其他不同时间段、不同浓度处理间其累积死亡率均达到了差异极显著性水平 (P < 0.01)。
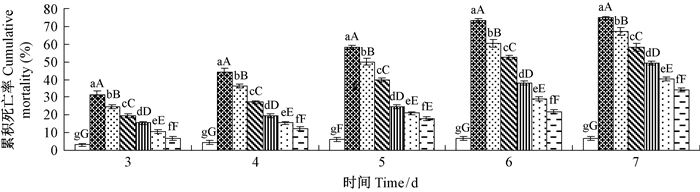
|
图 5 不同浓度菌株CFCC87327处理杨干象幼虫累积死亡率的动态变化 Fig.5 Dynamic changes of cumulative mortality ofC. lapathi larvae treated by different concentrations of strains CFCC87327 |
该菌株对杨干象幼虫的致死中浓度LC50在第7,6,5天别为1.0×106, 8.0×106, 1.5×108 conidia·mL-1(表 6)。
|
|
综合上述结果可知,菌株CFCC87323、ACCC30830、ACCC30831和CFCC87327对杨干象幼虫累积死亡率均随着孢子悬浮液浓度的增大而上升,说明这些菌株对杨干象幼虫的致病力与悬浮液浓度呈正相关。
从致死中浓度LC50结果可知,随着处理时间的延续, 致死中浓度LC50逐渐减小,剂量效应增强。
2.3 高致病力菌株感染杨干象幼虫的致病症状选用高致病力菌株CFCC87323接种杨干象幼虫并观察其致病特点,结果见图 6。杨干象幼虫接菌 (24.33±0.58) h后,虫体表面与正常幼虫相比没有明显变化 (图 6A);接菌 (47.67±1.53) h后,开始出现停止取食、反应迟钝等症状;接菌 (74.67±2.31) h后,幼虫开始出现死亡现象,刚死亡时虫尸柔软并有黑色斑点,虫体表面出现淡紫红色变色现象,随后虫尸变僵硬 (图 6B);接菌 (86.33±2.52) h后,体表开始长出白色菌丝 (图 6C);接菌 (93.67±3.21) h后,虫体长满菌丝 (图 6D)。从侵染到幼虫死亡变成僵虫再到虫体布满菌丝,这一侵染过程需4天时间,进一步验证了菌株CFCC87323对杨干象幼虫有很强的致病力。
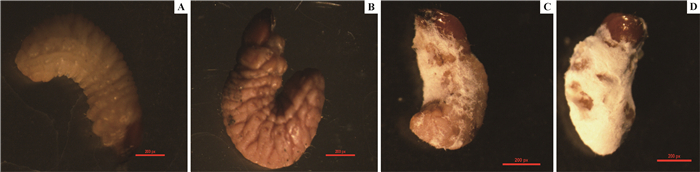
|
图 6 杨干象幼虫感染CFCC87323菌株外部形态变化 Fig.6 External morphological changes of C. lapathi larvae infected by CFCC87323 strains A.幼虫染病初期Early stage of infection; B.已变僵虫A dead worm;C.长出少量菌丝Small amount of hyphae grown from the body of C. lapathi;D.虫体长满菌丝Hyphae cover the whole body of C. lapathi. |
经过上述室内致病力测定试验,筛选出校正死亡率高于50%的白僵菌为菌株CFCC87323、ACCC30830、ACCC30831和CFCC87327,将这4株白僵菌分别以浓度为106,107,108 conidia·mL-1孢子悬浮液进行林间生防试验,结果见表 3。孢子悬浮液浓度为108 conidia·mL-1时,菌株CFCC87323致死率达79.33%,校正死亡率达77.62%,极显著高于其他菌株及对照 (P < 0.01);菌株ACCC30830致死率达68.67%,校正死亡率达66.06%,极显著高于菌株ACCC30831、CFCC87327及对照 (P < 0.01);菌株ACCC30831与CFCC87327致死率分别达61.67%,59.67%,校正死亡率分别达58.48%,56.32%,也极显著高于对照组 (P < 0.01)。
|
|
孢子悬浮液浓度为107 conidia·mL-1时,菌株CFCC87323致死率达70.67%,校正死亡率达68.23%,极显著高于其他菌株及对照 (P < 0.01);菌株ACCC30830、ACCC30831与CFCC87327致死率分别达53.33%,50.67%,49.33%,校正死亡率达49.46%,46.57%,45.13%,也均极显著高于对照 (P < 0.01)。
孢子悬浮液浓度为106 conidia·mL-1时,菌株CFCC87323致死率达57.33%,校正死亡率达53.79%,极显著高于其他菌株及对照 (P < 0.01);菌株ACCC30830、ACCC30831和CFCC87327致死率分别达41.67%,43%,38.67%,校正死亡率分别达36.82%,38.27%,33.57%,极显著高于对照 (P < 0.01)。
这说明菌株CFCC87323在林间对杨干象幼虫具有很强的致病力,并且致死率与孢子浓度呈正相关。菌株ACCC30830、ACCC30831和CFCC87327在林间对杨干象幼虫也有一定的致病力。
3 讨论杨干象对我国森林资源构成了严重威胁。为有效控制其危害,本研究选用6株白僵菌与1株绿僵菌菌株,分别在室内对杨干象幼虫进行致病力试验,综合比较这7株真菌菌株对杨干象幼虫的校正死亡率、致死中时LT50以及致病特点,发现菌株CFCC87323对杨干象幼虫的致病力最高。将菌株CFCC87323应用到林间进行生防试验发现,菌株CFCC87323对杨干象幼虫也有良好的致病效果。
本研究选用浓度为108 conidia·mL-1的菌株CFCC87323进行室内生物防治中,杨干象感染白僵菌第7天,校正死亡率达到93.38%,致死中时LT50为3.536天,致死中浓度LC50为7.0×103 conidia·mL-1;选用浓度为108 conidia·mL-1的菌株进行林间防治试验,幼虫致死率达79.33%,校正死亡率达77.62%。李亚杰等 (1980)采用喷干法,选用浓度为109 conidia·mL-1的白僵菌在林间防治杨干象幼虫,感染死亡率为72.94%;本试验筛选出的菌株CFCC87323对杨干象幼虫的致病力要优于上述研究的白僵菌菌株的致病力。邵国祥等 (1979)采用涂干法,选用浓度为50×108 conidia·g-1的白僵菌在林间防治杨干象幼虫,感染死亡率为88%,比本试验中CFCC87323菌株对杨干象幼虫的致病效果好,这可能是由于该研究应用的孢子浓度是本研究所用孢子浓度的50倍所致。Cavalcaselle (1975)研究表明,单独使用白僵菌悬浮液防治杨干象,死亡率仅为50%,而加入敌敌畏后,死亡率升至90%,此研究对杨干象的高致病力很大一部分原因来源于化学农药。与本试验使用的白僵菌悬浮液对杨干象的防治效果相比,Cavalcaselle使用的白僵菌对杨干象的防治效果相差很多。
从菌株CFCC87323对杨干象幼虫的致病特点上看,杨干象幼虫被该菌株侵染从出现明显症状到死亡变成僵虫需要 (74.67±2.31) h,到虫体布满菌丝需要 (93.67±3.21) h。这与菌株CFCC87323对杨干象幼虫的致死中时LT50基本一致,均表现出致死速度较快的特点,进一步验证了菌株CFCC87323对杨干象幼虫具有很好的致病效果。
选用浓度为108 conidia·mL-1的菌株ACCC30830、ACCC30831和CFCC87327进行室内致病力测定,校正死亡率分别为81.46%,73.51%,72.85%,致死中时LT50为4.248,4.393,4.482天;选用浓度为108 conidia·mL-1的菌株进行林间防治试验,校正死亡率分别为66.06%,58.48%,56.32%,说明菌株ACCC30830对杨干象幼虫的致病力仅次于菌株CFCC87323,菌株ACCC30831和CFCC87327对杨干象幼虫也表现出较好的致病效果,因此,可以进一步挖掘这3株菌株的应用潜力,在控制杨干象幼虫中发挥应有的作用。
菌株毒力受多种因素影响,如湿度、温度等 (何学友等,2011;Zhang et al., 2011)。对于控制蛀干害虫来说,另一个关键问题就是一定要确保分生孢子能与害虫接触。本研究测定的菌株CFCC87323在室内对杨干象幼虫的致病效果高于林间,这是由于林间环境比室内环境复杂,特别是环境的湿度小,不利于白僵菌分生孢子萌发;另外室内试验幼虫直接浸在分生孢子悬浮液中,而野外防治时是将白僵菌分生孢子悬浮液点涂到杨干象幼虫的排粪孔及坑道的外面,幼虫接触到分生孢子的概率远低于室内试验,导致菌株CFCC87323对杨干象幼虫林间与室内的侵染效果出现了一定差距。因此,在湿度较大的天气或降雨后使用白僵菌分生孢子悬浮液,并且尽可能将白僵菌分生孢子悬浮液涂入杨干象幼虫排粪孔中是提高白僵菌杀虫效果的关键。由于白天阳光足蒸发快,可选择在傍晚进行涂菌,以防止刚涂入的菌液蒸发变干,也可以通过增大孢子浓度和防治次数来提高对杨干象的控制效果。当然,对提高分生孢子在低湿度条件下的萌发能力与其他不利环境条件的适应能力尚需要进一步研究。
4 结论本研究筛选出的白僵菌菌株CFCC87323对杨干象幼虫致病力最高,ACCC30830次之,菌株ACCC30831和CFCC87327对杨干象幼虫也表现出较好的致病效果。本研究为安全有效地控制杨干象种群及其危害探索出了一条新途径,相关菌株在开发生物杀虫剂与杨干象生物防治方面具有广阔的应用前景。
| [] |
蔡建文, 孙玉峰, 周国庆, 等. 2000. 应用微胶囊剂防治杨干象幼虫. 林业科技, 25(1): 29–30.
( Cai J W, Sun Y F, Zhou G Q, et al. 2000. Cryptorrhynchus lapathi L. control with microcapsule dose. Forestry Science & Technology, 25(1): 29–30. [in Chinese] ) |
| [] |
高瑞桐. 2003. 杨树害虫综合防治研究. 北京: 中国林业出版社: 118-120.
( Gao R T. 2003. Research for integrated controlon poplar pests. Beijing: China Forestry Publishing House: 118-120. [in Chinese] ) |
| [] |
何学友, 蔡守平, 童应华, 等. 2011. 球孢白僵菌和金龟子绿僵菌不同菌株对黑足角胸叶甲成虫的致病力评价. 昆虫学报, 48(6): 975–981.
( He X Y, Cai S P, Tong Y H, et al. 2011. Pathogenicity evaluation of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae against adults of Basilepta melanopus(Coleoptera: Eumolpidae). Acta Entomologica Sinica, 48(6): 975–981. [in Chinese] ) |
| [] |
何学友, 陈顺立, 黄金水. 2005. 感染松墨天牛的金龟子绿僵菌菌株的初步筛选. 昆虫学报, 48(6): 975–981.
( He X Y, Chen S L, Huang J S. 2005. Preliminary screening of virulent strains of Metarhizium anisopliae against Monochamus alternatus. Acta Entomologica Sinica, 48(6): 975–981. [in Chinese] ) |
| [] |
胡秀芝, 康廷芝, 周建森. 2001. 蛀干害虫杨干象甲幼虫的防治试验. 中国林副特产(1): 7.
( Hu X Z, Kang T Z, Zhou J S. 2001. Experimental study of the prevention and control of Cryptorrhynchus lapathi. Quarterly of Forest By-product and Speciality in China(1): 7. [in Chinese] ) |
| [] | 李国伟, 王金华, 宋彩民, 等. 2011. 树干注药防治杨干象效果. 北华大学学报:自然科学版, 12(3): 330–333. |
| [] | Li G W, Wang J H, Song C M, et al. 2006. Trunk injection of pesticides to Combat Crrptorrhynchus lapathiL. Journal of Beihua University:Natural Science, 12(3): 330–333. |
| [] |
李建庆, 张永安, 梅增霞, 等. 2006. 白僵菌和绿僵菌蛋白对松墨天牛致病性的研究. 福建林学院学报, 26(2): 165–168.
( Li J Q, Zhang Y A, Mei Z X, et al. 2006. Pathogenicity of entomogenous fungi proteins to Monochamus alternatus. Journal of Fujian College of Forestry, 26(2): 165–168. [in Chinese] ) |
| [] |
李林青, 吴昊, 赵玉欣. 2005. 松褐天牛成虫高毒力菌株的筛选试验. 山东林业科技(1): 35–36.
( Li L Q, Wu H, Zhao Y X. 2005. The screening high virulent strain to Monochamus alternatus. Journal of Shandong Forestry Science and Technology(1): 35–36. [in Chinese] ) |
| [] |
李亚杰, 钟兆康. 1980. 应用白僵菌防治杨干象虫试验. 陕西林业科技(1): 81–82.
( Li Y J, Zhong Z K. 1980. Experimental study of the prevention and control of Cryptorrhynchus lapathi. Shaanxi Forest Science and Technology(1): 81–82. [in Chinese] ) |
| [] |
苗建才, 迟德富, 郝然喜. 1994. 灭幼脲对杨干象作用机制和防治的研究. 林业科学, 30(4): 325–331.
( Miao J C, Chi D F, Hao R X. 1994. Chlorbenzuron of mechanism of action and concrol for Cryptorrhynchus lapathiL. Scientia Silvae Sinicae, 30(4): 325–331. [in Chinese] ) |
| [] |
苗建才, 迟德富, 李清宇, 等. 1990. 氧乐果微胶囊剂的制备及防治杨干象的研究. 东北林业大学学报, 18(4): 35–41.
( Miao J C, Chi D F, Li Q Y, et al. 1990. Preparation of omethoate microcapsulated pesticides and contol Cryptorrhynchus lapathiL. Journal of Northeast Forestry University, 18(4): 35–41. [in Chinese] ) |
| [] |
蒲蜇龙, 李增智. 1996. 昆虫真菌学. 合肥: 安徽科学技术出版社.
( Pu Z L, Li Z Z. 1996. Insect mycology. Hefei: Anhui Science and Technology Publishing House. [in Chinese] ) |
| [] |
邵国祥, 郭春青. 1979. 白僵菌防治杨干象鼻虫试验. 新农业, 17.
( Shao G X, Guo C Q. 1979. Experimental study of the prevention and control of Cryptorrhynchus lapathi by Beauveria bassiana. New Agricultural, 17. [in Chinese] ) |
| [] |
孙向文, 田凤兰, 潘宏阳, 等. 1999. 高渗透有机磷杀虫剂毒杀杨干象幼虫的研究. 森林病虫通讯(1): 19–21.
( Sun X W, Tian F L, Pan H Y, et al. 1999. Research on high-penetration organophosphorous pesticide poison Cryptorrhynchus lapathi L. Forest Pest and Disease(1): 19–21. [in Chinese] ) |
| [] |
童应华, 陈顺立, 林强. 2010. 感染萧氏松茎象的金龟子绿僵菌菌株的初步筛选. 林业科学, 46(1): 169–174.
( Tong Y H, Chen S L, Lin Q. 2010. Preliminary screen of virulent strains of Metarhizium anisopliaeagainst Hylobitelus xiaoi. Scientia Silvae Sinicae, 46(1): 169–174. [in Chinese] ) |
| [] |
王素英, 邹立杰, 时亚琴, 等. 2000. 球抱白值菌加增效剂对光肩星天牛的防治效果. 中国生物防治, 16(2): 96–97.
( Wang S Y, Zou L J, Shi Y Q, et al. 2000. Effect of control Anoplophora glabripennis with Beauveria bassiana. Chinese Journal of Biological Control, 16(2): 96–97. [in Chinese] ) |
| [] |
王四宝, 黄勇平, 张心团, 等. 2004. 松褐天牛成虫高毒力病原真菌筛选及林间感染试验. 中国森林病虫, 23(6): 13–16.
( Wang S B, Huang Y P, Zhang X T, et al. 2004. Screening and biological control of high virulent strains against Monochamus alternatusadult. Forest Pest and Disease, 23(6): 13–16. [in Chinese] ) |
| [] | Cavalcaselle B. 1975. Possibility of using products based on Beauveria bassiana (Bals.) Vuill. against the larvae of some wood-eating insects. Mededelingen van de Faculteit Land bouwwetenschappen Rijksuniversiteit Gent, 437-442. |
| [] | Chung T C, Sun C N, Hung C Y. 1982. Resistance of Nilaparvata lugens to six insecticides in Taiwan. Journal of Economic Entomology, 75(2): 199–200. DOI:10.1093/jee/75.2.199 |
| [] | Dubois T. 2003. Biological control of the Asian longhoned beetle, Anoplophora glabripennis, with entomopathogenic fungi. Comell: Comell University. |
| [] | Dubois T, Hajek A E, Hu J F, et al. 2004. Evaluating the efficiency of entomopathogenic fungi against the Asian longhorned beetle, Anoplophora glabripennis (Coleoptera:Cerambyeidae), by using cages in the field. Environmental Entomology, 33(1): 62–74. DOI:10.1603/0046-225X-33.1.62 |
| [] | Goettel M S, Johnson D L. 1992. Environmental impact and safety of fungal biocontrol agents//Lomer C J, Prior C. Biological Control of Locusts and Grasshoppers. CAB International, Wallingford, 356-361. |
| [] | Roberts D W, Leger R J S. 2004. Metarhiziumspp., cosmopolitan insect-pathogenic fungi: mycological aspects. Advances in Applied Microbiology, 54: 1–70. DOI:10.1016/S0065-2164(04)54001-7 |
| [] | Shimazu M. 2004. Effects of temperature on growth of Beauveria bassianaF-263, a strain highly virulent to the Japanese pine sawyer, Monochamus alternatus, especially its tolerance to high temperatures. Applied Entomology and Zoology, 39(3): 469–475. DOI:10.1303/aez.2004.469 |
| [] | Shimazu M, Sato H. 2003. Effeets of larval age on mortality of Monochamus alternatus Hope (Coleoptera:Cerambyeidae) after application of nonwoven fabric strips with Beauveria bassiana. Applied Entomology and Zoology, 8(1): 1–5. |
| [] | Zhang L W, Liu Y J, Yao J, et al. 2011. Evaluation of Beauveria bassiana (Hyphomycetes) isolates as potential agents for control of Dendroctonus valens. Insect Science, 18(2): 209–216. DOI:10.1111/j.1744-7917.2010.01361.x |
 2017, Vol. 53
2017, Vol. 53

