文章信息
- 钟远标, 岳晋军, 楼崇, 袁金玲, 顾小平
- Zhong Yuanbiao, Yue Jinjun, Lou Chong, Yuan Jinling, Gu Xiaoping
- 麻竹的花器官与繁育系统
- Floral Organ and Breeding System of Dendrocalamus latiflorus
- 林业科学, 2017, 53(1): 1-10
- Scientia Silvae Sinicae, 2017, 53(1): 1-10.
- DOI: 10.11707/j.1001-7488.20170101
-
文章历史
- 收稿日期:2016-01-14
- 修回日期:2016-03-08
-
作者相关文章
2. 南方现代林业协同创新中心 南京 210037;
3. 南京林业大学生物与环境学院 南京 210037
2. Co-Innovation Center for Sustainable Forestry in Southern China Nanjing 210037;
3. College of Biology and the Environment, Nanjing Forestry University Nanjing 210037
植物的繁育系统是指直接影响后代遗传组成的所有有性特征,主要包括花综合特征、花各性器官寿命、花开放式样、自交亲和程度和交配系统(Wyatt, 1983),对植物繁育系统的研究是了解植物生活史及进化过程的关键。竹类植物有着开花周期长、开花时间不固定、开花地点不可预测以及花后植株死亡的特点,这导致人们对竹子繁育系统的认识极为有限。此外,近年来开展杂交育种对竹类植物进行遗传改良已成为业界关注的热点(张光楚等, 1986; 宁材强等, 1995; 袁金玲等, 2005),若要掌握正确的授粉时机和授粉技术,提高杂交的成功率,繁育系统的研究也是育种工作必不可少的前提与基础。以往国内外对于竹子的开花研究,多数都将重点关注于竹种的开花和结实现象、开花周期(张文燕等, 1989; 1992; 杜凡等, 2000)、开花生物学特性(Nadgauda et al., 1993; Huang et al., 2002; Ramanayake et al., 2003; 邢新婷等, 2005; 林新春等, 2010; 袁金玲等, 2011) 和花粉特性(张文燕等, 1990; 林树燕等, 2008; 刘倩倩等, 2012; 王青等, 2012) 等方面,少见有对繁育系统较深入和全面的研究报道。本研究以我国南方重要的经济竹种——麻竹(Dendrocalamus latiflorus) 为材料,试图对其繁育系统进行较全面的系统剖析,以期为麻竹及其他竹种的杂交育种提供技术指导,同时也为竹类植物适应环境的进化机制和多样性研究提供理论参考。
1 材料与方法 1.1 材料来源与研究地概况开花麻竹来源于福建竹产区,后移植于浙江省杭州市中国林业科学研究院亚热带林业研究所试验苗圃。苗圃所在地为亚热带季风气候,夏季平均气温26.5 ℃,冬季平均气温6.4 ℃,年平均降雨量1 457.8 mm,雨日152.3天,日照1 663.2 h。红壤。考虑到富阳冬季低温对试验材料的不利影响,冬季盖大棚保温,待第2年温度回升后揭去大棚。
1.2 研究方法 1.2.1 假小穗的解剖结构随机选取全部花药已开放的成熟假小穗50个,测量假小穗的长与宽;解剖后,记录每一假小穗基部的颖片、潜伏芽及花朵数等。
1.2.2 假小穗上不同部位小花的发育进程选取花序轴上不同发育大小的麻竹假小穗,每一大小级别的假小穗至少3个,对每一假小穗进行解剖,测量假小穗上所有小花的雌蕊长和花药长,按上(顶部2~3朵小花)、中(中部3~4朵小花)、下(基部2~3朵小花) 分别统计,计算假小穗上不同部位小花的发育进程。
1.2.3 花的开放动态选择开花盛期的竹株,从上、中、下各选1个花枝,在基部苞片发黄即将脱落时,开始观察花枝各节最先发育的假小穗,记录小花的开放动态,包括每朵小花的柱头和花药从稃片内伸出的时间和开放过程,直至假小穗上全部小花完成开放。
1.2.4 柱头可授性检测采用联苯胺-过氧化氢法(Dafni et al., 1998)。选择即将伸出柱头的小花,套袋防止授粉。并从柱头露出的第1天开始,对标记的柱头进行可授性检测,每天测定10个柱头,直至柱头萎缩枯死。期间若遇袋内假小穗花药开放,则待花药露出未散粉时及时清除,以免柱头先期授粉。
采用苯胺蓝染色荧光显色法观察花粉在柱头上的萌发,具体参照胡适宜(1994)的方法并做修改。对不同伸出天数未授粉的柱头授同一植株的花粉,2 h后取整个雌蕊,用Carnoy固定液[无水乙醇:乙酸=3:1(体积比)]固定1 h,然后经50%,30%,10%的梯度酒精换至蒸馏水中洗净(每级5 min),加适量的苯胺蓝溶液(0.05%苯胺蓝+0.15 mol·L-1磷酸钾) 进行染色,1.5 h后常规压片,用荧光显微镜观察拍照。
1.2.5 花粉萌发率及储藏寿命花粉的活力采用悬滴培养法(叶宝兴等, 2011) 测定。培养基配方经预试验,选定为质量分数15%的蔗糖+质量分数0.001%的硼酸的液体培养基。由于预试验发现,0 ℃以下的低温和超低温处理,麻竹花粉在0.5 h内活力会完全散失,所以本试验不选择0 ℃以下的温度处理。有关储藏寿命,共设置5个处理: 1) 花药4 ℃低温;2) 花粉4 ℃低温;3) 花粉硅胶干燥;4) 花粉4 ℃低温+硅胶干燥;5) 花粉常温(对照) 贮藏。每个处理设3次重复,每重复统计5个视野,每个视野内总花粉数不少于50,以花粉管长度大于或等于花粉直径作为花粉已萌发的标准。
1.2.6 杂交指数与花粉-胚珠比杂交指数(outcrosssing index, OCI) 的估算参照Dafni (1992)的评判标准。观测的指标有:花朵或花序直径、花药散粉与柱头可授期之间的时间间隔、柱头与花药的空间位置等。
单花花粉量的检测:据观察,麻竹花药散粉时可完全将花粉散出。根据这一特点,取单花将散粉的全部花药置于1 mL离心管中,置于30 ℃烘箱待其完全散粉后加入0.5 mL 50%的酒精,充分震荡,分取1 μL花粉悬浊液于凹面载玻片上,计数花粉的数量,重复6次,随机检测5朵小花的花粉数量。单花胚珠数的检测:采用常规石蜡切片法,随机检测5朵小花的胚珠数。单花的花粉量与胚珠数之比即为花粉-胚珠比(pollen-ovule ratio, P/O)。
2 结果与分析 2.1 麻竹花器官的形态特征对麻竹植株开花前后的动态观察发现,麻竹开花时,枝条上先出现变异型小叶,植株由营养生长开始转为生殖生长。原先应发育为营养轴(枝条) 的潜伏芽转而分化为仍带有节和节间的花序轴,或直接分化为小穗。花序轴各节部也分化小穗(图 1A)。除花序轴顶端的小穗外,其他各节生长的小穗基部第1~3颖片内有潜伏芽(图 1B),当小穗发育到达一定阶段后,潜伏芽可再萌生出小穗,续次发生,环绕于节部生长呈半轮生状。在竹类植物中,这种续次发生的小穗被称为“假小穗”。麻竹发育成熟的假小穗长17~20 mm,宽9~11 mm。每一假小穗萌生7~10朵小花(多为8朵),交互排列于小穗轴上。每一小花由外稃1片、内稃1片、雄蕊6枚和雌蕊1枚组成。雌蕊柱头单一,先端1~3裂,密被白色微毛。

|
图 1 麻竹花器官形态特征 Fig.1 The floral morphology of Dendrocalamus latiflorus A:不同级别花序轴上的假小穗; B:假小穗基部的颖片(1, 2, 3, 4) 和潜伏芽(a, b, c); C:成熟种子(1) 和未发育种子(2, 3)。 A: The pseudospikelet on the different levels of nutrition rachis; B: The glumes (1, 2, 3, 4) and latent buds (a, b, c) at the base of pseudospikelet; C: The matured seed (1) and the undeveloped seeds (2, 3). |
自然状态下麻竹假小穗萌生的7~10朵小花,通常只有顶端的小花能结出成熟种子,以下的小花不结实,或结实后发育不良(图 1C)。
2.2 麻竹的开花动态据资料记载(杜凡等, 2000) 和实地考察,麻竹为不定期、零星开花竹种。以丛为单位,从出现开花征兆,到部分枝条开花,再逐渐蔓延至单株或整丛,直至花后竹株枯萎死亡,一般会延续3~5年。麻竹的开花季节并不固定,但盛花期大体与麻竹的抽枝换叶期同步。观测开花竹株花序的开花顺序,未发现有明显的从下到上或从内到外等的规律。这显然与竹株上各部位存在的各级潜伏芽(发育为主枝、侧枝或小枝) 都可分化成花序或假小穗,而且又无先后次序等规律可循有关;另外,发生在不同级别营养轴(秆、枝条) 之节上的假小穗由于发育进程不同,而且假小穗基部存在潜伏芽又可续次发育产生第2、第3、…等不同批次假小穗,造成整个花期陆续都有假小穗成熟、开花,及开花次序在竹丛和竹株层面的无规律现象。
为探讨小穗层面花的发育进程,对麻竹假小穗上不同部位小花的发育进程和花开放过程进行了测定、观察。
2.2.1 假小穗上不同部位小花的发育进程将同一花序轴上不同发育大小的假小穗按上、中、基部,测量不同部位小花的雌蕊长度见图 2。可以发现,当假小穗长度﹤0.95 cm时,雌蕊长度的大小顺序为基部>中部>上部;当假小穗长度﹥1.25 cm后,雌蕊的长度大小顺序变为上部>中部>基部。这表明:假小穗上各部位小花的雌蕊发育是按基部→中部→上部的顺序逐步推进,但随着假小穗的生长,后发育的上部小花雌蕊反而超过了先发育的基部小花雌蕊。
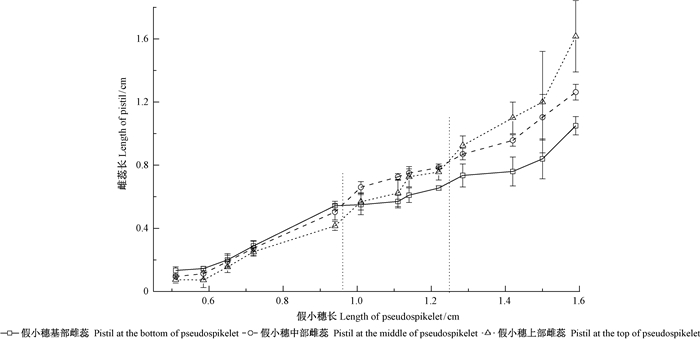
|
图 2 假小穗不同部位雌蕊的长度随假小穗增长的变化 Fig.2 The length of the pistil on the different part of pseudospikelet changing with pseudospikelet growth |
图 3显示的是同一假小穗不同部位花药的长度随假小穗增长的变化。可以看出,花药的发育也有着与雌蕊发育相同的生长规律。
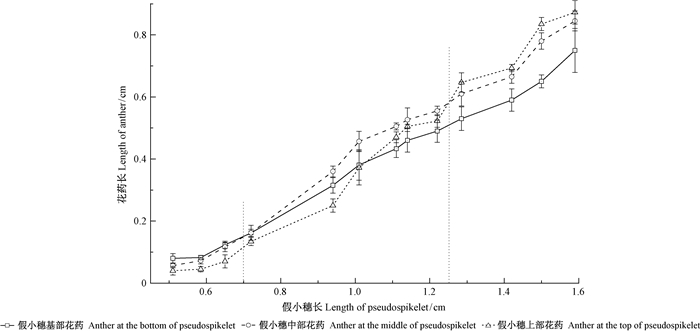
|
图 3 假小穗不同部位花药的长度随假小穗增长的变化 Fig.3 The length of anther on the different part of pseudospikelet changing with pseudospikelet growth |
由此可见,麻竹假小穗上不同部位小花的发育进程是按基部到顶部的顺序依次进行的,但随着假小穗的生长,后发育的小花却比先发育的小花生长加快。
2.2.2 假小穗上不同部位小花的开放过程对假小穗上不同部位小花的动态观察结果显示:同一假小穗上,小花是按从上到下的顺序依次开放。这与其发育进程的测定结果相吻合,即假小穗上部后启动的小花在发育速度上比下部小花快,会率先达到成熟并开放。假小穗上从第1朵小花开放至全部小花完成开放大约需要5~7天,且雌雄异熟,雌蕊先于雄蕊1~4天成熟。
假小穗上最先是由顶端小花的柱头从稃片内伸出(图 4A),但其全部伸出需要2~5天(多为3天和4天),期间,向下的第2~3或4朵小花的柱头依次从稃片内伸出。但假小穗中、下部小花的柱头通常不伸出,即便伸出,柱头也是短且纤细,多为发育不良(图 4B)。

|
图 4 假小穗的发育进程 Fig.4 The development process of pseudospikelets A:最顶端柱头伸出;B:上部3个全部伸出的柱头和1个纤细柱头(箭头所示);C:顶端花药开放;D:竹株开花后期花药的开放;E:竹株后期开裂于稃片内的花药。 A: The top stigma exerted; B: Three fully exerted stigmas and a slender stigma (indicated by the arrows); C: The blooming anther on the top; D: The not fully exerted anther in the late flowering; E: The anther dehisced in the glume in the late flowering. |
柱头完全伸出后,花药并不立即开放,通常有1~4天的间歇期,其开放顺序也是从顶端小花到基部小花的顺序推进(图 4C)。假小穗上全部小花的花药1~3天内开放完毕。单花花药在一个上午即完成开放,随后柱头逐渐枯萎,稃片成褐色。
竹株后期发育的假小穗,开花动态与前期和盛期有所不同。通常伸出的柱头短且纤细,表面微毛稀少,花药开放时也只伸出一半(图 4D),基部花药一般不开放,裂于稃片内(图 4E)。这表明:麻竹开花后期,柱头发育不良,花药散粉不畅,有可能造成麻竹在后期的结实率明显低于前期和盛期。
2.3 麻竹柱头的可授性麻竹柱头从开始伸出至死亡大约为7天。为了探讨育种过程中柱头最合适的授粉时机,采用联苯胺-过氧化氢法对不同伸出天数的柱头进行了可授性测定(表 1)。从表 1中可以看出,麻竹柱头可授期大约为6天。从稃片内伸出后的1~3天,柱头可授性逐渐增强,第3~4天可授性最强,随后逐渐减弱,7天后全部萎缩,不再具有可授性。
|
|
利用苯胺蓝荧光显色法观察花粉在柱头上的萌发(图 5) 也显示了同样的结果。柱头伸出的第1天,花粉萌发良好,说明此时柱头已具有可授性;第3~4天,花粉在柱头上大量萌发,说明此时可授性最强;到第6天,柱头上只有少量花粉萌发,说明此时可授性减弱。因此,若要进行杂交育种,应选择麻竹柱头伸出后即刻进行人工授粉,以尽量避免裸露的柱头接受自交花粉。

|
图 5 花粉在柱头上萌发的荧光显色 Fig.5 The observation of pollen grains germinating on the stigma by epifluorescence microscopy |
与其他竹类植物相比,麻竹的可授期相对较长。如牡竹(Dendrocalamus strictus) 可授期为3~4天(Nadgauda et al., 1993),篌竹(Phyllostachys nidularia)、水竹(Phyllostachys heteroclada) 和灰竹(Phyllostachys nuda) 可授期为1天左右(Huang et al., 2002),异叶苦竹(Arundinaria simonii f. heterophylla) 可授期只有3~5 h (林树燕等, 2013),鹅毛竹(Shibataea chinensis) 的柱头则不具可授性(林树燕等, 2013)。
2.4 麻竹花粉的萌发率及储藏寿命为探讨竹子异地开花、携带麻竹花粉开展杂交育种的可行性,将采集的花粉和花药进行常温、低温(4 ℃) 和干燥(硅胶) 等不同处理,测定了不同储藏时间的花粉萌发率(图 6)。麻竹新鲜花粉的萌发率为27.0%±11.4%,高时可达54.6%,常温条件下,花粉活力在36 h内迅速下降,萌发率会降至3.0%;若采用4 ℃低温储藏,则没发现有改善花粉寿命的效果;采用硅胶干燥处理,花粉活力在短时间内即出现大幅度下降,其寿命仅剩8 h左右。这表明:无论是4 ℃低温还是适度干燥处理,对改善花粉的储藏活力均无积极效果。但若采用花药,在4 ℃低温下贮藏,则花粉活力和寿命均出现一定程度改善(图 6)。张光楚(1986)也曾报导用毛竹花药在4 ℃冰箱中保存,5天后尚可授粉利用的结果。不过,即便如此,对麻竹而言,48 h后的花粉活力降到4.7%左右,也很难满足远距离携带,开展杂交育种。因此,在实际授粉操作中,若以麻竹作为父本,则应尽量在花药散粉后当天完成授粉为宜。
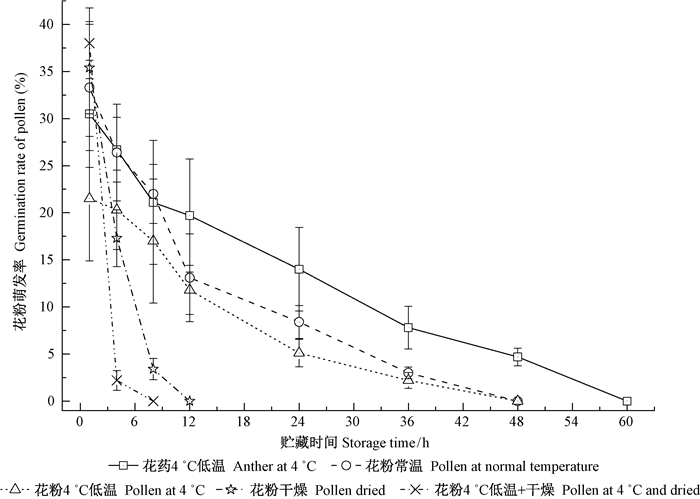
|
图 6 不同贮藏条件下花粉萌发率随时间的变化 Fig.6 The germination rate of pollen under different treatments changing with time |
根据Dafni (1992)的评判标准,可得出麻竹的杂交指数(OCI) 估算值为4(表 2)。同样如果依据该标准判断(当OCI=0时,繁育系统为闭花受精;当OCI=1时,繁育系统为专性自交;当OCI=2时,繁育系统为兼性自交;当OCI=3时,繁育系统为自交亲和,有时需要传粉者;当OCI=4时,繁育系统为部分自交亲和,异交,需要传粉者),则麻竹的繁育系统即为部分自交亲和,异交,需要传粉者。所谓“部分自交亲和”,表明麻竹在自然状态下能够开花结实;而“异交”则说明麻竹自然授粉时倾向于接受异花花粉,但在传粉过程中需要借助传粉者。
|
|
麻竹花粉-胚珠比(P/O) 的估算值为19 350~42 889(表 3)。依据Cruden (1977)的评判标准(P/O为2.7~5.4时,繁育系统为闭花受精;P/O为18.1~39.0时,繁育系统为专性自交;P/O为31.9~396.0时,繁育系统为兼性自交;P/O为244.7~2 588.0时,繁育系统为兼性异交;P/O为2 108.0~195 525.0时,繁育系统为专性异交),麻竹的繁育系统为专性异交。P/O表示的是交配系统自交和异交程度的大小,P/O越小,倾向自交,P/O越大,倾向异交。麻竹的P/O较大,倾向异交。
|
|
综合以上结果可知,麻竹的繁育系统以异交为主,部分自交亲和。
3 讨论耿伯介(1986)曾指出,“当我们论及禾本科(Gramineae) 植物的花序时,首先应注意:这里不像一般被子植物那样是以花来组成花序的,而是改用小穗来作为禾本科花序的基本单位”。麻竹为续次发生花序,若以假小穗为基本单位来观察花在花序轴或整个竹株层面的开放次序,则如前所述,由于假小穗可在不同级别的营养轴上发生,基部潜伏芽又可续次产生不同批次小穗,造成各假小穗的发育进程存在明显差异,并且又毫无规律,所以在花序轴上并没发现有特定的开花顺序。但如果以小花为基本单位来观察花在假小穗层面的开放次序,则可明显发现,麻竹小花的开放是从假小穗的顶端开始,逐渐向基部小花延伸的。这一观察结果与作者以往对孝顺竹(Bambusa multiplex)(袁金玲等, 2011) 及林新春等(2010)对雷竹(Phyllostachys violascens) 和李晓芬等(2009)对紫竹(Phyllostachys nigra) 开花的研究结果并不一致。同样是续次发生花序,孝顺竹和雷竹假小穗上的小花是从基部开始向上发展的,而紫竹假小穗上的小花一般中间的先开。同样无法理解的是,通常被子植物的无限花序其顶端保持了旺盛的生长能力,能不断产生新的花芽,形成了边分化边开放、从基部向上发展的开花顺序,而竹类植物的小穗是“假小穗”,与一般被子植物的无限花序在顶端保留生长点不同,其生长点存在于假小穗基部,可继续发育新的假小穗。原假小穗在开花前就已形成了固定数目的小花,应该不存在边分化花芽边开花的现象。本试验对麻竹假小穗上小花发育进程的观测,以及假小穗中下部小花发育不良和通常只有顶端小花能结实的现象,也都从不同角度证实了麻竹小花在小穗上的开放是按自上而下的顺序进行的。表明同属续次发生花序的各竹种,在假小穗层面上花的发育进程也存在开放模式的多样性。
对麻竹繁育系统的研究得到的结果是“异交为主,部分自交亲和”,与前人已报道的牡竹(Nadgauda et al., 1993)、梨竹(Melocanna baccifera)(Ramanayake et al., 2003)、篌竹、水竹和灰竹(Huang et al., 2002)、异叶苦竹(林树燕等, 2013) 等的结果大体相同。但需要指出的是,竹类植物与其他高等植物不同,物种的繁衍主要靠无性繁殖,看似2株(丛) 独立存在的个体,也不能排除早先是由同一无性系克隆产生的个体,或由地下竹鞭串联的同一个体。且竹子的零星同期开花现象最有可能发生在遗传背景一致的同一无性系,如同丛、同鞭系等,因此,看似异株间的授粉,也极有可能是具相同基因型个体间的交配。由此可见,实际过程中,竹类植物的结实由自交产生的概率还是挺大的,生产上常常采收自然繁殖的种子用于大面积造林,还需充分考虑“近交衰退”的危害。
目前多数资料显示,已开花的竹子当中,要么不结实,要么结实率偏低(张文燕等, 1989; 1992; 杜凡等, 2000)。有学者认为,这与竹类植物的花粉活力偏低有关(张文燕等, 1990; 1992; 林树燕等, 2008)。本研究中,麻竹新鲜花粉的萌发率高时可达50%以上,苯胺蓝荧光显色也发现花粉在柱头上具良好的萌发效果;另外,麻竹柱头可授性良好,且可授期长达5天。因此认为麻竹开花结实率低与其花粉活力和柱头可授性可能无关联。野外观察所发现的麻竹小穗上只有上部3~4朵小花的柱头能正常伸出稃片外,中、下部小花和开花后期发育的小花,其柱头往往生长不良或无法伸出稃片外,造成授粉率不高,这应该是结实率偏低的一个重要原因。另外如上所述,竹类植物自交的概率较大,而自交可能存在的自交不亲和现象,或许也是影响零星开花竹株结实率低的一大原因,尚待进一步研究。
4 结论1) 麻竹开花时叶片脱落,整个花期处于一个营养消耗的过程,到开花后期,植株体内消耗了大量的营养,以致柱头发育不良、花药散粉不畅,这有可能造成麻竹在后期的结实率会明显低于前期和盛期,故杂交育种试验应在开花前期或盛期进行。
2) 麻竹花粉不易贮藏,柱头从稃片内初露时可授性即良好。因此,在杂交育种中,若将麻竹作为父本,应在花药散粉的当天完成授粉,若作为母本,应在柱头伸出的第1天就进行授粉为宜。
3) 麻竹的繁育系统为“异交为主,部分自交亲和”,但考虑到竹子同期零星开花最有可能发生在遗传背景一致的同一无性系,因此异株间的授粉也极有可能是具相同基因型个体间的交配,故竹子的有性繁殖应充分关注“近交衰退”现象。
| [] |
杜凡, 薛嘉榕, 杨宇明, 等. 2000. 15年来云南竹子的开花现象及其类型研究. 林业科学, 36(6): 57–68.
( Du F, Xue J R, Yang Y M, et al. 2000. Study on flowering phenomenon and its type of bamboo in Yunan in past fifteen years. Scientia Silvae Sinicae, 36(6): 57–68. [in Chinese] ) |
| [] |
耿伯介. 1986. 试论竹类的花序及其演变. 武汉植物学研究, 4(4): 323–336.
( Geng Paichieh. 1986. A preliminary study of the inflorescence type arising from bamboos and its variation. Journal of Wuhan Botanical Research, 4(4): 323–336. [in Chinese] ) |
| [] |
胡适宜. 1994. 植物胚胎学实验方法(五):检查花粉在柱头上萌发和花粉管在花柱中生长的制片法. 植物学通报, 11(2): 58–60.
( Hu S Y. 1994. Method of preparation of slides used to examine the pollen germination on the stigma and pollen tube growth in the style. Chinese Bulletin of Botany, 11(2): 58–60. [in Chinese] ) |
| [] |
李晓芬, 林新春, 时燕, 等. 2009. 紫竹开花生物学特性观察及花粉生活力测定. 林业科技开发, 23(6): 64–67.
( Li X F, Lin X C, Shi Y, et al. 2009. Flowering biological characteristics and pollen viability of Phyllostachys nigra. China Forestry Science and Technology, 23(6): 64–67. [in Chinese] ) |
| [] |
林树燕, 丁雨龙, 张昊. 2008. 5种竹子花粉萌发率及开花特性. 林业科学, 44(10): 159–163.
( Lin S Y, Ding Y L, Zhang H. 2008. Pollen germination percentage and the floral character of five bamboo species. Scientia Silvae Sinicae, 44(10): 159–163. [in Chinese] ) |
| [] |
林树燕, 丁雨龙. 2013. 鹅毛竹与异叶苦竹的繁育系统研究. 南京林业大学学报:自然科学版, 37(3): 1–5.
( Lin S Y, Ding Y L. 2013. Studies on the breeding system in Shibataea chinensis and Arundinaria simonii f. heterophylla. Journal of Nanjing Forestry University: Natural Science Edition, 37(3): 1–5. [in Chinese] ) |
| [] |
林新春, 袁晓亮, 林绕, 等. 2010. 雷竹开花生物学特性研究. 福建林学院学报, 30(4): 333–337.
( Lin X C, Yuan X L, Lin R, et al. 2010. Studies on floral biology of Phyllostachys violascens. Journal of Fujian College of Forestry, 30(4): 333–337. [in Chinese] ) |
| [] |
刘倩倩, 徐一帆, 林新春, 等. 2012. 雷竹花粉萌发率及贮藏方法研究. 福建林学院学报, 32(2): 146–150.
( Liu Q Q, Xu Y F, Lin X C, et al. 2012. Pollen germination and storage of Phyllostachys violascens. Journal of Fujian College of Forestry, 32(2): 146–150. [in Chinese] ) |
| [] |
宁材强, 戴启惠. 1995. 撑篙竹×大绿竹杂交选育的研究. 广西林业科学, 24(4): 167–168.
( Ning C Q, Dai Q H. 1995. Studies on the crossbreeding of Bambusa pervariabilis and Dendrocalamopsis daii. Guangxi Forestry Science, 24(4): 167–168. [in Chinese] ) |
| [] |
王青, 彭祚登, 郭起荣, 等. 2012. 毛竹花粉活力测定及其适宜保存条件研究. 竹子研究汇刊, 31(1): 23–26, 32.
( Wang Q, Peng Z D, Guo Q R, et al. 2012. Pollen vitality test and conservation methods of Moso bamboo. Journal of Bamboo Research, 31(1): 23–26, 32. [in Chinese] ) |
| [] |
邢新婷, 傅懋毅, 肖贤坦. 2005. 麻竹开花生物学特性观察及控制授粉的初步研究. 北京林业大学学报, 27(6): 103–107.
( Xing X T, Fu M Y, Xiao X T. 2005. Biological characteristics of flowering and controlled pollination of Dendrocalamus latiflorus Munro. Journal of Beijing Forestry University, 27(6): 103–107. [in Chinese] ) |
| [] |
叶宝兴, 毕建杰, 孙印石. 2011. 植物细胞与组织研究方法. 北京:化学工业出版社, 74.
( Ye B X, Bi J J, Sun Y S. 2011. Research methods of plant cell and tissue. Beijing: Chemical Industry Press, 74. [in Chinese] ) |
| [] |
袁金玲, 傅懋毅, 庄金坤, 等. 2005. 几个丛生竹开花授粉特性及麻竹苗期初步选择. 竹子研究汇刊, 24(3): 9–13.
( Yuan J L, Fu M Y, Zhuang J K, et al. 2005. The characteristics of flowering and pollinating of several sympodial bamboos and elementary selection of Dendocalamus latiflorus seedlings. Journal of Bamboo Research, 24(3): 9–13. [in Chinese] ) |
| [] |
袁金玲, 顾小平, 岳晋军, 等. 2011. 孝顺竹开花生物学特性及杂交试验. 林业科学, 47(8): 61–66.
( Yuan J L, Gu X P, Yue J J, et al. 2011. Flowering biology and crossing of Bambusa multiplex. Scientia Silvae Sinicae, 47(8): 61–66. [in Chinese] ) |
| [] |
张光楚, 陈富枢. 1986. 竹类杂交育种的研究. 广东林业科技(3): 1–5.
( Zhang G C, Chen F S. 1986. Studies on the crossbreeding of bamboo. Guangdong Forestry Science and Technology(3): 1–5. [in Chinese] ) |
| [] |
张文燕, 马乃训. 1989. 竹类植物花期生物学特性. 林业科学研究, 2(6): 596–600.
( Zhang W Y, Ma N X. 1989. Biological characteristics of bamboo plants in flowering of stage. Forest Research, 2(6): 596–600. [in Chinese] ) |
| [] |
张文燕, 马乃训. 1990. 竹类植物花粉的生活力和自然授粉. 林业科学研究, 3(3): 250–255.
( Zhang W Y, Ma N X. 1990. Vitality of bamboo pollens and natural pollination in bamboo plants. Forest Research, 3(3): 250–255. [in Chinese] ) |
| [] |
张文燕, 马乃训, 吴玲玲, 等. 1992. 五月季竹开花结实的研究. 竹子研究汇刊, 11(2): 15–25.
( Zhang W Y, Ma N X, Wu L L, et al. 1992. A study on flowering and fruiting of Phyllostachys bambusoides. Journal of Bamboo Research, 11(2): 15–25. [in Chinese] ) |
| [] | Cruden R W. 1977. Pollen-ovule ratios: a conservative indicator of breeding systems in flowering plants. Evolution, 31(1): 32–36. DOI:10.2307/2407542 |
| [] | Dafni A. 1992. Pollination ecology. New York: Oxford University Press: 1-57. |
| [] | Dafni A, Maués M M. 1998. A rapid and simple procedure to determine stigma receptivity. Sexual Plant Reproduction, 11(3): 177–180. DOI:10.1007/s004970050138 |
| [] | Huang S Q, Yang H F, Lu B, et al. 2002. Honeybee-assisted wind pollination in bamboo Phyllostachys nidularia (Bambusoideae: Poaceae). Botanical Journal of the Linnean Society, 138(1): 1–7. DOI:10.1046/j.1095-8339.2002.00001.x |
| [] | Nadgauda R S, John C K, Mascarenhas A F. 1993. Floral biology and breeding behavior in the bamboo Dendrocalamus strictus Nees. Tree Physiology, 13(4): 401–408. DOI:10.1093/treephys/13.4.401 |
| [] | Ramanayake S M S D, Weerawardene T E. 2003. Flowering in a bamboo, Melocanna baccifera (Bambusoideae: Poaceae). Botanical Journal of the Linnean Society, 143(3): 287–291. DOI:10.1046/j.1095-8339.2003.00216.x |
| [] | Wyatt R. 1983. Pollinator-plant interactions and the evolution of breeding systems//Real L. Pollination biology. Orlando: Academic Press, 51-95. |
 2017, Vol. 53
2017, Vol. 53

