文章信息
- 韩树英, 池玉杰
- Han Shuying, Chi Yujie
- 栗黑层孔菌产三萜条件优化与提取工艺
- Optimization of Medium Components and Extraction Technique of the Triterpenoids from Melanoporia castanea (Polyporales: Polyporaceae)
- 林业科学, 2016, 52(9): 147-153
- Scientia Silvae Sinicae, 2016, 52(9): 147-153.
- DOI: 10.11707/j.1001-7488.20160918
-
文章历史
- 收稿日期:2015-01-06
- 修回日期:2015-05-18
-
作者相关文章
栗黑层孔菌(Melanoporia castanea)又称厚黑层孔菌,隶属于多孔菌科(Polyporaceae)黑层孔菌属(Melanoporia),主要生长于蒙古栎(Quercus mongolica)、水曲柳(Fraxinus mandschurica)等活立木干基部、枯立木和伐桩上,引起木材褐色腐朽(池玉杰,2003)。栗黑层孔菌的子实体木质、多年生,是一种含有多种生物活性成分的大型药用真菌。三萜类物质存在于药用真菌的菌丝体中,是药用真菌产生的主要次生代谢产物和生物活性成分之一(贾力耕等,2011)。三萜化合物是由异戊二烯单位头尾相连生成的次生代谢产物,在抗病毒、抗肿瘤以及生物体免疫调节等方面都具有良好的药理特性(Min et al.,1998; Morigiwa et al.,1986),同时在抗氧化、抗糖尿病、护肝和调节心血管系统等方面也呈现出较好的生物活性(Yamashita et al.,2002; Raphael et al.,2003)。目前已从紫芝(Ganoderma sinense)、灵芝(G. lucidum)、樟芝(Antrodia cinnamomea)、桦褐孔菌(Fuscoporia obliqua)、茯苓(Poria cocos)、粗毛纤孔菌(Inonotus hispidus)、红缘拟层孔菌(Fomitopsis pinicola)等真菌中分离出三萜类物质(张宪民等,2007; 王晓玲等,2009; Kubota et al.,1982; 余素萍等,2005; 贺元川等,2011; 朱春玉等,2012;Takaaki et al.,1992; 徐红云等,2012; 陈先晖等,2010)。对三萜类物质的提取,传统的提取方法主要有有机溶剂浸提法、超临界CO2提取法和超声提取法等,但关于双水相萃取技术提取三萜化合物的报道还较少。双水相萃取技术是一种高效温和的分离技术,具有试验设备简单、活性损失小、操作条件温和等特点(Karakatsanis et al.,2007; Mokhtarani et al.,2008)。本研究首先对采自长白山的栗黑层孔菌菌株CY-2012进行了液体发酵培养基成分的优化,目的是得到最多的菌丝体,以期获得最高得率的三萜类物质。在此基础上采用双水相超声法,以菌株CY-2012液体发酵的菌丝体为原材料,进行三萜类物质提取工艺的优化研究,为进一步研究栗黑层孔菌菌丝体内三萜物质的生物活性奠定基础。
1 材料与方法 1.1 菌种来源、试剂、培养基与菌种活化黑层孔菌菌株CY-2012采自长白山,菌种从子实体上经组织分离获得,保存于东北林业大学林学院森林保护学科森林病虫病理实验室。白桦脂醇(标准品,纯度>99%):上海融禾医药科技有限公司;其他试剂(分析纯):天津市永大化学试剂有限公司。
基础培养基:去皮马铃薯200 g·L-1,酵母5.0 g·L-1,MgSO4·7H2O 0.5 g·L-1,KH2PO4 0.5 g·L-1,维生素B1 0.5 g·L-1,pH自然。
菌株的活化:将4 ℃冰箱保存的试管斜面上的菌种接种于PDA平皿中央,于28 ℃静止培养,待菌丝体长满平皿后取最外围新鲜菌饼再1次接种于PDA平皿中央,在28 ℃培养箱中培养8天备用。
1.2 菌丝体生物量和菌丝体中三萜类物质含量的测定1) 菌丝体生物量的测定 收集在液体培养基中培养10天的菌丝体,用蒸馏水洗涤3~5次后,于70 ℃烘箱中烘干至恒质量,准确称量菌丝体干质量,即为菌丝体生物量(张文隽等,2010)。
2) 三萜类物质的提取方法与初始提取方式 提取方法:采用异丙醇和硫酸铵双水相超声萃取方法提取菌丝体内的三萜类物质(赵艳霞等,2014)。初始提取方式:取烘干的菌丝体,粉碎过70目筛,称取100 mg菌丝体粉末,溶于5 mL由异丙醇(终体积分数为40%)和硫酸铵(终质量浓度为0.175 g·mL-1)构成的双水相提取液中,室温浸提2 h,然后在4 800 r·min-1条件下离心10 min,上层有机相即为三萜粗提液。
3 ) 白桦脂醇-吸光度值标准曲线的制作 以白桦脂醇标准品作为对照品测定菌丝体内(即上述三萜粗提液内)的三萜含量,首先制作白桦脂醇浓度与吸光度值关系的标准曲线。称取2.00 mg白桦脂醇,加入无水乙醇溶解,并定容于50 mL容量瓶中,得终质量浓度为40 μg·mL-1的标准品。分别取0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8,2.0 mL,置于试管中,沸水浴挥干乙醇,加入0.2 mL 5%香草醛-冰乙酸溶液和0.8 mL高氯酸,摇匀,于60 ℃水浴保温反应20 min,立即冰浴至室温,再加入乙酸乙酯定容至5 mL,摇匀,静置5~10 min,以空白(不添加样品的显色剂)为参比,分别在550 nm波长处测定吸光值。以白桦脂醇的微克数为横坐标,吸光值为纵坐标,建立标准曲线。
4) 三萜类物质含量的测定与提取率 采用香草醛-冰乙酸-高氯酸分光光度法测定菌丝体内的三萜含量(林庚申等,2007)。将三萜粗提液用30%乙醇定容,取适量乙醇定容的三萜粗提液置于试管中,沸水浴挥干溶液,加入0.2 mL 5%香草醛-冰乙酸溶液和0.8 mL高氯酸,60 ℃水浴保温反应20 min,立即冰浴至室温,再加入乙酸乙酯定容至5 mL,摇匀,静置5~10 min,以空白(不添加样品的显色剂)为参比,在550 nm波长处测定吸光度。根据白桦脂醇浓度与吸光度关系的标准曲线计算三萜含量(即三萜化合物质量浓度),并根据以下公式计算三萜提取率:
三萜提取率(%)=C×V×100/M。
式中:C为三萜化合物质量浓度(mg·mL-1),V为提取液的定容体积(mL),M为样品质量(mg)。
1.3 产三萜类物质液体培养基成分的优化于三萜类物质主要存在于药用真菌的菌丝体中,而非发酵液中,因此,本试验通过对培养菌株CY-2012的液体培养基成分进行优化,一方面要得到最大量的菌丝体,另一方面使一定质量的菌丝体中三萜类物质含量最高。1)最适碳源和氮源的2项单因素筛选 碳源的筛选:以基础培养基作为产三萜类物质的初始培养条件,分别添加葡萄糖、果糖、蔗糖、乳糖、甘露醇作为不同的碳源(20 g·L-1),在含有100 mL培养液的250 mL锥形瓶中接入7块直径为9 mm的菌饼,于28℃,150 r·min-1条件下培养10天,再收集菌丝,烘干后称量并测定其中三萜类物质的含量。每个处理3次重复。氮源的筛选:以添加葡萄糖(20 g·L-1)的基础培养基作为初始培养基,分别添加磷酸铵、硝酸铵、硫酸铵、酒石酸铵作为不同的氮源(0.5 g·L-1),其他同上。
2) 4因素3水平的正交试验 由于多种因素都影响到菌丝体的产量和菌丝体内三萜类物质的含量,特别是不同碳源的质量浓度、不同氮源的质量浓度、菌丝体内三萜类物质含量的促进因子等是影响优化效果的主要因素。本项正交试验在2项单因素试验的基础上,选取葡萄糖质量浓度(A)、酵母质量浓度(B)、乳糖质量浓度(C)和硝酸铵质量浓度(D)4个因素在3个水平下(表 1)进行菌丝体产量和菌丝体内三萜类物质含量的检测和筛选。选择各因素水平的原则是把参数的水平区间拉开,尽可能使最适区域能包含在设定的水平区间内。利用SPASS软件设计了4因素3水平L9(34)的正交表,在28 ℃,150 r·min-1条件下培养10天,对菌株CY-2012进行9组不同组合的菌丝体液体培养正交试验,再收集菌丝,烘干后称量并测定其中三萜类物质的含量。每个处理3次重复。
|
|
3) 优化培养验证试验 综合优化培养结果,确定最优培养条件后,进行3组平行试验进行验证。
1.4 菌丝体内三萜物质提取工艺的优化过优化提取溶剂的浓度和提取时间,提高三萜的提取率。1)最适异丙醇浓度的筛选 分别称取100 mg菌丝体粉末置于试管中,加入5 mL由异丙醇(终体积分数分别为25%,30%,35%,40%,45%,50%和55%)和硫酸铵(终质量浓度为0.175 g·mL-1)构成的双水相提取液中,室温浸提2 h,4 800 r·min-1离心10 min,取上层有机溶剂相溶液以30%乙醇定容,测定三萜的含量并计算提取率。
2 )最适硫酸铵浓度的筛选 分别称取100 mg菌丝体粉末置于试管中,加入5 mL由异丙醇(终体积分数为40%)和硫酸铵(终质量浓度分别为0.10,0.12,0.14,0.16,0.18,0.20,0.22,0.24 g·mL-1)构成的双水相提取液中,其他同1)。
3)3因素3水平的正交试验 在上述2项单因素试验的基础上,选取异丙醇浓度、硫酸铵浓度和超声时间(在双水相提取液中室温浸提2 h后再超声)3个因素在3水平下(表 2)进行三萜含量的检测,比较不同组合提取工艺下的三萜提取率。
|
|
4) 优化培养验证试验 确定最优提取工艺后,通过5组平行试验进行验证。
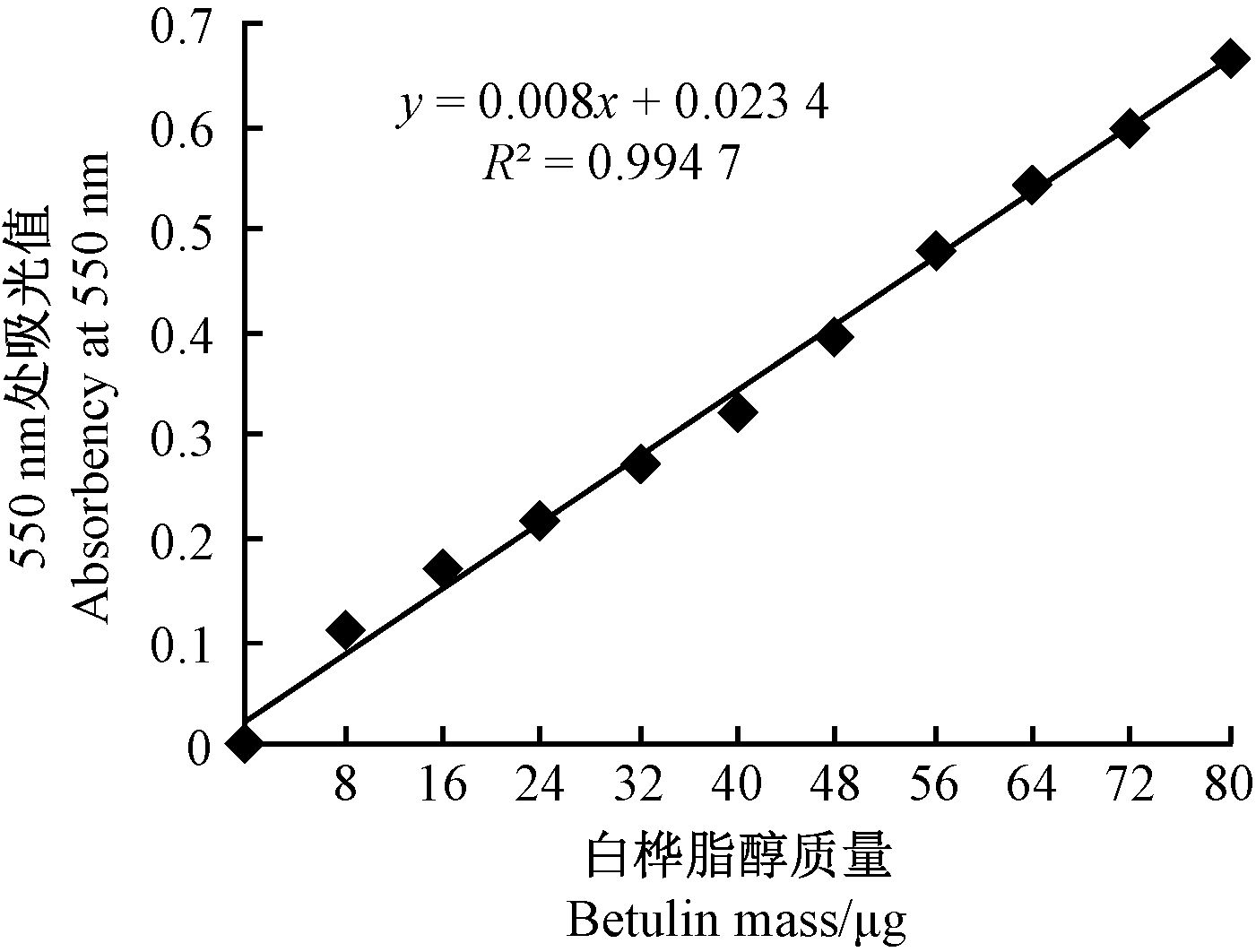
2 结果与分析 2.1 白桦脂醇-吸光度值标准曲线的绘制白桦脂醇的质量为横坐标,以对应的吸光值为纵坐标,运用Excel绘制标准曲线(图 1),对应的回归方程为:y=0.008x+0.023 4(R2=0.994 7),式中,x为质量,y为吸光度。该标准曲线线性关系良好,可以用于后续的三萜含量测定。
|
图 1 白桦脂醇-吸光度值标准曲线 Fig.1 Betulin-absorbency value standard curve |
1)不同碳源对栗黑层孔菌生物量及三萜产量的影响 碳源是微生物细胞的结构物质,可为微生物的生长繁殖提供能量;微生物能够利用单糖、二糖、多糖和醇类等。由图 2A可知,液体发酵培养10天后,菌株CY-2012在以葡萄糖为碳源的培养基中生物量最高,菌丝干质量达0.439 g·(100 mL)-1,三萜产量也最高,为2.772 mg·(100 mL)-1。通过Ducan’s新复极差法进行分析,得出在0.05水平上乳糖和葡萄糖培养得到的三萜含量显著高于其他碳源。在乳糖诱导下,相同质量的菌丝体中三萜含量最高,乳糖可作为诱导因子以促进该菌株产三萜类物质。因此,选择乳糖和葡萄糖作为混合碳源进行后续的正交试验。

|
图 2 不同碳源(A)和氮源(B)对栗黑层孔菌菌丝体干质量、三萜含量和三萜产量的影响 Fig.2 Effect of different carbon source(A)and nitrogen source(B) on mycelium dry mass,content and production of triterpenoids |
2) 不同氮源对栗黑层孔菌生物量及三萜产量的影响 氮源是微生物细胞核酸和蛋白质的主要成分,是微生物合成各种生物大分子的物质基础,对微生物的生长发育有重要意义。以添加葡萄糖(20 g·L-1)的基础培养基作为初始培养基,分别添加不同的氮源进行试验分析。由图 2B可知,添加氮源后,4种氮源的菌丝体干质量都显著提高,其中硫酸铵诱导下菌丝干质量最低,但也比无氮条件下多0.41 mg·(100 mL)-1。在硝酸铵诱导下,得到的三萜含量和三萜产量都为最高,分别为0.758 mg·(100 mg)-1、4.293 mg·(100 mL)-1,比以葡萄糖为碳源、不添加任何氮源的条件下分别提高0.125 mg·(100 mg)-1和1.521 mg·(100 mL)-1,比无碳、无氮条件下分别提高了0.6倍和9.5倍。因此,选择硝酸铵作为无机氮源进行下一步的正交优化培养试验。
3) 正交试验结果和优化培养验证结果 产三萜类物质液体培养基成分优化的正交试验结果见表 3。通过比较4因素3水平的均值K,得到每个因素的最大平均值,从而得到菌丝干质量的最优方案为A2B3C1D1,三萜含量的最优方案为A3B3C1D2,三萜产量的最优方案为A2B3C1D2,说明在试验范围内最高浓度的酵母和最低浓度的乳糖对菌丝生长量、三萜含量及三萜产量的效果都最好;其中对于菌丝生长量,中浓度的葡萄糖和低浓度的硝酸铵效果最好;对于三萜含量,高浓度的葡萄糖和中浓度的硝酸铵效果最好;对于三萜产量,中浓度的葡萄糖和中浓度的硝酸铵效果最好。通过极差分析,排列出4因素对不同因子影响的主次顺序,乳糖浓度对菌丝生长量的影响最大,硝酸铵浓度对三萜含量和三萜产量影响最大,酵母浓度对菌丝干质量、三萜含量及三萜产量影响都最小。
|
|
因为正交试验得到的3组优化方案,其中第3组A2B3C1D2是原有正交试验的第6组,所以补充了前2组方案A2B3C1D1和A3B3C1D2进行优化培养验证,结果是菌丝干质量分别为0.769,0.795 g·(100 mL)-1,三萜含量为1.902,1.455 mg·(100 mg)-1,三萜产量为14.529,12.475 mg·(100 mL-1)。3组进行比较的结果是,A2B3C1D1得到的三萜产量最高,为最佳的产三萜方案。
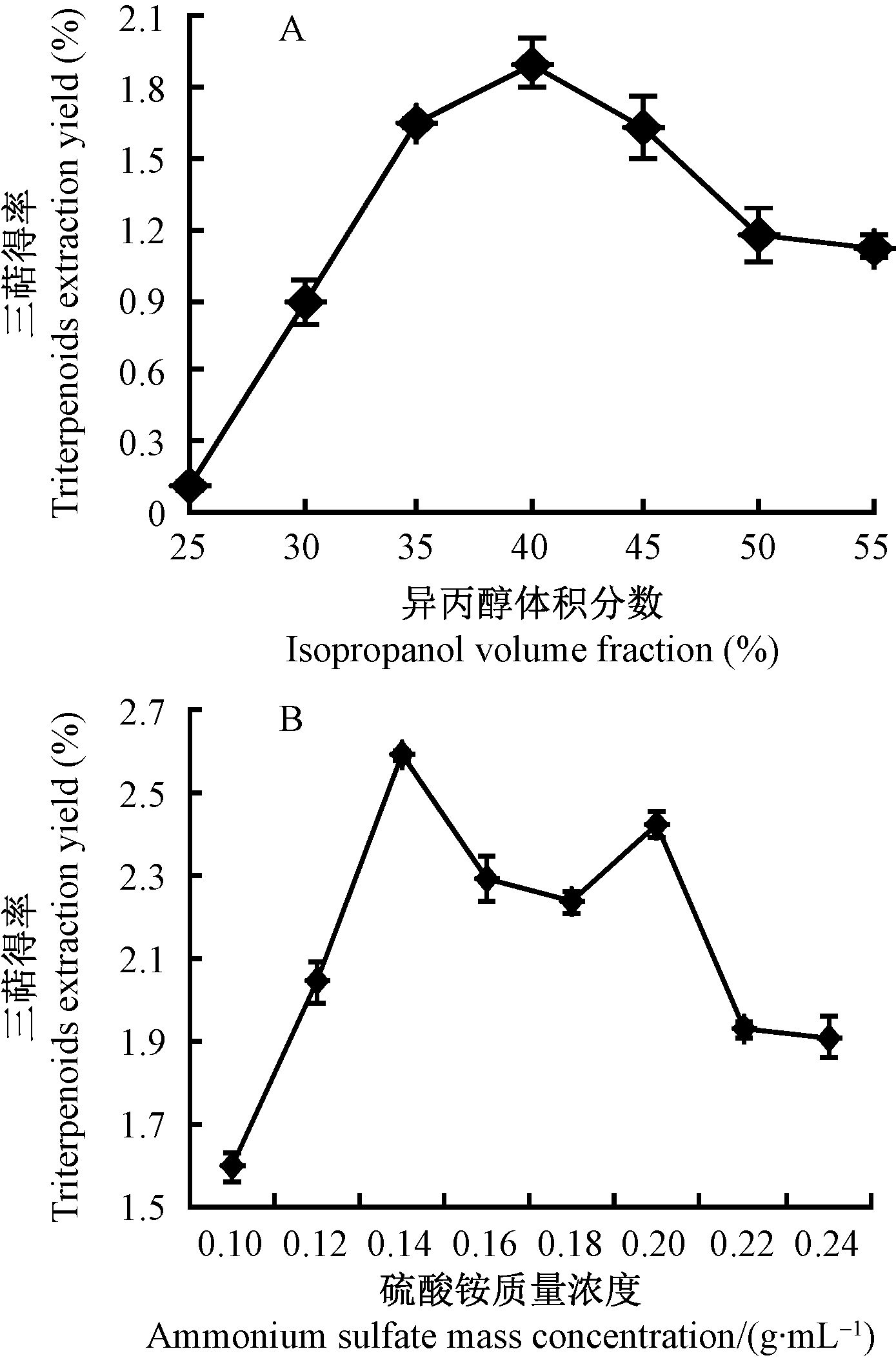
2.3 菌丝体内三萜物质提取工艺的优化1) 异丙醇浓度对提取效果的影响 由图 3A可知,在异丙醇体积分数25%~40%之间,随体积分数的增大,栗黑层孔菌三萜得率显著上升,当体积分数为40%时,得率最高为1.90%,当体积分数大于40%时,三萜得率呈下降趋势。根据相似相溶原理,由40%异丙醇构成的双水相体系中上相的极性接近于栗黑层孔菌三萜的极性,提取率较高,可作为进一步优化三萜得率的体积分数。
|
图 3 不同单因素对三萜得率的影响 Fig.3 Effect of isopropanol volume fraction(A) triterpenoids extraction yield |
2) 硫酸铵质量浓度对提取效果的影响 选择体积分数为40%异丙醇体积浓度作为有机相,添加不同质量浓度的硫酸铵进行优化试验,由图 3B可知,硫酸铵质量浓度在0.10~0.14 g·mL-1时,随着浓度的增加三萜的得率显著提高,当浓度为0.14 g·mL-1时三萜的得率最高为2.59%。在硫酸铵质量浓度为0.20 g·mL-1时三萜得率出现第2个高峰,之后随着质量浓度的继续增大,三萜得率逐渐下降。可见,不同质量浓度的硫酸铵影响异丙醇有机相的极性,从而影响三萜化合物在其中的分配。
3)正交试验结果和优化验证结果分析 在2项单因素试验的基础上,以不同的异丙醇体积分数、硫酸铵质量浓度和超声时间作为3个因素,进行L9(33)正交试验,通过比较正交试验3因素3个不同水平的均值Ki,得到各因素的最大平均值(表 4),三萜提取工艺的最优配方为E2F3G3,即异丙醇体积分数40%、硫酸铵质量浓度0.18 g·mL-1、超声波时间35 min。通过极差分析(表 4)排列出影响三萜提取率的主次顺序为G>E>F,即超声时间对三萜提取率影响最大,异丙醇体积分数次之,硫酸铵质量浓度影响最小。方差分析结果(表 5)表明,不同超声时间的三萜提取率差异极显著,而不同硫酸铵质量浓度之间的三萜提取率无显著差异,其结果与极差分析结果一致。
|
|
|
|
对最优配方E2F3G3进行5次重复试验,得到三萜提取率为3.65%±0.05%,该结果为最高,表明正交试验结果可靠。
3 结论与讨论通过优化培养基成分可以较大幅度地提高三萜的产量;优化异丙醇和硫酸铵双水相萃取提取工艺可以提高三萜提取率。
栗黑层孔菌产三萜类物质的最佳培养基成分为: 基础培养基内加入葡萄糖25 g·L-1、乳糖3 g·L-1和硝酸铵0.3 g·L-1,酵母含量增加到15 g·L-1,在此条件下培养10天后菌丝干质量、三萜含量和三萜产量分别是初始培养条件的9.96,4.05和35.52倍,由于菌丝生物量和菌丝体中的三萜含量都较高,从而使三萜产量达到最高。
筛选最佳碳源时,发现以乳糖为碳源,得到的菌丝生物量虽然不如葡萄糖为碳源的高,但是三萜含量明显高于葡萄糖条件下的液体培养,因此乳糖可作为诱导因子以促进该菌株产三萜类物质,故在正交试验中将葡萄糖和乳糖组合作为混合碳源以期提高菌丝体内的三萜含量;进一步研究发现低浓度的乳糖和硝酸铵的添加,有利于栗黑层孔菌三萜物质的产生。
收集优化培养后的菌丝体,采用2项单因子试验、1次3因素3水平的正交试验,应用异丙醇和硫酸铵双水相萃取技术,对菌丝体内三萜物质的提取工艺进行了优化,得到最佳提取工艺为:异丙醇体积分数40%、硫酸铵质量浓度0.18 g·mL-1、超声时间35 min,在此条件下三萜提取率达到最高,为3.65%。而赵艳霞等(2014)利用此方法优化得到桦褐孔菌菌丝体内三萜的提取率为6.18%,可能是因为栗黑层孔菌体内三萜含量整体低于桦褐孔菌。
| [1] |
陈先晖, 袁博, 鞠秀云, 等. 2010. 相应曲面法优化超声波提取红缘拟层孔菌总三萜工艺. 食品科学 , 31 (30) : 6–10.
( Chen X H, Yuan B, Ju X Y, et al.2010. Using response surface methodology to optimize the ultrasonic-aided extraction of total triterpenoids from fruit bodies of Fomitopsis pinicola (Swartz. :Fr.) Karst.Food Science , 31 (30) : 6–10. [in Chinese] ) (  0) 0)
|
| [2] |
池玉杰. 2003. 木材腐朽与木材腐朽菌. 北京: 科学出版社 .
( Chi Y J. 2003. Wood rotting and wood-rotting fungi. Beijing: Science Press . [in Chinese] ) |
| [3] |
贺元川, 蒲蔷, 何开泽, 等. 2011. 均匀设计法优化樟芝产三萜液体发酵条件. 应用与环境生物学报 , 17 (6) : 901–906.
( He Y C, Pu Q, He K Z, et al.2011. Optimization of liquid fermentation conditions of Antrodia cinnamomea producing triterpenoid by uniform design. Chinese Journal of Applied & Environmental Biology , 17 (6) : 901–906. [in Chinese] ) (  0) 0)
|
| [4] |
贾力耕, 包海鹰. 2011. 药用拟层孔菌研究进展. 菌物研究 , 9 (2) : 119–124.
( Jia L G, Bao H Y.2011. Advances of research on Fomitopsis officinalis. Journal of Fungal Research , 9 (2) : 119–124. [in Chinese] ) (  0) 0)
|
| [5] |
林庚申, 张小青, 魏铁铮, 等. 2007. 桦褐孔菌三萜类物质的提取与含量测定. 菌物学报 , 26 (3) : 396–403.
( Lin G S, Zhang X Q, Wei T Z, et al.2007. Extraction and determination of triterpenoids from Phaeoporus obliquus. Mycosystema , 26 (3) : 396–403. [in Chinese] ) (  0) 0)
|
| [6] |
王晓玲, 刘高强, 周国英, 等. 2009. 紫芝酸性三萜类化合物体外抑癌和抑菌作用的研究. 菌物学报 , 28 (6) : 838–845.
( Wang X L, Liu G Q, Zuou G Y, et al.2009. In vitro anti-tumor and antimicrobial activity of acidic triterpenoids from submerged culture of Ganoderma sinense. Mycosystema , 28 (6) : 838–845. [in Chinese] ) (  0) 0)
|
| [7] |
徐红云, 王占斌. 2012. 粗毛纤孔菌产三萜液体发酵条件优化. 食品工业科技 , 33 (24) : 206–214.
( Xu H Y, Wang Z B.2012. Optimization of submerged fermentation process of Inonotus hispidus for the yield of intracellular triterpenoid. Science and Technology of Food Industry , 33 (24) : 206–214. [in Chinese] ) (  0) 0)
|
| [8] |
余素萍, 张劲松, 杨焱, 等. 2005. 灵芝胞内三萜高产菌株的筛选及发酵条件的优化. 微生物学通报 , 32 (1) : 57–61.
( Yu S P, Zhang J S, Yang Y, et al.2005. Screening of Ganodema strain of high yield intracellular triterpenes and optimization of its fermentation conditions. Microbiology China , 32 (1) : 57–61. [in Chinese] ) (  0) 0)
|
| [9] |
张文隽, 吴亚召, 雷萍, 等. 2010. 桦树桑黄液体发酵培养基优化研究. 中国食用菌 , 9 (6) : 24–25.
( Zhang W J, Wu Y Z, Lei P, et al.2010. Study on the optimum submerged fermentation parameters of Phellinus igniarius growing on birch tree. Edible Fungi of China , 9 (6) : 24–25. [in Chinese] ) (  0) 0)
|
| [10] |
张宪民, 乔英, 邱明华. 2007. 紫芝中三萜化合物标准化提取方法研究. 天然产物研究与开发 , 19 : 109–112.
( Zhang X M, Qiao Y, Qiu M H.2007. Optimized preparation method of triterpenoids from Ganodema sinense. Natural Product Research and Development , 19 : 109–112. [in Chinese] ) (  0) 0)
|
| [11] |
赵艳霞, 刘峰, 魏娟娟, 等. 2014. 双水相超声法提取桦褐孔菌三萜. 菌物学报 , 33 (1) : 129–137.
( Zhao Y X, Liu F, Wei J J, et al.2014. Extraction of triterpenoids from Inonotus obliquus by aqueous two-phase systems associated with ultrasonic extraction. Mycosystema , 33 (1) : 129–137. [in Chinese] ) (  0) 0)
|
| [12] |
朱春玉, 郑方亮, 邵丽杰, 等. 2012. 桦褐孔菌子实体与菌丝体三萜化合物提取及活性比较研究. 食品科学 , 33 (15) : 161–165.
( Zhu C Y, Zheng F L, Shao L J, et al.2012. Extraction and bioactivity of triterpenoids from fruit bodies and mycelia of Inonotus obliquus. Food Science , 33 (15) : 161–165. [in Chinese] ) (  0) 0)
|
| [13] |
Karakatsanis A, Liakopoulou M.2007. Comparison of PEG/fractionated dextran and PEG/industrial grade dextran aqueous tow-phase systems for the enzymic hydrolysis of starch. Journal of Food Engineering , 80 (4) : 1213–1217.
DOI:10.1016/j.jfoodeng.2006.09.011 ( 0) 0)
|
| [14] |
Kubota T, Asaka Y, Miura I, et al.1982. Structures of ganoderic acid A and B,two new lanostane type bitter triterpenes from Ganoderma lucidum (Fr. ) Karst.Helv Chim Acta , 65 : 611–619.
DOI:10.1002/(ISSN)1522-2675 ( 0) 0)
|
| [15] |
Min B S, Nakamura N, Miyashio H, et al.1998. Triterpenes from the spores of Ganoderma lucidum and their inhibitory activity against HIV-1 protease. Chem Pharm Bull , 46 (10) : 1607–1612.
DOI:10.1248/cpb.46.1607 ( 0) 0)
|
| [16] |
Mokhtarani B, Karimzadeh R, Amini M H, et al.2008. Partitioning of ciprofloxacin in aqueous tow-phase system of poly (ethylene glycol) and sodium sulphate. Biochemical Engineering Journal , 38 : 241–247.
DOI:10.1016/j.bej.2007.07.009 ( 0) 0)
|
| [17] |
Morigiwa A, Kitabatake K, Fujimoto Y, et al.1986. Angiotensin converting enzyme-inhibitory triterpenes from Ganoderma lucidum. Chem Pharm Bul , 34 (7) : 3025–3028.
DOI:10.1248/cpb.34.3025 ( 0) 0)
|
| [18] |
Raphael T, Kuttan G.2003. Effect of naturally occurring triterpenoids glycyrrhizic acid,ursolic acid,oleanolic acid and nomilin on the immune system. Phytomedicine , 10 (6/7) : 483–489.
( 0) 0)
|
| [19] |
Takaaki T, Akira A, Tetsuro S.1992. A lanostane triterpenoids from Poria cocos. Phytochemistry , 31 (7) : 2548–2549.
DOI:10.1016/0031-9422(92)83325-S ( 0) 0)
|
| [20] |
Yamashita K, Lu H W, Lu J C, et al.2002. Effect of three triterpenoids,lupeol,botulin,and betulinic acid on the stimulus-induced superoxide generation and tyrosyl phosphorylation of proteins in human neutrophils. Clinca Chimica Acta , 325 (1/2) : 91–96.
( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52

