文章信息
- 王银翠, 周国娜, 张斌, 陈明叶, 高宝嘉
- Wang Yincui, Zhou Guona, Zhang Bin, Chen Mingye, Gao Baojia
- 油松毛虫取食和剪叶刺激胁迫下油松的蛋白质表达差异分析
- Difference in Protein Expression of Pinus tabulaeformis Induced by Dendrolimus tabulaeformis Feeding and Leaf-Cutting Stimulation
- 林业科学, 2016, 52(8): 68-75
- Scientia Silvae Sinicae, 2016, 52(8): 68-75.
- DOI: 10.11707/j.1001-7488.20160809
-
文章历史
- 收稿日期:2014-11-12
- 修回日期:2015-05-24
-
作者相关文章
2. 河北省林木种质资源与森林保护重点实验室 保定 071000
2. Key Laboratory of Germplasm Resources of Forest and Forest Protection in Hebei Prvince Baoding 071000
近年来,关于植物诱导抗性方面的研究发展迅速,结果发现植物体受到机械损伤或昆虫取食后,可发生一系列复杂反应,形成化学防御体系,使植物本身对害虫产生抗性(Pechan et al., 2000;Leon et al., 2001)。对于植物诱导防御反应的机制,也从植物生理、生化变化分析发展到蛋白质组学和转录组学变化的分析,从蛋白质和基因调控的角度揭示植物抗性的形成机制。有学者研究发现,创伤、病菌、外源化学物质、极端温度、盐渍等胁迫因素均可诱导植物不同类别的蛋白质表达(杨惠娟等,2012; 惠菲等,2012; 余永芳等,2011; 张智慧等,2012),应用蛋白质组学和基因组学技术,定向研究昆虫取食和病原体侵染对一些特殊防御蛋白表达的诱导效应,并鉴定了相关调控基因(George et al., 2011; Vandenborre et al., 2011;Que et al., 2011)。这些研究为揭示昆虫与植物互作的分子机制提供了有益的途径和方法。然而,植物的诱导防御反应是一个非常复杂的过程,诱导因素不同,植物的防御反应是大不相同的,相同的诱导因素作用于不同植物,其防御反应也不相同,植物防御反应的规律和机制还存在诸多的未知。
学者们对松树诱导抗虫性的研究取得了明显进展,发现在油松毛虫(Dendrolimus tabulaeformis)的取食刺激下,松树的营养物质、次生性化学物质、挥发性化学物质等可发生明显变化,并发现了油松(Pinus tabulaeformis)诱导抗性的滞后效应(李镇宇等,2000; 戈峰等,1997; 袁红娥等,2009); 也有研究表明剪叶和取食刺激可诱导落叶松(Larix gmelinii)蛋白酶抑制剂活性的变化(王琪等,2008)。这些研究为进一步探究松树防御反应的分子机制提供了基础。为揭示不同刺激因素下油松诱导防御反应的规律和分子机制,本文以自然环境中油松-山杏(Armeniaca sibirica)混交林内的油松为研究对象,分析不同刺激方式诱导下油松体内蛋白质表达的差异。
1 材料与方法 1.1 试验材料样地位于河北省承德市平泉县黄土梁子镇(118°21′03″—119°15′34″E,40°24′0″—40°40′17″N)油松林区的油松-山杏混交林内,油松与山杏株数比为3∶2。选择健康、长势均匀、15年生、平均树高6~7 m以及未被油松毛虫取食的油松20株,编号,作为处理株和对照株,在油松毛虫上树前将油松树干距离地面1.0~1.5 m处涂上粘虫胶,防止油松毛虫危害。2013年5月上旬,在处理株上分别选取1~2个2年生枝条,套笼放养10头、30头3~4龄的油松毛虫并剪叶处理(剪叶程度根据室内饲养30头油松毛虫的取食量确定),以无油松毛虫取食为对照,每个处理5次重复。于2013年6月底即油松毛虫长到7龄时,采集对照与处理的针叶样品。样品采集后立即放入液氮中带回实验室,装入保鲜袋,置-80 ℃冰箱中备用。
1.2 试验方法参照Damerval等(1986)的方法,采用TCA-丙酮提取总蛋白,再进行改进。取-80 ℃冻存的油松针叶适量,液氮研磨,称取0.5 g粉末至10 mL离心管中,加入PVPP 0.5 g和3倍体积的蛋白提取液Ⅰ(10%TCA,0.07%β-巯基乙醇溶于丙酮),-20 ℃沉淀过夜; 4 ℃,10 000 r·min-1离心30 min,保留沉淀,用3倍体积预冷的蛋白提取液Ⅱ(0.07%β-巯基乙醇的丙酮溶液)将沉淀充分溶解,-20 ℃沉淀1 h,重复洗涤沉淀3~4次,弃上清,沉淀冷冻干燥,得到蛋白粗提干粉; 取0.1~0.2 g干粉,加入2 mL平衡酚和2 mL SDS buffer(30%蔗糖,2%SDS,0.1 mol·L-1 Tris-Cl pH 8.0,5%β-巯基乙醇)于10 mL小管中,彻底涡旋30 s,4 ℃,10 000 r·min-1离心3 min,上层酚相吸出,至一新管中,在酚相中加入5倍体积0.1 mol·L-1冷醋酸铵甲醇溶液,-20 ℃沉降30 min; 4 ℃,10 000 r·min-1离心5 min,再用冷醋酸铵甲醇洗沉淀2次,80%丙酮洗2次,沉淀冷冻干燥。用Bradford法(Bradford,1976)测定其含量。
第1向等电聚焦在等电聚焦仪上进行,采用 pH 4~7的17 cm IPG预制胶条,在350 μL含6 mg蛋白质的裂解液中溶涨12 h,进行等电聚焦。参数设置:1) Rehydration 50 V/14 h; 2) step 250 V/1 h; 3) step 500 V/1 h; 4) step 1 000 V/1 h; 5) gradient 7 000 V/2 h; 6) 7 000 V 49 000 Vh。等电聚焦结束后,胶条依次在平衡液1(6 mol·L-1 Urea,2% SDS,50 mmol·L-1 Tris-HCl pH 8.8,30% 甘油,1% DTT)和平衡液2(6 mol·L-1 Urea,2% SDS,50 mmol·L-1 Tris-HCl pH 8.8,30% 甘油,2.5% 碘乙酰胺)中各平衡15 min。第2向SDS-PAGE使用垂直电泳装置,采用12%分离胶,参数设置:20 mA/gel,30 min,40 mA/gel,3~4 h。染色采用考马斯亮蓝R250染色。选取发生变化的蛋白点进行质谱分析,由华大基因蛋白质质谱平台测定蛋白种类。
2 结果与分析 2.1 不同提取方法的油松蛋白质双向电泳图谱要获得高分辨率和高度重复的双向电泳图谱,蛋白质样品制备是极为关键的一步,是结果分析的保证(Rabilloud,2002)。因此在制备蛋白质样品时,要根据材料的不同,选择不同的溶剂进行提取、分离和纯化,选择最适宜的样品制备方法。
本文采用TCA/丙酮直接提取和TCA/丙酮提取后再用平衡酚纯化2种方法提取油松针叶的全蛋白,2-DE图谱如图 1所示。
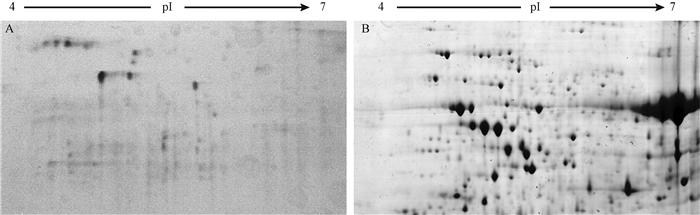
|
图 1 不同提取方法蛋白质电泳结果的比较 Fig.1 Comparation of electrophoresis using different methods A. TCA/丙酮法TCA/acetone method; B. TCA/丙酮沉淀平衡酚纯化法TCA/acetone precipitation equilibrium phenol purification method. |
由图 1可知,TCA丙酮法提取油松针叶的蛋白,经SDS-PAGE凝胶电泳后,得到的蛋白质点较少;而TCA丙酮沉淀平衡酚纯化法提取的蛋白,得到的蛋白质点多且在凝胶上显现的比较清晰。因此本试验采用TCA丙酮沉淀平衡酚纯化法提取油松针叶的总蛋白,并用于后续试验。
2.2 取食和剪叶刺激下油松蛋白质双向电泳图谱分析通过Imagemaster 2D Platinum图像分析软件对双向电泳图谱进行匹配和比较分析,对照组可匹配的蛋白质点共540个,10头、30头油松毛虫取食及剪叶处理组可匹配的蛋白质点分别为530,588,502个。与对照相比,油松毛虫取食及剪叶刺激后,均有特异表达蛋白点、消失蛋白点、上调蛋白点及下调蛋白点,但不同处理间蛋白点的表达差异不同(图 2)。与对照相比,油松毛虫取食和剪叶刺激后,有2个重复消失的蛋白点; 油松毛虫取食后,有3个重复消失的蛋白点、1个相同上调蛋白点、2个相同下调蛋白点(表 1)。
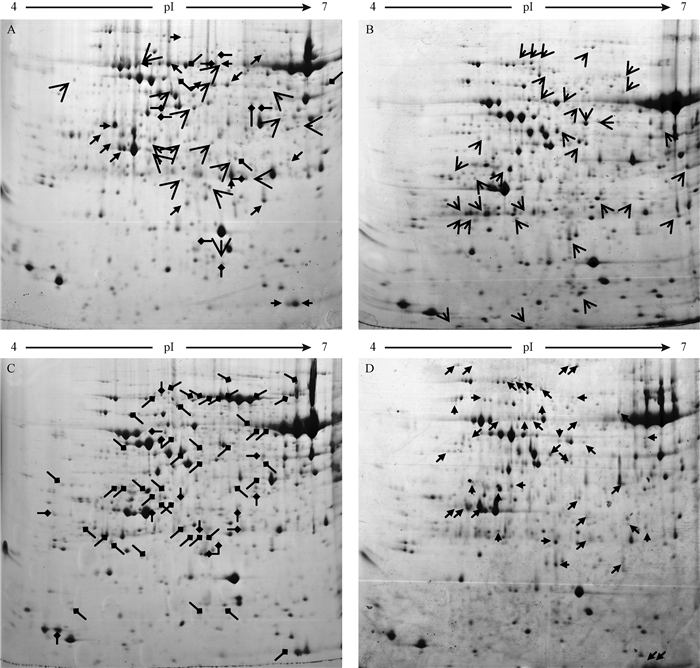
|
图 2 差异表达蛋白点在凝胶上的分布 Fig.2 The distribution of differentially expressed proteins A. 对照组,箭头表示对应处理组中消失的蛋白点位。CK. The arrows mean the disappeared protein spots according to treatment group. B.10头油松毛虫取食组,箭头表示与CK相比上调表达、下调表达和新增蛋白点位置。 10 D. tabulaeformis feeding group. The arrows mean the up-regulated protein spots, the down-regulated protein spots and the new increased protein spots according to control group.C.30头油松毛虫取食组,箭头表示与CK相比上调表达、下调表达和新增蛋白点位置。 30 D. tabulaeformis feeding group. The arrows mean the up-regulated protein spots, the down-regulated protein spots and the new increased protein spots according to control group.D.剪叶处理组,箭头表示与CK相比上调表达、下调表达和新增蛋白点位置。Clipping treatment group. The arrows mean the up-regulated protein spots, the down-regulated protein spots and the new increased protein spots according to control group. |
从表 1可知,下调表达的蛋白点以30头油松毛虫取食刺激高于10头油松毛虫取食刺激和剪叶处理; 新增蛋白点各处理间无差异。这说明昆虫取食和剪叶处理均能诱导油松蛋白质的表达,而且不同处理之间有差异。
|
|
小心切取蛋白质点的表达量具有3倍以上差异、新增或消失的蛋白质点进行质谱分析。分析结果包括匹配的蛋白点数目及得分、蛋白质的登录号、计算分子质量、等电点。数据库检索的结果是:油松毛虫取食后特异表达的蛋白点是叶绿体ATP合酶CF0β亚基、抗坏血酸过氧化物酶、噻唑生物合成酶、Lhcb5蛋白、ATP合酶β亚基及蛋白类谷胱甘肽S-转移酶,下调表达的蛋白点是蛋白酶亚基和假定蛋白CL304Contig1_01; 剪叶刺激后特异表达的蛋白点是tau蛋白类谷胱甘肽S-转移酶和Rubisco加氧酶,下调表达的蛋白点是磷酸甘油酸激酶Ⅰ和核酮糖-1, 5-二磷酸羧化酶/加氧酶大亚基。蛋白点的详细信息见表 2。
|
|
为了深入分析混交林差异表达蛋白的生物学功能,根据相关文献信息,将质谱分析得到的可溶性蛋白进行功能分类。这些差异表达蛋白涉及了植物体光合作用、能量、代谢、胁迫和防御及蛋白合成等重要的生命活动。
对照组中,这些差异表达蛋白质分别属于光合作用相关蛋白4个:核酮糖-1, 5-二磷酸羧化酶/加氧酶大亚基、叶绿素a/b结合蛋白、叶绿体捕光叶绿素a/b结合蛋白、叶绿素a/b结合蛋白Ⅲ型; 能量相关蛋白1个:磷酸甘油酸激酶Ⅰ; 代谢相关蛋白2个:甘油醛磷酸脱氢酶、蛋白酶亚基; 未知功能的蛋白5个。
10头油松毛虫取食处理组中,蛋白质的种类属于光合作用相关蛋白1个:Lhcb5蛋白; 能量相关蛋白1个:ATP合酶β亚基; 代谢相关蛋白1个:甘油醛磷酸脱氢酶; 胁迫和防御相关蛋白2个:DHAR类谷胱甘肽S-转移酶、tau蛋白类谷胱甘肽S-转移酶; 未知功能的蛋白2个。
30头油松毛虫取食处理组中,蛋白质的种类属于光合作用相关蛋白2个:叶绿体ATP合酶CF0β亚基和Lhcb5蛋白; 胁迫和防御相关蛋白1个:抗坏血酸过氧化物酶; 蛋白质合成相关蛋白1个:噻唑生物合成酶; 未知功能的蛋白1个。
剪叶处理组中,蛋白质的种类属于光合作用相关蛋白2个:Rubisco加氧酶和核酮糖-1, 5-二磷酸羧化酶/加氧酶大亚基; 胁迫和防御相关蛋白1个:tau蛋白类谷胱甘肽S-转移酶; 未知功能的蛋白2个。
进一步分析表明,对照组中光合作用的蛋白种类比较多,与防御相关的蛋白质没有表达。取食刺激处理后,胁迫和防御相关蛋白高度表达,并且30头松毛虫取食后,与蛋白合成相关的蛋白质也特异表达,光合作用蛋白的种类占的比例增加; 剪叶处理后,胁迫和防御相关蛋白也有特异表达,而且能量代谢相关蛋白下调。这说明取食和创伤刺激可明显诱导油松防御蛋白表达、光合作用增强、蛋白质合成和能量代谢降低等防御反应。
3 讨论研究表明,植物的诱导防御反应是多路径、多方面的,由多种蛋白质相互作用共同完成,而近年兴起的差异蛋白质组学则能够将蛋白质表达、基因表达与植物代谢等问题联系在一起,揭示植物受到胁迫刺激后体内物质的动态变化,并由此可以推测和证明植物诱导防御的机制(刘卫群等,2006; Kim et al., 2009; Fan et al., 2009)。
关于植物诱导防御反应的机制问题,已有的研究表明,胁迫因素不同,防御的机制也不相同。镉胁迫可使得紫苏(Perilla frutescens)叶片能量代谢有关蛋白上调,光合有关蛋白下调,进而增强抗性(谢惠玲等,2014);溃疡病菌胁迫可诱导毛白杨(Populus tomentosa)具有解毒作用的过氧化物歧化酶和具有水解酶活性的异戊烯二磷酸异构酶表达量增加,有可能因而增强抗性(理永霞等,2011); 烯丙异噻唑诱导水稻(Oryza sativa)使得参与植物呼吸代谢蛋白质降解、糖合成和活性氧清除等蛋白质表达,而使其抗性增强(刘文文等,2010)。本研究证明取食和剪叶刺激可以明显诱导油松胁迫防御有关蛋白的高表达、光合作用相关蛋白的上调、蛋白质的合成相关蛋白的特异表达和能量代谢有关蛋白质的降低等,这些变化应成为油松诱导防御反应的蛋白质基础,并在一定程度上揭示了油松防御反应的可能路径。
关于创伤对植物蛋白质表达的影响,一般认为创伤可诱导植物光合有关蛋白上调表达,能量代谢有关蛋白下调表达,植物对创伤的响应策略主要是调节生长等生理过程。但也有研究表明,打顶后烟草叶片抗病相关蛋白高表达,进而增强叶片抗性(杨惠娟等,2012)。本研究通过剪叶对油松进行创伤处理后,谷胱甘肽S-转移酶(gultathione S-transferases, GSTs)特异表达。而GSTs是由多基因编码、具有多种功能的超家族酶,是多种植物体内的主要解毒系统(伍忠銮等,2004)。还有研究表明,除草剂类似物、氧化胁迫、高温等外界逆境均也可诱导谷胱甘肽S-转移酶的合成(Flury et al., 1995)。可见,创伤对植物诱导抗性的影响是多方面的,不仅可以诱导植物生理、生长相关蛋白的表达,也可以诱导解毒等防御蛋白的特异表达。
关于取食刺激对植物蛋白质表达的影响,有些研究直接从调控植物防御的效应子蛋白和防御蛋白的活性进行,发现和鉴定了一些调控植物和昆虫关系的效应子蛋白和不利于昆虫取食的防御蛋白,以及防御蛋白的活性变化(Hogemhout et al., 2011; 王琪等,2008)。本研究表明,经油松毛虫取食后,抗坏血酸过氧化物酶(aseorbateperoxidase, APX)在油松体内特异表达,APX是植物体内的重要酶系,也是植物抗坏血酸-谷胱甘肽循环途径的重要组分,被认为是叶绿体中解毒H2O2的关键酶(Asada,1999)。在诸如热休克、盐渍等逆境条件下,均导致APX转录水平和酶活性的提高,且后者的提高幅度低于前者,抗坏血酸过氧化物酶在植物响应及防御氧化胁迫方面的重要作用已得到初步的证明。本研究还表明在受到取食刺激后,油松的DHAR类谷胱甘肽S-转移酶和tau蛋白类谷胱甘肽S-转移酶特异表达,进一步证明了取食刺激可诱导与防御有关的蛋白酶类的表达,这应该是构成油松抗性的重要的蛋白质基础和可能的代谢路径。
但在本研究中存在一些不足是采用的双向电泳方法只针对酸性蛋白进行了分离,不包括碱性蛋白质。另外由于蛋白质染色和质谱鉴定灵敏度的限制,会导致有一部分蛋白不能被检测出来,所以该研究检测蛋白质的数量还是有限的。
4 结论油松毛虫取食及剪叶刺激均可导致油松蛋白点的上调、下调、消失和特异表达,而且不同处理油松蛋白点的表达差异不同,其中30头松毛虫取食处理上调蛋白点数和消失点数最低,下调点数则最高,而新增蛋白点数各处理间无明显差异; 差异蛋白点的鉴定分析表明,不同处理间油松蛋白质表达在种类和比例上存在显著差异,取食刺激处理后的油松胁迫和防御相关蛋白高度表达,与蛋白合成相关的蛋白质特异表达,光合作用的蛋白种类比例增加; 剪叶处理后的油松胁迫和防御相关蛋白也有特异表达,能量代谢相关蛋白下调,而对照中与防御相关的蛋白质没有表达。说明昆虫取食和剪叶刺激均可明显诱导油松防御有关蛋白的高表达,促进光合作用的增强和蛋白质的合成,降低能量代谢等,这些变化应是构成油松防御反应的蛋白质基础。
| [] |
戈峰, 李典谟, 邱业先, 等. 1997. 松树受害后一些化学物质含量的变化及其对马尾松毛虫种群参数的影响. 昆虫学报 , 40 (4) : 337–342.
( Ge F, Li D M, Qiu Y X, et al.1997. Studies on the changes of some chemicals in damaged pine needles and their effects on population parameters of pine caterpillar. Acta Entomologica Sinica , 40 (4) : 337–342. [in Chinese] ) (  0) 0)
|
| [] |
惠菲, 梁启全, 於丽华, 等. 2012. NaCl和KCl胁迫对甜菜幼苗生长的影响. 中国糖料 (3) : 30–32.
( Hui F, Liang Q Q, Yu L H, et al.2012. influence of NaCl and KCl stress on sugerbeet seedling growth. Suger Crops of China (3) : 30–32. [in Chinese] ) (  0) 0)
|
| [] |
李镇宇, 王燕, 陈华盛, 等. 2000. 油松对赤松毛虫的诱导化学防御及滞后诱导抗性. 林业科学 , 36 (1) : 66–70.
( Li Z Y, Wang Y, Chen H S, et al.2000. Induced chemical defenses and delayed induced resistance of Pinus tabulaeformis Carr.to Dendrolimus spectabilis Butler. Scientia Silvae Sinicae , 36 (1) : 66–70. [in Chinese] ) (  0) 0)
|
| [] |
理永霞, 吕全, 梁军, 等. 2011. 杨树接种溃疡病菌后蛋白质表达差异分析. 南京林业大学学报 , 35 (4) : 1–6.
( Li Y X, Lu Q, Liang J, et al.2011. Differential analysis of two-dimensional gel electrophoresis profiles of protein in poplars after inoculation with Botryosphaeria dothidea. Journal of Nanjing Forestry University , 35 (4) : 1–6. [in Chinese] ) (  0) 0)
|
| [] |
刘卫群, 李浩. 2006. 差异蛋白质组学在植物研究中的应用. 安徽农业科学 , 34 (17) : 4201–4203.
( Liu W Q, Li H.2006. Research on the application of differential proteomics in botany. Journal of Anhui Agricultural Sciences , 34 (17) : 4201–4203. [in Chinese] ) (  0) 0)
|
| [] |
刘文文, 李永刚, 杨秀明, 等. 2010. 受烯丙异噻唑诱导的水稻叶片蛋白质表达差异分析. 植物保护学报 , 37 (2) : 109–113.
( Liu W W, Li Y G, Yang X M, et al.2010. Analysis of expressed protein differences in rice leaves induced by pobenazole. Acta Phytophylacica Sinica , 37 (2) : 109–113. [in Chinese] ) (  0) 0)
|
| [] |
王琪, 严善春. 2008. 剪叶及昆虫取食对兴安落叶松蛋白酶抑制剂的影响. 昆虫学报 , 51 (8) : 798–803.
( Wang Q, Yan S C.2008. Activities of proteinase inhibitors in Larix gmelinii seedlings under the stresses of cutting needles and herbivore feeding. Acta Entomologica Sinica , 51 (8) : 798–803. [in Chinese] ) (  0) 0)
|
| [] |
伍忠銮, 余新炳, 吴忠道. 2004. 胞液谷胱甘肽S-转移酶的研究进展. 中国热带医学 , 4 (2) : 285–286.
( Wu Z L, Yu X B, Wu Z D.2004. Recent advances of cytosolic glutathione S-transferase. China Tropical Medicine , 4 (2) : 285–286. [in Chinese] ) (  0) 0)
|
| [] |
谢惠玲, 刘杰, 陈珊, 等. 2014. 紫苏叶片响应镉胁迫的蛋白质表达差异分析. 中国生态农业学报 , 22 (10) : 1207–1213.
( Xie H L, Liu J, Chen S, et al.2014. Analysis of differentially expressed proteins in Perilla frutescens (L.) Britt. leaves under cadmium stress.Chinese Journal of Eco-Agriculture , 22 (10) : 1207–1213. [in Chinese] ) (  0) 0)
|
| [] |
杨惠娟, 许俐, 王景, 等. 2012. 打顶前后烤烟叶片蛋白质表达差异的研究. 中国烟草学报 , 18 (5) : 73–78.
( Yang H J, Xu L, Wang J, et al.2012. An investigation into differences in protein expression in fluecured tobacco leaf before and after topping. Journal of China Tobacco , 18 (5) : 73–78. [in Chinese] ) (  0) 0)
|
| [] |
袁红娥, 严善春, 佟丽丽. 2009. 剪叶损伤与昆虫取食对兴安落叶松针叶中缩合单宁诱导作用的差异. 生态学报 , 29 (3) : 1415–1420.
( Yuan H E, Yan S C, Tong L L, et al.2009. Content differences of condensed tannin in needles of Larix gmelinii by cutting needles and insect feeding. Acta Ecologica Sinica , 29 (3) : 1415–1420. [in Chinese] ) (  0) 0)
|
| [] |
余永芳, 赵丹丹, 李玉琴. 2011. 磷胁迫下油菜幼苗叶片差异蛋白质表达的初步分析. 河南农业科学 , 40 (8) : 89–91.
( Yu Y F, Zhao D D, Li Y Q.2011. Preliminary analysis of differential proteins of Brassica napus leaves under phosphorous deficiency. Journal of Henan Agricultural Sciences , 40 (8) : 89–91. [in Chinese] ) (  0) 0)
|
| [] |
张智慧, 聂燕芳, 何磊, 等. 2012. 外源茉莉酸甲酯诱导的水稻叶片蛋白质差异表达分析. 植物病理学报 , 42 (2) : 154–163.
( Zhang Z H, Nie Y F, He L, et al.2012. Proteomic analysis of differentially expressed proteins induced by methyl jasmonate in rice leaves. Acta Phytopathologica Sinica , 42 (2) : 154–163. [in Chinese] ) (  0) 0)
|
| [] |
Asada K.1999. The water cycle in chloroplasts:Scavenging of active oxygens and dissipation of excess photons. Annu Rev Plant Physiol Plant Mol Biol , 50 : 601–639.
DOI:10.1146/annurev.arplant.50.1.601 ( 0) 0)
|
| [] |
Bradford M M.1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem , 72 : 248–254.
DOI:10.1016/0003-2697(76)90527-3 ( 0) 0)
|
| [] |
Damerval C, Vienne D D, Zivy M.1986. Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat seedling proteins. Electrophoresis , 7 (1) : 52–54.
DOI:10.1002/(ISSN)1522-2683 ( 0) 0)
|
| [] |
Fan H Y, Chen J, Shao M N.2009. Proteomic analysis of R17 cucumber differentially expressed proteins induced by powdery mildew fungus. Acta Horticulturae Sinica , 36 (6) : 829–834.
( 0) 0)
|
| [] |
Flury T, Adam D, Kreuzd K.1995. A2,4-D-inducible glutathione-S-transferases from soybean ( Glycine max ) purification,characteristion and Induction. Physiologia Plantarum , 94 (2) : 312–318.
DOI:10.1111/ppl.1995.94.issue-2 ( 0) 0)
|
| [] |
George D, Babalola O O, Gatehouse A M R.2011. Differential protein expression in maize ( Zea mays ) in response to insect attack. African Journal of Biotechnology , 10 (39) : 7700–7709.
( 0) 0)
|
| [] |
Hogenhout S A, Jorunn IB B.2011. Effector proteins that modulate plant-insect interactions. Current Opinion Plant Biology , 14 (4) : 422–428.
DOI:10.1016/j.pbi.2011.05.003 ( 0) 0)
|
| [] |
Kim D H, Duh K, Shibato J, et al.2009. Gel-based proteomics approach for detecting low nitrogen-responsive proteins in cultivated rice species. Physiol Mol Biol Plants , 15 (1) : 31–41.
DOI:10.1007/s12298-009-0003-0 ( 0) 0)
|
| [] |
Leon J, Rojo E, Sanchez-Serrano J J.2001. Wound signaling in plants. Journal of Experimental Botany , 52 (354) : 1–9.
DOI:10.1093/jexbot/52.354.1 ( 0) 0)
|
| [] |
Pechan T, Ye L J, Chang Y M, et al.2000. A unique 33-kD cysteine proteinase accumulates in response to Larval feeding in maize genotypes resistant to fall armyworm and other lepidoptera. The Plant Cell , 12 (7) : 1031–1040.
DOI:10.1105/tpc.12.7.1031 ( 0) 0)
|
| [] |
Que Y X, Xu L P, Lin J W.2011. Differential protein expression in sugarcane during sugarcane-sporisorium scitamineum interaction revealed by 2-DE and MALDI-TOF-TOF/MS. Comparative and Functional Genomics , 4 : 252–254.
( 0) 0)
|
| [] |
Rabilloud T.2002. Two-dimensional gel electrophoresis in proteomic:old,old fashioned,but it still climbs up the mountains. Proteomics , 2 (1) : 3–10.
DOI:10.1002/1615-9861(200201)2:1<>1.0.CO;2-Y ( 0) 0)
|
| [] |
Vandenborre G, Smagghe G, Van Damme E M.2011. Plant lectins as defense proteins against phytophagous insects. Phytochemistry , 72 (13) : 1538–1550.
DOI:10.1016/j.phytochem.2011.02.024 ( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52

