文章信息
- 吴柯军, 闫绍鹏, 卢宏, 李海峰, 王秋玉
- Wu Kejun, Yan Shaopeng, Lu Hong, Li Haifeng, Wang Qiuyu
- 不同木质底物诱导下白囊耙齿菌胞外木质纤维素酶活性和胞内蛋白质组的差异
- Difference in the Activity of Extracellular Lignocellulolytic Enzymes and the Intracellular Proteome of Irpex lacteus Induced by Different Wood Substrates
- 林业科学, 2016, 52(8): 157-166
- Scientia Silvae Sinicae, 2016, 52(8): 157-166.
- DOI: 10.11707/j.1001-7488.20160819
-
文章历史
- 收稿日期:2015-06-23
- 修回日期:2015-11-10
-
作者相关文章
白腐菌是一类特殊的丝状真菌, 生长于阔叶树或针叶树的活立木、枯立木或倒木上,引起木材白色腐朽(王宏勋等,2006)。木质纤维素广泛存在于植物细胞中,是自然界含量最多的有机可再生资源(吕世翔等,2009),但难以被降解利用,造成资源和能源浪费。在所有能够分解木质素的微生物中,只有白腐菌能够彻底分解木质素,进而为纤维素的充分利用提供可能。白腐菌分泌3种与木质素降解相关的胞外降解酶:木质素过氧化物酶(lignin-peroxidase, LiP)、锰过氧化物酶(manganese peroxidase, MnP)和漆酶(laccase, Lac),这3种酶能够降解木质素以及卤素、有机氯农药、多环芳烃、偶氮染料等对环境有害的物质。白腐菌菌体对重金属离子、合成染料具有生物吸附能力(蒋晓云等,2005),在废水污染治理、能源利用、造纸工业、食品医药工业和环境保护等方面具有广泛的应用前景(Yaghoubi et al., 2008; Yoon et al., 2013);同时,也分泌纤维素降解相关酶。纤维素酶是一组能将纤维素分解成二糖或单糖分子的酶系,主要由内切β-葡聚糖酶、外切β-葡聚糖酶和β-D-葡萄糖苷葡萄糖水解酶组成(张晓勇等,2006)。纤维素是地球上存储量最大的可再生资源,利用微生物分泌胞外纤维素酶的降解作用是自然界中降解木质纤维素的主要环节(杨晓宸等,2007)。
一般来说,在木材腐朽过程中会发生一系列生理生化改变,从而诱导一些木材腐生菌基因的特异表达(Kerem et al., 1999;Ferraz et al., 2008)。国外多侧重于降解酶的酶学性质及其分子、蛋白质组学的研究,国内则侧重于木材腐朽菌酶活性动力学、木材和有机污染物降解以及细胞内多糖的研究,但尚未见对不同种类木材诱导下白囊靶齿菌(Irpex lacteus)的胞外蛋白酶活性和胞内蛋白质组差异表达的系统研究。
本研究选择白桦(Betula platyphylla)和红皮云杉(Picea korainsis)木屑作为诱导物,利用白囊耙齿菌对白桦、红皮云杉木材的生物降解能力,研究白囊耙齿菌5种胞外分泌蛋白酶的活性变化以及胞内蛋白质组的表达差异,从蛋白表达水平探讨该菌种对不同基质的机制,为筛选用于生物制浆、林木病腐防治和工业污染物降解的高效菌株提供科学依据。
1 试验材料菌种材料采自黑龙江省哈尔滨市东北林业大学帽儿山实验林场(127°18′0″—127°41′6″E,45°2′20″—45°18′16″N)。2013年9月从白桦枯立木上采集白囊耙齿菌子实体,用组织分离法得到纯菌丝(曹宇,2013),在木屑培养基中4 ℃保存。
木屑材料采自东北林业大学帽儿山实验林场的白桦和红皮云杉天然成熟林,选择优树,在大约胸高位置用木材生长锥(直径5 mm)钻取木样,带回实验室,破碎处理,4 ℃保存。
2 研究方法 2.1 培养基的配制1) 菌种的纯化和保藏 选用马铃薯葡萄糖琼脂培养基(PDA)(赵敏等,2011);马铃薯葡萄糖液体培养基用以在液体条件下培养白囊耙齿菌,进而制备5种胞外蛋白酶的粗酶液和提取胞内总蛋白。其配制方法与PDA培养基方法类似,只是不加琼脂,其他条件相同。
2) 产酶培养基 营养液中各物质的质量分数分别为:1×10-4NaCl,1×10-4CaCl2,1.6×10-5MnSO4·H2O,2×10-5CoCl2,2% (NH4)2SO4,5×10-5FeSO4·7H2O,0.5% MgSO4·7H2O,1.4×10-5ZnSO4·7H2O,0.1% KH2PO4。向50 mL三角瓶中加入1 g碳源物质(白桦或红皮云杉木屑)和10 mL营养液,0.1 MPa气压,121 ℃灭菌20 min。
2.2 菌种的活化与纯化选取菌种保藏箱中菌丝较多、无杂菌污染的菌株在PDA培养基平板上进行转接,获得纯菌株,4 ℃保存备用(曹宇等,2012)。
2.3 白囊耙齿菌5种胞外蛋白酶的酶活性检测1) 木质素降解相关酶的活性检测 取4块纯化的菌饼(直径约为1 cm)接种在装有45 mL马铃薯葡萄糖液体培养基的250 mL三角瓶中,再分别添加1 g红皮云杉或白桦木屑,对照样无木屑,每个样品3次重复。水平摇床上28 ℃、120 r·min-1摇动培养。在培养第3,6和9天时制取粗酶液:4 ℃以下、12 000 r·min-1离心10 min得到上清液,即为粗酶液。
LiP酶活性的测定:反应体系为2 mmol·L-1藜芦醇0.3 mL、0.4 mmol·L-1H2O20.1 mL、50 mmol·L-1酒石酸钠缓冲液(pH=2.5)0.6 mL以及1 mL粗酶液,紫外分光光度计检测波长在λ=310 nm时吸光度值在0~2 min内的变化情况。酶活单位定义:每分钟氧化1 μmol藜芦醇所需的酶量(李翠珍等,2005)。
MnP酶活性的测定: 0.2 mmol·L-1MnSO4溶液0.2 mL、0.4 mmol·L-1愈创木酚0.7 mL、50 mmol·L-1柠檬酸-柠檬酸钠缓冲液(pH=4.6)1 mL、0.1 mol·L-1 H2O2 0.1 mL以及1 mL粗酶液,在30 ℃条件下,紫外分光光度计检测λ=465 nm时吸光度值在0~2 min内的变化情况。酶活单位(U)定义:每分钟氧化1 μmol Mn2+所需的酶量(李翠珍等,2005)。
Lac酶活性的测定:反应体系为1 mmol·L-12, 2联氮-二(3-乙基-苯并噻唑-6磺酸)二铵盐(ABTS)1.5 mL、50 mmol·L-1醋酸-醋酸钠缓冲液(pH=5.0)0.5 mL以及1 mL粗酶液,紫外分光光度计检测波长为λ=420 nm时吸光度值在0~4 min内的变化情况。酶活性单位(U)定义:每分钟氧化1 μmol ABTS所需的酶量(付时雨等,2005)。
2) 纤维素降解相关酶活性的检测 取营养液10 mL装入容量为50 mL的三角瓶中,并加入1 g白桦或红皮云杉木屑,对照样不加木屑,配成产酶培养基,接入1块纯化菌饼(直径约1 cm)静置培养,每个样品3次重复。在培养第3,6,9天时制取粗酶液:向培养物中加入5倍质量的蒸馏水,盖上封口膜浸泡12 h,2~3层纱布过滤,4 ℃以下,6 000 r·min-1离心10 min,取上清即为粗酶液。
葡聚糖外切酶活性检测:反应体系为1 mL 2%微晶纤维素(溶于0.05 mol·L-1柠檬酸-柠檬酸钠缓冲液,pH=4.8)以及1 mL粗酶液,50 ℃恒温水浴2 h后,加入1 mL 3,5二硝基水杨酸(DNS),沸水浴5 min,冷却后测定波长λ=550 nm处的吸光度值。酶活单位(U)定义:每分钟释放1 μmol还原糖(葡萄糖)所需的酶量(王晓芳,2002)。
葡聚糖内切酶活性检测:反应体系为0.5 mL l%羧甲基纤维素钠(CMC)(溶于0.05 mol·L-1的柠檬酸-柠檬酸钠缓冲液,pH=4.8)以及0.5 mL粗酶液,50 ℃恒温水浴30 min,加入2 mLDNS,沸水浴5 min,冷却后测定波长λ=540 nm处的吸光度值。
酶活单位(U)定义:每分钟产生1 μmol葡萄糖所需的酶量(张瑞萍,2002;池雅琴等,2010)。
2.4 白囊耙齿菌胞内蛋白质组的差异表达分析1) 菌体总蛋白的提取 取5块纯化菌饼(直径约1 cm)接种于装有100 mL马铃薯液体培养基的1 000 mL三角瓶中,再分别添加1 g红皮云杉或白桦木屑,对照样无木屑,每组3次重复。水平摇床上28 ℃、120 r·min-1摇动培养20天,提取蛋白前取出菌丝体。
将每组3次重复样品取出,分别取1 g菌丝体,加入液氮研磨至粉末状,取0.5 mL粉末加入含有1 mL TCA/丙酮溶液的离心管中,震荡后,-20 ℃静置过夜;4 ℃,12 000 r·min-1离心30 min,取沉淀,加入100%丙酮,-20 ℃静置30 min;4 ℃、12 000 r·min-1离心30 min,取沉淀,真空冷冻干燥;在25 mg干燥蛋白粉末中加入500 μL裂解液(8 mol·L-1尿素、2 mol·L-1硫脲、4%CHAPS、60 mmol·L-1 DTT、40 mmol·L-1 Tris-base、0.5 mmol·L-1 PMSF、5%Pharmalate),处理4 h,13 000 r·min-1离心15 min除去杂质,取上清,上清液即为菌体的总蛋白溶液,并用Bradford法测定提取的蛋白质溶液的浓度(Bradford,1976),分装后,-80 ℃保存备用。
2)菌体总蛋白的双向电泳 第1向固相pH梯度等电聚焦电泳,IPG胶条(13 cm,pH=4~7),上样蛋白的量为750 μL,水化和聚焦温度为24 ℃,胶条极限电流为每根50 μA。等点聚焦程序为:50 V水化12~14 h,100 V聚焦1 h,500 V聚焦1 h,1 000 V聚焦1 h,8 000 V聚焦0.5 h,8 000 V聚焦5 h。
胶条的平衡和第2向SDS-PAGE电泳,参考杜照奎(2014)的方法,电泳参数如下:起始电流为4 mA/gel/13 cm,电压100 V,待样品全部跑出胶条下沿并完全进入浓缩胶中,电压改为150~200 V,待溴酚蓝或蛋白Marker前沿达到凝胶底部边缘时停止电泳。
3) 胶体的染色与扫描对比检测(Detection/Staining) 电泳结束后,采用考马斯亮蓝R-250染色,胶片使用Image Scanner Ⅲ (GE Healthcare, USA)扫描仪扫描,设置扫描分辨率为600 DPi,图像比例为1:1。胶体用保鲜膜密封,4 ℃保存备用。
4) 差异蛋白的质谱鉴定及功能分类 用Image Master 2D Platinum 6.0 (Amersham)、Melanie 6.0和Image master v501 trial((Amersham Biosciences)进行蛋白表达差异点比对分析,设置蛋白质点检测的参数为:Smooth=2,Minarea=5,Saliency=150。通过调整对比度、斑点检测、匹配凝胶,得到蛋白质斑点的具体信息,匹配后确定差异点。以蛋白点的相对体积对蛋白质斑点进行定量。从凝胶上切取差异蛋白质点,送到哈尔滨赛信生物科技开发有限公司进行考染串联质谱检测(4800型MALDI TOF/TOF Proteomics Analyzer)。数据返回后,利用MASCOT软件搜索NCBI Nr数据库鉴定蛋白质。
根据Nr注释信息,利用Blast2GO软件得到每个蛋白质点的功能分类。
2.5 数据处理方法采用Excel,SPSS,Origin7.0,Blast2GO和MASCOT软件对所测的数据进行统计分析。
3 结果与分析 3.1 白囊耙齿菌胞外酶的活性变化1) 木质素降解相关酶活性变化 检测白囊耙齿菌在白桦、红皮云杉木屑诱导下的木质素过氧化物酶、锰过氧化物酶、漆酶活性变化,如图 1所示。木屑诱导下的木质纤维素胞外酶活性都高于对照样品,说明木屑对木质素降解酶系的表达产生了明显诱导作用,3种酶都与木材成分的分解有关。3种酶中漆酶活性最强,木质素过氧化物酶次之,锰过氧化物酶活性最低。木屑诱导下的木质素过氧化物酶活性在不同测定时间上达到显著差异(P < 0.05);在培养第9天时,白桦诱导组和红皮云杉诱导组酶活都达到最高,分别为11.104 U和13.043 U,由T检验可知,白桦与红皮云杉诱导组间差异显著(P < 0.05)。锰过氧化物酶的木屑诱导组与对照组相比差异达显著水平(P < 0.05);第9天时,2个诱导组酶活都达到最高,白桦诱导组达到8.694 9 U,红皮云杉诱导组达到7.983 4 U。由T检验可知,培养第6天时,2个处理组间差异达到显著水平(P < 0.05),第9天时接近但差异不显著(P>0.05)。漆酶在表达量上较其他2种酶有极大优势,方差分析显示,木屑诱导组与对照组间差异随时间变化达极显著水平(P < 0.01),漆酶活性在第6天时达到最高,白桦和红皮云杉诱导组分别达到53.857 U和49.411 U。由T检验可知,在第6天时,2个处理组达到显著水平(P < 0.05),第9天时,差异达到极显著水平(P < 0.01)。在培养第6天时,白桦诱导组3种酶活性均高于红皮云杉诱导组,但在培养第9天时,红皮云杉诱导组的木质素过氧化物酶和漆酶活性都高于白桦诱导组,也就是说,白囊耙齿菌在生长的不同时间对不同木质材料的诱导反应不同。

|
图 1 3种木质素降解相关酶的活性变化 Fig.1 The activity changes of three kind of ligninolytic enzymes A:木质素过氧化物酶活性The activity of lignin-peroxidase;B:锰过氧化物酶活性The activity of manganese-peroxidase;C:漆酶活性The activity of laccase. |
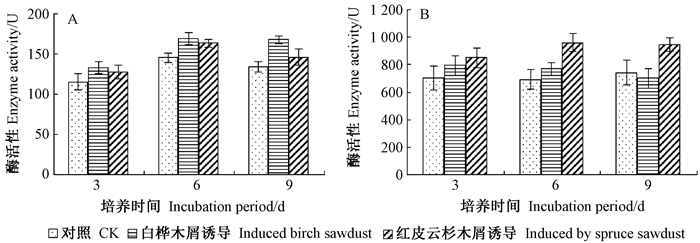
2) 纤维素降解相关酶活性变化 葡聚糖内切酶和葡聚糖外切酶活性变化如图 2所示。葡聚糖外切酶活性远高于相同培养天数的葡聚糖内切酶的活性,前者活性在700~850 U之间,后者活性在110~170 U之间,该菌可能更趋向于靠分泌葡聚糖外切酶来分解木材纤维素。
|
图 2 2种纤维素降解相关酶的活性变化 Fig.2 The activity changes of two kind of cellulase enzymes A:葡聚糖内切酶活性The activity changes of endoglucanase; B:葡聚糖外切酶活性变化The activity changes of exoglucanase. |
白桦诱导组和红皮云杉诱导组的葡聚糖内切酶酶活在第6天时都达到最大值,分别为169.28U和163.53 U,由T检验可知,对照组与红皮云杉处理组间在6天差异显著(P < 0.05),在9天时极显著(P < 0.01),2个处理组间在第9天时差异显著(P < 0.05)。白桦诱导组的葡聚糖外切酶酶活在第3天时达到最大值792.77 U,红皮云杉诱导组的葡聚糖外切酶酶活在第6天时达到最大值957.82 U。由T检验可知,对照组与红皮云杉诱导组在第6和9天时差异均显著(P < 0.05),2个诱导组间在第6和第9天时差异均显著(P < 0.05)。白桦诱导组在培养全过程中内切酶活性均高于红皮云杉诱导组,而红皮云杉诱导组的外切酶活性均高于白桦诱导组,由此可见,不同的纤维素酶对不同木质底物的诱导反应也不同。
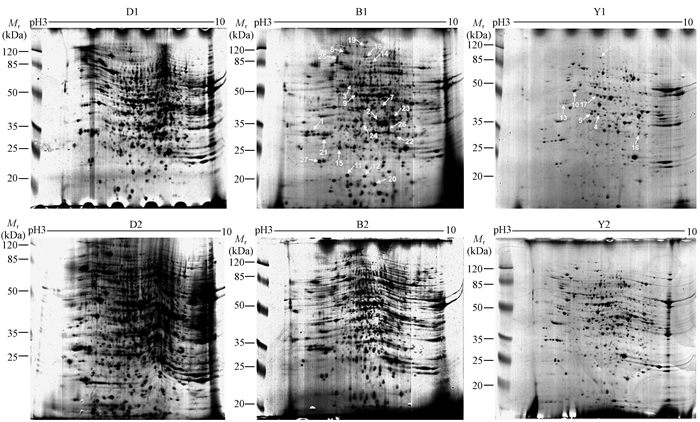
3.2 不同木屑底物诱导下白囊耙齿菌胞内蛋白质组的差异表达分析1) 白囊耙齿菌胞内蛋白双向电泳图谱 图 3所示胞内蛋白双向电泳图谱中,每个样品重复2次以保证蛋白表达的可重复性。白桦的2D-page图谱质量较好,蛋白点清晰且圆润,虽有条纹但蛋白点较多,表达比较丰富。相比之下,对照样品蛋白表达最为丰富。红皮云杉样品各蛋白点清晰,但本身表达量较少且多为小分子蛋白,在图谱上可观察到的点较少。3组蛋白点均分布在中部偏上位置,蛋白分子质量在10~120 kda之间,等电点pI多分布在4~7之间,且在6附近最多,说明菌体蛋白多数偏酸性,而且这一结果在之后的蛋白质谱结果中也得到了证实。
|
图 3 白囊耙齿菌胞内蛋白双向电泳图谱 Fig.3 2-DE maps of intracellular proteome from I. lacteus D1,D2:对照组2-DE maps of the control from Irpex lacteus; B1, B2:白桦木屑诱导下的胞内蛋白双向电泳图谱2-DE maps of intracellular proteome induced with brich wood powder; Y1, Y2:红皮云杉木屑诱导下的胞内蛋白双向电泳图谱2-DE maps of intracellular proteome induced with spruce wood powder. |
2) 不同木屑诱导下胞内蛋白表达差异 对照组检测到823个蛋白质点,白桦处理组检测到673个蛋白质点,红皮云杉处理组检测到684个蛋白质点。与对照组相比,白桦和红皮云杉处理组检测发现32个明显差异蛋点,对32个差异蛋白进行质谱鉴定,共成功鉴定27个蛋白质点(表 1)。其中12个蛋白点表达量上调表达,15个蛋白点表达量下调表达,包括6个蛋白点为未知功能蛋白。
|
|
3) 差异表达蛋白质点的质谱鉴定结果 (1)白桦处理组特异蛋白鉴定 将白桦处理组与对照组检测到的蛋白点经过反复比对后,得到明显差异蛋白点23个,白桦处理组特异蛋白点有3个(表 1),分别为:点1(丙酮酸脱氢酶E1组件β亚基),是丙酮酸脱氢酶复合体的构成之一,是生物体内催化丙酮酸转变成乙酰辅酶A反应的3种酶及5种辅酶的组成。另外,此复合物也是生物体内另外2种酶复合物的原型,分别参与柠檬酸循环的α-酮基戊二酸复合物以及参与一些氨基酸氧化路径的支链α-酮酸脱氢酶复合物(Leung et al., 2007)。点2(细胞膜整合蛋白),该蛋白属于溴化丙胺太林家族的成员之一,是一种膜上的脂筏蛋白,具有脚手架功能,推测能与多种膜蛋白,如离子通道、转运子、骨架蛋白和信号转导蛋白等结合,并影响其功能(Eikmanns,2005)。点3(甲基跨膜接受蛋白),主要存在于与ATP结合的蛋白质中,包括组氨酸激酶、甲基转移酶、热休克蛋白等,推测该结构域的主要功能是将胞外的信号传递给胞内激酶,主要由2个N-末端跨膜区及其他信号输入结构域来感受胞外信号,可感知溶液和胞外营养条件等。
(2) 红皮云杉处理组特异蛋白鉴定 将红皮云杉处理组与对照组检测到的蛋白质点经过反复比对后,发现明显差异点27个,红皮云杉组特异蛋白点有3个(表 1),分别为:点4(拉齐家族转录调节因子),包括7个功能成员,由氨基末端的螺旋-转角-螺旋(HTH)基序和1个羧基端结构域对于低聚和效应器结合组成,可能在很多细菌或真菌对不同碳源等能源的利用中扮演重要角色,在分解木材过程中起很大作用。点5(蛋白合成修饰),即40S核糖体蛋白,定位于细胞质内,是一个大类的总称,其中包括许多小的蛋白簇,如核糖体蛋白质(ribosomal protein, RP)是一种广泛存在的RNA结合蛋白,主要参与蛋白质的翻译、翻译后修饰或辅助蛋白质折叠等功能。点6(类似保守假定蛋白),涉及的具体生物功能还不能确定。
由此可见,白囊耙齿菌对阔叶树的白桦木材和针叶树的红皮云杉木材的分解过程中在胞内特异蛋白表达上有明显差异,白桦木材诱导下特异表达蛋白与膜蛋白、膜运输和能量提供有关,而红皮云杉诱导组特异表达蛋白大多与蛋白合成有关。其原因可能与2类树种的木材结构差异有关,其各自的木材分解机制还有待于进一步探讨。
(3) 2个处理组共同特异蛋白的鉴定 在2个处理组检测发现并成功鉴定的27个明显差异蛋白点中,去除组内特异表达和功能不明的蛋白点,还有15个在2个处理组共同表达的差异蛋白点,其中5个蛋白点上调表达,10个蛋白点下调表达(表 1)。
2个处理组发现的差异蛋白质按功能不同可以分为6大类。第Ⅰ类,与能量和物质代谢作用相关的蛋白7种,包括丙酮酸脱氢酶E1组件β亚基(点1),赖氨酸/鸟氨酸单加氧酶(点9)、NADH脱氢酶(点10)、转醛醇酶(点12)、螺旋酶B亚基(点13)、转醛酶(点15),依赖ATP的RNA解旋酶(点19);第Ⅱ类,与物质传导和运输相关蛋白3种,包括甲基跨膜接受蛋白(点3)、类似驱动蛋白K39的假定蛋白(点8)、鸟嘌呤核苷酸结合蛋白β亚基(点11);第Ⅲ类,与分解和防御有关的蛋白3种,包括拉齐家族转录调节因子(点4)、GTP结合蛋白延伸因子-Tu(点17)、依赖ATP的核酸外切酶(点18);第Ⅳ类,细胞膜整合蛋白1种,即溴化丙酰太林家族(点2);第Ⅴ类,蛋白合成修饰1种,即40S核糖体蛋白(点5);第Ⅵ类,未知功能蛋白质6种,包括点7,23,24,25,26和27,这6个蛋白点质谱结果显示为假设蛋白,其功能目前还不明确,可能是新蛋白或者是刚被收录进入数据库的蛋白质,有待进一步研究。
4 讨论白囊耙齿菌为非褶菌目(Aphyllophorales)多孔菌科(Polyporaceae)耙齿菌属(Irpex),是一种担子菌,能够造成木材白色腐朽。该菌生长在北温带,如北美、欧洲和亚洲;常生于阔叶树的枯立木枝干和倒木上,偶尔生于针叶树上(Ryvarden et al., 1993)。木材腐朽菌的木质纤维素酶是由菌种基因表达并分泌到细胞外的一类蛋白质,用于分解木材的木质纤维素,造成木材腐朽。本研究以阔叶树白桦和针叶树红皮云杉木屑作为诱导物从蛋白表达水平上研究白囊耙齿菌对不同木材底物的腐朽机制和作用差异。
Song等(2015)利用密粘褶菌(褐腐菌)[Gloeophyllum trabeum(Pers.: Fr) Murr]和白囊耙齿菌(白腐菌)同时侵染北美白桦(Betula papyrifera)、红槲栎(Quercus rubra)、松(Pinus sp.)和白云杉(Picea glauca)木样,探讨2种菌的生长竞争优势,发现不论是阔叶树还是针叶树,尽管密粘褶菌的接种量远远高于白囊耙齿菌,但白囊耙齿菌在处理3周内长势还是优于密粘褶菌。Tubajika等(2007)报道了利用射频处理研究白囊耙齿菌侵染的栎(Quercus spp.)、银白杨(Populus alba)和松(Pinus spp.)木材的变色控制,处理效果达到98%~100%。与其他白腐菌相比,白囊耙齿菌具有非常强的木质纤维素生物降解能力。由于其对木馏油有很强的耐受性,已成为检测化学和生物木材防腐剂作用效果的指示菌种(Novotný et al., 2009)。本研究也证实白囊耙齿菌在白桦木屑诱导下的锰过氧化物酶、漆酶和葡聚糖内切酶活性显著高于红皮云杉木屑诱导,而红皮云杉木屑诱导下的木质素过氧化物酶,漆酶以及葡聚糖外切酶活性均高于白桦木屑诱导。这也说明白囊耙齿菌的木质纤维素酶在针叶和阔叶木材底物诱导下均能表达,但在不同的酶表达量上差异很大。推测白桦木材腐朽主要是通过锰过氧化物酶和漆酶降解木质素、葡聚糖内切酶降解纤维素途径完成,而红皮云杉木材腐朽主要通过木质素过氧化物酶和漆酶降解木质素、葡聚糖外切酶降解纤维素途径完成。
研究显示,木屑诱导的5种与木质纤维素降解相关的胞外分泌蛋白酶活性大都高于对照样品。该菌分泌的木质素降解酶中漆酶活性最强,木质素过氧化物酶次之,锰过氧化物酶活性最低,漆酶酶活在处理组和对照组间差异达极显著水平,且白桦处理组酶活在培养中期达到最高,红皮云杉处理组在培养后期达到最高,可见漆酶对不同木材底物诱导表达的反应在时间上是有差异的,但均为高表达酶蛋白。白囊靶齿菌分泌的纤维素降解酶系中,葡聚糖外切酶活性远大于葡聚糖内切酶活性,2种纤维素酶的表达在同一处理内总体趋于稳定。红皮云杉处理组的葡聚糖外切酶酶活总体上远高于白桦处理组。可见,白囊耙齿菌分泌的葡聚糖外切酶可能也更偏好于分解针叶类树种的纤维素。除了漆酶和葡聚糖外切酶,另外2种酶活性相对很低,但真菌对木材的腐朽关系复杂(刘欣等,2008),是活性高的酶单独作用腐朽能力强还是几种酶相互作用腐朽能力更强,还有待于进一步研究。
使用2-DE差异分析软件对不同的蛋白点进行比对分析,检测到对照样品823个蛋白点,而2个处理样品均有不少于600多个蛋白点,说明木质底物的诱导会关闭一些胞内基因的表达,但会增加胞外木质纤维素酶蛋白的大量表达,这也是木材腐朽的机制所在。另外,在胞内蛋白质组检测中,白桦和红皮云杉木屑处理组共检测到32个明显差异蛋白点,对32个点做质谱鉴定,成功得到27个蛋白点的质谱鉴定结果,有12个点表达上调,15个点表达下调。蛋白表达量上调,说明该菌内部代谢系统可能正在调节相关的机能,使一些有助于菌体更好适应环境的酶或蛋白质表达量增多;蛋白表达量下调,是菌体为了更好地生存,降低了表达量或者没有效应的蛋白表达量。大多蛋白质表达量基本不变,这类蛋白质通常参与细胞的基础代谢,能够维持基本的生命活动。在胞内蛋白质组检测中几乎没有发现木质纤维素降解酶在胞内的差异表达,这可能也与该类酶的胞外分泌有关。因此,可以推测白囊耙齿菌的木质纤维素酶蛋白一旦在胞内转录表达后会迅速地分泌到胞外用于木材的木质纤维素降解,但它与胞内膜蛋白转运以及胞内蛋白大量合成和代谢参与是分不开的。
5 结论用阔叶树白桦和针叶树红皮云杉2种不同类型树种木屑对白囊耙齿菌进行诱导,白桦和红皮云杉诱导组的5种胞外分泌蛋白酶活性大都高于不加木屑诱导的对照样品,说明白囊耙齿菌可以在阔叶树白桦和针叶树红皮云杉上生长,与Ryvarden等(1993)的研究相符;5种胞外分泌蛋白酶中,木质素降解相关酶的漆酶活性最高,纤维素降解相关酶的葡聚糖内切酶和葡聚糖外切酶的酶活性均很高,尤其是葡聚糖外切酶,这表明可以选择白囊耙齿菌作为高产漆酶、葡聚糖外切酶和葡聚糖内切酶的工程菌株应用在相关的生物工程上,扩大了工程菌株的选择范围;白桦和红皮云杉处理组各有3个特异差异蛋白点,白桦处理组特异表达蛋白与膜蛋白、膜运输和能量提供有关,而红皮云杉处理组特异表达蛋白多与蛋白的合成有关,这说明针叶和阔叶木材木屑诱导下白囊耙齿菌胞内蛋白质的表达存在差异,在分解白桦木屑时分泌蛋白的胞内外运输可能是木材降解的关键,而在分解红皮云杉木屑时其相关分泌蛋白的大量合成将起决定作用;胞内蛋白质组存在的差异,同时也证明了白囊耙齿菌对针叶树和阔叶树木材的腐朽机制是不相同的,其菌种胞内外蛋白的相互作用机理还有待于菌种的基因转录组结合蛋白表达水平上的深入研究。
| [] |
曹宇, 徐晔, 王秋玉. 2012. 木蹄层孔菌不同居群间生长特性、木质素降解酶与SRAP标记遗传多样性. 生态学报 , 32 (22) : 7061–7071.
( Cao Y, Xu Y, Wang Q Y.2012. Growth characteristies, lignin degradation enzyme and genetic diversity of Fomes fomentarius by SRAP marker among populations. Acta Ecologica Sinica , 32 (22) : 7061–7071. DOI:10.5846/stxb [in Chinese] ) (  0) 0)
|
| [] |
曹宇.2013.海绵状白腐菌木质纤维素酶活性及其基因的遗传变异研究.哈尔滨:东北林业大学硕士学位论文. ( Cao Y.2013.Studies on the lignocellulose enzyme activity of wood spongy of white-rot fungi and genetic variations.Harbin:MS thesis of Northeast Forestry University.[in Chinese][in Chinese]) http://cdmd.cnki.com.cn/article/cdmd-10225-1013366824.htm |
| [] |
池雅琴, 黄奎. 2010. 纤维素酶活力测定方法研究进展. 现代农业科技 (24) : 32–34.
( Chi Y Q, Huang K.2010. Research progress on method for determination of cellulase activity. Modern Agricultural Science and Technology (24) : 32–34. [in Chinese] ) (  0) 0)
|
| [] |
杜照奎, 李钧敏, 钟章成, 等. 2014. 花生叶片蛋白组对UV-B辐射增强的影响. 生态学报 , 34 (10) : 2589–2598.
( Du Z K, Li J M, Zhong Z C, et al.2014. A proteomic analysis of Arachis hypogaea leaf in responses to enhanced ultraviolet-B radiation. Acta Ecologica Sinica , 34 (10) : 2589–2598. [in Chinese] ) (  0) 0)
|
| [] |
付时雨, 周攀登. 2005. 真菌漆酶及其催化对苯基苯酚聚合条件的研究. 化学通报 (3) : 225–228.
( Fu S Y, Zhou P D.2005. Fungal laccase and its application of polymerization of 4-phenylphenol. Chemistry (3) : 225–228. [in Chinese] ) (  0) 0)
|
| [] |
蒋晓云, 曾光明, 黄国和, 等. 2005. 白腐菌的研究进展及其在重金属修复中的展望. 中国生物工程杂志 (S1) : 118–121.
( Jiang X Y, Zeng G M, Huang G H, et al.2005. Research progress of white-rot fungi and its prospect in heavy metal remediation. China Biotechnology (S1) : 118–121. [in Chinese] ) (  0) 0)
|
| [] |
李翠珍, 文湘华. 2005. 白腐真菌F2的生长及产木质素降解酶特性的研究. 环境科学学报 , 25 (2) : 226–231.
( Li C Z, Wen X H.2005. Characterization of growth and ligninolytic enzymes production of a white rot fungus F2. Acta Scientiae Circumstantiae , 25 (2) : 226–231. [in Chinese] ) (  0) 0)
|
| [] |
刘欣, 赵敏, 王秋玉. 2008. 5种木材腐朽菌的生物学特性及对白桦木材腐朽能力的分析. 东北林业大学学报 , 36 (3) : 41–44.
( Liu X, Zhao M, Wang Q Y.2008. Biological characters of five species of wood rot fungi and decay capacity to Betula platyphylla. Journal of Northeast Forestry University , 36 (3) : 41–44. [in Chinese] ) (  0) 0)
|
| [] |
吕世翔, 王秋玉. 2009. 白腐菌在木质纤维素降解中的应用进展. 森林工程 , 25 (4) : 26–31.
( Lü S X, Wang Q Y.2009. Application progress of white rot fungi in lignocellulose degradation. Forest Engineering , 25 (4) : 26–31. [in Chinese] ) (  0) 0)
|
| [] |
王宏勋, 杜甫佑, 张晓昱. 2006. 白腐菌选择性降解秸秆木质纤维素研究. 华中科技大学学报:自然科学报 , 34 (3) : 97–100.
( Wang H X, Du F Y, Zhang X Y.2006. Selective degradation of corn straw lignocellulose by white-rot fungi. Journal of Huazhong University of Sci&Tech:Nature Science Edition , 34 (3) : 97–100. [in Chinese] ) (  0) 0)
|
| [] |
王晓芳.2002.产纤维素酶的真菌筛选与纤维素酶的诱导及其理化性质研究.南京:南京师范大学硕士学位论文. ( Wang X F.2002.Screening of cellulase-producing fungi and the induction of cellulase and its physical and chemical properties.Nangjing:MS thesis of Nanjing Normal University.[in Chinese][in Chinese]) http://cdmd.cnki.com.cn/article/cdmd-10319-2002092150.htm |
| [] |
杨晓宸, 卢雪梅, 黄峰. 2007. 木质纤维素微生物转化机理研究进展. 纤维素科学与技术 , 15 (1) : 52–58.
( Yang X C, Lu X M, Huang F.2007. Research progress on the mechanism of microbial transformation of lignocellulose. Journal of Cellulose Science and Technology , 15 (1) : 52–58. [in Chinese] ) (  0) 0)
|
| [] |
张瑞萍. 2002. 纤维素酶活力测定方法. 印染 (8) : 38–54.
( Zhang R P.2002. Determination methods of cellulase activity. Printing and Dyeing (8) : 38–54. [in Chinese] ) (  0) 0)
|
| [] |
张晓勇, 高向阳, 陈秀霞, 等. 2006. 纤维素酶半纤维素酶的应用及分子相关性. 纤维素科学与技术 , 14 (1) : 47–51.
( Zhang X Y, Gao X Y, Chen X X, et al.2006. Application and molecular correlation of cellulase and hemicellulases. Journal of Cellulose Science and Technology , 14 (1) : 47–51. [in Chinese] ) (  0) 0)
|
| [] |
赵敏, 王海东, 赵丹, 等. 2011. 产漆酶疣孢漆斑菌NF-05的分离及对偶氮染料的脱色. 菌物学报 , 30 (4) : 604–611.
( Zhao M, Wang H D, Zhao D, et al.2011. Isolation and decolorization of azo dye of a laccase-producing Myrothecium verrucaria NF-05. Mycosystema , 30 (4) : 604–611. [in Chinese] ) (  0) 0)
|
| [] |
Bradford M M.1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem , 72 : 248–254.
DOI:10.1016/0003-2697(76)90527-3 ( 0) 0)
|
| [] | Eikmanns B J.2005.Central metabolism:tricarboxylic acid cycle and anaplerotic reactions.Handbook of Corynebacterium glutamicum.CRC Press, Boca Raton, FL. |
| [] |
Ferraz A, Guerra A, Mendona R., et al.2008. Technological advances and mechanistic basis for fungal biopulping. Enzyme Microb Technol , 43 (2) : 178–185.
DOI:10.1016/j.enzmictec.2007.10.002 ( 0) 0)
|
| [] |
Kerem Z, Jensen K A, Hammel K E.1999. Biodegradative mechanism of the brown rot basidiomycete Gleophyllum trabeum:evidence for an extracellular hydroquinone-driven fenton reaction. Febs Letters , 446 (1) : 49–54.
DOI:10.1016/S0014-5793(99)00180-5 ( 0) 0)
|
| [] |
Leung P S C, Rossaro L, Davis P A., et al.2007. Antimitochondrial antibodies in acute liver failure:implications for primary biliary cirrhosis. Hepatology , 46 (5) : 1436–1442.
DOI:10.1002/hep.21828 ( 0) 0)
|
| [] |
Novotný Č, Cajthaml T, SvobodováK., et al.2009. Irpex lacteus, a white-rot fungus with biotechnological potential. Folia Microbiologica , 54 (5) : 375–390.
DOI:10.1007/s12223-009-0053-2 ( 0) 0)
|
| [] | Ryvarden L, Gilbertson R L.1993.European Polypores Part 1. Abortiporus-Lindtnria, Synopsis Fungorum 6, Fungiflora.Oslo (Norway), 36-37, 351-353. |
| [] |
Song Z W, Vail A, Sadowky M J, et al.2015. Influence of hyphal inoculum potential on the competitive success of fungi colonizing wood. Microbial Ecology , 69 (4) : 1–10.
( 0) 0)
|
| [] |
Tubajika K M, Jonawiak J J, Mack R, et al.2007. Efficacy of radio frequency treatment and its potential for control of sapstain and wood decay fungi on red oak, polar, and southern yellow pine wood speices. The Japan Wood Reaseach Society , 53 : 258–263.
( 0) 0)
|
| [] |
Yaghoubi K, Pazouki M, Shojaosadati S A.2008. Variable optimization for biopulping of agricultural residues by Ceriporiopsis subvermispora. Bioresource Technology , 99 (10) : 4321–4328.
DOI:10.1016/j.biortech.2007.08.043 ( 0) 0)
|
| [] |
Yoon J J, Cha C J, Kim Y S, et al.2013. Degradation of cellulose by the major endoglucanase produced from the brown-rot fungus Fomitopsis pinicola. Biotechnology Letters , 30 (8) : 1373–1378.
( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52

