文章信息
- 赵乐, 邢艺林, 李正楠, 郭金堂, 冉隆贤
- Zhao Le, Xing Yilin, Li Zhengnan, Guo Jintang, Ran Longxian
- 枣缩果病初侵染链格孢菌的抗硫酸铜标记及稳定性
- Resistance-Labeling and Stability of Jujube Shrunken-Fruit Disease Pathogen Alternaria alternata to Copper Sulfate
- 林业科学, 2016, 52(7): 53-58
- Scientia Silvae Sinicae, 2016, 52(7): 53-58.
- DOI: 10.11707/j.1001-7488.20160707
-
文章历史
- 收稿日期:2015-05-21
- 修回日期:2016-04-13
-
作者相关文章
2. 河北省林木种质资源与森林保护重点实验室 保定 071000;
3. 河北省山区研究所 保定 071001
2. Hebei Key Lab of Forest Germplasm Resources and Protection, Agricultural University of Hebei Baoding 071000 ;
3. Mountain Area Research Institute of Hebei Province Baoding 071001
枣缩果病又名枣铁皮病、枣黑腐病、枣干腰缩果病等(郑晓莲等,1996),主要危害枣果,是我国各大枣区的主要病害之一。近10多年来枣缩果病发生日趋严重,已成为枣果生产上的毁灭性病害(侯晓杰,2010)。由于枣缩果病表现症状多样,诊断困难,因此至今对该病病原仍存在很大争议,目前共报道了11种真菌和2种细菌可引致该病。韩党悦等(2012)研究认为,枣缩果病的初侵染病菌为链格孢菌(Alternaria alternata)。
链格孢菌是一种在自然界中广泛分布的重要的病原菌(康子腾等,2013),种类多,寄主范围广(Thomma,2003; Taralova et al.,2011; Woudenberg et al.,2013),对环境和基质的适应性强(Konstantinova et al.,2002),且95%以上的种都能兼性寄生于植物上,可引起多种植物发生病害(Davis et al.,1977; Pryor et al.,2002; Andersen et al.,2009),不仅可引起枣树缩果病(韩党悦,2012),还可引起烟草赤星病(张乐等,2007)等多种植物叶斑病,严重影响作物的产量和品质,给农林生产造成巨大的经济损失。
目前,对枣缩果病的初侵染病菌已进行了深入研究,但生产上防治该病的难度仍然很大,枣农盲目多次喷施化学药剂,但防治效果仍不理想,这主要是由于在整个生长季节,发病部位很难观察到病菌的子实体,对病原菌的侵入时间、侵入途径和致病机制尚不清楚。因此,本文重点研究初侵染病菌链格孢菌的抗药性标记技术,并利用该菌的抗药突变体在林间接种,探讨其初侵染时期和途径。
筛选真菌或细菌的抗药性突变体是研究其在植物、土壤中运转动态的一种可靠方法。山崎义人等(1990)利用单孢分离菌在含硫酸铜的马铃薯培养基上培养得到了稻瘟病菌(Magnaporthe oryzae)的抗硫酸铜突变体。Glandorf等(1992)通过不断增加培养基中利福平的含量得到了恶臭假单胞杆菌(Pseudomonas putida)WCS358的抗利福平突变体菌株,并对其稳定性和根际定殖力进行了研究。刘玲等(2005)通过秸秆降解的白腐菌(Phanerochaete chrysosporium)菌株抗药性标记的筛选试验,得到了抗氟康唑和十一烯酸真菌清的秸秆降解菌株。但尚未见对链格孢菌进行抗药性标记的报道。本试验基于在培养基中逐渐升高硫酸铜浓度的方法对链格孢菌进行抗药性突变体筛选,得到稳定的、具有致病性的突变体菌株并用于枣缩果病菌侵染时期的研究,以期为生产上防治该病适时喷药提供依据。
1 材料与方法 1.1 试验材料链格孢菌CN193野生型菌株,河北农业大学林木病理实验室提供;硫酸铜为分析纯试剂;氯化钴;硝酸银;放线菌酮;马铃薯葡萄糖琼脂(PDA)培养基。
1.2 试验方法 1.2.1 最适标记药剂的筛选将链格孢菌在PDA培养基上于25℃下黑暗培养1周,制成孢子悬浮液,调节孢子浓度至105 mL-1,备用。选择直径1 cm的滤纸片,干热灭菌后浸泡在浓度均为1 mg·mL-1的硫酸铜、氯化钴、硝酸银和放线菌酮药液中4 h(胡伟群等,2011),无菌条件下晾干。将处理后的不同药剂的滤纸片放在涂布了100μL链格孢菌孢子悬浮液PDA培养基上,每皿3片,共3皿,以浸无菌水的滤纸片作为对照。25℃下培养,每隔24 h记录数据1次,共6次。
1.2.2 硫酸铜起始浓度的测定硫酸铜药剂的浓度依次为1.0,1.5,2.0 mg·mL-1。取上述配制好的菌悬液于3个凹玻片的凹槽中,每个凹槽50μL,在10×10倍镜下观察,直到孢子浓度调节至每个视野有50~60个孢子为宜,并分别取等量不同浓度硫酸铜药液混合均匀,25℃下培养(邢小萍等,2006)。孢子萌发率为:
| $\begin{array}{*{20}{c}} {{\rm{孢子萌发率}}\left({\rm{\% }} \right){\rm{ = }}}\\ {\left({{\rm{孢子萌发数}}/孢子总数} \right)\times 100\% .} \end{array}$ |
配制100 mg·mL-1硫酸铜母液,无菌过滤,保存备用。制作硫酸铜不同浓度梯度药剂培养基,起始浓度设定为1.5 mg·mL-1。取100μL浓度为400~500 mL-1的孢子悬浮液均匀涂布于含硫酸铜的PDA培养基上,25℃下培养。以涂布无硫酸铜的PDA培养基作为对照。待起始浓度硫酸铜培养基上长出突变体单菌落后,将菌落转接入无药剂PDA培养基上培养生长,长出孢子后配制浓度为400~500 mL-1的孢子悬浮液,取100μL接入高浓度药剂培养基中,培养菌株对硫酸铜的抗性,从而得到具有抗硫酸铜的突变体菌株CN193Cur(Glandorf et al.,1992)。
1.2.4 林间接种致病力测定选择没有发生枣缩果病的河北农业大学标本园林木病理实验室的试验地作为接种地。将得到的突变体菌株CN193Cur配制成孢子悬浮液,浓度为2.0×105 mL-1,进行花期喷雾接种和枣果刺伤接种(武海霞等,2012),待发病后将发病枣果带回实验室分离并置于含硫酸铜(4.5 mg·mL-1)的培养基上培养,观察生长状况,判定是否为突变体菌株CN193Cur,并从花期喷雾接种后发病枣果分离菌株判定病菌能否在花期侵染。
1.2.5 抗硫酸铜突变体CN193Cur稳定性的检测孢子萌发率的检测:将抗硫酸铜突变体CN193Cur接种到无硫酸铜的培养基上培养5代,再将第5代的CN193菌株和抗硫酸铜突变体CN193Cur的孢子悬浮液(400~500 mL-1)取100μL分别涂布于含硫酸铜(4.5 mg·mL-1)和不含硫酸铜的培养基上,25℃下培养72 h后,观察孢子的萌发率。
菌落生长速度检测:将野生型菌株CN193和抗硫酸铜突变体CN193Cur的菌落块(直径约7 mm)分别接种到含硫酸铜和不含硫酸铜的培养基上,25℃下培养72 h后,观察菌落生长情况。
1.2.6 BOX-PCR指纹图谱分析将田间分离得到的抗硫酸铜突变体菌株CN193Curp、室内筛选出的突变体菌株CN193Cur和野生型菌株CN193进行BOX-PCR指纹图谱分析,鉴定菌株是否一致。按DV811A型真菌DNA提取试剂盒(由大连TaKaRa公司提供)使用说明提取链格孢菌DNA。
PCR扩增引物序列:BOXA1R:5′-CTACGGCAAGGCGACGCTGACG-3′(Versalovic et al.,1994)。
扩增体系:10×PCR buffer 2.5μL,DNA模版用量1μL,dNTP 0.2 mmol·L,引物50 pmol,2.0 U Taq酶,补双蒸水至25μL。
PCR反应条件:95℃预变性7 min;94℃变性1 min,53℃退火1 min,65℃延伸8 min;共35个循环;最后65℃延伸15 min,4℃停止反应(杨凤环等,2008)。
通过1%琼脂糖凝胶电泳检测PCR产物,用凝胶成像分析系统照相。
2 结果与分析 2.1 不同药剂对链格孢菌孢子萌发的抑制作用硫酸铜对链格孢菌孢子萌发具有明显的抑制作用,氯化钴、硝酸银的抑制效果较弱,与硫酸铜的抑菌作用有显著差异,放线菌酮则对链格孢菌孢子萌发没有明显的抑制作用(表 1)。因此,选择硫酸铜作为抗性标记药剂。
|
|
由表 2可知,浓度为1.0 mg·mL-1的硫酸铜对链格孢菌孢子萌发的抑制率与对照差异极显著,表明硫酸铜对链格孢菌孢子具有显著抑制作用。在硫酸铜浓度为1.0 mg·mL-1时孢子萌发率与浓度为1.5,2.0 mg·mL-1时的差异极显著;浓度为1.5 mg·mL-1的硫酸铜对链格孢菌孢子具有较强的抑制作用,同时孢子具有一定的萌发率,而硫酸铜浓度为2.0 mg·mL-1时,孢子萌发率较低或不萌发。因此,选择浓度1.5 mg·mL-1作为链格孢菌抗硫酸铜突变体筛选的起始浓度。
|
|
在PDA培养基上,当硫酸铜初始浓度为1.5 mg·mL-1时,链格孢菌的突变率为12%。
2.3 野生型菌株CN193和抗硫酸铜突变体CN193Cur的生长状况当硫酸铜浓度达到4.5 mg·mL-1时,经过浓度梯度训练的突变体菌株CN193Cur仍可生长,而野生型菌株CN193在相同浓度下则无法生长(图 1),以此来区分野生菌株与抗硫酸铜突变体CN193Cur。得到的突变体菌株经过接种到无硫酸铜培养基5代后重新接回到含硫酸铜的培养基上,得到稳定的抗硫酸铜突变体CN193Cur。
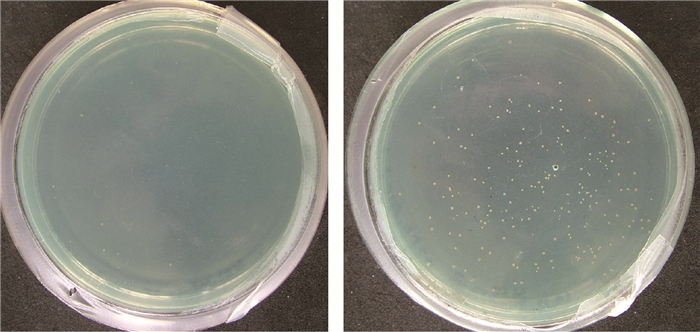
|
图 1 野生型菌株CN193和抗硫酸铜突变体CN193Cur在相同硫酸铜浓度下的生长状况 Fig.1 The growth of wild type CN193 and copper resistant strain CN193Cur on PDA medium with copper sulfate |
抗硫酸铜突变体CN193Cur在林间接种后可以导致枣果发病,且症状与野生型菌株的致病症状相同,说明CN193Cur具有致病性(图 2)。表明突变体菌株可作为区别于野生型菌株的稳定致病菌株应用于枣缩果病的研究中。

|
图 2 抗硫酸铜突变体CN193Cur林间接种与自然发病症状 Fig.2 Symptoms of jujube fruits inoculated with mutant strain CN193Cur 左:为刺伤接种;中:为喷雾接种;右:为自然发病。 Left: diseased fruit by inoculation of needle stabbing; Middle: diseased fruit by inoculation of flower spraying; Right: naturally infected fruit. |
在花期喷雾接种的枣果能够发病,且发病症状与自然发病症状相同,表明链格孢菌在花期就能侵入枣树中,致使枣果发病。
2.5 抗硫酸铜突变体CN193Cur的稳定性抗硫酸铜突变体CN193Cur与野生型菌株CN193在含硫酸铜培养基PDA+Cu上培养后孢子萌发率差异明显,抗硫酸铜突变体CN193Cur的孢子萌发率为96%,野生型菌株CN193孢子萌发率为0,而在不含硫酸铜的PDA上孢子萌发率差异不明显(表 3)。CN193Cur在不含硫酸铜的PDA培养基上比野生型菌株生长快,而在含硫酸铜的PDA上CN193Cur的菌落块直径为4.2 cm,野生型菌株CN193则不能生长。此结果表明,抗硫酸铜突变体CN193Cur突变特征明显且稳定,可以用于研究枣缩果病的侵染循环。
|
|
将田间致病性测定后分离得到的CN193Curp与室内筛选出的CN193Cur以及野生型CN193进行BOX-PCR指纹图谱分析,电泳结果显示,3个菌株扩增出的条带相同,均出现在250~2 000 bp之间。表明田间分离得到的突变体菌株CN193Curp与室内筛选得到的突变体一样,都是链格孢菌CN193(图 3)。
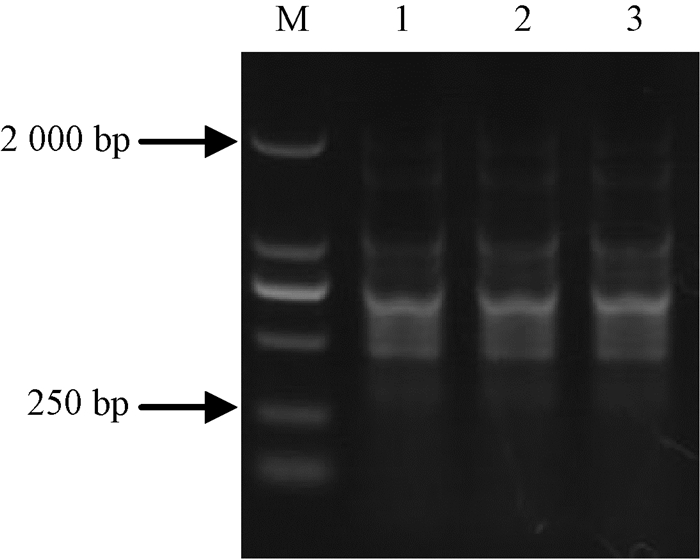
|
图 3 野生型菌株CN193和突变体菌株CN193Cur的BOX-PCR指纹图谱分析 Fig.3 The BOX-PCR fingerprint analysis of wild type strain CN193 and copper resistant mutant strain CN193Cur M:DL2000 maker; 1: CN193; 2: CN193Cur; 3:经过致病性测定后分离的 CN193Curp CN193Cur strains after determination of pathogenicity. |
为了确定适合的药剂标记,试验初期将病枣枝条的清洗液及枣林地表土的悬浮液涂布于含硫酸铜(4.5 mg·mL-1)的培养基上,结果发现,枣枝条表面及土壤中存在的细菌、真菌均不能在硫酸铜培养基上生长,表明硫酸铜具有广谱杀菌特性,适宜作为链格孢菌的标记药剂,为其他真菌建立抗药性标记提供参考。
本研究参照Glandorf等(1992)筛选细菌抗利福平突变体的方法,通过逐渐提高培养基中硫酸铜的含量培养菌株对硫酸铜的抗性,得到了稳定的抗硫酸铜突变体CN193Cur。试验筛选出链格孢菌抗硫酸铜突变体菌株,并在林间接种表现出稳定的抗硫酸铜特性,这与山崎义人等(1990)的研究结果一致,获得的抗硫酸铜稻瘟病菌永久变异性菌株在稻体上生长后其抗硫酸铜特性未发生变化。上述研究表明,采用抗生素或化学药剂浓度递增的方法,可以有效地获得真菌和细菌突变体,这为其他植物病原真菌或细菌侵染机制的研究提供了技术支持。
BOX-PCR技术利用BOX插入因子在真菌基因组中具有高度保守的特性,可以快速检测真菌多样性。Alves等(2004)应用BOX-PCR结合REP,ERIC-PCR技术对从感病的葡萄(Vitis vinifera)上分离到的病原真菌进行分子检测,指纹图谱分析与MSP-PCR获得的结果进行比较,结果显示BOX-PCR与REP-PCR,ERIC-PCR显示的条带能够清楚地进行种间区分,也可揭示种内的差异。
试验通过对林间接种后再分离得到的CN193Curp与室内筛选出的CN193Cur以及野生型CN193进行BOX-PCR检测,其指纹图谱相同,表明突变体菌株仍为CN193,BOX-PCR没有检测到种的特征上发生变化(Konstantinova et al.,2002),且突变体的致病性与野生型菌株相同,突变体稳定。因此,链格孢菌的突变体可用于枣树林间侵染规律的研究。
4 结论通过几种化学药剂对链格孢菌孢子萌发的抑制作用试验以及对硫酸铜起始浓度的测定、突变体筛选、致病力测定、稳定性检测和BOX-PCR指纹图谱分析,确定硫酸铜可以作为标记链格孢菌的药剂,获得的突变体抗性稳定,为其他植物病原真菌或细菌抗药性标记提供了理论依据,也为研究这些病菌的侵染机制提供了技术支持;采用BOX-PCR指纹图谱分析技术可快速检测出真菌的多样性,能够较为有效地提供菌株的种内差异信息;本研究所获的抗药突变体CN193Cur菌株具有稳定的突变特征及致病性,可以应用于对枣缩果病菌的侵染机制及致病机制的研究。
| [] |
韩党悦. 2012.枣缩果病初侵染病原及防治研究.保定:河北农业大学硕士学位论文. ( Han D Y. 2012. Identification of initial pathogen causing fruit shrinking disease in Ziziphus jujuba Mill. and its control. Baoding:MS thesis of Agricultural University of Hebei.[in Chinese][in Chinese]) http://cdmd.cnki.com.cn/article/cdmd-11920-1012332256.htm |
| [] |
侯晓杰. 2010.枣缩果病病原和防治研究.保定:河北农业大学博士学位论文. ( Hou X J. 2012. The study on the pathogens and control of jujube fruit shrink disease. Baoding:PhD thesis of Agricultural University of Hebei.[in Chinese][in Chinese]) |
| [] |
胡伟群, 朱卫刚, 张蕊蕊, 等. 2011. 灰葡萄孢多药抗性菌株的筛选和鉴定. 农药学学报 , 13 (6) : 586–590.
( Hu W Q, Zhu W G, Zhang R R, et al.2011. Screening and identification of multi-drug resistant Botrytis cinerea strains. Chinese Journal of Pesticide Science , 13 (6) : 586–590. [in Chinese] ) (  0) 0)
|
| [] |
康子腾, 姜黎明, 罗义勇, 等. 2013. 植物病原链格孢属真菌的致病机制研究进展. 生命科学 , 25 (9) : 908–914.
( Kang Z T, Jiang L M, Luo Y Y, et al.2013. The research advances of mechanism of pathogenicity of Alternaria phytopathogenic fungi. Chinese Bulletin of Life Sciences , 25 (9) : 908–914. [in Chinese] ) (  0) 0)
|
| [] |
刘玲, 叶博, 刘长江. 2005. 秸秆降解菌株抗药性标记的筛选. 生物技术 , 15 (6) : 53–54.
( Liu L, Ye B, Liu C J.2005. Study on antifungal agents marker of the fungus for degradation straws. Biotechnology , 15 (6) : 53–54. [in Chinese] ) (  0) 0)
|
| [] |
山崎义人, 高坂淖尔. 1990.稻瘟病与抗病育种.凌忠专, 孙昌其.译.北京:农业出版社. ( Yamazaki Y, Kozaka T. 1990. Blast disease and breeding for blast resistant varieties of rice. Translated by Ling Z Z, Sun C Q. Beijing:Agriculture Press.[in Chinese][in Chinese]) |
| [] |
武海霞, 李红霞, 高洁. 2012. 山西省枣缩果病病原菌的研究. 山西林业科技 , 41 (4) : 34–36.
( Wu H X, Li H X, Gao J.2012. Study on pathogens of jujube fruit shrink disease in Shanxi province. Shanxi Forestry Science and Technology , 41 (4) : 34–36. [in Chinese] ) (  0) 0)
|
| [] |
邢小萍, 袁红霞, 孙炳剑, 等. 2006. 11种杀菌剂对小麦黑胚病菌的室内毒力测定. 河南农业科学 , 35 (12) : 54–55.
( Xing X P, Yuan H X, Sun B J, et al.2006. Determination of indoor toxicities of 11 fungicides against Alternaria alternata. Henan Agricultural Sciences , 35 (12) : 54–55. [in Chinese] ) (  0) 0)
|
| [] |
杨凤环, 李正楠, 姬惜珠, 等. 2008. BOX-PCR技术在微生物多样性研究中的应用. 微生物学通报 , 35 (8) : 1282–1286.
( Yang F H, Li Z N, Ji X Z, et al.2008. Applications of BOX-PCR technique in diversity study of microorganisms. Microbiology , 35 (8) : 1282–1286. [in Chinese] ) (  0) 0)
|
| [] |
张乐, 王革, 高智谋, 等. 2007. 烟草赤星病菌(Alternaria alternata)营养生理研究. 中国农学通报 , 23 (5) : 330–333.
( Zhang L, Wang G, Gao Z M, et al.2007. Studies on nutritional physiology of Alternaria alternata. Chinese Agricultural Science Bulletin , 23 (5) : 330–333. [in Chinese] ) (  0) 0)
|
| [] |
郑晓莲, 赵光耀, 武丽芬, 等. 1996. 枣缩果病主要病原菌生物学特性的初步研究. 植物保护 , 22 (1) : 13–16.
( Zhang X L, Zhao G Y, Wu L F, et al.1996. Biological characteristics of tow main of jujube fruit shrink disease. Plant Protection , 22 (1) : 13–16. [in Chinese] ) (  0) 0)
|
| [] |
Alves A, Henriques I, Fragoeiro S, et al.2004. Applicability of rep-PCR genomic fingerprinting to molecular discrimination of members of the genera Phaeoacremonium and Phaeomoniella. Plant Pathology , 53 (5) : 629–634.
DOI:10.1111/ppa.2004.53.issue-5 ( 0) 0)
|
| [] |
Andersen B, Sørensen J L, Nielsen K F, et al.2009. A polyphasic approach to the taxonomy of the Alternaria infectoria species-group. Fungal Genetics and Biology , 46 (9) : 642–656.
DOI:10.1016/j.fgb.2009.05.005 ( 0) 0)
|
| [] |
Davis N D, Diener U L, Morgan-jonest G.1977. Tenuazonic acid production by Alternaria alternata and Alternaria tenuissima isolated from cotton. Applied Environmental Microbiology , 34 (2) : 155.
( 0) 0)
|
| [] |
Glandorf D C M, Brand I, Bakker P A H M, et al.1992. Stability of rifampicin resistance as a marker for root colonization studies of Pseudomonas putida in the field. Plant and Soil , 147 (1) : 135–142.
DOI:10.1007/BF00009379 ( 0) 0)
|
| [] |
Konstantinova P, Bonants P J M, van Gent-Pelzer M P E, et al.2002. Development of specific primers for detection and identification of Alternaria spp.in carrot material by PCR and comparison with blotter and plating assays. Mycological Research , 106 (1) : 23–33.
DOI:10.1017/S0953756201005160 ( 0) 0)
|
| [] |
Pryor B M, Michailides T J.2002. Morphological, pathogenic, and molecular characterization of Alternaria isolates associated with Alternaria late blight of Pistachio. Ecology and Population Biology , 92 (4) : 406–416.
( 0) 0)
|
| [] |
Taralova E H, Schlecht J, Barnard K, et al.2011. Modelling and visualizing morphology in the fungus Alternaria. Fungal Biology , 115 (11) : 1163–1173.
( 0) 0)
|
| [] |
Thomma B P H J.2003. Alternaria spp.:from general saprophyte to specific parasite. . Molecular Plant Pathology , 4 (4) : 225–236.
DOI:10.1046/j.1364-3703.2003.00173.x ( 0) 0)
|
| [] |
Versalovic J, Schneider M, De Bruijin F J, et al.1994. Genomic fingerprinting of bacteria using repetitive sequence based PCR rep-PCR). Methods in Molecular and Cellular Biology , 5 (1) : 25–40.
( 0) 0)
|
| [] |
Woudenberg J H C, Groenewald J Z, Binder M, et al.2013. Alternaria redefined. Studies in Mycology , 75 : 171–212.
DOI:10.3114/sim0015 ( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52

