文章信息
- 李志军, 刘国成
- Li Zhijun, Liu Guocheng
- 软枣猕猴桃大小孢子发育过程的细胞形态学观察
- Morphologic Characters of Microspores and Megaspores in Actinidia arguta during the Development of Floral Organs
- 林业科学, 2016, 52(7): 158-164
- Scientia Silvae Sinicae, 2016, 52(7): 158-164.
- DOI: 10.11707/j.1001-7488.20160719
-
文章历史
- 收稿日期:2015-06-15
- 修回日期:2015-09-15
-
作者相关文章
2. 沈阳农业大学 沈阳 110866
2. Shenyang Agricultural University Shenyang 110866
软枣猕猴桃(Actinidia arguta)属于猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)多年生落叶藤本植物,多为野生,主要分布于我国东北、华北、西南及华东各省(周繇,2008)。软枣猕猴桃是9种光果猕猴桃种类之一(曹家树等,2005)。软枣猕猴桃绝大多数是雌雄异株,但偶有少数是雌雄同株或两性花,存在性别的多样性(杨妙贤等,2009)。软枣猕猴桃的雄花、雌花都是形态上的两性花,生理上的单性花。
猕猴桃在中国是一种古老的植物,中国是世界猕猴桃的起源中心(黄宏文等,2000)。国外对软枣猕猴桃资源的开发利用较早,且对其进行了大量的研究工作。据报道,新西兰已培育出一些软枣猕猴桃品种,美国和智利把软枣猕猴桃作为 “baby-kiwi”已大量人工栽培并出口到日本等国(Kataoka et al., 2006)。在软枣猕猴桃开发利用中,日本处于领先地位。片冈等对日本境内分布的软枣猕猴桃资源进行了详细的调查,发现日本各州县分布的软枣猕猴桃有2倍体、4倍体、6倍体、7倍体和8倍体,倍数性上有很大的变异性;日本利用这些资源培育的软枣猕猴桃品种多达9个(峰香、香粹、里泉、山形娘、雪娘、花之井、茂绿、光香、信山)(郭晓成,2006)。软枣猕猴桃果实、根、茎、叶具有止泻、解烦热、利尿、祛痰、健胃等作用,对胃癌及癌肿有一定疗效(王晓东等,2006)。具有丰富营养成分、保健以及庭园绿化功能的新兴水果软枣猕猴桃具有巨大的发展空间,目前对软枣猕猴桃的研究多集中在组织培养、资源分布和开发利用与栽培等方面,有关花粉的发育与结构鲜有报道。针对软枣猕猴桃发育过程中出现的雌株小孢子不育及雄株大孢子不育的问题开展大小孢子育性研究有助于更好地了解该物种的繁殖特性,研究结果可为育种研究和科学合理的栽培管理措施提供理论依据。
1 材料与方法 1.1 植物材料供试材料来自于沈阳农业大学东北野生猕猴桃资源圃。选择生长发育正常、管理水平基本一致、长势一致和花量基本相同的软枣猕猴桃雌株和雄株作为试材。从5月开始,收集整个生长发育时期的花药和子房。
1.2 试验方法石蜡切片的制作及其染色:花药和子房经FAA(70%乙醇90 mL,福尔马林5 mL,冰醋酸5 mL)固定转入70%乙醇中过夜后经系列乙醇(85%乙醇→95%乙醇→100%乙醇)脱水各1 h,二甲苯透明(1/3二甲苯+2/3乙醇→1/2二甲苯+1/2乙醇→纯二甲苯)各1 h,浸蜡包埋后,按照常规石蜡制片法,利用切片机进行连续切片。番红-固绿对染,加拿大树胶封片。OLYMPUS BX51光学显微镜下对比观察并进行拍照。
超薄切片的制作:花药经2%戊二醛固定,pH7.2的磷酸盐缓冲液清洗3次,1%锇酸固定后,pH7.2的磷酸盐缓冲液再次清洗3次。常规乙醇系列脱水,丙酮过渡用环氧树脂渗透包埋。超薄切片机切片,醋酸双氧铀-柠檬酸铅双重染色,日立JEM100CX-Ⅱ透射电镜观察拍照。
扫描电镜观察:选取健壮刚开放的雌、雄株的花,自然阴干条件下将其花粉挑出,pH7.2的磷酸盐缓冲液清洗样品,经2%戊二醛固定,pH7.2的磷酸盐缓冲液清洗3次,1%锇酸固定后,pH7.2的磷酸盐缓冲液再次清洗3次。常规乙醇系列脱水,醋酸异戊酯中置换,放入干燥仪中干燥,用导电胶将样品粘在样品台上,镀金膜。日立S-450型扫描电镜观察拍照。
2 结果与分析 2.1 雌株小孢子败育过程中细胞形态学的观察1)花药显微结构的观察 软枣猕猴桃雌、雄株花药均为4室,4个花粉囊成蝶形排列,花粉囊壁依次由表皮、药室壁、中层和绒毡层构成(图 1a,b)。雄株药室壁在小孢子后期开始出现纤维层,中层细胞在减数分裂时期开始退化消失,绒毡层伴随着小孢子的发育开始降解退化(图 1c,d,e),成熟后花药壁由表皮细胞和纤维层构成,有部分的中层和绒毡层细胞(图 1f)。雌株花药表皮、药室壁及中层均未见异常,但绒毡层直至小孢子细胞解体时才出现降解(图 1k,l)。
软枣猕猴桃雌、雄株的花粉母细胞均能进行减数分裂,分裂方式为胞质同时型,并且都能形成正常的四面体形四分体小孢子(图 1g)。在胼胝质解体之前,小孢子为单核(图 1c,d,h,i)。当胼胝质解体之后,雌、雄株的花粉发育开始出现区别。随着花药的进一步发育,雄株的小孢子经有丝分裂形成成熟的二核花粉粒,较小的为生殖细胞,较大的则为营养细胞。雌株的四分体小孢子在胼胝质解体后,没有经有丝分裂而停留在单核状态(图 1j, k)。
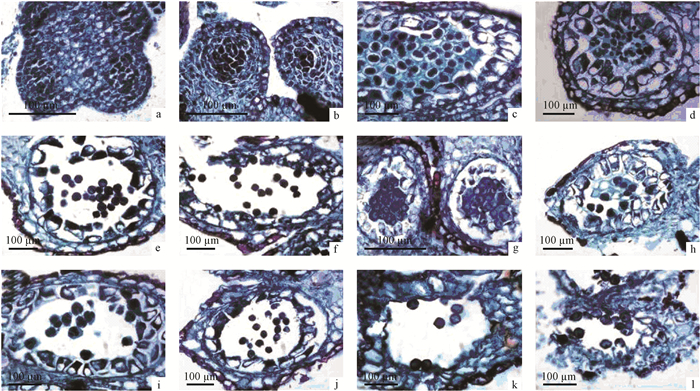
|
图 1 软枣猕猴桃雌、雄株花粉发育过程 Fig.1 The development process of pollen in female and male plants of Actinidia arguta a-f:雄株Male; g-l:雌株Female.a, b, g: 花粉母细胞时期; c, h: 减数分裂期; d, i: 四分体时期; e, j: 单核花粉期; f, k, l: 成熟期。a, b, g: Pollen mother cell phase; c, h: Meiophase; d, i: Tetrad phase; e, j: Uninucleate pollen phase; f, k, l: Mature pollen grains. |
2)花粉超微结构的观察 雄株可育小孢子单核期近球形,细胞核位于近中央,外壁基粒棒成短粗棒状发育成熟清晰可见且基粒棒之间存在空隙(图 2a,b)。细胞质内含有丰富的线粒体及发达的质体并形成了一定数量的小液泡,线粒体轮廓清晰、结构正常、脊依稀可见,内质网高度发达,其上附有核糖体(图 2b)。雌株不育小孢子单核期外壁内缩成不规则“梨状”畸形,外壁无基粒棒形成,细胞质浓缩至中央,细胞器难以辨认(图 2e,f)。
雄株可育小孢子成熟期液泡增多,细胞核变大并被挤到边侧,细胞质中细胞器大多为线粒体,逐渐减少并贴向细胞的周边,细胞内含物增多充满整个细胞(图 2c,d)。小孢子外壁没有明显变化,核经有丝分裂形成成熟花粉粒。雌株不育小孢子细胞进一步皱缩,内含物明显减少,细胞质仍然凝集成一团电子致密的物质并移至细胞一侧,此时内外壁物质沉积更加致密,外壁变薄,同时内壁加厚(图 2g)。小孢子因无法进行有丝分裂,同时细胞内物质发生自融现象,形成空腔(图 2h),导致小孢子不育。
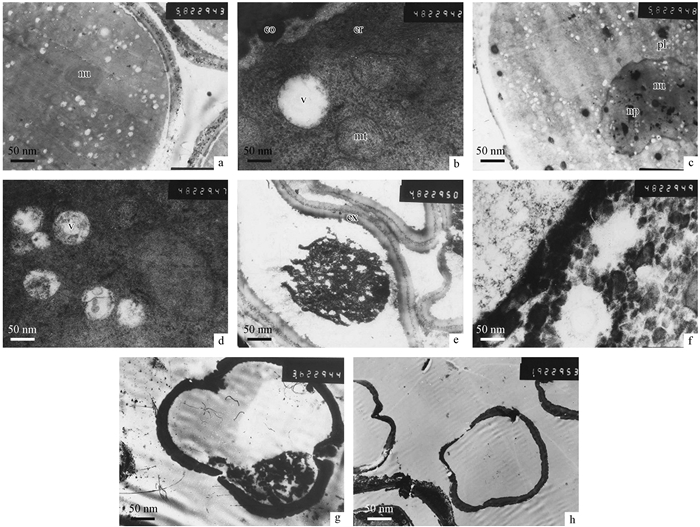
|
图 2 软枣猕猴桃雌、雄株小孢子超微结构 Fig.2 Ultrastructure of microspore in female and male plants of Actinidia arguta a-d:雄株Male; e-h:雌株Female.a, b, e, f: 单核期; c, d, g, h: 成熟期。ex: 外壁; co: 基粒棒; mt: 线粒体; er: 内质网; pl: 质体; v: 液泡; nu: 细胞核; np: 核孔。a, b, e, f: Mononucleate microspore; c, d, g,h: Mature microspore. ex: Extine; co: Columellae; mt: Mitochondria; er: Endoplasmic reticulum; pl: Plastids; v: Vacuoles; nu: Nucleus; np: Nucleus pole. |
3)花粉扫描结构的观察 猕猴桃雄株可育花粉粒量大且均匀饱满,长宽为15~17 μm×14~16 μm,极面观为钝三角形,赤道面观呈扁圆形,具三孔沟,萌发沟宽而深未及两端,一端变尖,表面瘤状纹饰明显且均一(图 3a, b, c, d)。雌株不育花粉粒量小,外观不均匀,有些甚至内陷至“帽子”状,大小25~30 μm×8~10 μm,为近圆柱形或圆锥形,极面观为长棒形,也具三孔沟,但萌发沟窄,并且萌发沟宽度保持不变,但有的萌发沟因花粉内陷至“帽子”状而被包裹住,表面皱波状纹饰不明显(图 3e, f, g, h, i)。

|
图 3 软枣猕猴桃雌、雄株花粉扫描结构 Fig.3 SEM structure of pollen in female and male plants of Actinidia arguta a, b, c, d: 雄株可育花粉; e, f, g, h, i: 雌株不育花粉。a, b, c, d: Fertile pollens in male plants; e, f, g, h, i: Sterile pollens in female plants. |
软枣猕猴桃雄株的花芽在分化发育的初期也有雌蕊原基的出现,但在花药开始分化后花柱就不再发育。雄株雌蕊的花柱和柱头因发育不良形成簇生的白色绒毛状(图 4a)。软枣猕猴桃雌蕊由子房、花柱和柱头组成,中轴胎坐,子房上位,由34~45个心皮呈辐射状排列构成。雄株的心室在花粉母细胞时期就已形成,然而心室内胎座上几层细胞一直不进行分裂,不能突起膨大形成胚珠原基;但心室细胞随着发育过程的进行都呈现出细胞核增大、细胞质增浓、排列整齐的特征,整个心室则显得窄而长(图 4b, c, d)。
雌株的雌蕊原基出现后迅速发育,中间向下凹陷形成粗短中空的花柱,上端为放射状柱头,开花后它们都明显高于雄蕊,在柱头和花柱的下部,形成一个膨大的子房,在花柱与子房的外壁上着生许多纤细的表皮毛(图 4e)。开花前25天左右胎座内壁下几层细胞迅速分裂,逐渐突起膨大形成胚珠原基,为薄珠心。珠心基部出现珠被原基,珠被单层逐渐向顶端生长,最后包围珠心,珠被内层细胞中还有大型结晶体,珠被最内层细胞横向伸长,胞质变浓,排列整齐,成为明显的珠被绒毡层(图 4f, g)。开花前15天左右,珠心顶端表皮下层1个细胞的细胞核显著增大成为细胞质高度浓缩的孢原细胞,随后直接发育为大孢子母细胞,随着花的发育形成胚珠,为倒生型(图 4h, i)。整个心室显得宽而圆(图 4f)。

|
图 4 软枣猕猴桃雌、雄株的雌蕊发育过程 Fig.4 Developmental process of pistil in male and female plants of Actinidia arguta a, b, c, d: 雄株雌蕊的发育; e, f, g, h, i: 雌株雌蕊的发育。a, b, c, d: Development of pistil in male; e, f, g, h, i: Development of pistil in female. |
花粉发育开始于花粉母细胞进行减数分裂产生四分孢子,结束于花药裂开释放出成熟的花粉(González-Melendi et al., 2008),期间任何一个过程出现异常都会导致小孢子不育。前人研究小孢子不育主要着眼于绒毡层细胞代谢异常与其之间的关系。绒毡层的重要作用已经在大部分不育系植株中得到证明(Ma,2005)。同时绒毡层解体时间的提前和延迟对花粉的育性起着至关重要的作用(Kawanabe et al., 2006)。本试验发现软枣猕猴桃雄株花药的绒毡层伴随着小孢子的发育开始降解退化,而雌株花药的绒毡层直至小孢子细胞解体时才出现降解。这一结果与杨妙贤等(2011)关于中华猕猴桃(A. chinensis)雌株小孢子不育的研究结果一致。可见绒毡层细胞的代谢异常是软枣猕猴桃雌株小孢子不育的原因之一。在绒毡层细胞代谢异常的同时,由于雌株的四分体小孢子在胼胝质解体后,没有经有丝分裂而停留在单核状态,也导致了雌株小孢子的不育。
对软枣猕猴桃花粉的超微结构观察发现,雄株可育小孢子外壁基粒棒成短粗棒状,发育成熟且清晰可见,而雌株小孢子外壁发育异常没有出现基粒棒。Chapman(1987)认为由小孢子本身产生的早期初生外壁提供了外壁发育的模式,指导着孢粉素物质的沉积。Lu等(2002)指出即使绒毡层发育正常,适时地分泌孢粉素物质,但如果小孢子本身异常,无法提供外壁发育的模式,致使孢粉素异常沉积,同样会导致花粉败育。这与本试验的结果相一致。
Coimbra等(2004)研究发现,美味猕猴桃(Actinidia deliciosa)雌性花的花粉囊中的小孢子在降解过程中出现了典型的细胞质浓缩、质膜皱缩、核膜起泡和染色质体浓缩等现象,认为有花植物中小孢子退化消亡很可能为一种程序性细胞死亡。本试验对雌株不育花粉超微结构观察也发现细胞质出现凝集,内含物发生自噬现象,最后导致空腔的出现。可能软枣猕猴桃雌株小孢子的不育也是细胞程序性死亡的一种体现。
3.2 大孢子败育过程中细胞形态学的观察正常的植物雌配子体形成是一系列细胞分化发育的结果,包括孢原细胞和大孢子母细胞的分化以及减数分裂、功能大孢子的确立和配子细胞命运的选择及其功能分化等精确控制的发育过程(高荣村等,2009)。如果雌性器官发育异常如胚珠或卵细胞发育受阻或败育,就表现出植物雌性不育现象。性别分化过程的形态学研究表明,大多数植物种类单性花的性别决定是由性器官原基的选择性诱导或败育引起的。2种性器官原基在发育的起始都出现,即单性花发育的初期先经过一个两性花时期,但其维持的时间在不同植物中有所不同。由于性决定基因的作用,其中一种原基在特定的阶段发育停滞,致使生殖器官败育而丧失功能。这种停滞在不同植物种类中往往在形态发生的不同阶段发生(Dellaporta et al., 1993)。本试验发现软枣猕猴桃雄株心室在花药未分化前就已形成,然而心室内胎座上几层细胞一直不进行分裂,不能突起膨大形成胚珠原基。这是导致软枣猕猴桃雄株大孢子不育的原因。这一结果与杨妙贤等(2011)关于中华猕猴桃雄株大孢子不育的研究结果一致。同时江雪飞等(2004)对白花山碧桃(Amygdalus davidiana‘Baihuashanbitao’)的研究也发现,白花山碧桃的雌蕊发育滞缓,其表现为胚珠原基发育停滞、子房室不再膨大、花柱基本不伸长和柱头表面异常,从而确定白花山碧桃雌蕊败育的主要原因是胚珠败育,其败育的起始时期为性细胞分化初期。
4 结论软枣猕猴桃雌株花药绒毡层代谢异常;四分体小孢子在胼胝质解体后有丝分裂异常而停留在单核状态;小孢子早期初生外壁发育异常没有基粒棒的产生,无法提供外壁发育的模式致使孢粉素异常沉积;雌株花药中细胞程序性死亡的发生,在以上因素的作用下软枣猕猴桃雌株花粉出现了败育。软枣猕猴桃雄株心室在花药未分化前就已形成,然而心室内胎座壁上的几层细胞一直不进行分裂,导致不能突起膨大发育形成胚珠原基。可见导致软枣猕猴桃雄株大孢子不育的原因是胚珠原基发育停滞。
| [] |
曹家树, 秦岭. 2005. 园艺植物种质资源学. 北京: 中国农业出版社 .
( Cao J Y, Qing L. 2005. Horticulture plant germplasm resources science. Beijing: China Agriculture Press . [in Chinese] ) |
| [] |
郭晓成. 2006. 日本选育的猕猴桃品种简介. 中国果树 (3) : 63–64.
( Guo X C.2006. Actinidia varieties bred in Japan. China Fruit (3) : 63–64. [in Chinese] ) (  0) 0)
|
| [] |
高荣村, 姜程曦, 魏晓星, 等. 2009. 水稻雌性不育突变体研究进展及应用展望. 浙江农业科学 (5) : 33–34.
( Gao R C, Jiang C X, Wei X X, et al.2009. Rice female sterile mutant progress and application prospect. Journal of Zhejiang Agricultural Sciences (5) : 33–34. [in Chinese] ) (  0) 0)
|
| [] |
黄宏文, 龚俊杰, 王圣梅, 等. 2000. 猕猴桃属(Actinidia) 植物的遗传多样性. 生物多样性 , 8 (1) : 1–12.
( Huang H W, Gong J J, Wang S M, et al.2000. Genetic diversity in the genus Actinidia.. Biodiversity Science , 8 (1) : 1–12. [in Chinese] ) (  0) 0)
|
| [] |
江雪飞, 王力荣, 邹志荣, 等. 2004. 白花山碧桃雌蕊败育特性的解剖学研究. 果树学报 , 21 (3) : 201–203.
( Jiang X F, Wang L R, Zou Z R, et al.2004. Study on the anatomical characteristics of pistil abortion of ‘Baihuashanbitao’, a variety of Amygdalus davidiana.. Journal of Fruit Science , 21 (3) : 201–203. [in Chinese] ) (  0) 0)
|
| [] |
王晓东, 段全猛. 2006. 软枣猕猴桃的利用与栽培. 特种经济动植物 (2) : 33–34.
( Wang X D, Duan Q M.2006. Actinidia use and cultivation. Special Economic Animal and Plant (2) : 33–34. [in Chinese] ) (  0) 0)
|
| [] |
杨妙贤, 梁红, 贺苏丹. 2009. 猕猴桃性别分化与鉴定研究进展. 仲恺农业工程学院学报 , 22 (1) : 57–60.
( Yang M X, Liang H, He S D.2009. Research progress in sex differentiation and identification of Actinidia. Journal of Zhongkai University of Agriculture and Engineering , 22 (1) : 57–60. [in Chinese] ) (  0) 0)
|
| [] |
杨妙贤, 肖得兴, 梁红, 等. 2011. 中华猕猴桃性别分化的细胞形态学观察. 园艺学报 , 38 (2) : 257–264.
( Yang M X, Xiao D X, Liang H, et al.2011. Cytomorphological observation on sex differentiation of Actinidia chinensis.. Acta Horticulturae Sinica , 38 (2) : 257–264. [in Chinese] ) (  0) 0)
|
| [] |
周繇. 2008. 长白山植物资源学. 吉林: 吉林人民出版社 .
( Zhou Y. 2008. Plant resource science of Changbai Mountain. Changchun: Jilin People's Publishing House . [in Chinese] ) |
| [] |
Chapman G P.1987. The tapetum. Int Rev Cytol , 107 (6) : 111–125.
( 0) 0)
|
| [] |
Coimbra S, Torrão L, Abreu I.2004. Programmed cell death induces male sterility in Actinidia deliciosa female flowers. Plant Physiology and Biochemistry , 42 (6) : 537–541.
DOI:10.1016/j.plaphy.2004.05.004 ( 0) 0)
|
| [] |
Dellaporta S L, Calderon-Urrea A.1993. Sex determination in flowering plants. Plant Cell , 5 (10) : 1241–1251.
DOI:10.1105/tpc.5.10.1241 ( 0) 0)
|
| [] |
Kataoka I, Mizugami T, Kim J G, et al.2006. Distribution and character of ploidy variance in Actinidia arguta.. Hort Res(Japan) , 75 (2) : 121.
( 0) 0)
|
| [] |
Kawanabe T, Ariizumi T, Kawai-Yamada M, et al.2006. Abolition of the tapetum suicide program ruins microsporogenesis. Plant & Cell Physiology , 47 (6) : 784–787.
( 0) 0)
|
| [] |
Lu Y G, Feng J H, Liu X D, et al.2002. Ultrastructural studies on the developmental process of pollen and anther in rice (Oryza sativa L.). Chin J Rice Sci , 126 (1) : 29–37.
( 0) 0)
|
| [] |
Ma H.2005. Molecular genetic analyses of microsporogenesis and microgametogenesis in flowering plants. Annual Review of Plant Biology , 56 (1) : 393–434.
DOI:10.1146/annurev.arplant.55.031903.141717 ( 0) 0)
|
| [] |
Pablo González-Melendi, Uyttewaal M, Morcillo C N, et al.2008. A light and electron microscopy analysis of the events leading to male sterility in Ogu-INRA CMS of rapeseed (Brassica napus). Journal of Experimental Botany , 59 (4) : 827–838.
DOI:10.1093/jxb/erm365 ( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52
