文章信息
- 余仲东, 唐光辉, 曹支敏
- Yu Zhongdong, Tang Guanghui, Cao Zhimin
- 陕西小叶杨叶内生真菌群体多样性和结构特征
- Diversity and Community Structure of Endophytic Fungi in the Leaves of Populus simonii in Shaanxi Province
- 林业科学, 2016, 52(6): 86-92
- Scientia Silvae Sinicae, 2016, 52(6): 86-92.
- DOI: 10.11707/j.1001-7488.20160610
-
文章历史
- 收稿日期:2014-07-31
- 修回日期:2015-10-12
-
作者相关文章
内生真菌是植物体中广泛存在的一类特殊微生物(Wilson,1995)。近年来,内生真菌强大的生理学和生态学功能引起了人们的高度重视(Rosenblueth et al.,2006;Newcombe et al.,2009;袁志林等,2008)。杨树作为优良的用材和防护林树种,其内生真菌的研究和利用在世界范围内广泛开展。从毛白杨(Populus tomentosa)上分离的内生真菌Chaetomium spirale防治苹果溃疡病取得良好的效果(Xin et al.,2005);而分离得到的内生细菌可以产生抗生素,抑制杨树溃疡病菌(Botyosphaeria dothidea)及其他病原菌的生长(Yin et al.,2011)。袁秀英等(2006) 从杨树上分离到的内生真菌青霉(Penicillium sp.)可以迅速对杨树烂皮病病原菌(Cytospora sp.)的菌落进行包围、覆盖,抑制病原菌的生长。从杂交杨Neva(P. deltoides × P. nigra )上分离的内生真菌具有抗真菌和细菌的活性(Zhong et al.,2011)。杨树叶部内生真菌能够诱导杨树(Populus sp.)数量抗锈性(Melampsora × columbiana)产生,叶片丰富的内生菌及其分布提供了杨树叶片对多种病原菌的局部抗性(Raghavendra et al.,2013)。在铜和铅污染的土壤中生长的杨树,其内生真菌的数量较未污染土壤中生长的杨树中的多,而且生长良好(Karlinski et al.,2010)。从杂交杨DN177中分离的内生细菌(Enterobacteria sp.)能够分解三氯乙烯(Kang et al.,2012)。杨树上分离的3株内生酵母菌还可以分泌吲哚-3-乙酸(Xin et al.,2009),来自杨柳树上的内生细菌及酵母还可以固氮(Doty et al.,2009),明显地促进玉米(Zea mays)、西红柿(Lycopersicon esculentum)、辣椒(Capsicum annuum)等作物及多种杂草的生长(Khan et al.,2012)。
小叶杨(Populus simonii)属森林草原偏湿的旱生发育型树种,种内形态差异大,分布广,有5个变种3个变型(郑万钧,2004),是我国20世纪50年代造林的先锋树种。在三北防护林地区,迄今保存的小叶杨人工林面积约64万hm2,占全国杨树人工林面积的10%。但由于恶劣的环境条件和病虫害的肆虐,我国当年营造的小叶杨人工林大多衰败、零星残存,许多变成了“小老树”。然而,作为中国特有杨树种,小叶杨在我国西北地区和华北地区仍能找到天然林分布和残存的成百上千年的古树,较其他杨树种表现出更强的耐旱、耐瘠薄、耐病虫、耐极端气候等特征。
本文试图通过不同地理气候特征下小叶杨内生真菌多样性的调查和分析,以期揭示小叶杨内生真菌结构及其群体特征,以及他们在小叶杨生态分布中的差异,为内生真菌的开发利用和小叶杨的经营管理提供依据。
1 材料与方法 1.1 采样地点陕西省榆林地区:包括红山、青云、无定河3个采集点;宝鸡地区:包括鹦鸽、桃川、凤南3个采集点,均为小叶杨纯林,林分特征见表 1。
|
|
在2013春季、秋季和2014年春季采集同一株小叶杨的健康叶片,每个地点采集4~5棵树,分别从树冠的东南西北4个方向采集约2 m高的树叶各4~6片,标记采集地点,时间、方向等,装入塑封袋,冰盒保存,带回实验室进行分离。
1.3 分离方法用2%次氯酸钠水溶液进行表面消毒2 min后,用无菌水冲洗2次,每次1 min。冲洗后的叶片放在PDA上25 ℃恒温黑暗培养,第2次无菌水漂洗液接种PDA恒温培养以检测表面消毒效果。为增加纤维素型真菌的分离,也将前面方法表面消毒后的叶片置灭菌的面巾纸上,在无菌的密封袋中进行25 ℃恒温培养。每棵树按东南西北每个方向采2个叶片,分别放在PDA和面巾纸上保湿无菌培养,每个培养皿、每个密封袋各1个叶片,共4×2×2 个处理。2~3周后,纯化内生真菌并统计培养结果。
1.4 内生真菌的鉴定和统计分析根据培养物生物学特征、形态特征和ITS-DNA分子系统学,对分离到内生真菌进行属种鉴定,参照Sun等(2012) ,以属为单位统计内生真菌群体定植率、相对分离率、多样性指数、相似性系数。
定植率(CF,colonization frequency)=分离到内生真菌的叶片数目/总的叶片数目×100%,反映内生真菌在叶片中的分布程度;
相对分离率(RF,relative freguency)=分离到的内生真菌株数/总的叶片数目×100%,反映内生真菌在叶片中的丰富程度;
Shannon-Wiener 多样性指数(H′)=-ΣPilnPi,反映内生真菌群体的多样性, 式中,Pi是第i个属菌株占全部内生真菌总数目的比例;
相似性系数(Cs,similarity coefficient)=2j/(a+b),反映2个地点或时间点内生真菌群体的相似程度。式中,a,b分别表示2地点或时间点分离到的内生真菌群体总数目,j表示2地点或时间点上均具有的内生真菌群体的数目。
统计以上指标,按采集点、春秋季节取均值,经Excel 2010处理后用软件SASS进行分析和做图。
2 结果与分析 2.1 小叶杨叶片内生真菌种类组成及优势菌群比较从陕西省宝鸡地区和榆林地区采集的600个小叶杨表面消毒叶片内,总共分离到1 160株内生真菌菌株。其中,无性型子囊菌菌群占全部菌株的88.79%,有性型子囊菌菌群占10.86%,接合菌和担子菌分别占0.02%。在目的分类水平上,丛梗孢目(Moniliales)占全部菌株的51.21%,球壳孢目(Sphaeropsidales)占45.95%,这2个目为优势菌群。从科的分类水平上,丛梗孢科(Moniliaceae)占9.66%,暗梗孢科(Dematiaceae)占50.95%,球壳孢科(Sphaerpsidaceae)占24.74%;在属的水平上,交链孢属(Alternaria)、单隔孢属(Ulocladium)、茎点霉属(Phoma)为优势属,分别占全部菌株的23.10%,22.50%,14.22%。前后2年分离的内生真菌群体基本相似(表 2)。
|
|
在宝鸡地区和榆林地区小叶杨叶片内生真菌种类组成中,主要的优势菌群没有差别,均为交链孢属、单隔阳属、茎点霉属,但是优势菌群相对分离频率差别较大,整体表现为榆林地区优势菌群的相对分离频率高于宝鸡地区(图 1)。除此之外,2个地区有各自特有的优势菌群,在宝鸡地区是毛壳菌属(Chaetomium)(RF=4.07%)、梭孢壳属(Thielavia)(RF=1.23%)、拟茎点霉属(Phomopsis)(RF=5.97%);在榆林地区有壳囊孢属(Cytospora)(RF=7.58%)、平脐蠕孢(Bipolaris)(RF=2.32%)。
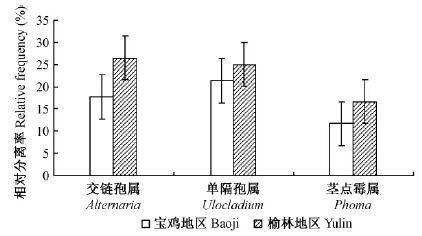
|
图 1 宝鸡地区与榆林地区小叶杨内生真菌优势菌群比较 Fig.1 Comparison of dominant fungi communities in P. simonii in Baoji and Yulin |
在分离到的1 160株内生真菌中,总体上看,榆林地区内生真菌的相对分离率略高于宝鸡地区,定植率差别不显著(图 2)。榆林和宝鸡地区内生真菌的相对分离率表现为秋季高于春季,但春秋两季的定植率无显著差别。榆林地区内生真菌在春季和秋季的相对分离率分别高于宝鸡地区内生真菌在春季和秋季的分离率,且春秋季节相对分离率差异显著(图 3)。

|
图 2 宝鸡地区与榆林地区小叶杨内生真菌的相对分离率和定植率 Fig.2 Relative frequency(RF)and Colonization frequency(CF) rates of endophytic fungi in P. simonii in Baoji and Yulin |
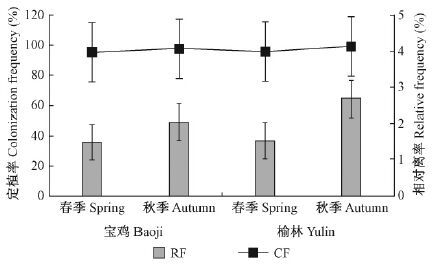
|
图 3 不同季节宝鸡地区与榆林地区小叶杨内生真菌的相对分离率和定植率 Fig.3 RF and RF of P. simonii endophytic fungi in Baoji and Yulin in different seasons |
宝鸡地区内生真菌的菌株数量低于榆林地区,而多样性指数高于榆林地区(图 4)。在同一地理范围,内生真菌在春季的菌株数量低于秋季,多样性指数则表现为春季高于秋季(图 5)。
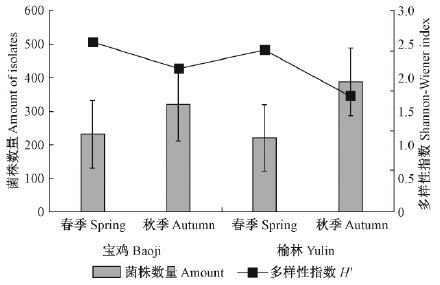
|
图 4 宝鸡地区与榆林地区小叶杨内生真菌的菌株数量和多样性指数 Fig.4 Amount and Shannon-Wiener index of endophytic fungi in P. simonii in Baoji and Yulin |
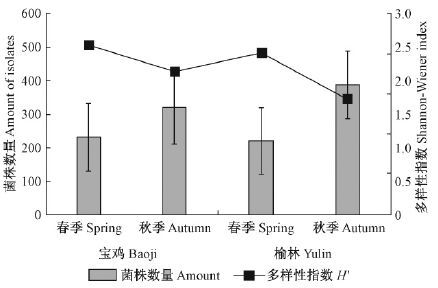
|
图 5 不同季节宝鸡地区与榆林地区内生真菌的多样性指数 Fig.5 Shannon-Wiener index of P. simonii endophytic fungi in Baoji and Yulin in different seasons |
宝鸡地区和榆林地区小叶杨叶片内生真菌群体的相似性系数为0.445 4,接近0.5,2个区域内生真菌群体基本相似。
6个不同地点间内生真菌群体的相似性系数略有差异,变化范围在0.388 9~0.689 7之间。在宝鸡地区的3个采集地点间相似性系数最低为0.500 0,在榆林地区的3个采集点间相似性系数最低为0.666 7,地区内内生真菌群体相似系数大于地区间(表 3)。地区间林龄接近、林下植被类似,内生真菌相似系数高,鹦鸽采集点与青云采集点的小叶杨树龄分别为8和5年,林下植被相似,二者内生真菌群体相似系数达0.514 2,是榆林与宝鸡地区间最高的相似系数。
|
|
不同季节小叶杨叶片内生真菌的相似性系数比较发现,桃川、凤南、青云3个地点春季和秋季内生真菌的相似性系数小于0.5,鹦鸽、红山、无定河3个地点春季和秋季内生真菌相似性系数大于0.5,其中鹦鸽春季和秋季内生真菌相似性系数最高为0.583 3,凤南春季和秋季内生真菌相似性系数最低,为0.424 2。生长季节对不同地点小叶杨叶片内生真菌的种类组成差异有一定的影响(图 6)。
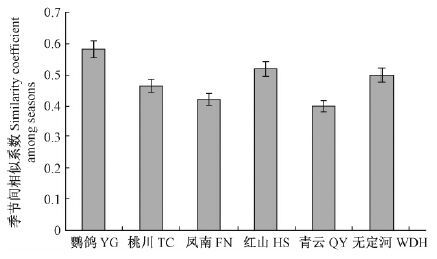
|
图 6 不同采集点叶片内生真菌春秋季间的相似性系数 Fig.6 Similarity coefficients of fungal endophyte communities of P. simonii between Spring and Autumn |
沙漠地区植物被证实含有大量的DSE内生真菌(Sun et al.,2012; Martin et al.,2012)。DSE真菌通常被认为和植物有较长时期的协同进化过程,DSE真菌黑色素可为寄主植物提供耐热保护、驱散环境热量和因热产生的氧化物,同时,寄主也为其免受暴露于高热、强紫外线和干燥环境提供了庇护(Baynes et al.,2012)。小叶杨是旱生型树种,在我国西北、华北干旱地区均有分布,从毛乌素沙漠边缘榆林地区采集的小叶杨内生真菌群体也表现出明显的旱生DSE真菌特征,青霉属、曲霉属、交链孢属、单隔孢属、枝孢霉属、茎点霉属等是常见的优势菌群。但宝鸡地区处秦岭北麓,气候温和湿润,年降雨量800~1 000 mm,远大于榆林地区年降雨量(200~550 mm),小叶杨内生真菌群体却与榆林地区类似,优势菌群基本相似,表明小叶杨内生真菌群体对寄主植物有明显的选择性。Unterseher等(2012) 在比较不同树种内生菌群体时也发现,相同科属的寄主树木具有更高的相似性,胡杨(P. euphratica)与欧洲山杨(P. tremula)内生真菌群体相似性较与松属(Pinus)、水青冈属(Fagus)树木高,杨树(Populus sp.)上的内生菌与柳树(Salix sp.)上的截然不同(Doty et al.,2009),而同一杂交杨无性系内内生细菌群体却基本一致(Ulrich et al.,2007)。
气候对树木内生菌群有影响但不起决定性作用,宝鸡和榆林地区小叶杨内生真菌类群多样性并无显著差异。宝鸡地区小叶杨叶内生真菌群体多样性大于陕北榆林地区,但分离率却相对较少,可能与秦岭林区丰富的植被选择有关。对于小叶杨这种落叶阔叶树,这种选择性可能与水平传播的内生真菌分生孢子随机定植密切相关,宝鸡地区较丰富的降雨和植被类群,为内生真菌的定植提供了更高的可能性和多样性。但榆林地区小叶杨树龄较大、林下植被相对稳定,对内生真菌群体表现出更高的选择性,优势菌群定植率高。2个地区也分别孕育出一些特有的种群,宝鸡地区有毛壳菌属、梭孢壳属、拟茎点霉属,毛壳菌是常见的纤维素分解真菌,纸培养能分离出许多,其出现可能和林下丰富的枯落物有关。榆林地区特有种群有壳囊孢属(RF=7.58%)、平脐蠕孢(RF=2.32%),分别为树木干部和杂草根部常见病原菌。特有种真菌的生态学功能,需要进一步研究。
不同生境下,内生真菌群体可能对寄主存在不同的相互选择模式。对亚利桑那州不同样点的仙人掌(Opuntia stricta)内生真菌群体研究发现,寄主对内生真菌群体并无明显的选择性;沙漠地区干燥的气候、稀疏的植被、强烈的紫外线使得内生真菌某些生活史阶段离开寄主后将无法生存,因而表现出无寄主选择性(Suryanarayanan et al.,2005)。田间状态下,内生真菌对寄主的选择可能是受环境和寄主分布影响的随机事件,但对寄主组织的选择也许是必然事件。苹果茎点霉(Phoma pomorum)有明显的组织选择性,沙漠植物叶片和茎干部内生真菌群体相似系数非常低(Sun et al.,2012)。鹿角菌(Xylariaceous)、球座菌(Guignardia)内生真菌优势群大多出现在野香蕉(Musa acuminata)叶片,寄生拟梨孢霉(Pyriculariopsis parasitica)、指环菌(Dactylaria sp.)出现在假茎,而香蕉炭疽菌(Colletotrichum musae)、胶孢炭疸菌(C. gloeosporioides) 在叶脉和叶柄中常见(Photiat et al.,2001),内生真菌对寄主组织的选择可能反映了它们对底物利用和生存的能力(Rodrigues et al.,1994),叶部角质层、组织的质地、组织生理和化学的变化都可能对内生真菌群体结构产生影响(Stone,1987)。本研究未就小叶杨各组织内生真菌群体进行比较,但叶部中分离到的枝干腐烂和溃疡病菌与树龄密切相关,壳囊孢属、拟茎点霉属、葡萄座腔菌属等菌群只出现在红山、无定河、凤南30年生以上小叶杨,也预示这些真菌可能具有明显的组织选择性,尚需进一步确定。
小叶杨叶内生真菌在春秋时节,无论是分离率、定植率还是多样性指数都有差异,表明内生真菌群体在宿主上存在一个动态过程,种群间存在对抗、抑制、相容直至平衡这样一个激烈过程,早春的随机定植需要接受寄主、环境条件及其他内生菌的选择,这在一些常绿阔叶树中和多年生植物组织中表现尤为明显(袁秀英等,2006;Mysore et al.,2005;臧威等,2014),但不同生态区域环境中出现的特有种群,他们在寄主中定植的历史、消长的规律及与寄主种群的生态适应性有何关系,值得深入研究。
4 结论小叶杨内生真菌群体对寄主具有较强的选择性,来自地理气候显著差异的宝鸡和榆林地区小叶杨真菌类群相似系数接近0.5,优势菌群基本相似,以单隔孢属、交链孢属、枝孢霉属、茎点霉属、青霉菌属等深色有隔内生真菌(dark septate endophyte,DSE)为优势种群。
采集时间、林下植被和树龄对内生真菌种群结构有影响。在6个采集点中,春季分离的内生真菌定植率、相对分离率均较秋季低,而多样性指数却相反。
林下植被对早春小叶杨内生真菌群体的相似性系数有较大影响。相同的林下植被类型可孕育较高相似性的内生真菌群体,如榆林地区的3个采集点植被类型均为柠条灌木型、宝鸡地区的3个采集点为杂草+小阔叶乔木型,内生真菌群体的相似系数在地区内均在0.5以上。宝鸡鹦鸽采集点和榆林青云采集点,小叶杨均为幼树,林下植被相似,尽管相距约800 km,但内生真菌群体的相似系数也达到0.514 2。桃川、凤南、青云采集点,林下植被相对丰富,更新较快,春季内生真菌菌群同秋季内生真菌菌群相似系数小于0.5,鹦鸽采集点在一个相对封闭的庭院内,林下植被受影响小,春秋季内生真菌群体相似系数较高(0.583 3) 。小叶杨内生真菌群体差别主要决定于寄主小叶杨树龄、林下植被类型,区域地理环境和降雨对小叶杨内生真菌群体类型不起主要作用。
| [1] |
袁秀英, 白红霞, 白玉明, 等. 2006. 杨树内生真菌的分离和拮抗生防菌的筛选. 林业科学研究 , 19 (6) : 713–717.
( Yuan X Y, Bai H X, Bai Y M, et al.2006. Isolation of endophytes and screen of antagonistic strains in polar trees. Forestry Research , 19 (6) : 713–717. [in Chinese] ) (  0) 0)
|
| [2] |
袁志林, 章初龙, 林福呈. 2008. 植物与内生真菌互作的生理与分子机制研究进展. 生态学报 , 28 (9) : 4430–4439.
( Yuan Z L, Zhang C L, Lin F C.2008. Recent advances on physiological and molecular basis of fungal endophyte-plant interactions. Acta Ecologica Sinica , 28 (9) : 4430–4439. [in Chinese] ) (  0) 0)
|
| [3] |
臧威, 孙翔, 孙剑秋, 等. 2014. 南方红豆杉内生真菌多样性和群落结构. 生态学杂志 , 25 (7) : 2071–2078.
( Zang W, Sun X, Sun J Q, et al.2014. Diversity and community structure of endophytic fungi from Taxus chinensis var. mairei. Chinese Journal of Applied Ecology , 25 (7) : 2071–2078. [in Chinese] ) (  0) 0)
|
| [4] |
郑万钧. 2004. 中国树木志. 京: 中国林业出版社 .
( Zheng W J. 2004. Dendrology of China. Beijing: Chinese Forestry Publishing House . [in Chinese] ) |
| [5] |
Baynes M, Newcombe G, Dixon L, et al.2012. A novel plant-fungal mutualism associated with fire. Fungal Biology , 116 (1) : 133–144.
( 0) 0)
|
| [6] |
Doty S L, Oakley B, Xin G, et al.2009. Diazotrophic endophytes of native black cottonwood and willow. Symbiosis , 47 (1) : 23–33.
( 0) 0)
|
| [7] |
Kang J W, Khan Z, Doty S L.2012. Biodegradation of trichloroethylene by an endophyte of hybrid poplar. Appl Environ Microbiol , 78 (9) : 3504–3507.
( 0) 0)
|
| [8] |
Karlinski L, Rudawska M.2010. Relationship between genotype and soil environment during colonization of poplar roots by mycorrhizal and endophytic fungi. Mycorrhiz , 20 : 315–324.
( 0) 0)
|
| [9] | Khan Z, Guelich G, Phan H, et al. 2012. Bacterial and yeast endophytes from poplar and willow promote growth in crop plants and grasses. ISRN Agronomy. Doi:10.5402/2012/890280. |
| [10] |
Martin U, Anne P, Martin S.2012. Xerotolerant foliar endophytic fungi of Populus euphratica from the Tarim River basin, Central China are conspecific to endophytic ITS phylotypes of Populus tremula from temperate Europe. Fungal Diversity , 54 (1) : 133–142.
( 0) 0)
|
| [11] |
Mysore V T, Basavanna M, Monnanda S N, et al.2005. Endophytic fungal assemblages from inner bark and twig of Terminalia arjuna (Combretaceae). World Journal of Microbiology & Biotechnology , 21 : 1535–1540.
( 0) 0)
|
| [12] |
Newcombe G, Shipuno A, Eigenbrode S, et al.2009. Endophytes influence protection and growth of an invasive plant. Communicative and Integrative Biology , 2 (1) : 29–31.
( 0) 0)
|
| [13] |
Photita W, Lumyong S, Lumyong P, et al.2001. Endophytic fungi of wild banana (Musa acuminate) at Doi Suthep Pui National Park, in Thailand. Mycol Res , 105 (1) : 1508–1513.
( 0) 0)
|
| [14] |
Raghavendra A K H, Newcombe G.2013. The contribution of foliar endophytes to quantitative resistance to Melampsora rust. New Phytologist , 197 (3) : 909–918.
( 0) 0)
|
| [15] |
Rodrigues K F, Samuels G J.1990. Preliminary study of endophytic fungi in tropical palm. Mycol Res , 94 (6) : 827–830.
( 0) 0)
|
| [16] |
Rosenblueth M, Martínez-Romero E.2006. Bacterial endophytes and their interactions with hosts. Mol Plant Microbe Interact , 19 (8) : 827–837.
( 0) 0)
|
| [17] |
Stone J K.1987. Initiation and development of latent infection by Rhabdocline parkeri on Douglas fir. Can J Bot , 65 (4) : 2614–2621.
( 0) 0)
|
| [18] |
Sun Y, Wang Q, Lu X D, et al.2012. Endophytic fungal community in stems and leaves of plants from desert areas in China. Mycol Progress , 11 (3) : 781–790.
( 0) 0)
|
| [19] |
Suryanarayanan T S, Wittlinger S K, Faeth S H.2005. Endophytic fungi associated with cacti in Arizona. Mycol Res , 109 (5) : 635–639.
( 0) 0)
|
| [20] |
Ulrich K, Ulrich A, Ewald D.2007. Diversity of endophytic bacterial communities in poplar grown under field conditions. FEMS Microbiol Ecol , 63 (2) : 169–180.
( 0) 0)
|
| [21] |
Unterseher M, Schnittler M.2010. Species richness analysis and ITS rDNA polygeny revealed majority of cultivable foliar endophytes from beech (Fagus sylvatica). Fungal Ecol , 3 (1) : 366–378.
( 0) 0)
|
| [22] |
Wilson D.1995. Endophyte-the evolution of a term, and clarification of its use and definition. Oikes , 73 (2) : 207–215.
( 0) 0)
|
| [23] |
Xin G, Glawe D, Doty S.2009. Characterization of three endophytic, indole-3-acetic acid-producing yeasts occurring in Populus trees. Mycologial Research , 113 (9) : 973–980.
( 0) 0)
|
| [24] |
Xin Y, Shang J.2005. Bio-control trials of Chaetomium spirale ND35 against apple canker. J For Res , 16 (2) : 121–124.
( 0) 0)
|
| [25] |
Yin X T, Xu L N, Xu L, et al.2011. Evaluation of the efficacy of endophytic Bacillus amyloliquefaciens against Botryosphaeria dothidea and other phytopathogenic microorganisms. African Journal of Microbiology Research , 5 (4) : 340–345.
( 0) 0)
|
| [26] |
Zhong L Y, Zhou Y F, Gao S, et al.2011. Endophytic fungi from the hybrid ‘Neva’ of Populus deltoides Marsh×Populus nigra L. and their antimicrobial activity. African Journal of Microbiology Research , 5 (23) : 3924–3929.
( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52
