文章信息
- 孙玉芳, 宋福强, 常伟, 范晓旭
- Sun Yufang, Song Fuqiang, Chang Wei, Fan Xiaoxu
- 盐碱胁迫下AM真菌对沙枣苗木生长和生理的影响
- Effect of Arbuscular Mycorrhizal Fungi on Growth and Physiology of Elaeagnus angustifolia Seedlings Subjected to Salinity Stress
- 林业科学, 2016, 52(6): 18-27
- Scientia Silvae Sinicae, 2016, 52(6): 18-27.
- DOI: 10.11707/j.1001-7488.20160603
-
文章历史
- 收稿日期:2015-03-16
- 修回日期:2016-04-15
-
作者相关文章
盐碱土资源是我国一种很重要的后备耕地资源,随着人口增加与土地减少、资源短缺与生态恶化的矛盾日益尖锐化,人们越来越重视开发利用盐碱地来缓解危机。据联合国教科文组织和粮农组织的不完全统计,全球盐碱地面积已达9.5亿hm2,且每年以 100万~150万hm2速度增长。其中,我国盐碱地面积约为9.9×107 hm2,主要分布于23个省、自治区的平原,包括滨海盐碱土区、黄淮海平原盐碱土区、西北半干旱盐碱土区和干旱盐碱土区以及东北盐碱土区(李培夫,1999)。同时,土壤盐碱化引发诸多生态环境问题,如水土流失、土地荒漠化、森林和草地资源减少、生物多样性减少等。
沙枣(Elaeagnus angustifolia)为胡颓子科(Elaegnaceae)胡颓子属落叶乔木或小乔木,主要分布在我国西北地区和内蒙古以及华北西北部。沙枣生活力很强,具有抗旱、抗风沙、耐盐碱、耐贫瘠等特点,兼具生态、经济和药用价值,目前已经成为我国北方生态脆弱地区造林绿化的先锋树种。研究盐渍条件下的抗逆措施,对提高沙枣幼苗抗逆性能和生长特性具有重要的现实意义。丛枝菌根(arbuscular mycorrhizal,AM)真菌是一类能够与大多数植物的根系建立共生关系的土壤真菌,是潜在适合于盐碱土壤接种的菌种之一(Sheng et al.,2009)。AM真菌广泛存在于盐碱地土壤中(盖京苹等,2004),盐碱胁迫下接种AM真菌可以提高植物的抗逆性,这可能是与菌根能改善植物的营养状况、增强光合特性(Talaat et al.,2014)、提高植株过氧化物酶活性(Latefa et al.,2011)有关。目前,沙枣耐盐性方面已见报道(陈志强等,2010; 齐曼·尤努斯等,2005; 杨升等,2014),但AM真菌在盐碱胁迫下对沙枣的生长效应的研究还鲜见报道。笔者课题组前期对盐碱地生长的沙枣根际土壤进行AM真菌多样性研究,共分离鉴定出2属8种AM真菌,其中 根内球囊霉(Glomus intraradices, GI)和摩西球囊霉(Glomus mosseae,GM)为优势种,并在长势好的沙枣苗木根系发现了丛枝菌根结构。本试验在盆栽条件下以GI和GM 2种AM真菌与沙枣共生关系为切入点,研究不同浓度盐碱胁迫下AM真菌对沙枣苗木的生长及生理效应,旨在为充分利用AM真菌资源促进沙枣生长及提高盐碱地利用率提供理论依据,对菌根化苗木推广应用具有一定的现实意义。
1 材料与方法 1.1 供试材料沙枣组培苗由黑龙江锦绣大地生物工程有限公司提供。组培室温度白天控制在25~27 ℃,晚上15~18 ℃;湿度控制在50%~70%;每天平均光照13.5 h。沙枣组培苗炼苗基质为草炭土∶蛭石∶沙子=5∶3∶2比例混匀灭菌(121 ℃,2 h)备用,该基质 pH7.13、土壤含盐量0.13%、碱解氮122.40 mg·kg-1、速效磷12.1 mg·kg-1、速效钾77.5 mg·kg-1。室温下炼苗,时间约15天,选择健壮、长势一致的沙枣苗木用于试验。
供试AM真菌为根内球囊霉(GI)和摩西球囊霉(GM),孢子含量均约25个·g-1接种物,由黑龙江大学修复生态研究室扩繁、保存。接种物由孢子、菌丝、菌根片段组成的根际混合物。
栽培供试苗木的土壤取自黑龙江省肇东市的肇岳山,使用前高压灭菌(121 ℃,2 h)。分别用S0,S1,S2,S3代表无盐碱胁迫和轻度、中度、重度盐碱胁迫,其理化性质见表 1。
|
|
试验设计包括2个试验因素:AM真菌和盐碱胁迫。AM真菌处理为:对照组CK(接种经高温灭活的接种物),接种根内球囊霉(GI)和接种摩西球囊霉(GM)3水平处理。盐碱胁迫为4水平,无盐碱胁迫、轻度、中度和重度盐碱胁迫。整个试验采用完全随机区组设计,包括12种处理,10次重复,共120盆。
本试验于2014年4月25日选取健壮、长势基本一致的沙枣苗木,将其定植于装有不同盐碱度土壤的15 cm×20 cm(高×口径)营养钵内,营养钵下面套塑料托盘,防止盐分流失。在植株根部分别接种GI和GM,对照组接种灭活菌剂,菌剂接种量为1%(g/g)。定期检测AM真菌对苗木侵染情况。8月1—20日选择天气晴朗、无风,上午09:00—11:00测定植株光合作用。8月27日将试验苗全部收获,测量植株长势、生物量;从上向下选取第4~10轮功能叶片,每个处理取5株植株叶片作为混合样;每处理随机选取5株植株根系混合,用于测定生理生化指标。采集的叶片和根系洗净立即放入液氮中速冻,并于-80 ℃超低温冰箱中保存,备用。
1.2.2 试验方法苗木菌根侵染率测定采用酸性品红染色方法(Phillips et al.,1970)。持米尺和游标卡尺测定株高、地径。称重法测定生物量,即每个处理选取5株植株,在105 ℃下杀青1 h,80 ℃烘干至恒质量,称取干质量。乙醇提取法测定叶绿素含量(李和生等,2000)。CI-340光合测定仪测定光合作用,参数包括净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)和蒸腾速率(Tr)。超氧化物歧化酶(SOD)活性采用氧化硝基四氮唑蓝法测定;过氧化氢酶(CAT)活性采用紫外吸收法测定;过氧化物酶(POD)活性采用愈创木酚法测定(陈建勋等,2002)。丙二醛(MDA)含量采用硫代巴比妥酸法测定;游离脯氨酸含量采用酸性茚三酮法测定(王学奎,2006)。采用火焰光度计法测定植株各组织中Na+,K+含量(萨如拉等,2014)。
1.3 数据处理用EXCEL 2003对数据进行前处理及绘制图表,SPSS 19.0进行方差分析及Tukey多重比较。
2 结果与分析 2.1 盐碱胁迫下AM真菌对沙枣苗木侵染率和生长的影响由表 2可知,未接种AM真菌的沙枣苗木根系没有观察到菌丝的侵染,而接种处理植株在不同浓度盐碱胁迫下均有不同程度的侵染。在S3盐碱胁迫下,接种GI植株菌根侵染率显著高于接种GM处理植株(P<0.05)。
|
|
盐碱双重逆境胁迫严重影响植物生长。接种AM真菌显著促进了盐碱胁迫下沙枣幼苗的生长,其株高、地径以及干物质生物量都显著高于未经处理的沙枣幼苗(P<0.05)。S2胁迫下接种GI和GM的沙枣株高分别较未接种植株增加了20.07%,9.68%,叶干质量增加43.88%,15.52%,但总体上沙枣幼苗的各项生长指标随着盐碱胁迫程度的增加均呈下降趋势。重度盐碱胁迫(S3)下未接种及接种GI和GM处理苗木株高比S0胁迫下相应处理植株降低了49.3%,46.68%,44.95%,根干物质质量分别降低了80.04%,69.59%,77.51%,这表明沙枣幼苗受盐碱胁迫导致生长受阻,但接种AM真菌植株生长状况受逆境影响略小,说明AM真菌在胁迫环境下仍可促进植株正常生长发育。盐碱胁迫下接种GI的沙枣苗木株高、地径以及干物质质量都比接种GM的有所增加,且部分达到显著水平,这表明GI提高植株抗逆性较好。
2.2 盐碱胁迫下AM真菌对沙枣苗木叶绿素含量及光合特性的影响随着盐碱胁迫程度的增加,沙枣幼苗叶片中叶绿素含量均显著下降(P<0.05),下降幅度与盐碱浓度呈正相关(表 3)。但在盐碱胁迫下,接种AM真菌植株Chl a,Chl b,Car和Chl a+b含量较对照处理植株之间差异显著(P<0.05),即接种处理植株随着盐浓度的增加较未接种处理植株下降幅度小。Chl b在中度碱胁迫下,接种GI和GM 2种处理之间均无显著差异(P>0.05),Chl a,Chl b,Car和Chl a+b含量在同一盐碱胁迫下接种GI处理苗木较接种GM处理植株叶绿素含量存在显著差异(P<0.05)。接种AM真菌显著提高了盐碱胁迫下的沙枣幼苗叶片的光合生理特性,其叶片净光合速率Pn,蒸腾速率Tr,气孔导度Gs,胞间二氧化碳Ci均显著高于未经处理的沙枣幼苗(P<0.05)。在相同盐碱胁迫下,接种GI处理的沙枣幼苗的Pn,Gs,Ci均显著高于接种GM植株,但这2种处理Tr无显著性差异。随着盐碱胁迫程度的增加,沙枣幼苗叶片的Pn,Tr,Gs以及Ci呈明显下降趋势,这表明盐碱胁迫下沙枣幼苗叶片光合生理特性严重受阻。
|
|
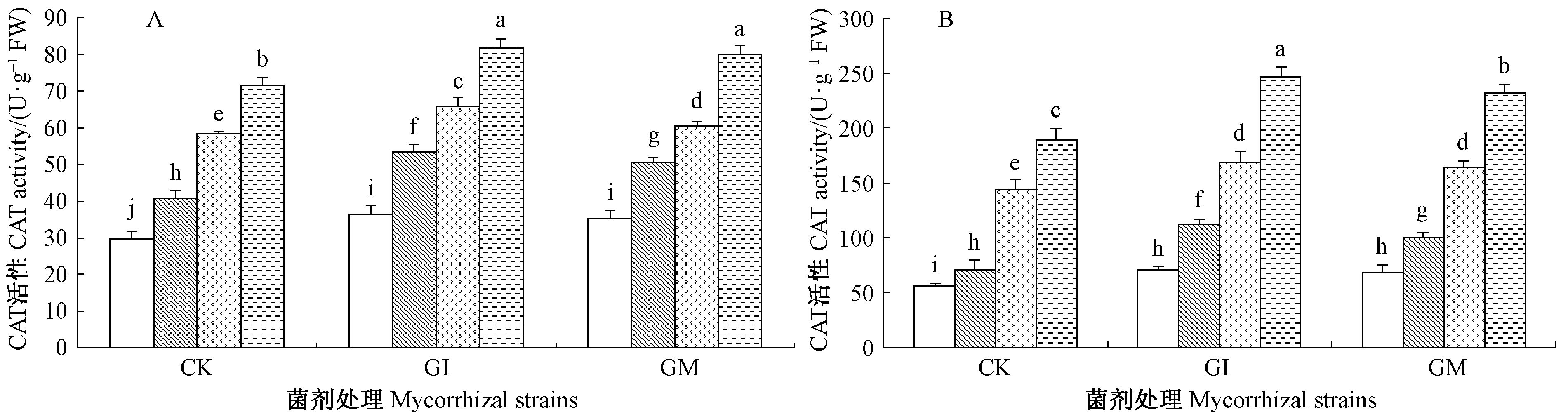
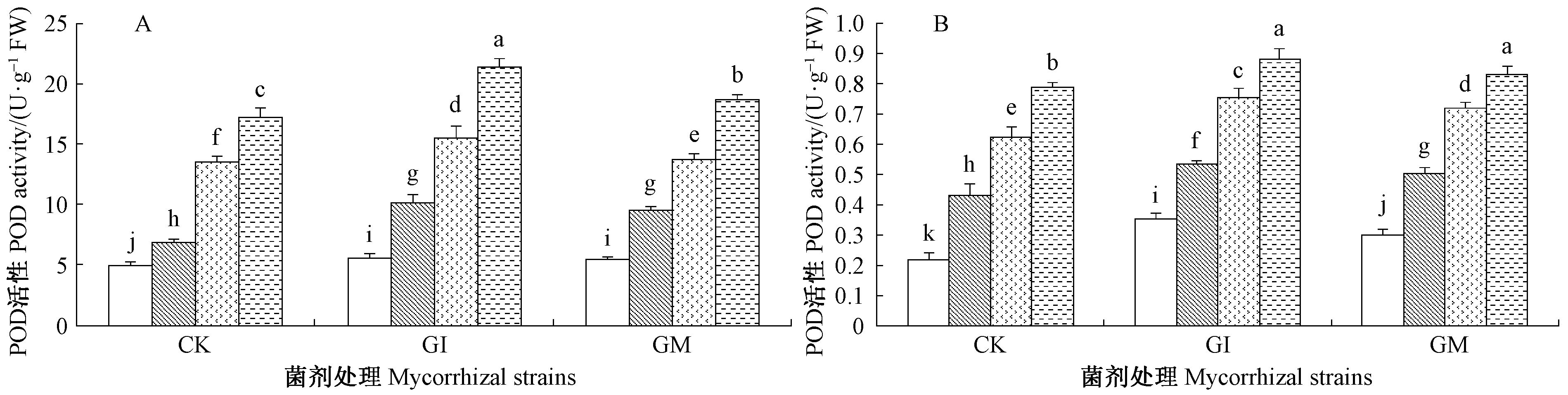
由图 1~3可知,接种AM真菌显著提高叶片和根系组织内SOD,CAT和POD活性,不论根系还是叶片中SOD,CAT和POD活性随盐碱胁迫程度的增加而呈现显著性增加(P<0.05)。结果显示,在S3盐碱胁迫下接种GI和GM处理植株叶片组织内SOD,CAT和POD活性较未接种植株分别提高了15.68%,29.66%,14.25%,11.14%,27.94%,5.93%。叶片、根系组织中SOD和POD活性,在S0盐碱胁迫下接种GI和GM两者无显著差异(P>0.05),但在其他处理组中各种抗氧化酶系均是接种GI植株显著高于GM植株(P<0.05),表明GI真菌更能提高沙枣苗木抗氧化能力。根系组织中SOD和POD酶活性均高于叶组织,而CAT酶活性为叶部高于根组织。
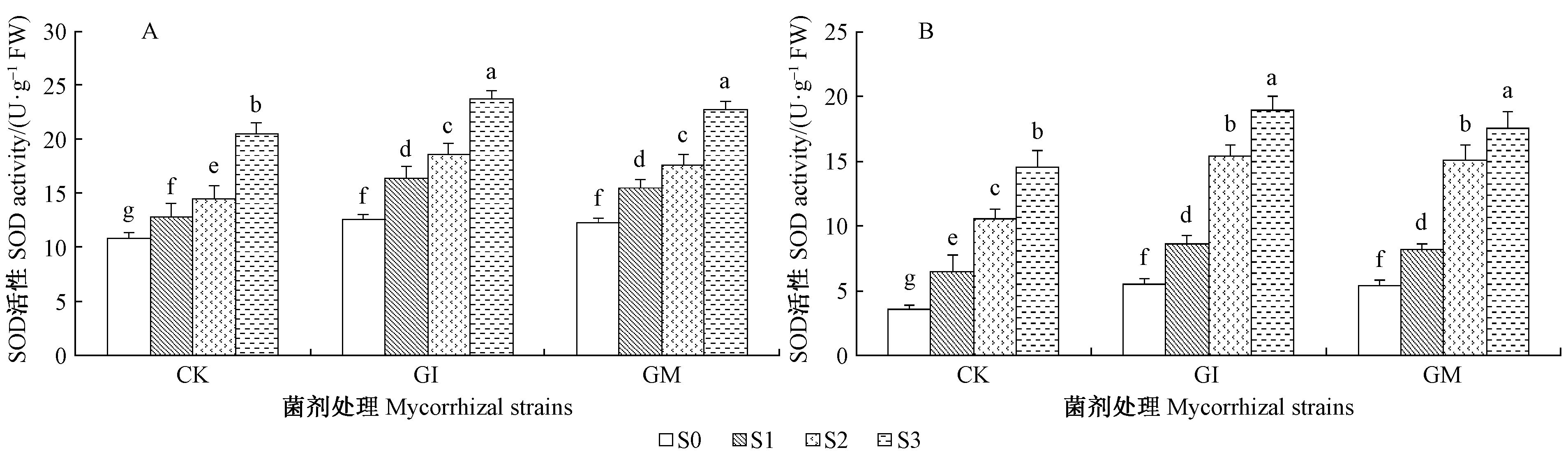
|
图 1 盐碱胁迫下AM真菌对根、叶组织中SOD活性的影响 Fig.1 Effects of AM fungi on SOD activity in leaves and roots of E. angustifolia under salinity stress A: 根 Root; B: 叶 Leaves。不同字母间表示组织差异达5%显著水平,菌剂处理分别用CK,GI,GM,数值表示4次重复的平均值(±SD),下同。 Different letters in the same column mean signification difference at 0.05 level. CK: No mycorrhizal; GI: G. intraradices; GM: G. mosseae. The column value represents the mean(±SD)of four replicates. The same below. |
|
图 2 盐碱胁迫下AM真菌对根、叶组织中CAT活性的影响 Fig.2 Effects of AM fungi on CAT activity in leaves and roots of E. angustifolia under salinity stress |
|
图 3 盐碱胁迫下AM真菌对根、叶组织中POD活性的影响 Fig.3 Effects of AM fungi on POD activity in leaves and roots of E. angustifolia under salinity stress |
不论根系还是叶片,丙二醛含量都随盐碱胁迫程度的增加而显著性增加。由图 4可知,在S3盐碱胁迫下接种GI和GM处理植株根系组织内丙二醛含量较未接种植株分别降低了31.0%,26.4%,叶片组织降低了19.68%,16.38%,证明接菌植株较对照处理植株更能缓解膜脂过氧化作用。在同一盐碱胁迫下,接种GI和GM可显著降低沙枣苗木根系和叶片丙二醛含量(P<0.05),2种菌剂之间也存在显著差异,接种GI植株的丙二醛含量显著低于接种GM植株(P<0.05),这说明接种GI更能减缓沙枣细胞膜的氧化。苗木根系中丙二醛含量均低于叶片中的含量。
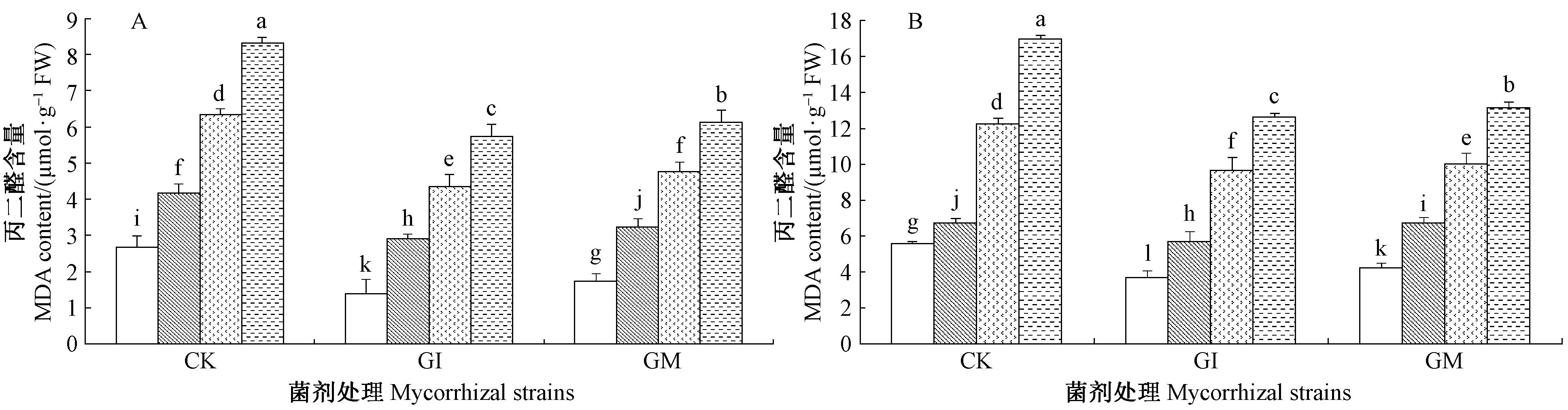
|
图 4 盐碱胁迫下AM真菌对沙枣根系和叶片丙二醛含量的影响 Fig.4 Effects of AM fungi on MDA content in leaves and roots of E. angustifolia under salinity stress |
由图 5、图 6可知,接种AM真菌植株脯氨酸含量显著高于对照处理的沙枣幼苗(P<0.05)。S3胁迫下接种GI和GM的沙枣根系脯氨酸含量分别较对照植株增加了23.45%,10.29%,叶片脯氨酸含量增加36.86%,29.42%,但总体上脯氨酸含量随盐碱胁迫程度的增加均成上升趋势。盐碱胁迫下接种GI的沙枣根系和叶片脯氨酸含量都比接种GM的有所增加,且达到显著水平,这表明GI真菌能很好增加沙枣苗木的抗逆性。本研究中脯氨酸含量在叶组织中分布大于根部。
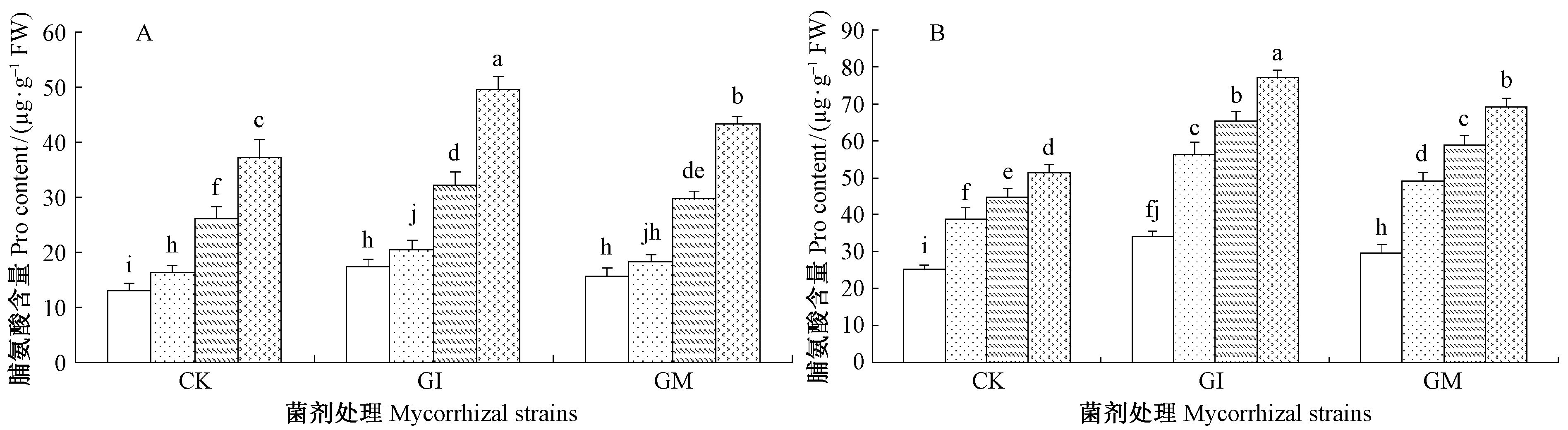
|
图 5 盐碱胁迫下AM真菌对沙枣根系和叶片脯氨酸含量的影响 Fig.5 Effects of AM fungi on Pro content in leaves and roots of E. angustifolia under salinity stress |
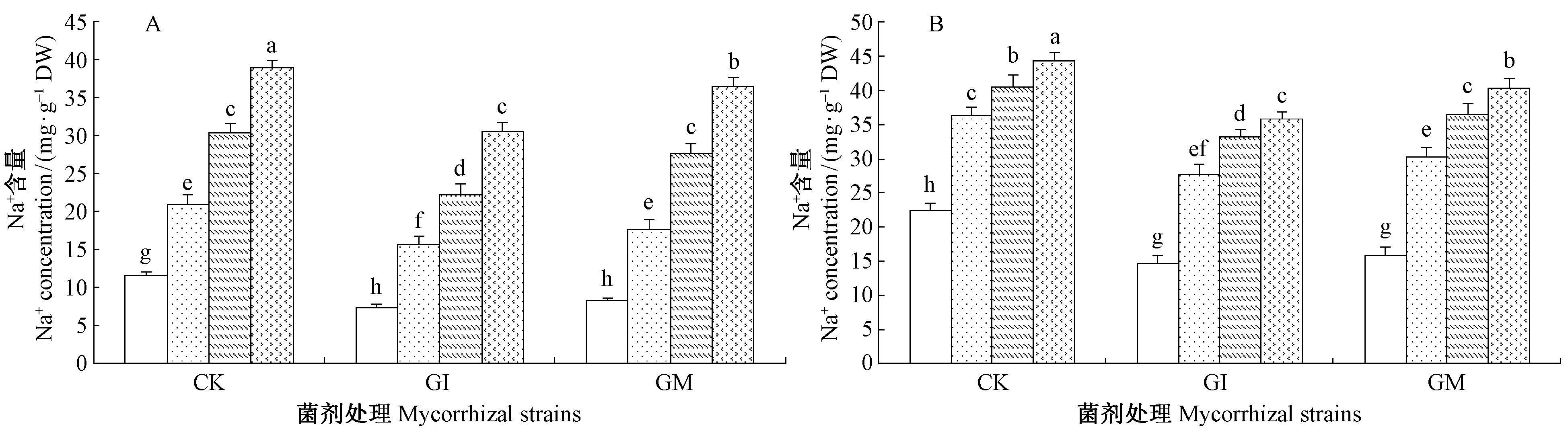
|
图 6 盐碱胁迫下AM真菌对沙枣根系和叶片Na+含量的影响 Fig.6 Effects of AM fungi on Na+ content in leaves and roots of E. angustifolia under salinity stress |
由图 7可知,不同盐碱胁迫条件下,沙枣苗木各组织中Na+、K+含量具有相同的变化规律,均为叶>根。无论根系还是叶片中Na+含量均随盐碱胁迫程度的增加呈上升趋势,K+含量呈下降趋势,说明盐碱度对植 物有一定程度的影响。S3胁迫下接种GI和GM的沙枣根系Na+含量分别较未接种AM真菌植株降低了17.39%,9.5%,叶片Na+含量降低了19.19%,9.03%,根系K+含量增加了83.70%,51.85,叶片K+含量增加了22.17%,12.32%。这表明AM真菌能减少根系细胞吸收外界土壤中Na+,增加对K+的吸收。2种菌剂均能缓解离子对宿主植物的毒害,接种GI在一定程度上比接种GM对离子造成的渗透胁迫调节效果更明显。
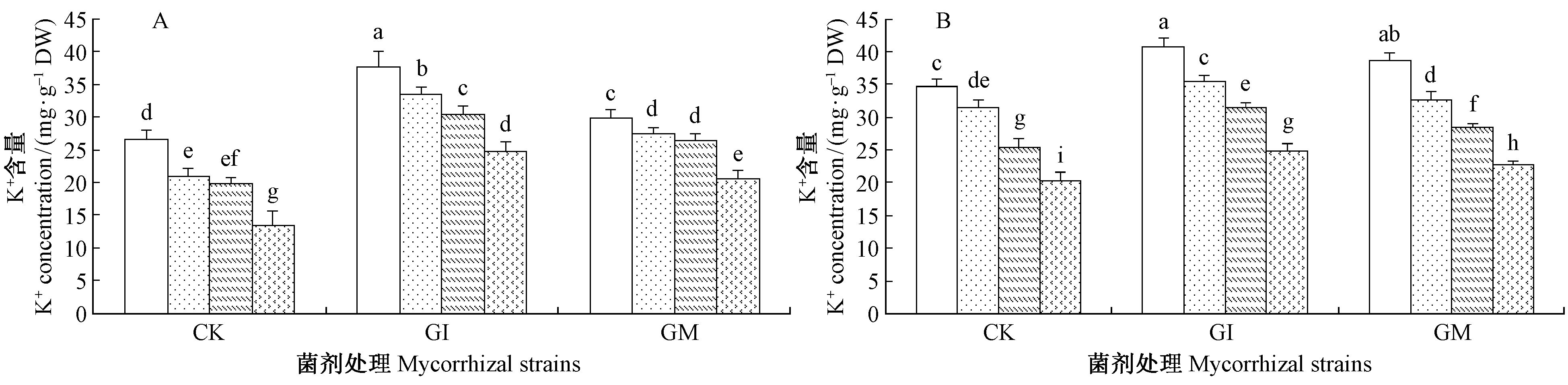
|
图 7 盐碱胁迫下AM真菌对沙枣根系和叶片K+含量的影响 Fig.7 Effects of AM fungi on K+ content in leaves and roots of E. angustifolia under salinity stress |
沙枣苗木根系和叶片中K+/Na+比值变化趋势均一致,随着盐碱胁迫程度的增加比值均呈下降趋势(图 8)。轻度盐碱胁迫比对照处理下降幅度较大,说明沙枣苗木对盐逆境反应敏感,轻度、中度以及重度盐碱胁迫条件下对植株变化趋势不明显,可能是由于Na+抑制植株对K+吸收,对植株造成不同程度的盐害。接菌植株的K+/Na+比值较对照植株明显增大,说明接种AM真菌缓解了Na+对植株的毒害作用,同时提高对K+选择性吸收。
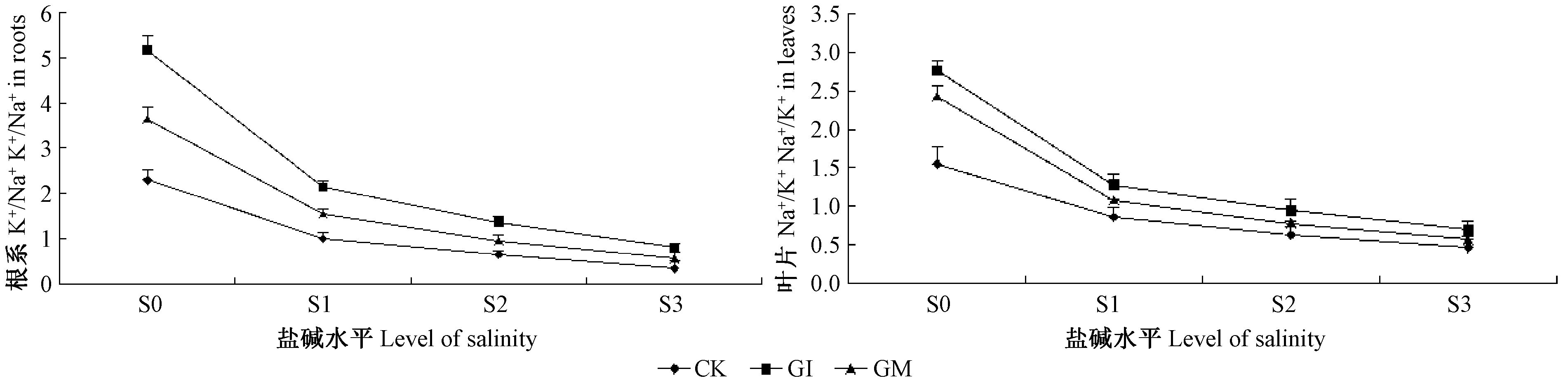
|
图 8 盐碱胁迫下AM真菌对沙枣根系和叶片K+/Na+的影响 Fig.8 Effects of AM fungi on K+/Na+ in leaves and roots of E. angustifolia under salinity stress |
盐度可以抑制孢子的萌发(Hirrel,1981),抑制菌丝的生长(McMillen et al.,1998)并减少菌根内丛枝的数量,减少AM真菌侵染(Pfeiffer et al.,1988)。本研究结果也显示出类似的趋势,在高盐碱胁迫下沙枣菌根侵染率减少,这表明重度盐碱土壤抑制菌丝生长进而影响菌根的侵染进程(Hajiboland et al.,2010)。不同的AM真菌提高植物承受盐碱胁迫的能力存在差异,随着胁迫程度的增加,供试的2种AM真菌中,G. intraradices与植物形成的菌根共生体表现出的活力和效率更稳定,而G. mosseae对重度盐碱胁迫表现较为敏感。这一结果证明G. intraradices在承受盐碱的抑制作用和促进沙枣苗木生长方面效果显著。
土壤盐渍化是一个世界性问题,AM真菌与植物共生能有效减少盐离子对植物的毒害作用,提高植物对盐胁迫的耐受性(Poss et al.,1985; Feng et al.,2002; 申连英等,2004; Rabie,2005)。接种AM真菌显著增加了植物的干质量,且随着盐碱胁迫程度的增加,这种促进作用更为明显,这与Al-Karaki等(2001)得到的结果一致。盐碱逆境下AM真菌能提高植物的干质量,且植株地上部生物量比根生物量增加的更为显著,可能原因是AM真菌侵染引起的碳水化合物的分配比例地上部分比根系组织多(Latefa et al.,2011)。
3.2 盐碱胁迫下菌根植物抗氧化酶系的活性变化盐渍逆境胁迫严重影响植物细胞内的自由基代谢平衡,导致大量活性氧在细胞内积累,引起细胞膜质的过氧化,破坏植物细胞结构。盐碱胁迫下接种AM真菌可以调节宿主植物体内各组织抗氧化酶活性,激活抗氧化酶清除自由基的能力。在盐渍逆境胁迫下SOD,CAT和POD在防御生物体氧化损伤方面起着重要作用,抗氧化酶类之间相互协调,消除细胞内活性氧,从而防止细胞膜质过氧化。通常盐碱胁迫会影响抗氧化酶类的活性,并且酶活性与植物的抗氧化胁迫能力成正相关。在沙枣苗木叶和根系组织中抗氧化酶活性(SOD,CAT和POD)随着盐碱胁迫程度的增加而增加。He等(2007)对菌根化植株与非菌根化植物根部进行比较发现,植物SOD,CAT和POD的一般刺激来源于AM真菌。菌根植物与非菌根植物相比具有较高的抗氧化酶活性,较低的脂质过氧化积累,表明较低的氧化损伤与AM真菌侵染有关。丙二醛含量随盐碱胁迫程度的增加而增加,说明沙枣根系和叶片中较高的SOD,CAT和POD活性并没能完全清除活性氧,而引起了膜脂过氧化作用,使其丙二醛含量增加。不同抗氧化酶协同作用,更好维持细胞膜的完整性和稳定性(Latefa et al.,2011),抵御盐分胁迫。大多数研究认为,真菌加强了宿主植物根系有些抗氧化酶的活性,但宿主植物种类不同结果也不尽相同。Latefa等(2011)研究表明,随盐胁迫程度增加植物体内SOD,CAT活性会表现出下降趋势。郭绍霞等(2011)研究盐胁迫下接种AM真菌对杜梨(Pyrus betulifolia)幼苗抗氧化酶活性的影响,发现SOD,CAT和POD活性的变化呈现先升高后下降的趋势。上述研究与本试验研究结果存在差异,可能是测定过氧化酶类的时期不同或者AM真菌与不同植物共生产生的差异,其具体原因有待进一步研究。
3.3 盐碱胁迫下菌根植物对阳离子吸收的调节植物耐盐性的实质是钠离子和其他离子的代谢关系,各离子之间存在竞争性吸收,比如Na+和K+之间的选择性竞争。两者之间吸收平衡被破坏,会影响植株体内正常生理代谢。菌根化沙枣苗木各组织中Na+含量较非菌根化植株低,能减缓离子对植株的伤害。在盐胁迫条件下,植物与菌根真菌的互惠关系可以改善植物体内的离子平衡。AM真菌与植株共生降低了组织中Na+含量,可能将这些离子转移到根细胞液泡中,调节根系渗透压(AI-karaki,2006)。K+在水平衡调节、促进及激活细胞内酶的活性、气孔保卫细胞中引起气孔运动等方面起着重要作用,是Na+无法取代的。植物组织对Na+和K+进行选择性吸收,两者之间存在竞争。本研究中沙枣苗木在盐碱处理下显示,随盐碱胁迫程度增大,Na+不断累积会导致K+吸收受阻。接种AM真菌后较未接菌植株植物组织中K+含量显著提高,缓解了Na+对植物的毒害作用,调节了K+/Na+比值,即降低Na+累积增大K+吸收,维持了K+/Na+吸收平衡,从而可以减轻质膜和酶损伤程度,从而减轻离子植物生理毒害。渗透调节机制和活性氧清除机制共同来抵御盐分胁迫,以离子平衡和渗透物质调节为主,其不仅能调节细胞内的渗透势,还可保护细胞内许多重要代谢活动所需要的酶类活性。
4 结论AM真菌能够从植物的光合作用、抗氧化系统、渗透调节物质等方面改善植物组织渗透平衡和离子毒害,从而缓解盐碱胁迫对植物的伤害,有利于植物在盐碱地的生长。接种根内球囊霉在促进沙枣苗木生长及提高抗盐碱胁迫能力的各项生理指标方面,均显著高于接种摩西球囊霉处理的沙枣苗木,表明根内球囊霉在盐碱地改良方面具有很好的推广应用前景。
| [1] | ChenJ Y, WangX F. 2002. Experimental Instructions of Plant Physiology. Guangzhou: South China University of Technology Press . |
| [2] |
陈志强, 李庆贱, 时瑞亭, 等. 2010. 不同树种种质耐苏打盐碱土的苗木试验. 防护林科技 , 97 (4) : 23–26.
( Chen Z Q, Li Q J, Shi R T, et al.2010. Seedling trial of different plant germplasm resist to soda-saline-alkali soil. Protection Forest Science and Technology , 97 (4) : 23–26. [in Chinese] ) (  0) 0)
|
| [3] |
盖京苹, 冯固, 李晓林. 2004. 我国北方农田土壤中AM真菌的多样性. 生物多样性 , 12 (4) : 435–440.
( Gai J P, Feng G, Li X L.2004. Diversity of arbuscular mycorrhizal fungi in field soils from North China. Biodiversity Science , 12 (4) : 435–440. [in Chinese] ) (  0) 0)
|
| [4] |
郭绍霞, 陈丹明, 刘润进. 2010. 盐水胁迫下接种AM真菌对牡丹幼苗抗氧化酶活性的影响. 园艺学报 , 37 (11) : 1796–1802.
( Guo S X, Chen D M, Liu R J.2010. Effects of arbuscular mycorrhizal fungi on antioxidant enzyme activity in peony seedlings under salt stress. Acta Horticulturae Sinica , 37 (11) : 1796–1802. [in Chinese] ) (  0) 0)
|
| [5] | LiH S, SunQ, ZhaoS J. 2000. Principles and techniques of plant physiology and biochemistry experiment. Beijing: High Education Press . |
| [6] |
李培夫. 1999. 盐碱地的生物改良与抗盐植物的开发利用. 垦殖与稻作 (3) : 38–40.
( 0) 0)
|
| [7] |
齐曼·尤努斯, 李秀霞, 李阳, 等. 2005. 盐胁迫对大果沙枣膜脂过氧化和保护酶活性的影响. 干旱区研究 , 22 (4) : 503–506.
( Qiman Y, Li X X, Li Y, et al.2005. Effects of salt stress on membrane lipid peroxidation and protective enzymes in leaves of Elaeagnus angustifolia L. Arid Zone Research , 22 (4) : 503–506. [in Chinese] ) (  0) 0)
|
| [8] |
萨如拉, 刘景辉, 刘伟, 等. 2014. 碱性盐胁迫对燕麦矿质离子吸收与分配的影响. 麦类作物学报 , 34 (2) : 261–266.
( Sa R L, Liu J H, Liu W, et al.2014. Effects of alkali salt stress on mineral ion absorption and distribution of oats. Journal of Triticeae Crops , 34 (2) : 261–266. [in Chinese] ) (  0) 0)
|
| [9] |
申连英, 毛永民, 鹿金颖, 等. 2004. 丛枝菌根对酸枣实生苗耐盐性的影响. 土壤学报 , 41 (3) : 426–433.
( Shen L Y, Mao Y M, Lu J Y, et al.2004. Effects of arbuscular mycorrhizae on salt tolerance of wild jujube (Zizyphus spinosusu Hu. ) seedlings. Acta Pedologica Sinica , 41 (3) : 426–433. [in Chinese] ) (  0) 0)
|
| [10] | 王学奎. 2006. 植物生理生化实验原理和技术. 北京: 高等教育出版社 . |
| [11] |
杨升, 刘涛, 张华新, 等. 2014. 盐胁迫下沙枣幼苗的生长表现和生理特性. 福建林学院报 , 34 (1) : 64–70.
( Yang S, Liu T, Zhang H X, et al.2014. Growth and physiological characteristics of Elaeagnus angustifolis L. under salt stress. Journal of Fujian College of Forestry , 34 (1) : 64–70. [in Chinese] ) (  0) 0)
|
| [12] |
Al-Karaki G N, Rusan R H M.2001. Response of two tomato cultivars differing in salt tolerance to inoculation with mycorrhizal fungi under salt stress. Mycorrhiza , 11 (1) : 43–47.
( 0) 0)
|
| [13] |
Al-Karaki G N.2006. Nursery inoculation of tomato with arbuscular mycorrhizal fungi and subsequent performance under irrigation with saline water. Scientia Horticulturae , 109 (1) : 1–7.
( 0) 0)
|
| [14] |
Feng G, Zhang F, Li X, et al.2002. Improved tolerance of maize plants to salt stress by arbuscular mycorrhiza is related to higher accumulation of soluble sugars in roots. Mycorrhiza , 12 (4) : 185–190.
( 0) 0)
|
| [15] |
Hajiboland R, Aliasgharzadeh N, Laiegh S F, et al.2010. Colonization with arbuscular mycorrhizal fungi improves salinity tolerance of tomato (Solanum lycopersicum L. ) plants. Plant and Soil , 331 (1/2) : 313–327.
( 0) 0)
|
| [16] |
He Z Q, He C X, Zhang Z B, et al.2007. Changes of antioxidative enzymes and cell membrane osmosis in tomato colonized by arbuscular mycorrhizae under NaCl stress. Colloids and Surfaces B:Biointerfaces , 59 (2) : 128–133.
( 0) 0)
|
| [17] |
Hirrel M C.1981. The effect of sodim and chloride salts on the germination of Gigaspora margarita. Mycologia , 73 (4) : 610–617.
( 0) 0)
|
| [18] |
Latef A A H A, Chaoxing H.2011. Effect of arbuscular mycorrhizal fungi on growth,mineral nutrition,antioxidant enzymes activity and fruit yield of tomato grown under salinity stress. Scientia Horticulturae , 127 (3) : 228–233.
( 0) 0)
|
| [19] |
McMillen B G, Juniper S, Abbott L K.1998. Inhibition of hyphal growth of a vesicular-arbuscular mycorrhizal fungus in soil containing sodiumchloride limits the spread of infection from spores. Soil Biology and Biochemistry , 30 (13) : 1639–1646.
( 0) 0)
|
| [20] |
Pfei ffer C M, Bloss H E.1988. Growth and nutrition of guayule (Parthenium argentatum) in a saline soil as influenced by vesicular arbuscular mycorrhiza and phosphorus fertilization. New Phytologist , 108 (3) : 315–321.
( 0) 0)
|
| [21] |
Phillips J M, Hayman D S.1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid, assessment of infection. Transation British Mycological Society , 55 (1) : 158–161.
( 0) 0)
|
| [22] |
Poss J A, Pond E, Menge J A, et al.1985. Effeet of salinity on mycorrhizal onion and tomato in soil with and without additional phosphate. Plant and Soil , 88 (3) : 307–319.
( 0) 0)
|
| [23] |
Rabie G H.2005. Influence of arbuscular mycorrhizal fungi and kinetin on the response of mungbean plants to irrigation with seawater. Mycorrhiza , 15 (3) : 225–230.
( 0) 0)
|
| [24] |
Sheng M, Tang M, Chen H, et al.2009. Influence of arbuscular mycorrhizae on the root system of maize plants under salt stress. Canadian Journal of Microbiology , 55 (7) : 879–886.
( 0) 0)
|
| [25] |
Sheng M, Tang M, Chen H, et al.2008. Influence of arbuscular mycorrhizae on photosynthesis and water status of maize plants under salt stress. Mycorrhiza , 18 (6/7) : 287–296.
( 0) 0)
|
| [26] |
Talaat N B, Shawky B T.2014. Protective effects of arbuscular mycorrhizal fungi on wheat (Triticum aestivum L. ) plants exposed to salinity. Environmental and Experimental Botany , 98 (1) : 20–31.
( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52

