文章信息
- 石江涛, 李坚
- Shi Jiangtao, Li Jian
- 东北常见树种木材形成早期组织波谱特征差异分析
- Comparative Analysis of Spectroscopy Features of Early-Stage Wood Forming Tissue in Common Tree Species in Northeast, China
- 林业科学, 2016, 52(6): 115-121
- Scientia Silvae Sinicae, 2016, 52(6): 115-121.
- DOI: 10.11707/j.1001-7488.20160614
-
文章历史
- 收稿日期:2015-01-12
- 修回日期:2016-02-28
-
作者相关文章
2. 东北林业大学生物质材料科学与技术教育部重点实验室 哈尔滨 150040
2. Key Laboratory of Bio-Based Material Science and Technology of Ministry of Education, Northeast Forestry University Harbin 150040
木材源于树木的高生长和直径生长。高生长是根和茎主轴生长点的分生活动,即顶端分生组织或原分生组织分生活动的结果;而直径生长则是形成层(即侧生分生组织)细胞分生的结果。直径生长经历了年复一年的细胞分裂、成熟与物质沉积等生命过程,其不仅是简单意义的生物量累积,还包含遗传信息表达、物质代谢与转化、生物信号传导与调控等生命程序,即木材形成中细胞的形态、结构、化学物质以及生理生态等均是动态变化的,既受遗传因素控制,也会智能响应生长环境(温度、湿度、日照、营养、水分等)的变化,也就是说,木材形成是“生命物质”转变为“非生命物质”的过程。所以,选取分化中的木材细胞进行解剖构造、化学成分、生理生化以及生物学研究具有重要意义。
鉴于活立木生长过程中较难准确定位木材细胞的发育阶段,因此通常将木质部初始细胞的产生至其发育成为成熟木质部细胞整个过程的细胞集合作为发育中的木材细胞,即木材形成组织。木材形成组织具有环境和发育过程的时空特异性,包括瞬时的细胞大小、形状、细胞壁结构以及化学组成,是揭示木材细胞壁构建的有效试验材料。一般采用解剖显微观察方法研究木材形成组织的构造特征,总结细胞生物学规律,采集包含韧皮部、形成层及木质部组织的样品,连续切片观察细胞发育过程,寻找木质素、纤维素的沉积与排列规律(殷亚方等,2004a; 2004b)。尹增芳等(2006) 观察美洲黑杨(Populus deltoides)枝条维管形成层细胞超微结构的季节动态变化,发现不同活动周期木材细胞内细胞器的种类和数量差异明显,认为其与细胞壁物质的形成有关;随后又明确了导管细胞壁构建时期与步骤及主要物质之间的关系(尹增芳等,2008)。近年来,木材形成相关基因组、转录组、蛋白质及代谢组的研究也多以该组织为对象(Plomion,2001; 王桂凤等,2007; Mellerowicz et al.,2008; 石江涛等,2011; Shi et al.,2012; 蒋淑磊等,2013)。
作为木材的主要组分,纤维素、半纤维素及木质素的特征在木材形成中是动态的、变化的,并与木材利用中的性质密切相关。本文选取东北10种主要商品材树种,采集木材形成早期组织,测定其傅里叶变换红外光谱和X射线衍射光谱,分析光谱特征,总结化学成分与纤维素结晶度的变化规律,旨在为揭示树木生长过程中木材细胞壁的自组装行为和木材形成的分子机制提供科学依据。
1 材料与方法 1.1 样品制备健康林木选自东北林业大学校内实验林场,样木信息见表 1,各树种3株。木材形成早期组织采集于6月树木生长较旺盛时期,采集方法参照Paiva等(2008a),依次去除树皮、内皮,露出新鲜木材,在刚分化形成的木质部区域收集木材形成组织,液氮处理后带回实验室低温保存。取适量冷冻组织,液氮条件下充分研磨,将每树种3株独立样品取等量均匀混合,作为待检测样品。
|
|
采用美国尼高力(Nicolet)公司的Magna-IR 560 E.S.P型傅里叶变换红外光谱仪测定FTIR光谱,溴化钾压片法。扫描范围4 000~400 cm-1,分辨率4 cm-1,扫描次数40次。吸收峰强度用各吸收带占最强吸收峰吸光度的百分比Ax%表示:
| ${A_x}\% = \frac{{{A_x}}}{{{A_{{\rm{am}}}}}} \times 100\% $ | (1) |
式中:Ax%为吸光度百分比;Ax为吸收峰吸光度;Aam为最强吸收峰吸光度。
XRD在日本Rigaku-XRD D/MAX 2200型X光衍射仪上进行,X光管为铜靶,用镍片消除Cu-Kα辐射(λ=1.541 78),管电压40 kV,管电流30 mA,采用2θ/θ联动扫描,扫描范围3°~40°(2θ),取样间隔0.02°,狭缝装置DS=1°,SS=1°,RS=0.3 mm。每个样品重复测量2次,取平均值。采用Turley法定点取值计算纤维素相对结晶度。在6°和32°附近画一直线,与衍射强度曲线最低2点相切,以除去背景。
通过式(2) 计算纤维素相对结晶度:
| ${{C}_{r}}\text{I=}\frac{{{I}_{002}}-{{I}_{_{am}}}}{{{I}_{002}}}\times 100%。$ | (2) |
式中:CrI为纤维素相对结晶度;I002为扫描曲线2θ=22°处衍射峰强度;Iam为2θ=18°处衍射峰强度。
采用Excel 2007和Origin 8.0软件进行数据统计并作图。
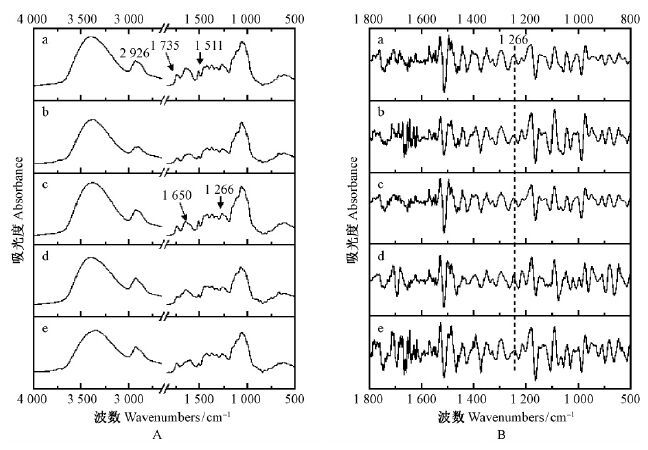
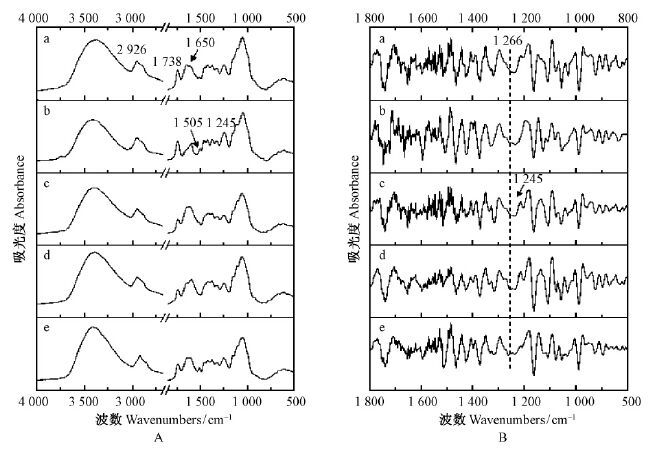
2 结果与分析 2.1 木材形成组织的红外光谱分析10种树种木材形成早期组织的FTIR光谱如图 1A和图 2A所示。红外吸收峰归属解析参考相关文献,各吸收峰强度用该峰占最强吸收峰的百分吸光度表示(李坚等,2003)。在谱图高波数区域,由羟基—OH伸缩振动引起的较强吸收峰(Pandey,1999; 李坚等,2003; 秦特夫等,2004),峰形宽,针叶树种木材波峰位置除樟子松(3 344 cm-1)外,其他4种均在3 385 cm-1附近;阔叶树种木材此峰位置分散,水曲柳吸收峰位置最高,为3 414 cm-1,胡桃楸吸收峰位置最低,为3 354 cm-1,白桦、春榆和小叶杨吸收峰介于二者之间。波数2 926 cm-1附近的吸收峰是由甲基或亚甲基伸缩振动引起的(Pandey,1999; 李坚等,2003; 秦特夫等,2004),该峰的强度在针叶树种木材中差异较明显,臭冷杉最低为5.4%,樟子松最高为35.9%;而阔叶树种木材中差距较针叶树种木材小,白桦最高为39.5%,小叶杨最低为26.6%。这2个吸收峰的官能团来自纤维素、半纤维素和木质素的共同贡献。在波数900~2 000 cm-1之间的指纹区域,各树种木材的吸收峰与成熟木材中有较明显差别,同时树种之间存在差异。出现在波数1 735 cm-1附近的吸收峰归属为木聚糖乙酰基CO 伸缩振动引起,其强度常表征半纤维素的相对含量(Pandey et al.,2003; 李坚等,2003; 王小青等,2009)。比较得知,针叶树种木材中此峰的位置低于阔叶树种木材,并且阔叶树种木材的分布更集中,表明针叶树种木材木质素与纤维素的相对含量之比大于阔叶树种木材(Owen et al.,1989),且变化幅度较大,与胡爱华等(2009) 研究的30种针、阔叶树种木材FTIR结论一致。此外,阔叶树种木材该峰的相对强度显著小于针叶树种木材,樟子松最高为17.6%,红松最低仅为6.9%,白桦最高达45.4%,水曲柳最低为21%,表明阔叶树种木材中半纤维素相对含量较高。针、阔叶树种木材在1 630 ~1 660 cm-1之间均出现不同强度的吸收峰,峰形较宽,Paiva等(2008a; 2008b)研究确认该峰归属为蛋白质肽段中氨基化合物振动引起,表明木材形成组织处于细胞发育时期,富含氨基酸、含氮化合物等生物活性物质。因此,当前利用分子生物学方法探索木材形成过程及调控机制的研究多以该组织为对象。针叶树种木材1 511 cm-1附近出现的中吸收峰归属为木质素苯环碳骨架振动,而阔叶树种木材中该峰常出现在1 505 cm-1附近(Pandey,1999; Pandey et al.,2003; 2004; 李坚等,2003; 秦特夫等,2004; 池玉杰,2005)。白桦的吸收强度最高为13.7%,胡桃楸为4.5%,小叶杨未检测到;但是鱼鳞云杉、落叶松和红松峰形明显,吸收强度分别为19.5%,16.8%和7.9%。另外,小叶杨和白桦均在1 596 cm-1处有吸收峰,也归属为木质素苯环的碳骨架振动(李坚等,2003; 秦特夫等,2004),强度分别为18%和17%。这首先说明树种之间差别明显,其次木材形成组织没有完全木质化,木质素沉积程度不高,所以针、阔叶树种木材之间木质素和半纤维素的沉积过程有差别。针叶树种木材1 266 cm-1出现的吸收峰归属为木质素愈创木基环加CO伸缩振动(Pandey,1999; Pandey et al.,2003; 秦特夫等,2004),该峰百分吸光度鱼鳞云杉最高为17%,臭冷杉最低为9.1%。红外谱图二阶导数处理后,显示有明显吸收峰(图 1B)。阔叶树种木材1 245 cm-1附近出现的吸收峰由木质素紫丁香基环振动引起(Pandey et al.,2003),白桦的百分吸光度最高为42.1%,春榆和小叶杨最低,同为17.8%,这主要与木质素在针叶和阔叶树种木材中基本组成单元差别有关。针叶树种木材中主要是愈创木基木质素,而阔叶树种木材中含有较多的紫丁香基木质素。虽然阔叶树种木材中也有一定量的愈创木基木质素,但红外谱图并未在相应位置出现吸收峰,二阶导数图(图 2B)也验证了这一点,表明阔叶树种木材木质素沉积早期紫丁香基更多。
|
图 1 针叶树种木材形成组织的FTIR波谱(A)和二阶导数波谱(B) Fig.1 FTIR spectrum(A)and second derivative(B)of wood forming tissue in softwood species a: 鱼鳞云杉P. jezoensis;b: 臭冷杉A. nephrolepis;c: 落叶松L. gmelinii;d: 红松P. koraiensis;e: 樟子松P. sylvestris var. mongolica. |
|
图 2 阔叶树种木材形成组织的FTIR波谱(A)和二阶导数波谱(B) Fig.2 FTIR spectrum(A)and second derivative(B)of wood forming tissue in hardwood species a: 胡桃楸J.mandshurica;b: 白桦B. platyphylla;c: 春榆U. japonica;d: 小叶杨P. simonii;e: 水曲柳F. mandshurica. |
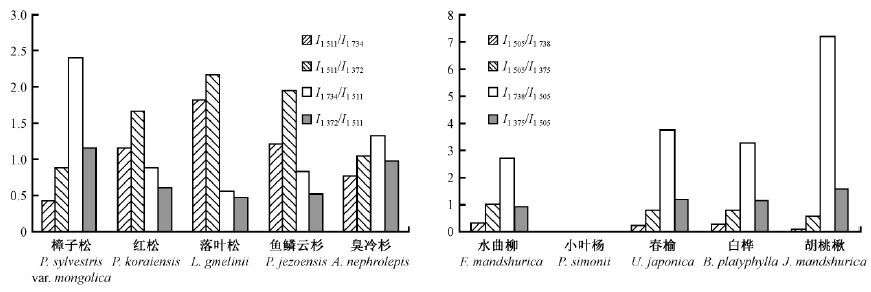
通过计算木质素特征峰与碳水化合物特征峰相对强度之间的比值,可间接表征待测样品中的木质素或综纤维素含量,其相关性可达95%以上(李改云等,2010; 林剑等,2010)。本文分别计算针、阔叶各树种木材形成早期组织中木质素及碳水化合物对应典型特征吸收峰相对强度比值,结果如图 3所示。由于各树种木种特征峰波数位置有较小差别,在计算中选择实际峰值,图示中用统一波数表示。针叶树种木材中I1 511/I1 734和I1 511/I1 372与阔叶树种木材中I1 505 /I1 738和I1 505/I1 375表征木质素与碳水化合物特征吸收峰的强度比值,比较得知针叶树种木材中这2个比值均大于阔叶树种木材,说明针叶树种木材中木材形成早期组织木质素相对含量高于阔叶树种木材。前人研究结果表明,这2个特征吸收峰的相对强度可以分别代表木质素与碳水化合物的含量(Pandey et al.,2003; 李改云等,2010)。与之对应,阔叶树种木材中I1 735/I1 505和I1 375/I1 505大于针叶树种木材中对应特征峰比值,说明阔叶树种木材中木材形成早期组织碳水化合物的相对含量高于针叶树种木材。
|
图 3 各树种木材形成组织红外特征峰相对强度比 Fig.3 The relative intensity ratio of characteristic peaks in wood forming tissue of tree species |
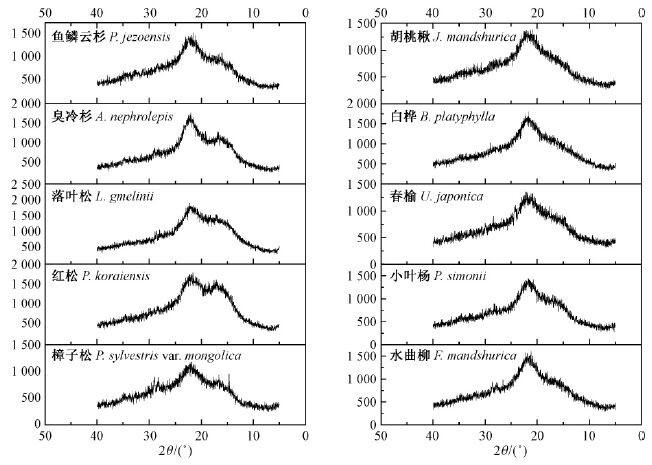
图 4为10种树种木材形成早期组织的X射线衍射光谱。由图可知,除臭冷杉外,其余树种的谱图形状与成熟木材有明显差异。所有谱图I002有较强的衍射峰,但Iam的衍射峰并不明显,尤其是阔叶树种木材。这表明木材形成早期组织中纤维素的晶型、晶胞或晶区大小与成熟木材不同,针叶树种木材的结晶程度要高于阔叶树种木材,树种之间存在差异。同时,在FTIR光谱中显示针叶树种木材有相对高的木质素沉积,而阔叶树种木材中沉积有较多的碳水化合物,这表明木材形成中木质素的沉积可能会影响纤维素微纤丝的排列。另外,阔叶树种木材中较多的碳水化合物可能多以无定形态存在。计算纤维素结晶度发现,针叶树种木材中红松和落叶松的纤维素结晶度分别为23.15%和25.54%,显著低于其成熟木材;而樟子松、臭冷杉和鱼鳞云杉的纤维素结晶度均超过40%,与成熟木材接近。阔叶树种木材纤维素结晶度均低于成熟木材,其中水曲柳和白桦的纤维素结晶度较高,接近40%,其他3种为35%左右。总体来说,针叶树种木材形成组织中纤维素结晶度大于阔叶树种木材,并且树种之间差异明显。在棉花的生长过程中,纤维素结晶度不断提高,随生长期延长,纤维素结晶度增加,微晶大小增加(李坚等,2003)。竹笋发育成竹子的过程中,纤维素、木质素和多戊糖的含量随竹子的成熟、细胞壁的加厚而不断增加,其中纤维素增长最快,木质素增加最慢(徐有明等,2008)。这些都说明细胞壁组分在植物生长过程中是动态变化的,这其中不仅是物质含量的变化,也有纤维素、半纤维素及木质素等结构的变化。
|
图 4 各树种木材形成组织的X射线衍射图谱 Fig.4 X-ray diffraction spectrum in wood forming tissue of all tree species |
本文从木材生物形成的视角出发,采用红外光谱和X射线衍射技术分析木材形成早期组织的化学特征。东北10种主要商品材树种之间,木材形成早期组织的红外光谱在波数900~2 000 cm-1区域有较明显差别。针叶树种木材中木聚糖乙酰基CO 伸缩振动引起的波数1 735 cm-1的吸收峰相对强度显著小于阔叶树种木材。波数1 630~1 660 cm-1的宽吸收峰归属为蛋白质或多肽氨基化合物的振动。针叶树种木材中归属为木质素苯环骨架振动吸收峰(1 511 cm-1)强度有显著差异,尤其是落叶松和鱼鳞云杉;阔叶树种木材中1 505 cm-1处吸收峰强度差异并不明显,但小叶杨和白桦在1 596 cm-1处有吸收峰。胡爱华等(2009) 发现针叶树种成熟木材1 505~1 510 cm-1之间吸收强度树种间差异最明显。针叶树种木材在波数1 266 cm-1处有明显吸收峰,该峰归属为愈创木基环加CO伸缩振动,阔叶树种木材中并未发现,但阔叶树种木材在1 245 cm-1处有明显吸收峰,由木质素紫丁香基环振动引起。说明在木质素沉积早期,针叶树种木材以愈创木基木质素为主,而阔叶树种木材以紫丁香基木质素为主。木材形成早期组织的X射线衍射峰相对强度比成熟木材减弱,结晶度也低于成熟木材,这与前期朱莉等(2011) 研究结论一致。针叶树种木材的纤维素结晶度高于阔叶树种木材,树种之间差异明显。除臭冷杉外,其余树种X射线衍射谱图I002有较强的衍射峰,但Iam的衍射峰并不明显,尤其是阔叶树种木材。因此认为木材形成组织中纤维素的晶型、晶胞或晶区大小与成熟木材不同。
木材形成过程是细胞结构与化学成分不断变化的生理活动过程,其细胞的增大伸长、纤维素在不同壁层上的沉积、木质素的合成与积累等均受到严格的细胞和分子水平调控。次生木质部细胞分化过程中细胞壁不同区域木质素前体的种类、分布以及木质化启动因子存在差异,木质素的沉积与细胞壁上其他物质如纤维素微纤丝、蛋白质等的沉积过程密切相关(Zhang et al.,2014)。这些为揭示树木生长过程中木材细胞壁的构筑机制奠定了重要的理论基础。总之,木材形成组织没有完成细胞壁木质化过程,木质素的沉积并不完全,细胞壁构建中木质素的分布与纤维素、半纤维素的分布相互影响,而且在针、阔叶树种之间存在差别。以后可结合分子、细胞和组织水平,借助更先进的无损检测技术,从细胞结构、生理生化以及基因调控等角度揭示木材细胞壁的形成机制。
| [1] |
池玉杰. 2005. 6种白腐菌腐朽后的山杨木材和木质素官能团变化的红外光谱分析. 林业科学 , 41 (2) : 136–140.
( Chi Y J.2005. FTIR analysis on function groups of david poplar wood and lignin degraded by 6 species of wood white-rot fungi. Scientia Silvae Sinicae , 41 (2) : 136–140. [in Chinese] ) (  0) 0)
|
| [2] |
胡爱华, 邢世岩, 巩其亮. 2009. 基于FTIR的针阔叶材木质素和纤维素特性. 东北林业大学学报 , 37 (9) : 79–81.
( Hu A H, Xing S Y, Gong Q L.2009. Lignin and cellulose characteristics of different woods based on FTIR. Journal of Northeast Forestry University , 37 (9) : 79–81. [in Chinese] ) (  0) 0)
|
| [3] |
蒋淑磊, 陈加飞, 卢孟柱, 等. 2013. 应用nanolLC-MS/MS分析毛白杨次生维管系统的蛋白质表达谱. 林业科学 , 49 (5) : 44–52.
( Jiang S L, Chen J F, Lu M Z, et al.2013. Proteome profile in secondary vascular system of Populus tomentosa by nanoLC-MS/MS. Scientia Silvae Sinicae , 49 (5) : 44–52. [in Chinese] ) (  0) 0)
|
| [4] |
李改云, 黄安民, 秦特夫, 等. 2010. 马尾松木材褐腐降解的红外光谱研究. 光谱学与光谱分析 , 30 (8) : 2133–2136.
( Li G Y, Huang A M, Qin T F, et al.2010. FTIR studies of masson pine wood decayed by brown-rot fungi. Spectroscopy and Spectral Analysis , 30 (8) : 2133–2136. [in Chinese] ) (  0) 0)
|
| [5] |
李坚. 2003. 木材波谱学. 北京: 科学出版社 : 20 -110.
( Li J. 2003. Wood spetroscopy. Beijing: Science Press : 20 -110. [in Chinese] ) |
| [6] |
林剑, 赵广杰, 孟令萱, 等. 2010. 利用X射线衍射技术与红外光谱分析真菌侵蚀的木材. 光谱学与光谱分析 , 30 (6) : 1674–1677.
( Lin J, Zhao G J, Meng L X, et al.2010. Analysis of decayed wood by fungi with X-ray diffractometry and fourier transform infrared spetroscopy. Spectroscopy and Spectral Analysis , 30 (6) : 1674–1677. [in Chinese] ) (  0) 0)
|
| [7] |
秦特夫, 黄洛华, 周勤. 2004. 杉木幼龄材与成熟材木质素的化学官能团和化学键特征研究. 林业科学 , 40 (2) : 137–141.
( Qin T F, Huang L H, Zhou Q.2004. The chemical groups and bonds characterization of juvenile wood and mature wood lignins of Chinese fir. Scientia Silvae Sinicae , 40 (2) : 137–141. [in Chinese] ) (  0) 0)
|
| [8] |
石江涛, 李坚. 2011. 红松正常木与应力木木材形成组织中极性代谢物对比分析. 北京林业大学学报 , 33 (6) : 196–200.
( Shi J T, Li J.2011. Comparative analysis of polar phase metabolite in wood forming tissue of normal wood and reaction wood in Pinus koraiensis. Journal of Beijing Forestry University , 33 (6) : 196–200. [in Chinese] ) (  0) 0)
|
| [9] |
王桂凤, 高燕, 杨立伟, 等. 2007. 杉木木材形成过程特异表达基因的鉴定与分析. 遗传 , 29 (4) : 483–489.
( Wang G F, Gao Y, Yang L W, et al.2007. Identification and analysis of differentially expressed genes during wood formation in Chinese fir by SSH. Hereditas(Beijing) , 29 (4) : 483–489. [in Chinese] ) (  0) 0)
|
| [10] |
王小青, 费本华, 任海青. 2009. 杉木光变色的FTIR光谱分析. 光谱学与光谱分析 , 29 (5) : 1272–1275.
( Wang X Q, Fei B H, Ren H Q.2009. FTIR spectroscopic studies of the photo-discoloration of Chinese fir. Spectroscopy and Spectral Analysis , 29 (5) : 1272–1275. [in Chinese] ) (  0) 0)
|
| [11] |
徐有明, 郝培应, 费本华. 2008. 竹笋形态发育构建过程中解剖结构及化学成分的动态变化. 东北林业大学学报 , 36 (4) : 8–11.
( Xu Y M, Hao P Y, Fei B H.2008. Dynamic change of anatomical structure and chemical constitutes of bamboo shoots for Phyllostachys pubescence at developmental stage. Journal of Northeast Forestry University , 36 (4) : 8–11. [in Chinese] ) (  0) 0)
|
| [12] |
殷亚方, 姜笑梅, 刘晓丽. 2004a. 毛白杨枝条木质部细胞分化动态变化及其与形成层活动的相互关系. 林业科学 , 40 (3) : 119–125.
( Yin Y F, Jiang X M, Liu X L.2004a. Dynamic changes in cambial anatomy and xylem cell differentiation of shoots in Populus tomentosa. Scientia Silvae Sinicae , 40 (3) : 119–125. [in Chinese] ) (  0) 0)
|
| [13] |
殷亚方, 姜笑梅, 瞿超. 2004b. 人工林毛白杨次生木质部细胞分化过程中木质素沉积的动态变化. 电子显微学报 , 23 (6) : 663–668.
( Yin Y F, Jiang X M, Qu C.2004b. Dynamic changes of lignin deposition in secondary xylem cell wall during secondary xylem differentiation in Populus tomentosa Carr. Journal of Chinese Electron Microscopy Society , 23 (6) : 663–668. [in Chinese] ) (  0) 0)
|
| [14] |
尹增芳, 樊汝汶, 黄金生. 2006. 美洲黑杨维管形成层活动周期性及细胞超微结构的动态变化. 南京林业大学学报:自然科学版 , 30 (6) : 1–6.
( Yin Z F, Fan R W, Huang J S.2006. Periodicity of vascular cambial activity and dynamic changes of cell ultrastructure in Populus deltoides. Journal of Nanjing Forestry University:Natural Sciences Edition , 30 (6) : 1–6. [in Chinese] ) (  0) 0)
|
| [15] |
尹增芳, 樊汝汶. 2008. 美洲黑杨次生木质部导管分化进程的超微结构分析. 浙江林学院学报 , 25 (4) : 431–436.
( Yin Z F, Fan R W.2008. Differentiation in a secondary xylem vessel element of Populus deltoides using ultrastructural analysis. Journal of Zhejiang Forestry College , 25 (4) : 431–436. [in Chinese] ) (  0) 0)
|
| [16] |
朱莉, 石江涛. 2012. 红松应力木木材形成组织的化学组成特征分析. 植物研究 , 32 (2) : 232–236.
( Zhu L, Shi J T.2012. Chemical compound characteristic analysis of wood forming tissue from reaction wood of Pinus koraiensis. Bulletin of Botanical Research , 32 (2) : 232–236. [in Chinese] ) (  0) 0)
|
| [17] |
Mellerowicz E J, Sundberg B.2008. Wood cell wall:biosynthesis, developmental dynamics and their implications for wood properties. Currunt Opinion in Plant Biology , 11 (3) : 293–300.
( 0) 0)
|
| [18] |
Owen N L, Thomas D W.1989. Infrared studies of "Hard" and "Soft" woods. Applied Spectroscopy , 43 (3) : 451–455.
( 0) 0)
|
| [19] |
Paiva J A P, Garcés M, Akves A, et al.2008a. Molecular and phenotypic profiling from the base to the crown in maritime pine wood-forming tissue. New Phytologist , 178 (2) : 283–301.
( 0) 0)
|
| [20] |
Paiva J A P, Garnier-Géré P H, Rodrigues J C, et al.2008b. Plasticity of maritime pine (Pinus pinaster) wood-forming tissues during a growing season. New Phytologist , 179 (4) : 1080–1094.
( 0) 0)
|
| [21] |
Pandey K K.1999. A study of chemical structure of soft and hardwood and wood polymers by FTIR spectroscopy. Journal of Applied Polymer Science , 71 (12) : 1969–1975.
( 0) 0)
|
| [22] |
Pandey K K, Pitman A J.2003. FTIR studies of the changes in wood chemistry following decay by brown-rot and white-rot fungi. International Biodeterioration & Biodegradation , 52 (3) : 151–160.
( 0) 0)
|
| [23] |
Pandey K K, Pitman A J.2004. Examination of the lignin content in softwood and a hardwood decayed by a brown-rot fungus with the acetyl bromide method and fourier transform infrared spectroscopy. Journal of Polymer Science, Part A:Polymer Chemistry , 42 (10) : 2340–2346.
( 0) 0)
|
| [24] |
Plomion C, Leprovost G, Stokes A.2001. Wood formation in trees. Plant Physiology , 127 (4) : 1513–1523.
( 0) 0)
|
| [25] |
Shi J, Li J.2012. Metabolites analysis of wood forming tissue. Wood Research , 57 (4) : 561–572.
( 0) 0)
|
| [26] |
Zhang J, Nieminen K, Serra J A A, et al.2014. The formation of wood and its control. Current Opinion in Plant Biology , 17 : 56–63.
( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52

