文章信息
- 王林, 代永欣, 郭晋平, 高润梅, 万贤崇
- Wang Lin, Dai Yongxin, Guo Jinping, Gao Runmei, Wan Xianchong
- 刺槐苗木干旱胁迫过程中水力学失败和碳饥饿的交互作用
- Interaction of Hydraulic Failure and Carbon Starvation on Robinia pseudoacacia Seedlings During Drought
- 林业科学, 2016, 52(6): 1-9
- Scientia Silvae Sinicae, 2016, 52(6): 1-9.
- DOI: 10.11707/j.1001-7488.20160601
-
文章历史
- 收稿日期:2015-11-05
- 修回日期:2016-04-26
-
作者相关文章
2. 中国林业科学研究院林业新技术所 北京 100091
2. Research Institute of Forestry New Technology, Chinese Academy of Forestry Beijing 100091
随着全球温度的升高和降水格局变化,干旱频发,在未来受干旱影响的地区会越来越多,树木受到干旱影响的可能性大大增加(IPCC,2007)。已有很多关于干旱对树木影响的研究,但至今对树木应对干旱的生理学机制尚未完全了解(Allen et al,2010;Ryan,2011),尤其是在干旱后恢复过程中的生理学机制了解较少。在干旱条件下水力学结构和碳平衡的维持是影响植物应对干旱能力的2个重要方面(McDowell et al,2008;Choat et al,2012)。严重干旱会造成木质部导管大量栓塞,降低水分输导能力(靳欣等,2012;Leng et al,2013),导致植物组织干燥死亡(McDowell et al,2008),但复水后树木的水力学结构是否能够完全恢复存在很大争议,有研究表明树木会迅速恢复水分输导功能和光合作用(靳欣等,2012;Martorell et al,2014),也有研究表明干旱后树木水分输导系统会受到栓塞修复、栓塞疲劳等因素限制,短期内不能恢复到原来的水平(Lu et al,2010;Leng et al.,2013),这可能是物种、干旱程度等的差异而有不同的响应。干旱条件下影响树木存活的另外一个重要因素是碳平衡(Sala et al.,2012;McDowell et al,2013)。关于干旱对树木非结构性碳(NSC,nonstructural carbohydrate)的影响也存在不同的观点,有研究认为干旱会通过限制气孔导度或破坏光合系统导致碳摄取受限,造成碳的负平衡,随着干旱时间的延长发生碳饥饿(McDowell et al,2013;Klein et al,2014;Sevanto et al,2014);也有研究表明树木可以在干旱过程中通过减少生长等自身调节策略保持碳平衡(Anderegg et al.,2012;Wiley et al.,2013),树木在干旱过程中NSC如何变化目前还存在很大争议(Martínez-Vilalta,2014)。一些树种在严重干旱条件下会通过落叶来减少水分蒸散,水分条件好转后重新长出新叶,这就是称谓“干旱恢复性策略”(Mitchell et al,2013)。但目前对干旱恢复性策略植物在干旱导致落叶后能否恢复到原来的水平以及树木干旱后叶片恢复的限制因素还不清楚。经历干旱和从干旱中恢复是树木应对干旱的重要阶段,因此研究树木干旱和复水阶段的水力学结构、NSC和恢复生长之间的关系有利于更全面了解树木应对干旱的生理学机制,同时也为干旱半干旱地区森林人工抚育管理提供理论依据。
刺槐(Robinia pseudoacacia)是我国华北和西北常用的造林树种(杨建伟等,2004;王林等,2013),对气候环境有较强的适应性,但是受季风性气候的影响这些地区每年的春夏之交会出现较严重的干旱,刺槐对干旱有一定的适应性,但受到较严重的干旱时容易表现出落叶、枝条干枯等症状,在土层浅薄、土壤持水能力低下的区域衰败现象尤为明显(王林等,2013)。笔者的初步观察发现:经历干旱导致落叶后,水分条件恢复后的刺槐叶片恢复量减少,上部枝条发生干枯,但目前对刺槐在干旱和复水阶段的水力学性状和碳代谢的变化以及在复水后叶片恢复的限制因素还不清楚。本研究以盆栽刺槐苗为研究对象,通过分析干旱导致落叶阶段和复水后的茎水分输导能力、叶片光合作用、不同部位NSC含量的变化,研究干旱胁迫对刺槐水力学结构和碳代谢的影响,并探讨在复水阶段植物水分输导能力、NSC含量对叶片恢复的影响。研究结果可以阐明刺槐干旱和复水过程中水力学结构和碳代谢的交互作用,同时为揭示干旱半干旱地区刺槐衰败死亡的生理学机制提供思路和试验证据。
1 材料与方法 1.1 试验材料及试验设计本研究在山西省太谷县山西农业大学林学院实验基地进行。于2014年3月选取大小基本一致、生长良好的3年生刺槐苗定植到直径35 cm、高35 cm的花盆中,盆土采用2/3田间表层土+1/3沙,每盆栽植1株,试验处理前保持土壤体积含水量在30%左右(预试验表明:土壤体积含水量30%相当于相对含水量80%左右)缓苗3个月,选择生长基本一致苗木,随机分为2组,每组10株。分别进行干旱和对照处理。盆栽苗放在避雨棚中,有降雨时用塑料布遮盖,其余时间避雨棚完全开放。试验开始后干旱处理组停止浇水,直到叶片完全脱落后开始复水,复水阶段保持土壤体积含水量30%左右,选择试验开始时、干旱导致90%~100%叶片脱落(干旱处理后24天)、复水后叶片完全展开时(复水后30天)测定凌晨和正午水势、枝条正午栓塞、光合作用,枝条韧皮部、枝条木质部、根韧皮部、根木质部的可溶性糖和淀粉含量,并在复水后新长出叶片完全展开时测定叶面积、单株总叶面积、枝条凌晨和正午水势,枝条正午栓塞、枝条栓塞脆弱性曲线(vulnerability curves),由于复水后除了枝条上部芽萌发以外,在茎基部也有潜伏芽萌发,上部和茎基部萌发的叶片形态上有很大的差别,因此本研究分别检测了枝条上部新生叶片和茎基部新生叶片的凌晨和正午水势、光合作用和叶片形态。处理开始时刺槐苗高为(80±7)cm,基径为(3.5±0.4)cm,对照和干旱处理植株在苗高和基径上无显著差异。
1.2 试验方法 1.2.1 土壤含水量测定采用TRME-T3 TDR便携式土壤水分测定仪(IMKO,Ettlingen,Germany),测定部位为刺槐苗主干和花盆边缘的中间部分,测定深度为8 cm,处理开始时土壤含水量为29%±2.52%,在叶片全部脱落时,土壤含水量下降到6.16%±0.76%。复水后土壤水分恢复到处理开始时的水平。
1.2.2 水势、导水损失率和栓塞脆弱性测定小枝水势用PMS1505D-EXP水势仪测定(PMS Albany USA),凌晨水势测定时间为日出 前,正午水势的测定时间为12:00—14:00。正午导水损失率(PLC)的测定采样时间为中午12:00—14:00,具体测定过程参照王林等(2015)。栓塞脆弱性采用空气注入法(air injection)用PMS 1505D-EXP水势仪的气穴室测定(PMS Albany USA),具体方法参照Wang等(2014)。
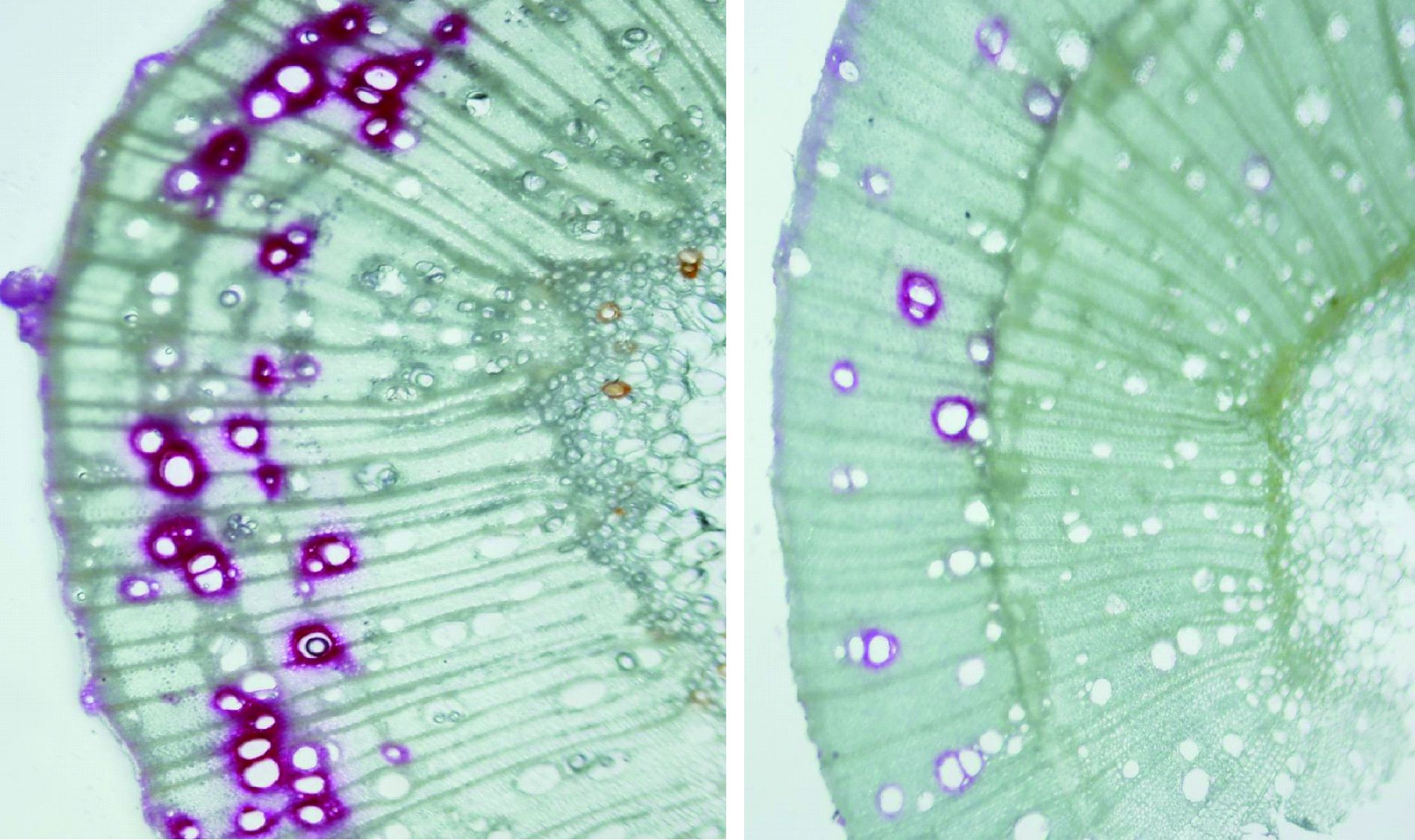
1.2.3 枝条木质部导管染色在干旱导致90%以上叶片脱落时用碱性品红染色法对对照和干旱处理枝条木质部导管进行了染色,取样时间为正午12:00—14:00。在水中剪取长度在30 cm以上枝条,在水下重新剪取长度3 cm茎段,用5 kPa的压力推动0.2%浓度的品红溶液通过茎段5 min,使正常导水的导管染色,染色后取茎段中段部分做成显微切片,在OLYMPUS BX61数码显微镜(Olympus Tokyo Japan)下拍照。
1.2.4 光合速率的测定最大光合速率和气孔导度在晴天上午09:00—11:00用Li-6400光合仪测定系统(LI-COR,Lincoln,USA)测定,设定光强为 1 500 μmol ·m-1s-1,预试验表明设定光强在刺槐光饱和点之上,使用大气CO2浓度(400 μmol ·mol),具体方法参照王林等(2015)。
1.2.5 叶片形态、茎和根非结构性碳(NSC)含量的测定叶面积和单株总叶面积用叶面积仪测定,比叶质量用叶片干质量除以叶面积计算。可溶性糖和淀粉含量测定取枝条和粗根(直径>2mm),测定方法参照Mitchell等(2013),NSC含量为可溶性糖含量与淀粉含量之和。
1.3 数据处理采用SPSS 13.0统计软件进行数据统计分析,对照和处理的均值比较采用T检验,不同时间的测定指标差异显著性检验采用One-way ANOVA分析,并用最小显著差数法(LSD)进行多重比较。利用SigmaPlot 10.0软件制图,所有测定重复5次以上。
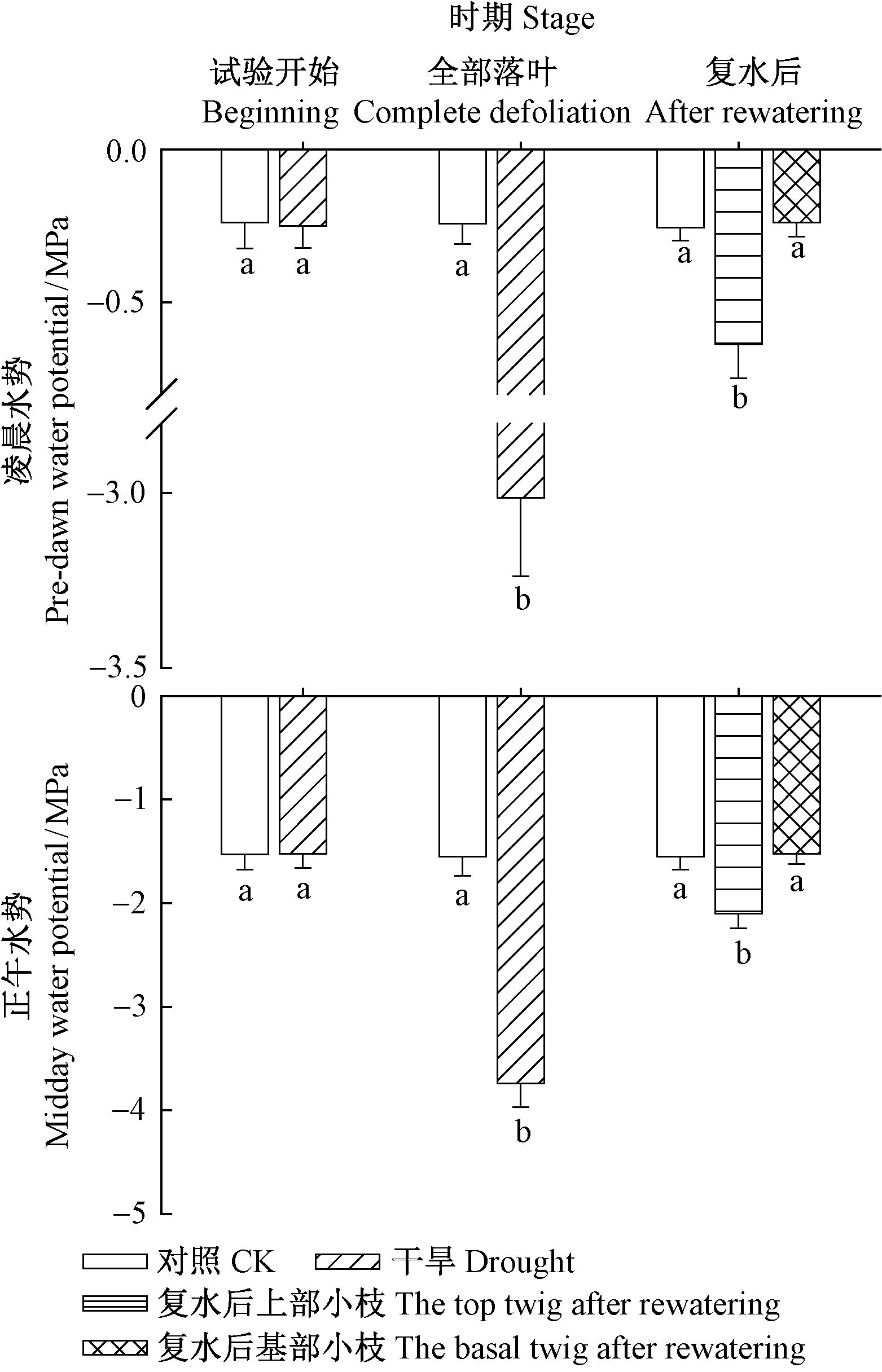
2 结果与分析 2.1 干旱和复水对刺槐凌晨和正午水势的影响在处理开始时,处理和对照凌晨水势和正午水势均无显著差异,在全部落叶时,干旱处理的凌晨水势和正午水势分别为 (-3.01±0.23)MPa和(-3.73±0.22)MPa,均显著低于对照(P<0.05)。复水后,上部小枝凌晨和正午水势显著低于基部萌发枝条(P<0.05),基部小枝水势和对照没有显著差异(P=0.34),而上部萌发枝条水势显著低于对照(P<0.05)(图 1)。
|
图 1 干旱处理不同阶段的小枝凌晨和正午水势 Fig.1 Pre-dawn and midday twig water potential at different stages during drought treatments 不同小写字母表示处理和对照之间的差异显著性(P<0.05)。 Different small letters indicate significant differences between CK and dry treatment(P<0.05). |
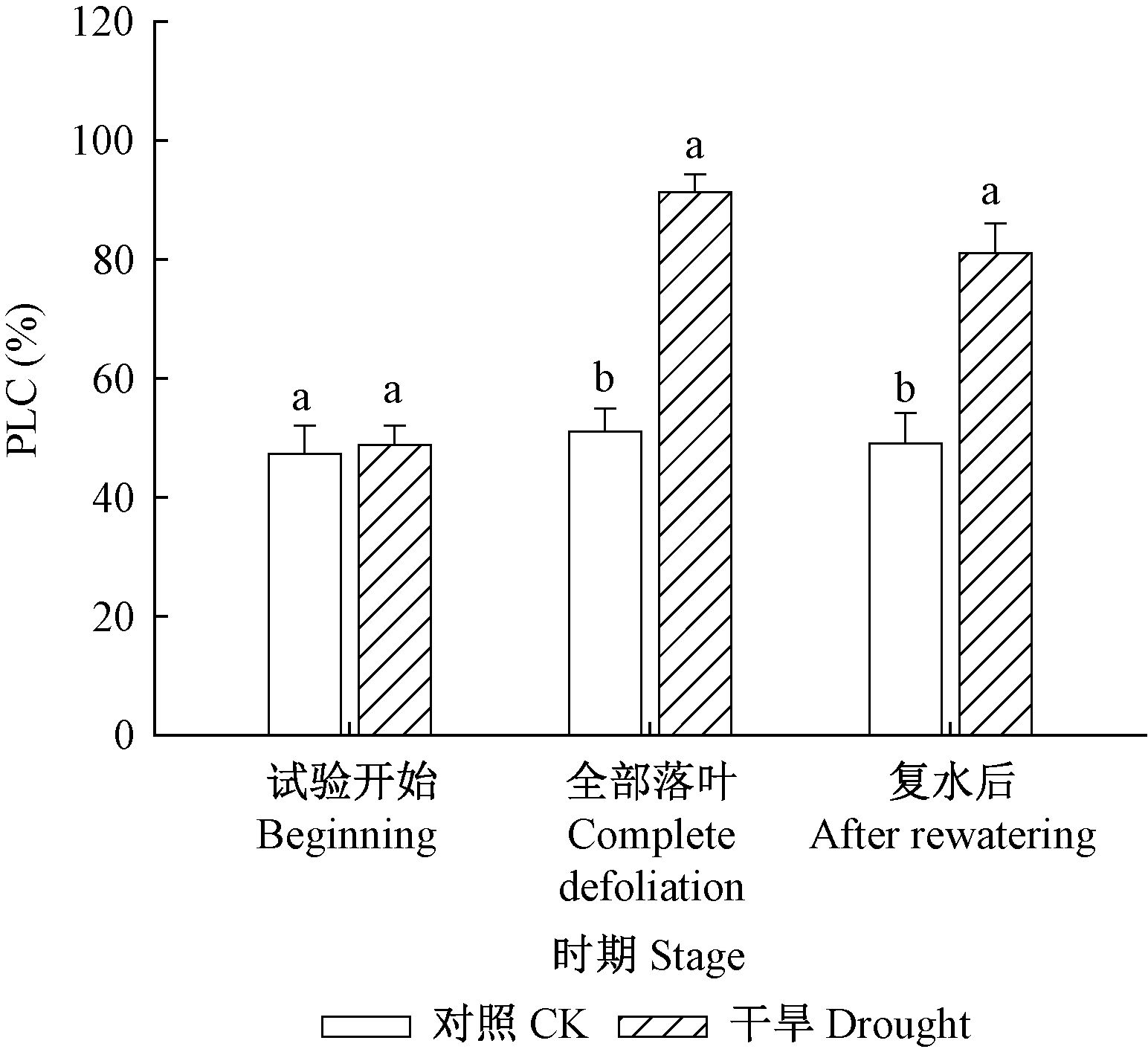
在试验开始时,干旱处理和对照的导水损失率(PLC,percentage loss of conductivity)无显著差异(图 2),在干旱导致叶片全部脱落时干旱处理枝条PLC达到91.3%±3%,显著高于对照(51%±3.9%),在显微图片上也可以看出:在严重干旱时期,对照有接近一半导管被染成红色,而干旱处理导管只有约10%被染色(图 3)。
|
图 2 干旱和复水不同阶段枝条导水损失率 Fig.2 PLC(percentage loss of conductivity)of stems at different stages during drought and re-watering treatments |
|
图 3 严重干旱时期枝条木质部导管染色 Fig.3 The dyeing of branch uglem vessel during severe drought 染成红的为正常导水导管,未染色导管为栓塞导管。 The left was control the right was drough Dying vessels were functional,and undying ones were embolismed. |
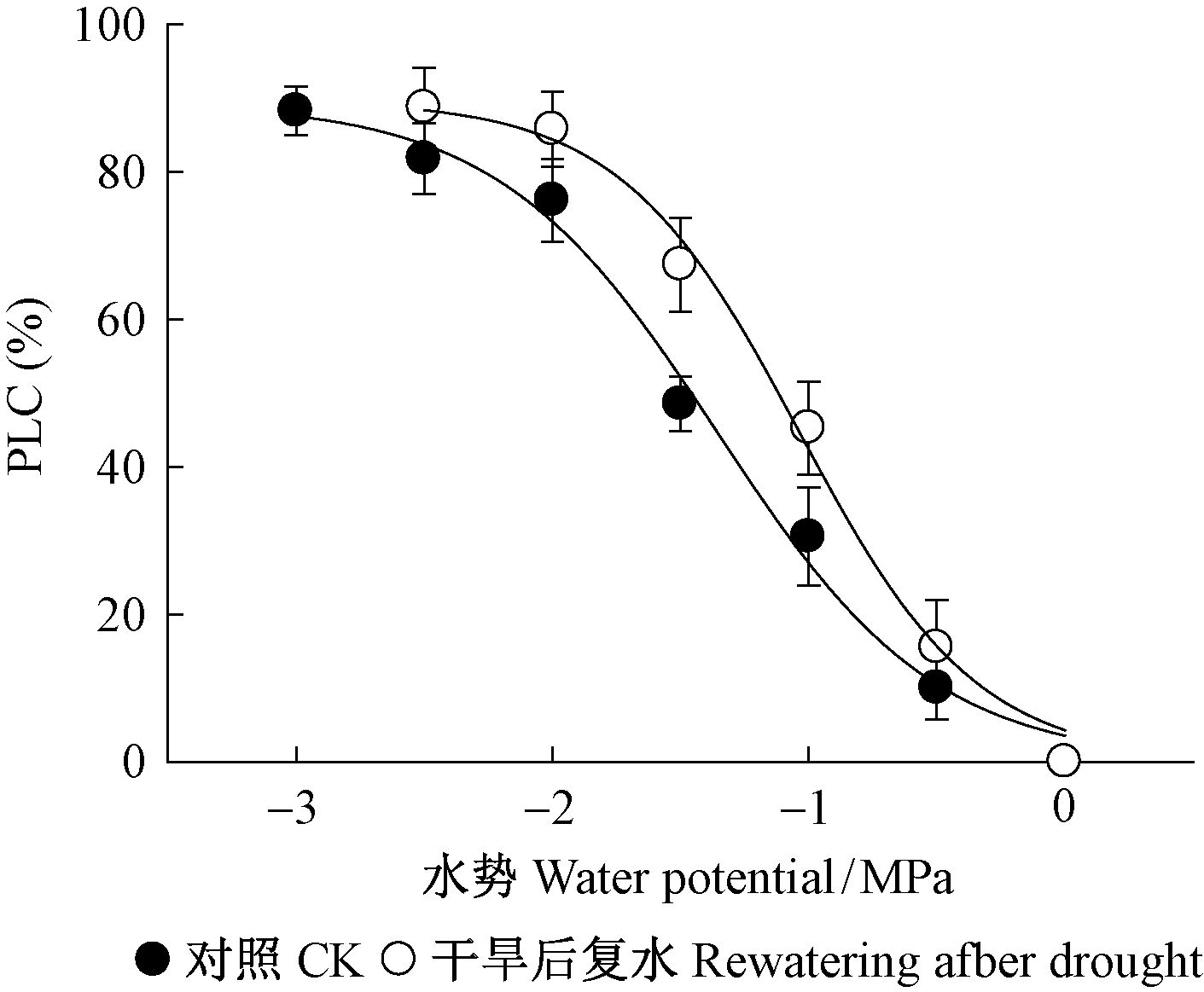
比较对照和经过干旱和复水处理枝条的栓塞脆弱性曲线(vulnerability curves),结果表明,干旱处理显著增加了茎的栓塞脆弱性,对照的P50(PLC达到50%时的水势值)为-1.46 MPa,而干旱处理的P50值为-1.09 MPa,干旱处理枝条P50值比对照增加0.37 MPa(图 4)。
|
图 4 干旱复水后刺槐的栓塞脆弱性曲线 Fig.4 Vulnerability curves of R. pseudoacacia after drought and rewatering treatments |
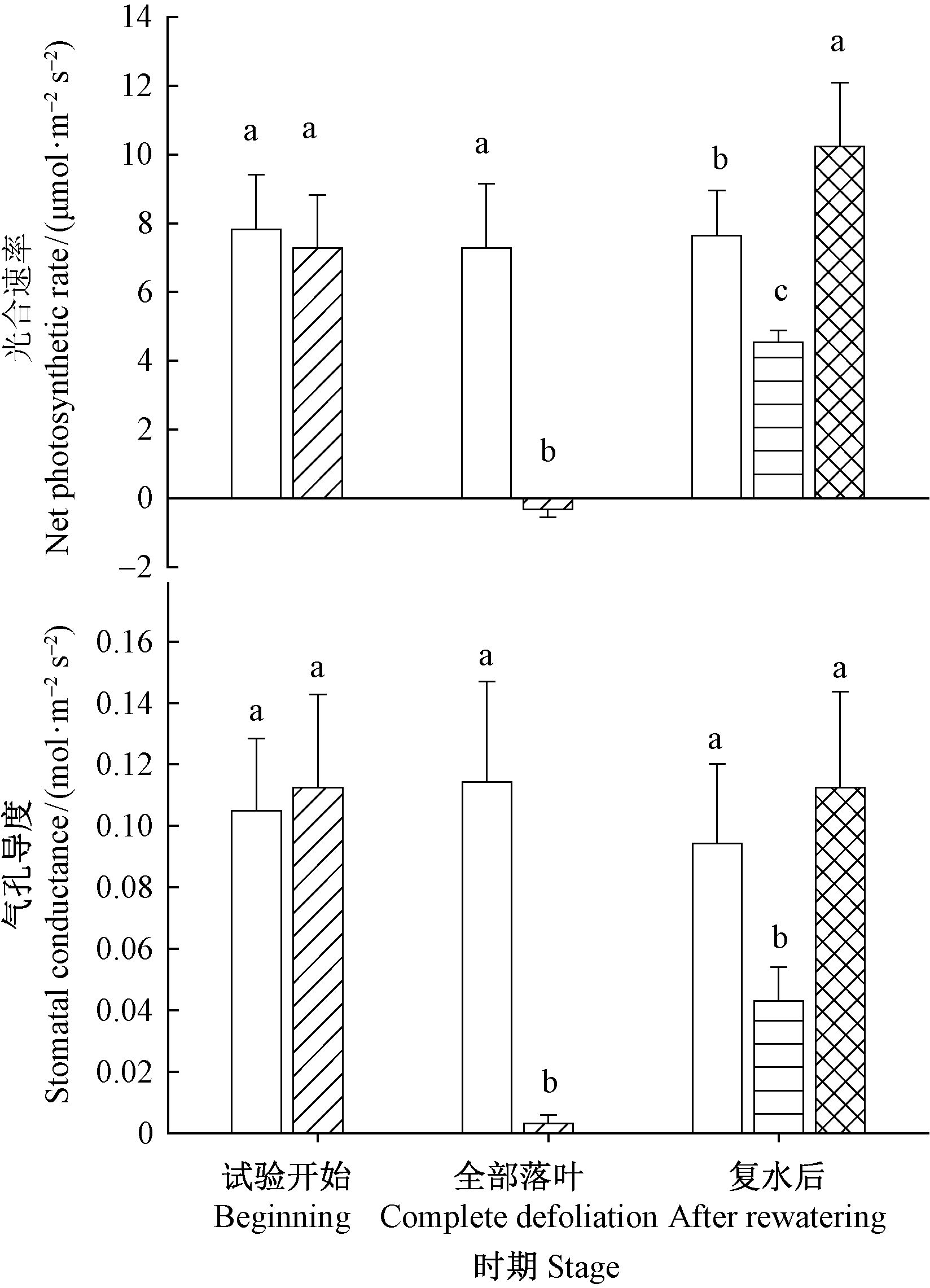
在试验开始时,干旱处理和对照的光合速率和气孔导度均无显著差异,在干旱导致90%~100%落叶时,干旱处理剩余叶片的光合速率为负,气孔导度接近于0(为0.003 26 mol ·m-2s-1),在复水后叶片完全展开时,基部萌发叶片光合速率和气孔导度均显著高于上部叶片(P<0.05),上部叶片的光合速率仅相当于基部叶片的44%,气孔导度仅相当于基部叶片的38%。植株上部叶片光合速率和气孔导度均显著低于对照(P<0.05),而基部萌发叶片的光合速率显著高于对照(P<0.05),基部萌发叶片的气孔导度也略高于对照,但两者之间没有显著差异(P=0.28)(图 5)。
|
图 5 干旱处理不同阶段的光合速率和气孔导度 Fig.5 Net photosynthetic rate,stomatal conductance of R. pseudoacacia at different stages during drought treatments |
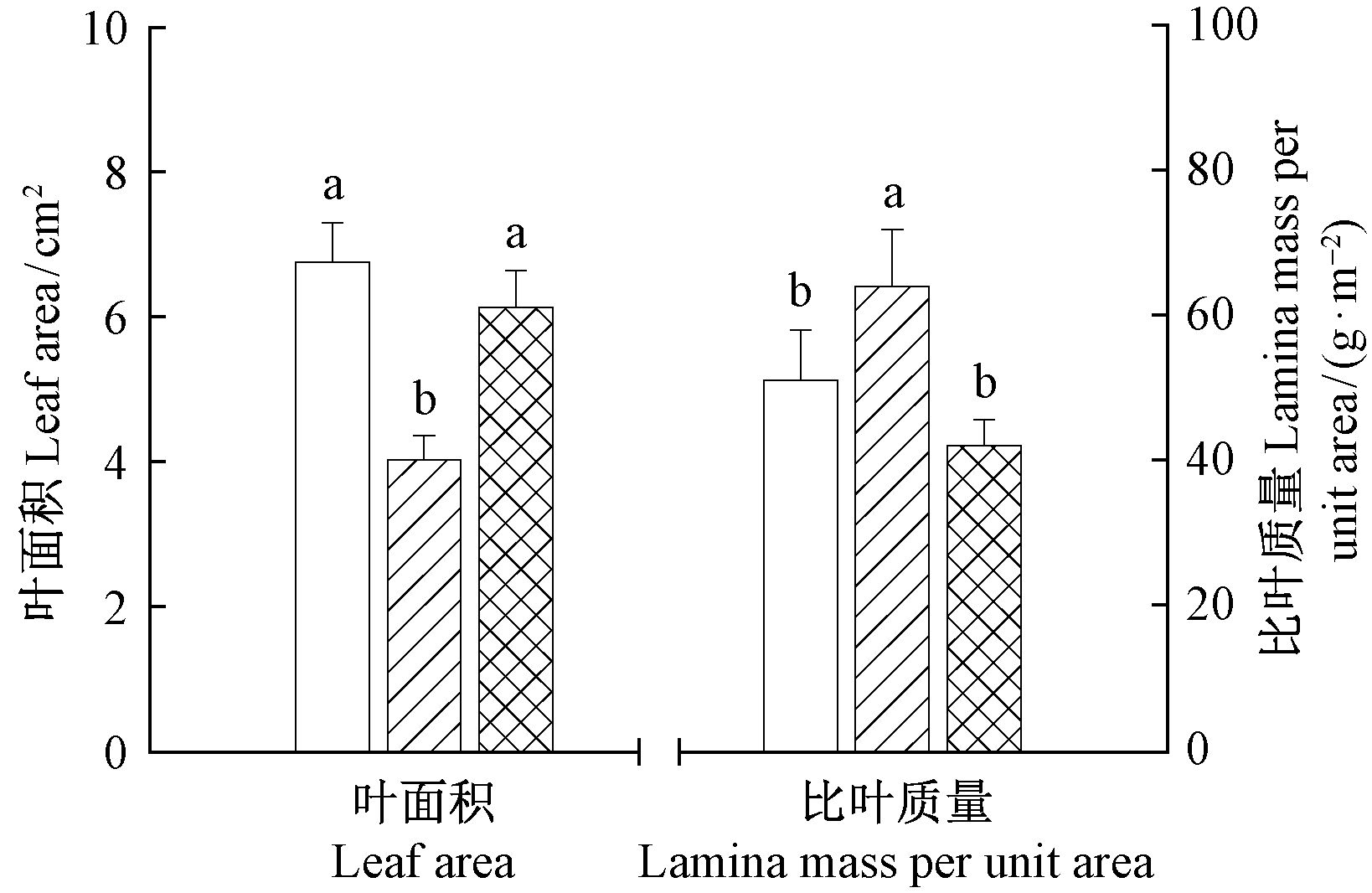
在复水后叶片长成时,基部萌发叶片叶面积显著大于上部萌发叶片(P<0.05),基部萌发叶片的叶面积与对照无显著差异,上部叶片的叶面积显著低于对照(P<0.05),仅为对照的65%。上部萌发叶片的比叶质量显著高于基部萌发叶片(P<0.05),也显著高于对照(P<0.05),基部萌发叶片的比叶质量和对照无显著差异(P=0.43)(图 6)。
|
图 6 复水后茎基部和上部叶片的单叶叶面积和比叶质量 Fig.6 Leaf area and leaf mass per area of different portions of stem after rewatering |
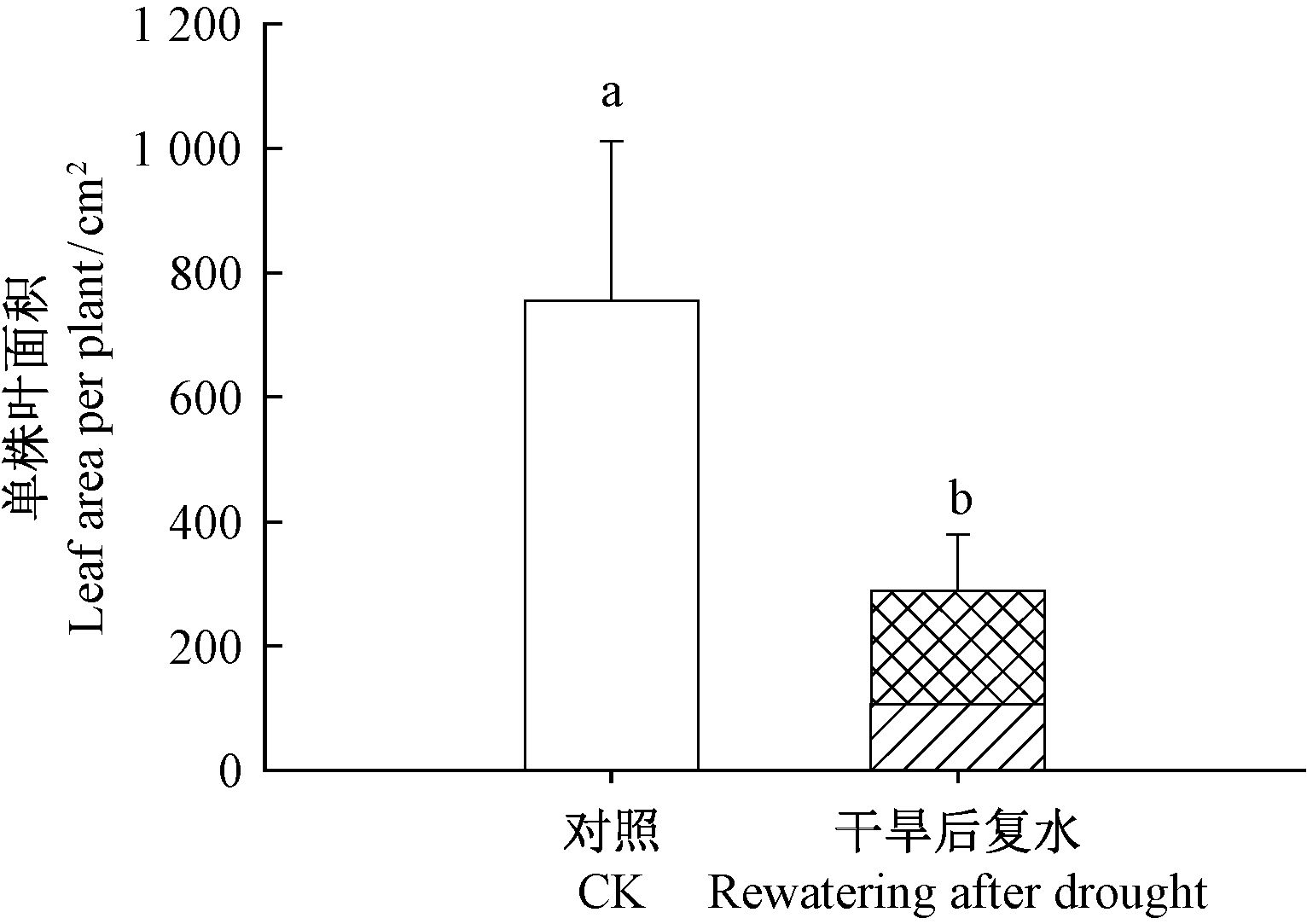
复水后新生叶片单株总叶面积显著低于对照(P<0.05),严重干旱复水后单株叶面积仅相当于对照的约38%,其中,单株枝条上部恢复叶面积为(182±62.2)cm2,占总恢复叶面积的63%,基部恢复叶面积为(107±36)cm2,占总恢复叶面积的37%(图 7)。
|
图 7 干旱和复水后的单株总叶面积 Fig.7 Leaf area per plant of control and rewatering treatments |
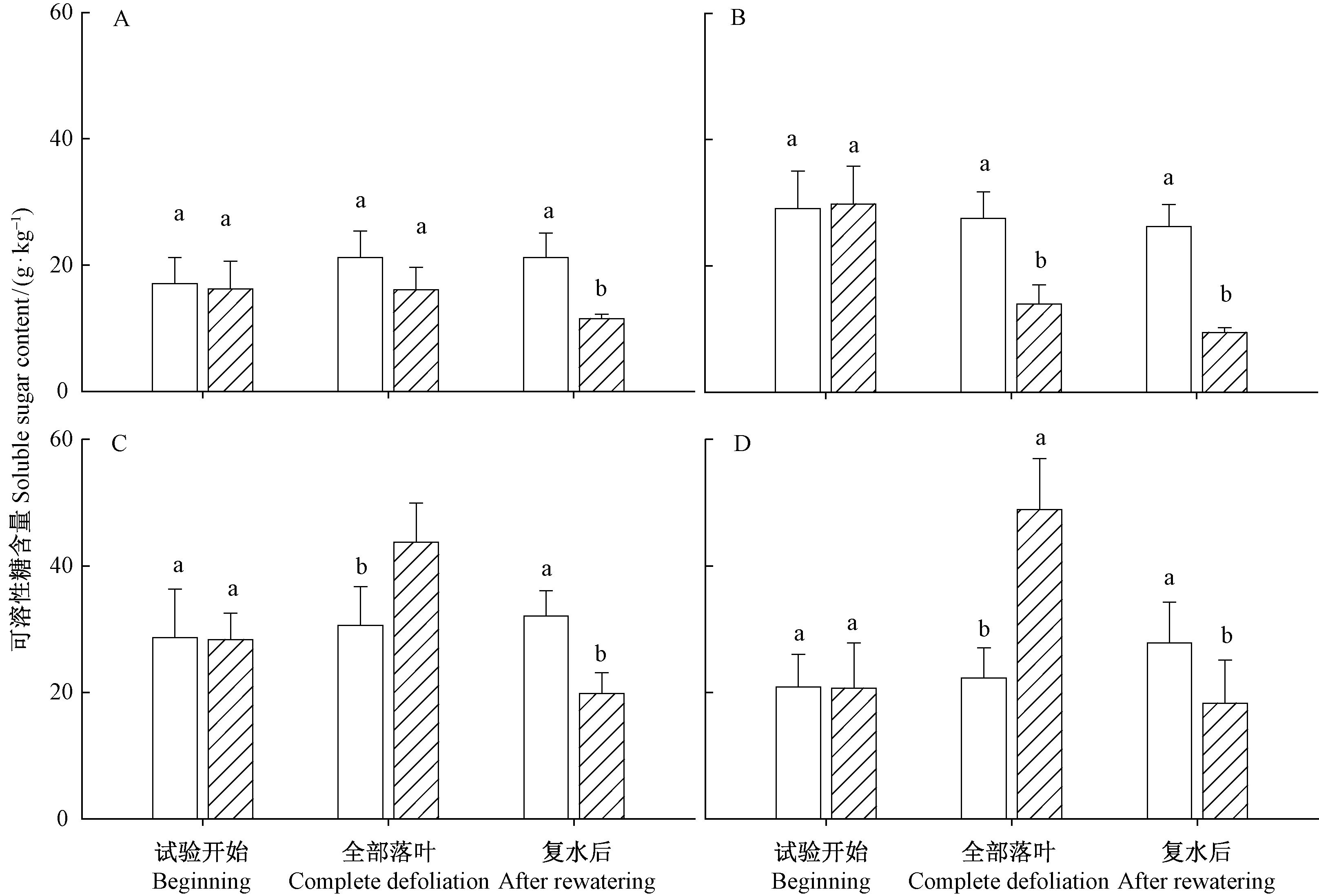
对枝条木质部、韧皮部,根木质部、韧皮部可溶性糖含量比较表明:在干旱导致叶片脱落时,干旱处理枝条木质部可溶性糖含量显著低于对照(P<0.05),枝条韧皮部可溶性糖含量与对照无显著差异(P=0.18),干旱处理的根木质部和韧皮部可溶性糖含量均显著低于对照(P<0.05),在复水后叶片长成时,不同部位可溶性糖含量均显著低于对照(P<0.05)(图 8)。
|
图 8 刺槐干旱和复水处理的枝条韧皮部(A)、枝条木质部(B)、根韧皮部(C)、根木质部(D)可溶性糖含量 Fig.8 The soluble sugar contents of branch phloem(A),branch xylem(B),root phloem(C),root xylem(D) |
在干旱导致全部落叶时,不同部位的NSC含量均显著低于对照(P<0.05),复水后叶片长成时,不同部位NSC含量也显著低于对照(P<0.05),复水后不同部位NSC含量均显著低于干旱导致落叶时(P<0.05)(图 9)。
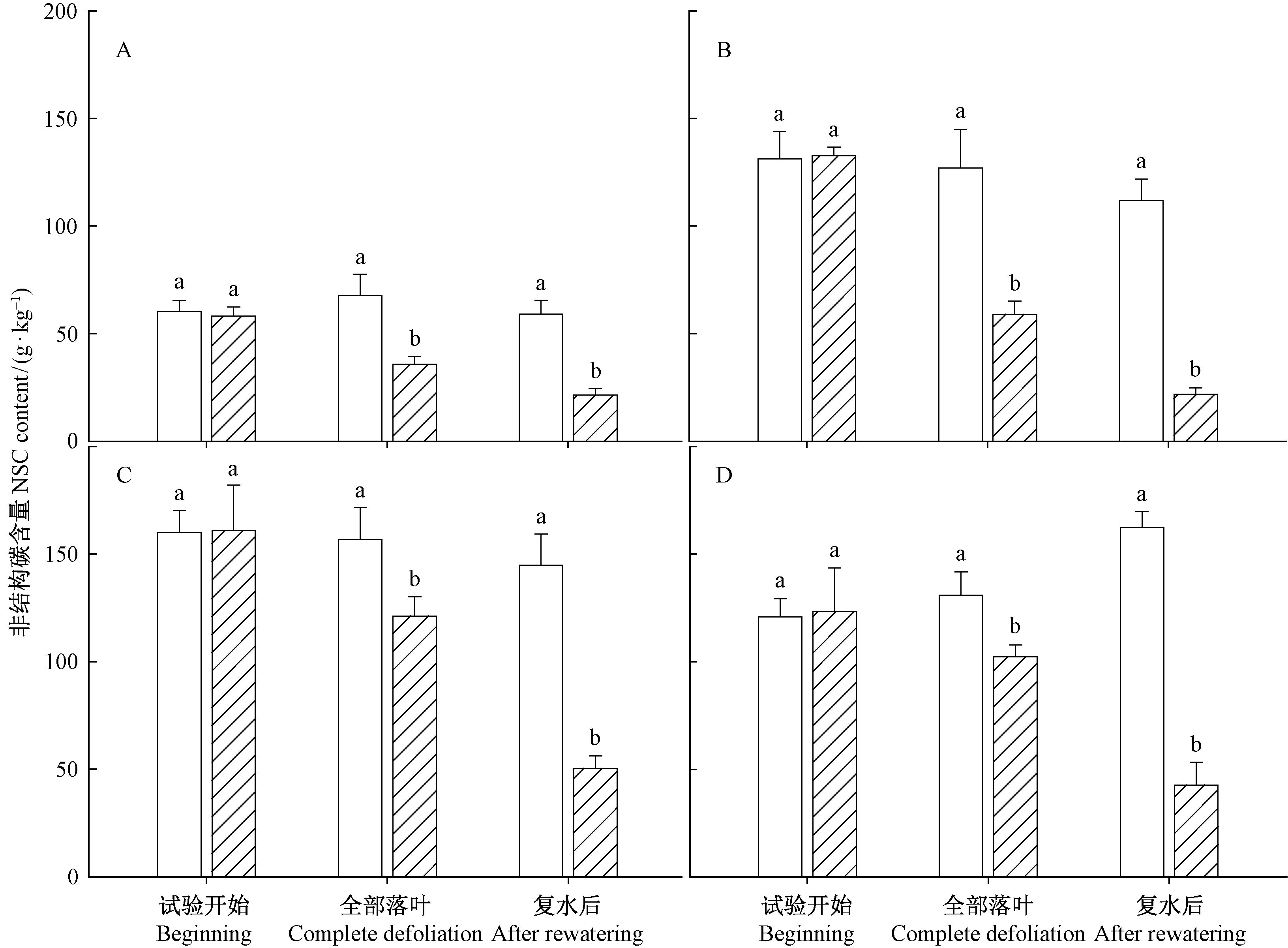
|
图 9 干旱和复水对刺槐枝条韧皮部(A)、枝条木质部(B)、根韧皮部(C)和根木质部(D)NSC含量的影响 Fig.9 The NSC contents of branch phloem(A),branch xylem(B),root phloem(C),root xylem(D) |
水力学结构的维持是树木在干旱条件下存活的重要条件,在干旱条件下,树木木质部导管内的水柱张力增大,气穴栓塞增加,限制水分向叶片的输导能力(Tyree et al,1989)。干旱导致全部落叶时,刺槐的枝条正午PLC值超过90%,严重限制了水分从根到叶片的运输。复水后水力学结构的恢复对树木从干旱条件下恢复起到重要作用(Blackman et al,2009)。在复水后叶片完全展开时,枝条正午PLC值依然为81%,与干旱导致全部落叶时的PLC值(91%)相比有一定程度上的恢复,但PLC值仍远高于对照(图 2),这表明严重干旱后的复水并不能使茎的气穴栓塞完全恢复。枝条栓塞脆弱性测定结果(图 4)表明干旱后刺槐枝条的栓塞脆弱性显著增加,更容易发生气穴栓塞,是导致复水后水分输导能力下降的重要原因。严重干旱后茎栓塞脆弱性增加可能与附着在导管表面的小气泡或者纹孔结构改变导致的栓塞疲劳有关(Hacke et al,2001; Peng et al,2011; Leng et al,2012)。同时,茎木质部和韧皮部非结构碳含量降低可能会限制栓塞修复(Nardini et al,2011)。茎干的栓塞修复能力降低或者抗栓塞能力降低(栓塞脆弱性增加)都会导致栓塞水平升高(Tyree et al,2002;Mayr et al,2014),限制枝条的水分输导能力,进而限制光合作用和复水后的叶片恢复。
3.2 干旱和复水条件下刺槐的NSCNSC对植物碳素缓冲起到重要作用(Dietze et al,2014; Gea-Izquierdo et al,2015),干旱导致气穴栓塞增加限制了植物的水分输导能力,降低了光合作用和气孔导度,导致碳摄取受阻,而植物本身的呼吸代谢消耗并没有发生很大的变化(McDowell et al,2008),当光合速率小于呼吸消耗时,植物会出现负的碳平衡,长期负的碳平衡必然导致非结构碳含量下降(McDowell et al,2013;Sevanto et al.,2014)。在本研究中干旱严重限制了叶片的光合作用,在叶片完全脱落前光合作用出现负值,对NSC的测定表明在干旱导致落叶时干旱处理不同部位的NSC含量均显著降低,这表明严重干旱限制了植物的碳摄取,会导致植物出现负的碳平衡。虽然也有研究表明在干旱前期会抑制生长,使得碳消耗减少,表现出NSC含量升高或者维持不变(Anderegg et al,2012),这可能与干旱时间和干旱程度有关,也会因物种的抗旱策略会有不同的响应。在本研究中,干旱导致全部落叶时,茎韧皮部和木质部NSC减少24.2和73.7 g ·kg-1、根韧皮部和木质部NSC减少12.1和 14.7 g ·kg-1,这表明干旱降低了刺槐不同部位的NSC浓度。比较不同部位的NSC变化发现,干旱更多地降低了茎的NSC浓度,而根的NSC浓度降低相对较小,这表明干旱过程中NSC向根部的分配比例增加,这有利于根系的生长,增加水分吸收面积,也有利于维持根的水分吸收能力,从而增强对干旱的抵御能力(Dietze et al,2014)。
在复水阶段,不同部位的NSC含量均显著低于干旱导致落叶时,因为复水阶段的叶片恢复和植物呼吸代谢又消耗了部分NSC。复水后叶片恢复期间根NSC含量降低程度更大(图 8),这可能是因为恢复生长时更多地是利用根部储藏的NSC,由于叶片恢复后植物的NSC水平降低,而NSC对栓塞的主动修复起重要作用,可以为栓塞主动修复提供能量和低渗透势,因此低NSC浓度可能会影响到木质部栓塞的即时修复(Tyree et al,2002;Mayr et al,2014),进而影响刺槐的水力结构。
3.3 水力学结构和NSC储量对刺槐经历干旱后叶片恢复的影响刺槐属于干旱恢复性策略植物,严重干旱条件下刺槐会通过落叶减少水分消耗,在干旱结束后会重新长出叶片,但是否能恢复到干旱前的叶面积水平是本研究关注的一个问题。在本研究中,复水后7~10天,叶片开始长出,复水后30天,新生叶片长成时,单株恢复叶面积显著低于对照,也显著低于干旱前的叶面积,仅为对照的38%,这表明刺槐在干旱导致落叶后恢复的叶面积显著降低,重新长出叶片过程中需要水分提供膨压(Zhang et al,2011),也需要NSC提供碳源(Martínez-Vilalta,2014),因此两方面对叶片恢复有重要意义。水分条件是影响叶片生长的重要因素,在展叶期遇到干旱,植物会表现出叶面积减小、比叶质量增加(Poorter et al,2009; Zhang et al,2012; 王林等,2013),在本研究中,刺槐在经历严重干旱后枝条上部恢复叶片叶面积减小、比叶质量增加,同时,经历干旱和复水过程,上部枝条水势显著低于对照,枝条栓塞程度显著高于对照(图 2),这表明水分是限制上部叶片恢复的重要原因。基部萌发的叶面积显著大于上部恢复叶片,基部萌发枝条的凌晨和正午水势均显著高于上部枝条,这表明基部萌发叶片水分状况好于上部萌发叶片,而茎基部恢复叶片和上部叶片的主要差别在于是否需要茎木质部参与水分输导,严重干旱导致的茎水分输导能力下降限制了上部叶片的伸展和叶片水分利用,这也佐证了水分输导在限制刺槐叶片恢复中的作用。NSC是植物叶片生长的物质基础, Anderegg等(2012)的研究表明,碳饥饿条件下美洲山杨(Populus tremuloides)的单株叶面积均显著降低。在本研究中,经历严重干旱胁迫后,刺槐枝条和根中NSC含量均显著低于对照(图 8),这表明干旱胁迫降低了植株的NSC储藏水平,这也可能是影响刺槐经历干旱后叶片恢复的一个重要原因。
在正常情况下,基部腋芽或潜伏芽的萌发会受到茎干的抑制,这主要是与生长素的极性运输有关(Wan et al,2006),但在枝条受到伤害或者严重胁迫条件下,会有腋芽或者潜伏芽萌发(Lu et al,2010)。在本研究中,经过严重的干旱以后,叶片全部脱落,一定程度上失去的顶端优势(Wan et al,2006),导致茎基部和枝条顶端腋芽同时萌发,表明除了水分输导能力外,经历干旱后的茎干在激素等其他方面也可能受到影响。
4 结论本研究测定了刺槐在干旱和复水期间的植物水分状况、光合作用、NSC含量和叶片恢复生长情况。结果表明:干旱导致刺槐水势显著降低,PLC值显著增加。在复水后,枝条正午PLC值仍显著高于对照,经历严重干旱枝条的抗气穴栓塞能力显著降低。NSC浓度为试验开始时>干旱落叶后>复水后,在复水后叶片长成时NSC含量较干旱落叶后又有更大程度的降低。复水后恢复叶面积显著低于对照,茎基部恢复叶片水分状况明显好于上部叶片。严重干旱限制了刺槐的水分输导,导致植物碳摄取限制,出现碳的负平衡,在复水阶段,严重干旱导致的茎木质部水分输导能力下降和NSC含量减少限制了新叶的萌发,并可能影响木质部栓塞的即时修复。
| [1] |
靳欣, 徐洁, 白坤栋, 等. 2011. 从水力结构比较3种共存木本植物的抗旱策略. 北京林业大学学报 , 33 (6) : 135–141.
( Jin X, Xu J, Bai K D, et al.2011. Comparison of drought strategies of three co-existing woody plants by their hydraulic structures. Journal of Beijing Forestry University , 33 (6) : 135–141. [in Chinese] ) (  0) 0)
|
| [2] |
王林, 冯锦霞, 万贤崇. 2013. 土层厚度对刺槐旱季水分状况和生长的影响. 植物生态学报 , 37 (3) : 248–255.
( Wang L, Feng J X, Wan X C.2013. Effects of soil thickness on dry-season water relations and growth in Robinia pseudoacacia. Chinese Journal of Plant Ecology , 37 (3) : 248–255. [in Chinese] ) (  0) 0)
|
| [3] |
王林, 代永欣, 樊兴路, 等. 2015. 风对黄花蒿水力学性状和生长的影响. 生态学报 , 35 (13) : 4454–4461.
( Wang L, Dai Y X, Fan X L, et al.2015. Effects of wind on hydraulic properties and growth of Artemisia annua Linn. Acta Ecologica Sinica , 35 (13) : 4454–4461. [in Chinese] ) (  0) 0)
|
| [4] |
杨建伟, 梁宗锁, 韩蕊莲. 2004. 不同土壤水分状况对刺槐的生长及水分利用特征的影响. 林业科学 , 40 (5) : 93–98.
( Yang J W, Liang Z S, Han R L.2004. Characteristics of growth and water use of Robinia pseudoacacia under different soil water conditions. Scientia Silvae Sinicae , 40 (5) : 93–98. [in Chinese] ) (  0) 0)
|
| [5] |
Allen C D, Macalady A K, Chenchouni H, et al.2010. A global overview of drought and heat-induced tree mortality reveals emerging climate change risks for forests. Forest Ecology and Management , 259 (4) : 660–684.
( 0) 0)
|
| [6] |
Anderegg W R, Berry J A, Smith D D, et al.2012. The roles of hydraulic and carbon stress in a widespread climate-induced forest die-off. Proceedings of the National Academy of Sciences , 109 (1) : 233–237.
( 0) 0)
|
| [7] |
Blackman C J, Brodribb T J, Jordan G J.2009. Leaf hydraulics and drought stress:response, recovery and survivorship in four woody temperate plant species. Plant, Cell and Environment , 32 (11) : 1584–1595.
( 0) 0)
|
| [8] |
Choat B, Jansen S, Brodribb T J, et al.2012. Global convergence in the vulnerability of forests to drought. Nature , 491 (7426) : 752–755.
( 0) 0)
|
| [9] |
Dietze M C, Sala A, Carbone M S, et al.2014. Nonstructural carbon in woody plants. Annual Review of Plant Biology , 65 : 667–687.
( 0) 0)
|
| [10] |
Gea-Izquierdo G, Guibal F, Joffre R, et al.2015. Modelling the climatic drivers determining photosynthesis and carbon allocation in evergreen Mediterranean forests using multiproxy long time series. Biogeosciences Discussions , 12 (3) : 2745–2786.
( 0) 0)
|
| [11] |
Hacke U G, Stiller V, Sperry J S, et al.2001. Cavitation fatigue. Embolism and refilling cycles can weaken the cavitation resistance of xylem. Plant Physiology , 125 (2) : 779–786.
( 0) 0)
|
| [12] |
( 0) 0)
|
| [13] |
Klein T, Hoch G, Yakir D, et al.2014. Drought stress, growth and nonstructural carbohydrate dynamics of pine trees in a semi-arid forest. Tree physiology , 34 (9) : 981–992.
( 0) 0)
|
| [14] |
Leng H, Lu M, Wan X.2013. Variation in embolism occurrence and repair along the stem in drought-stressed and re-watered seedlings of a poplar clone. Physiologia Plantarum , 147 (3) : 329–339.
( 0) 0)
|
| [15] |
Lu Y, Alejandra Equiza M, Deng X, et al.2010. Recovery of Populus tremuloides seedlings following severe drought causing total leaf mortality and extreme stem embolism. Physiologia Plantarum , 140 (3) : 246–257.
( 0) 0)
|
| [16] |
Martorell S, Diaz-Espejo A, Medrano H, et al.2014. Rapid hydraulic recovery in Eucalyptus pauciflora after drought:linkages between stem hydraulics and leaf gas exchange. Plant, Cell and Environment , 37 (3) : 617–626.
( 0) 0)
|
| [17] |
Martínez-Vilalta J.2014. Carbon storage in trees:pathogens have their say. Tree Physiology , 34 : 215–217.
( 0) 0)
|
| [18] |
Mayr S, Schmid P, Laur J, et al.2014. Uptake of water via branches helps timberline conifers refill embolized xylem in late winter. Plant Physiology , 164 (4) : 1731–1740.
( 0) 0)
|
| [19] | McDowell N G, Pockman W T, Allen C D, et al. 2008. Mechanisms of plant survival and mortality during drought:why do some plants survive while others succumb to drought? New Phytologist 178(4):719-739. |
| [20] |
McDowell N G, Ryan M G, Zeppel M J B, et al.2013. Improving our knowledge of drought-induced forest mortality through experiments, observations, and modeling. New Phytologist , 200 (2) : 289–293.
( 0) 0)
|
| [21] |
Mitchell P J, O'Grady A P, Tissue D T, et al.2013. Drought response strategies define the relative contributions of hydraulic dysfunction and carbohydrate depletion during tree mortality. New Phytologist , 197 (3) : 862–872.
( 0) 0)
|
| [22] |
Nardini A, Gullo M A L, Salleo S.2011. Refilling embolized xylem conduits:is it a matter of phloem unloading? Plant Science 180(4):604-611. Plant Science , 180 (4) : 604–611.
( 0) 0)
|
| [23] |
Peng C, Ma Z, Lei X, et al.2011. A drought-induced pervasive increase in tree mortality across Canada's boreal forests. Nature Climate Change , 1 (9) : 467–471.
( 0) 0)
|
| [24] |
Poorter H, Niinemets U, Poorter L, et al.2009. Causes and consequences of variation in leaf mass per area (LMA):a meta-analysis. New Phytologist , 182 (3) : 565–588.
( 0) 0)
|
| [25] |
Ryan M G.2011. Tree responses to drought. Tree Physiology , 31 (3) : 237–239.
( 0) 0)
|
| [26] |
Sala A, Woodruff D R, Meinzer F C.2012. Carbon dynamics in trees:feast or famine? Tree Physiology 32(6):764-775. Tree Physiology , 32 (6) : 764–775.
( 0) 0)
|
| [27] |
Sevanto S, McDowell N G, Dickman L T, et al.2014. How do trees die? a test of the hydraulic failure and carbon starvation hypotheses. Plant, Cell and Environment , 37 (1) : 153–161.
( 0) 0)
|
| [28] |
Tyree M T, Sperry J S.1989. Vulnerability of xylem to cavitation and embolism. Annual Review of Plant Physiology and Plant Molecular Biology , 40 (1) : 19–36.
( 0) 0)
|
| [29] | Tyree M T, Zimmermann M H. 2002. Xylem structure and the ascent of sap. Springer Verlag. |
| [30] |
Wan X C, Landhäusser S M, Lieffers V J, et al.2006. Signals controlling root suckering and adventitious shoot formation in aspen (Populus tremuloides). Tree Physiology , 26 (5) : 681–687.
( 0) 0)
|
| [31] |
Wang R, Zhang L, Zhang S, et al.2014. Water relations of Robinia pseudoacacia L. :do vessels cavitate and refill diurnally or are R-shaped curves invalid in Robinia? Plant, Cell and Environment , 37 (12) : 2267–2278.
( 0) 0)
|
| [32] |
Wiley E, Huepenbecker S, Casper B B, et al.2013. The effects of defoliation on carbon allocation:can carbon limitation reduce growth in favour of storage? Tree Physiology 33(11):1216-1228. Tree Physiology , 33 (11) : 1216–1228.
( 0) 0)
|
| [33] |
Zhang Y X, Equiza M A, Zheng Q S, et al.2012. Factors controlling plasticity of leaf morphology in Robinia pseudoacacia L. II:the impact of water stress on leaf morphology of seedlings grown in a controlled environment chamber. Annals of Forest Science , 69 (1) : 39–47.
( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52

