文章信息
- 雷海迪, 尹云锋, 张鹏, 万晓华, 马红亮, 高人, 杨玉盛
- Lei Haidi, Yin Yunfeng, Zhang Peng, Wan Xiaohua, Ma Hongliang, Gao Ren, Yang Yusheng
- 生物质炭输入对杉木人工林土壤碳排放和微生物群落组成的影响
- Impacts of Biochar Input on Soil Carbon Emission and Microbial Community Composition in Cunninghamia lanceolata Plantation
- 林业科学, 2016, 52(5): 37-44
- Scientia Silvae Sinicae, 2016, 52(5): 37-44.
- DOI: 10.11707/j.1001-7488.20160505
-
文章历史
- 收稿日期:2015-06-02
- 修回日期:2016-03-31
-
作者相关文章
生物质炭是生物质在低氧或缺氧的条件下,高温热解形成的富含碳元素的固态物质(Joseph et al., 2010; Lehmann et al., 2011; 谢祖彬等,2011)。制备材料、高温热解条件等对生物质炭的物理和化学性质影响显著(Lehmann et al., 2006; Mašek et al., 2013; Gomez et al., 2014)。生物质炭孔隙结构发达、比表面积大、带负电荷多,能提高土壤养分和持水能力,促进植物的生长,被认为是改良土壤的理想材料(Sohi et al., 2010; Novak et al., 2012; Drake et al., 2015)。生物质炭具有高芳香化结构,存留时间长,在稳定土壤碳库方面亦发挥着重要作用(Lehmann et al., 2006; Liang et al., 2010; Ameloot et al., 2015)。已有研究表明,生物质炭输入对土壤CO2排放有不同程度的影响。如Bamminger等(2014)通过57天的培养试验显示添加生物质炭——220 ℃水热碳化玉米(Zea mays),促进了土壤CO2排放。Zimmerman等(2011)的培养试验结果显示,添加生物质炭——650 ℃热解栎树(Quercus laurifolia),培养前期阶段促进了淋溶土的CO2排放,后期则产生抑制作用。亦有研究发现生物质炭——400 ℃热解黑麦草(Lolium perenne),输入对土壤CO2排放无显著影响(Kuzyakov et al., 2009)。上述研究尚未考虑植物或凋落物存在的条件下输入生物质炭对土壤CO2排放的影响,目前有关存在凋落物条件下输入生物质炭对土壤CO2排放影响的研究报道较少。Keith等(2011)在添加不同比例甘蔗(Saccharum officinarum)渣(添加量分别为土壤质量的0%,1%,2%和4%)的土壤中输入生物质炭——450和550 ℃热解柳桉(Eucalyptus saligna),后发现添加生物质炭处理的土壤CO2累积排放量显著低于未添加生物质炭的处理,且输入550 ℃生物质炭处理的土壤CO2累积排放量显著低于输入450 ℃生物质炭的处理。Zavalloni等(2011)研究表明在土壤中添加0.5%小麦(Triticum aestivum)秆后,输入生物质炭——500 ℃热解山毛榉(Fagaceae)、榛树(Corylus chinensis)、栎树和桦树(Betula)的混合物,土壤CO2排放与未添加生物质炭的处理之间无显著差异。Novak等(2010)研究显示在土壤中添加柳枝稷(Panicum virgatum)(添加量为土壤质量的1%)后,输入生物质炭——山核桃(Carya cathayensis)壳在170 ℃热解30 min,随后在700 ℃热解30 min,使土壤CO2累积排放量高于未输入生物质炭的处理,但未达到显著水平。
土壤微生物作为森林生态系统的重要组成部分,在驱动碳、氮、磷、硫等生物地球化学循环,维持森林生态系统过程和功能等方面具有十分重要的作用(Kennedy et al., 1995; Falkowski et al., 2008)。生物质炭输入会影响土壤微生物群落组成,且因生物质炭性质、土壤性质和环境因素等不同而异。Ameloot等(2013)研究发现输入生物质炭——350 ℃热解白柳(Salix alba),分别在350和700 ℃热解猪粪,使土壤革兰氏阳性细菌的丰度显著增加,并且输入350 ℃生物质炭比输入700 ℃生物质炭的革兰氏阴性细菌的丰度更高。Chen等(2013)在中国西南地区弱酸性水稻土中施入生物质炭(分别在350和550 ℃热解小麦秆)后,土壤细菌的基因丰度增加,土壤真菌的基因丰度降低。Gomez等(2014)研究表明添加生物质炭,550 ℃热解沼生栎(Quercus palustris),可增加微生物丰度并改变微生物群落组成,特别是添加较大比例(添加量为土壤质量的20%)生物质炭会促进革兰氏阴性细菌的生长。
我国亚热带地区杉木(Cunninghamia lanceolata)人工林分布广泛,且土壤呈酸性,肥力水平较低(郑璐嘉等,2015)。在人工林经营初期,若将采伐剩余物和凋落物制成生物质炭,并将其返还土壤,可避免直接火烧造成的环境污染和水肥流失等问题,也有可能改善人工林土壤肥力,提高人工林土壤的固碳能力(尹云锋等,2014)。本研究以杉木人工林土壤为研究对象,设置未添加凋落物和添加杉木凋落物条件下,输入3种不同温度制备的杉木生物质炭进行为期1年的室内培养,研究生物质炭输入对杉木人工林土壤CO2排放和微生物群落组成的影响,以期为亚热带人工林生物质资源合理利用以及人工林固碳管理提供科学依据。
1 研究区概况研究区位于福建建瓯市万木林自然保护区(118°09′E,27°03′N)内的杉木人工林。该区属亚热带季风气候,年平均气温19.4 ℃,年均降水量1 731 mm,年均蒸发量1 466 mm; 土壤为花岗岩发育的红壤。杉木人工林为1969年天然林皆伐后人工造林形成,林分密度为1 117 株·hm-2,树种单一,林分结构简单,灌木层以杜茎山(Maesa japonica)、狗骨柴(Diplospora dubia)为主,草本层有狗脊(Woodwardia japonica)和草珊瑚(Sarcandra glabra)等,样地具体介绍参见张彪等(2010)。
2 研究方法 2.1 供试材料2013年3月多点选取表层(0 ~ 15 cm)土壤,剔除可见碎石及动植物残体,过2 mm筛,混匀,于4 ℃保存备用。
利用盆栽试验种植杉木幼苗,采集1.5 年生杉木活叶,用蒸馏水洗净并置于70 ℃烘箱中烘至恒质量,冷却后剪成1 cm左右,备用。
采集1.5年生的杉木茎叶,用蒸馏水洗净并置于烘箱中,70 ℃烘干至恒质量,冷却后粉碎混匀。称取一定量置于锡箔纸中,放入KTF管式炉中封闭,持续输入氮气形成厌氧环境,达到预设温度后开始计时,燃烧2 h。燃烧温度分别为350,550和750 ℃,制备的生物质炭相应标记为BC350、BC550和BC750。取出放置于无氧环境冷却至室温,过2 mm筛备用。供试材料基本性质见表 1。
|
|
本试验设置8个处理: 土壤(S)、土壤+BC350(S+BC350)、土壤+BC550(S+BC550)、土壤+BC750(S+BC750)、土壤+杉木凋落叶(S+L)、土壤+杉木凋落叶+BC350(S+L+BC350)、土壤+杉木凋落叶+BC550(S+L+BC550)和土壤+杉木凋落叶+BC750(S+L+BC750),每个处理重复4次。其中生物质炭和凋落物的添加量各自为土壤质量(以烘干土计)的2%。
具体方法如下: 称取相当于50 g干土的鲜土,按照试验处理方式加入生物质炭或杉木凋落物并混合均匀,装入50 mL塑料杯中,再将湿度调节为60%土壤饱和持水量(WHC),置于1 L的密闭培养瓶中,瓶内同时放置盛有20 mL 0.5 mol·L-1的NaOH溶液的塑料杯1个以吸收土壤释放的CO2,装有蒸馏水的塑料杯1个以维持培养瓶内湿度。在25 ℃的培养箱中培养364天,定期校正土壤水分含量。在培养的第1,3,5,7,14,28,56,85,112,140,168,224,280,336和364天,取出装有NaOH溶液的小瓶,利用0.25 mol·L-1的HCl滴定,分析土壤中释放的CO2。培养结束后,进行破坏性取样,样品冷冻干燥后,测定土壤微生物磷脂脂肪酸。
2.3 样品测定土壤、凋落物和生物质炭样品的全碳与全氮含量采用碳氮元素分析仪(Elementar Vario EL III,德国)测定; pH值采用电位法测定(水与生物质炭的比例为5:1,水与土的比例为2.5:1)。
土壤微生物磷脂脂肪酸的提取参照White等(1979)的方法,提取出的脂肪酸甲酯通过气相色谱仪(Agilent 6890 N,美国),根据其停留时间并结合MIDI微生物识别系统(MIDI Inc.,Newark,DE)进行鉴定。用i14:0,i15:0,a15:0,i16:0,i17:0,a17:0表征革兰氏阳性细菌(Gram-positive bacteria)(Denef et al., 2009; Landesman et al., 2010),用16:1ω9c,16:1ω7c,cy17:0,18:1ω7c,18:1ω5c,cy19:0ω8c表征革兰氏阴性细菌(Gram-negative bacteria)(Swallow et al., 2009; Frostegård et al., 2011),16:1ω5c表征丛枝菌根真菌(Arbuscular mycorrhizal fungi)(Swallow et al., 2009),10Me16:0,10Me17:0和10Me18:0表征放线菌(Actinomycetes)(Ringelberg et al., 1997),18:1ω9c和18:2ω6,9c表征真菌(Fungi)(Frosteget al., 1996; Swallow et al., 2009)。PLFA总量(Total PLFAs)为大于0.40%磷脂脂肪酸的含量之和。
2.4 数据处理数据采用Excel 2007和SPSS 17.0软件进行统计分析。采用单因素方差分析(ANOVA)确定处理对土壤CO2排放和微生物群落组成的影响,多重比较采用Duncan法,显著性水平设为α=0.05。通过相关分析确定土壤CO2累积排放量与土壤磷脂脂肪酸含量之间的关系。
3 结果与分析 3.1 不同处理对土壤CO2排放速率的影响不同凋落物条件下(未添加凋落物和添加凋落物)输入生物质炭,土壤CO2排放速率随时间变化趋势不同(图 1)。未添加凋落物条件下,输入3种温度制备的生物质炭,土壤CO2排放速率均随着时间延长逐渐降低并趋于平稳。与培养初期(1天)相比,培养至14天时S、S+BC350、S+BC550和S+BC750土壤CO2排放速率分别下降了94.3%,88.9%,91.9%和84.6%。1 ~ 14天培养过程中,土壤CO2排放速率均表现为S+BC350>S+BC550>S+BC750,4个处理间差异显著(P<0.05)。28天后土壤CO2排放速率逐渐下降趋于平稳,4个处理土壤CO2排放速率差异减小且不显著(P>0.05)。添加凋落物条件下,4个处理土壤CO2排放速率呈现先上升后下降,最后趋于稳定的趋势。培养至7天时4个处理土壤CO2排放速率达到最大值,与培养初期(第1天)相比S+L、S+L+BC350、S+L+BC550和S+L+BC750土壤CO2排放速率分别上升了178.1%,38.4%,92.1%和127.1%。第1天时4个处理间存在极显著差异(P<0.01),其中S+L+BC350土壤CO2排放速率最大。3天后各处理之间土壤CO2排放速率差异减小且不显著(P>0.05)。
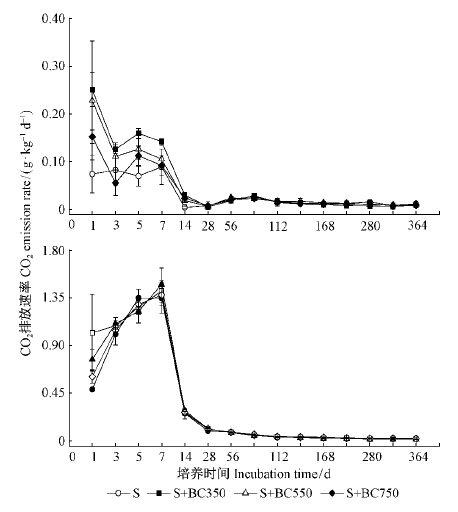
|
图 1 土壤CO2排放速率动态变化 Fig. 1 Dynamic of soil CO2 emission rate during the incubation period |
添加凋落物条件下4个处理的土壤CO2累积排放量显著高于对应的未添加凋落物条件下4个处理的土壤CO2累积排放量,且在培养前期阶段添加凋落物条件下4个处理比未添加凋落物条件下4个处理的土壤CO2累积排放量上升速度更快(图 2)。方差分析结果显示,凋落物对土壤CO2累积排放量存在极显著影响(P<0.01),不同温度制备的生物质炭仅在培养前期阶段对土壤CO2累积排放量存在显著影响(P<0.05)。未添加凋落物条件下,1~168天培养过程中S+BC350土壤CO2累积排放量最大,显著高于S; 224 ~ 364天培养过程中,4个处理间土壤CO2累积排放量差异不显著(P>0.05)。添加凋落物条件下,培养初期(第1天)4个处理土壤CO2累积排放量差异显著(P<0.05),S+L+BC350显著高于S+L与S+L+BC750; 3天后4处理间土壤CO2累积排放量差异减小。
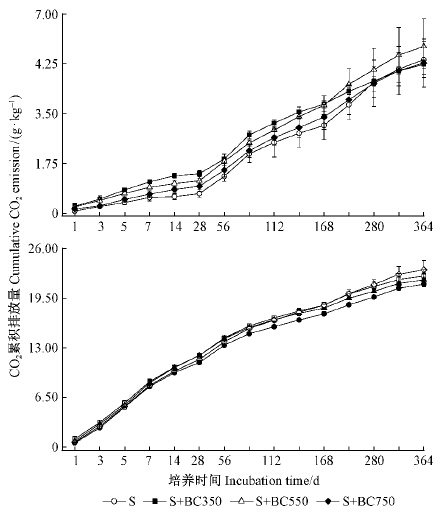
|
图 2 土壤CO2累积排放量随时间变化 Fig. 2 Cumulative CO2 emission during the incubation period |
未添加凋落物条件下,输入3种生物质炭后,培养前期阶段3个处理土壤CO2累积排放量均显著高于S; 在后期阶段,与S相比,S+BC350、S+BC550与S+BC750的土壤CO2累积排放量均减少,其中S+BC350显著低于S(表 2)。添加凋落物条件下,输入3种生物质炭后,培养前期阶段3个处理土壤CO2累积排放量显著高于S+L; 后期阶段除S+L+BC750显著高于S+L外,S+L+BC350和S+L+BC550均低于S+L; 且添加凋落物条件下4个处理土壤CO2排放主要出现在培养前期阶段(表 2)。
|
|
从土壤PLFA总量来看(表 3),S+BC350、S+BC550和S+BC750的土壤PLFA总量与S无显著差异(P>0.05),S+L+BC350、S+L+BC550和S+L+BC750的土壤PLFA总量与S+L无显著差异(P>0.05),但S+L的土壤PLFA总量显著高于S(P<0.05)。从微生物群落组成来看(表 3),S+L的真菌丰度、真菌/细菌比值均显著高于S,而革兰氏阳性细菌、革兰氏阴性细菌和放线菌的丰度均显著低于S。S+BC350、S+BC550和S+BC750革兰氏阴性细菌丰度均显著低于S,导致革兰氏阳性/革兰氏阴性细菌比值增加; S+L+BC350、S+L+BC550和S+L+BC750放线菌丰度均显著高于S+L。制备生物质炭的温度因素仅在添加凋落物条件下对微生物群落组成有显著影响(P<0.05),S+L+BC750革兰氏阳性细菌的丰度显著高于S+L+BC350,其真菌丰度显著低于S+L+BC350和S+L+BC550。
|
|
相关分析显示,土壤CO2累积排放量与5大微生物群落的磷脂脂肪酸含量均极显著正相关(P<0.01),且与真菌含量的相关系数最大; 土壤CO2累积排放量与土壤PLFA总量之间极显著正相关(P<0.01)。
4 讨论 4.1 不同处理对土壤CO2排放的影响本研究中,未添加凋落物条件下输入3种生物质炭后,土壤CO2排放速率随着时间延长逐渐降低趋于平稳(图 1)。这与Bamminger等(2014)的研究结果一致,采用3种不同的生物质炭(220 ℃水热碳化玉米,600 ℃热解玉米,20%木材碎屑热解制成的生物质炭与80%商业堆肥混合)按2种不同比例(土壤质量的20%和40%)分别添加至土壤中培养57天,发现土壤呼吸在培养12 h达到最大值随后逐渐降低,20 ~ 30天趋于平稳。生物质炭包含不容忽视的易变成分,在培养试验的第1周容易被微生物吸收利用,由土壤呼吸速率随时间延长而下降反映出来(Whitman et al., 2014)。添加凋落物条件下,输入3种生物质炭后土壤CO2排放速率呈现出先上升,7天达到最大值随后逐渐下降的趋势(图 1),这与Zavalloni等(2011)的研究结果一致。可能是因为生物质炭的性质比凋落物更稳定,培养前期阶段微生物主要分解利用凋落物所致。热解温度对生物质炭的性质有重要影响(Mašek et al., 2013; Bergemn et al., 2013),低温制备的生物质炭比高温制备的生物质炭存留更多的易分解碳,比表面积较小且孔隙不发达,导致培养前期阶段输入低温制备的生物质炭(BC350)比输入高温制备的生物质炭(BC550和BC750)的土壤CO2排放速率更快,土壤CO2累积排放量更高(图 2)。
在不同凋落物条件下(未添加凋落物和添加凋落物),输入3种温度制备的生物质炭,培养前期阶段促进土壤CO2排放,后期阶段抑制土壤CO2排放(表 2)。Maestrini等(2014)将生物质炭(450 ℃热解黑麦草,添加量为土壤质量的1.3%)添加至温带森林土壤中培养158天,发现培养前期(1 ~ 18天)促进了土壤呼吸,培养后期(18 ~ 158天)则产生抑制作用。生物质炭含有易分解碳,同时能提供N,P等营养物质,增加土壤微生物活性,因此培养前期阶段会促进土壤CO2排放。随着时间延长,生物质炭所含易分解成分消耗殆尽,且生物质炭的包封作用和吸附作用促使土壤中有机碳的可利用性降低,从而对土壤CO2排放产生抑制作用(Zimmerman et al., 2011)。S+L+BC750处理中,微生物优先选择利用凋落物,BC750性质较稳定导致微生物分解速度慢所需时间长,培养364天后对土壤CO2排放仍存在促进作用,其对土壤CO2排放的抑制作用可能在较晚时间出现。
4.2 不同处理对微生物群落组成的影响Prayogo等(2014)研究表明,生物质炭(470 ℃热解柳树枝,添加量为土壤质量的2%)添加至含有1%柳树叶的土壤中,在培养试验30天时显著增加了土壤PLFA总量,但在培养试验90天时对土壤PLFA总量无显著影响。本研究中,无论土壤中是否存在凋落物,生物质炭输入对土壤PLFA总量均无显著影响; 而凋落物的存在使土壤PLFA总量显著增加(表 3)。生物质炭和凋落物均能为微生物提供碳源,但生物质炭的易分解碳含量比凋落物少,可能导致生物质炭在培养364天后对土壤PLFA总量无显著影响。这说明生物质炭性质和培养时间对土壤PLFA总量有重要影响。本研究中,土壤CO2累积排放量与土壤PLFA总量之间存在极显著正相关关系,其原因在于凋落物的存在显著增加了土壤PLFA总量,进而促进土壤中有机碳的分解利用,导致土壤CO2累积排放量增加。凋落物的存在使真菌丰度显著增加(表 3),单一针叶凋落物分解时,土壤微生物主要通过调节群落真菌含量促进分解(陈法霖等,2011),因此5大微生物群落中真菌含量与土壤CO2累积排放量的相关性最高。
Farrell等(2013)在土壤中输入生物质——450 ℃热解小麦和蓝桉(Eucalyptus globulus),经过74天的培养,发现输入生物质炭显著改变了土壤微生物群落,可能由生物质炭所含易分解碳引起。Prayogo等(2014)研究表明在不同凋落物条件下(有柳树凋落叶和无柳树凋落叶),不同比例(添加量为土壤质量的0.5%和2%)的生物质炭(470 ℃热解柳枝)输入使革兰氏阴性细菌和放线菌丰度增加。而本研究中,生物质炭输入使革兰氏阴性细菌的丰度降低(表 3),这与Prayogo等(2014)的研究结果不一致。革兰氏阴性细菌是一种富营养群落,利用难分解有机质的能力较弱(Kramer et al., 2008; Diedhiou et al., 2009); 本试验培养364天后,土壤CO2排放趋于平稳,较难分解碳的比例增加,因此革兰氏阴性细菌丰度显著降低。Watzinger等(2014)通过100 天培养试验,发现输入生物质炭(525 ℃热解小麦壳和柳树枝,添加量为土壤质量的3%)后革兰氏阳性细菌和真菌均有小幅增加但未参与生物质炭的分解,放线菌含量增加并参与生物质炭的分解。生物质炭富含难分解碳,放线菌能分泌一系列的胞外酶并参与难分解碳的降解过程(McCarthy et al., 1992),因此生物质炭的输入会促进放线菌的生长(表 3)。本研究中,制备生物质炭的温度因素在添加凋落物条件下对微生物群落组成影响显著(表 3)。BC750比BC350含有更多的难分解碳,革兰氏阳性细菌作为一种贫养群落利用难分解有机质的能力较强(Kramer et al., 2008; Diedhiou et al., 2009),使S+L+BC750革兰氏阳性细菌的丰度显著高于S+L+BC350。S+L+BC750土壤CO2排放主要集中于培养前期阶段(表 2),且凋落物的分解占主导地位; 培养后期阶段凋落物的分解减少,可能导致真菌的丰度降低。
5 结论在不同凋落物条件下(未添加凋落物和添加凋落物),生物质炭输入在培养前期阶段促进了杉木人工林土壤CO2排放,后期则产生抑制作用; 生物质炭输入对土壤PLFA总量无显著影响,但改变了微生物群落组成;凋落物的存在改变了土壤CO2排放趋势,显著增加了土壤CO2累积排放量; 凋落物使土壤PLFA总量显著增加,并使真菌丰度显著上升。
| [1] |
陈法霖, 郑华, 欧阳志云, 等. 2011. 土壤微生物群落结构对凋落物组成变化的响应. 土壤学报, 48 (3)
:603–611.
( Chen F L, Zheng H, Ouyang Z Y, et al.2011. Responses of microbial community structure to the leaf litter composition. Acta Pedologica Sinica, 48 (3) :603–611 . [in Chinese] ) (  0) 0)
|
| [2] |
谢祖彬, 刘琦, 许燕萍, 等. 2011. 生物炭研究进展及其研究方向. 土壤, 43 (6)
:857–861.
( Xie Z B, Liu Q, Xu Y P, et al.2011. Advances and perspectives of biochar research. Soils, 43 (6) :857–861 . [in Chinese] ) (  0) 0)
|
| [3] |
尹云锋, 张鹏, 雷海迪, 等. 2014. 不同热解温度对生物质炭化学性质的影响. 热带作物学报, 35 (8)
:1496–1500.
( Yin Y F, Zhang P, Lei H D, et al.2014. Influence of different pyrolysis temperature on chemical properties of biochar. Chinese Journal of Tropical Crops, 35 (8) :1496–1500 . [in Chinese] ) (  0) 0)
|
| [4] |
张, 高人, 杨玉盛, 等. 2010. 万木林自然保护区不同林分土壤可溶性有机氮含量. 应用生态学报, 21 (7)
:1635–1640.
( Zhang B, Gao R, Yang Y S, et al.2010. Soil soluble organic nitrogen content in different forest stands in Wanmulin Nature Reserve. Chinese Journal of Applied Ecology, 21 (7) :1635–1640 . [in Chinese] ) (  0) 0)
|
| [5] |
郑璐嘉, 黄志群, 何宗明, 等. 2015. 林龄, 叶龄对亚热带杉木人工林碳氮稳定同位素组成的影响. 林业科学, 51 (1)
:22–28.
( Zheng L J, Huang Z Q, He Z M, et al.2015. Influence of forest and foliar ages on the composition of stable carbon and nitrogen isotope of Cunninghamia lanceolata in Subtropic China. Scientia Silvae Sinicae, 51 (1) :22–28 . [in Chinese] ) (  0) 0)
|
| [6] |
Ameloot N, De Neve S, Jegajeevagan K, et al.2013. Short-term CO2 and N2O emissions and microbial properties of biochar amended sandy loam soils. Soil Biology and Biochemistry, 57 :401–410
.
( 0) 0)
|
| [7] |
Ameloot N, Sleutel S, Das K C, et al.2015. Biochar amendment to soils with contrasting organic matter level: effects on N mineralization and biological soil properties. Global Change Biology Bioenergy, 7 (1)
:135–144
.
( 0) 0)
|
| [8] |
Bamminger C, Marschner B, Jüschke E.2014. An incubation study on the stability and biological effects of pyrogenic and hydrothermal biochar in two soils. European Journal of Soil Science, 65 (1)
:72–82
.
( 0) 0)
|
| [9] |
Bergemn S P, Bradley R L, Munson A, et al.2013. Physico-chemical and functional characteristics of soil charcoal produced at five different temperatures. Soil Biology and Biochemistry, 58 :140–146
.
( 0) 0)
|
| [10] |
Chen J H, Liu X Y, Zheng J W, et al.2013. Biochar soil amendment increased bacterial but decreased fungal gene abundance with shifts in community structure in a slightly acid rice paddy from Southwest China. Applied Soil Ecology, 71 :33–44
.
( 0) 0)
|
| [11] |
Denef K, Roobroeck D, Wadu M C W M, et al.2009. Microbial community composition and rhizodeposit-carbon assimilation in differently managed temperate grassland soils. Soil Biology and Biochemistry, 41 (1)
:144–153
.
( 0) 0)
|
| [12] |
Diedhiou S, Dossa E L, Badiane A N, et al.2009. Decomposition and spatial microbial heterogeneity associated with native shrubs in soils of agroecosystems in semi-arid Senegal. Pedobiologia, 52 (4)
:273–286
.
( 0) 0)
|
| [13] |
Drake J A, Carrucan A, Jackson W R, et al.2015. Biochar application during reforestation alters species present and soil chemistry. Science of the Total Environment, 514 :359–365
.
( 0) 0)
|
| [14] |
Falkowski P G, Fenchel T, Delong E F.2008. The microbial engines that drive Earth’s biogeochemical cycles. Science, 320 (5879)
:1034–1039
.
( 0) 0)
|
| [15] |
Farrell M, Kuhn T K, Macdonald L M, et al.2013. Microbial utilisation of biochar-derived carbon. Science of the Total Environment, 465 :288–297
.
( 0) 0)
|
| [16] |
Frostegård Å, Bååth E.1996. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil. Biology and Fertility of Soils, 22 (1)
:59–65
.
( 0) 0)
|
| [17] |
Frostegård Å, Tunlid A, Bååth E.2011. Use and misuse of PLFA measurements in soils. Soil Biology and Biochemistry, 43 (8)
:1621–1625
.
( 0) 0)
|
| [18] |
Gomez J D, Denef K, Stewart C E, et al.2014. Biochar addition rate influences soil microbial abundance and activity in temperate soils. European Journal of Soil Science, 65 (1)
:28–39
.
( 0) 0)
|
| [19] |
Joseph S D, Camps-Arbestain M, Lin Y, et al.2010. An investigation into the reactions of biochar in soil. Australian Journal of Soil Research, 48 (7)
:501–515
.
( 0) 0)
|
| [20] |
Keith A, Singh B, Singh B P.2011. Interactive priming of biochar and labile organic matter mineralization in a smectite-rich soil. Environmental Science and Technology, 45 (22)
:9611–9618
.
( 0) 0)
|
| [21] |
Kennedy A C, Smith K L.1995. Soil microbial diversity and the sustainability of agricultural soils. Plant and Soil, 170 (1)
:75–86
.
( 0) 0)
|
| [22] |
Kramer C, Gleixner G.2008. Soil organic matter in soil depth profiles: distinct carbon preferences of microbial groups during carbon transformation. Soil Biology and Biochemistry, 40 (2)
:425–433
.
( 0) 0)
|
| [23] |
Kuzyakov Y, Subbotina I, Chen H Q, et al.2009. Black carbon decomposition and incorporation into soil microbial biomass estimated by 14C labeling. Soil Biology and Biochemistry, 41 (2)
:210–219
.
( 0) 0)
|
| [24] |
Landesman W J, Dighton J.2010. Response of soil microbial communities and the production of plant-available nitrogen to a two-year rainfall manipulation in the New Jersey Pinelands. Soil Biology and Biochemistry, 42 (10)
:1751–1758
.
( 0) 0)
|
| [25] |
Lehmann J, Gaunt J, Rondon M.2006. Bio-char sequestration in terrestrial ecosystems-a review. Mitigation and Adaptation Strategies for Global Change, 11 (2)
:395–419
.
( 0) 0)
|
| [26] |
Lehmann J, Rillig M C, Thies J, et al.2011. Biochar effects on soil biota-a review. Soil Biology and Biochemistry, 43 (9)
:1812–1836
.
( 0) 0)
|
| [27] |
Liang B, Lehmann J, Sohi S P, et al.2010. Black carbon affects the cycling of non-black carbon in soil. Organic Geochemistry, 41 (2)
:206–213
.
( 0) 0)
|
| [28] |
Maestrini B, Herrmann A M, Nannipieri P, et al.2014. Ryegrass-derived pyrogenic organic matter changes organic carbon and nitrogen mineralization in a temperate forest soil. Soil Biology and Biochemistry, 69 :291–301
.
( 0) 0)
|
| [29] |
Mašek O, Brownsort P, Cross A, et al.2013. Influence of production conditions on the yield and environmental stability of biochar. Fuel, 103 (1)
:151–155
.
( 0) 0)
|
| [30] |
McCarthy A J, Williams S T.1992. Actinomycetes as agents of biodegradation in the environment-a review. Gene, 115 (1/2)
:189–192
.
( 0) 0)
|
| [31] |
Novak J M, Busscher W J, Watts D W, et al.2012. Biochars impact on soil-moisture storage in an ultisol and two aridisols. Soil Science, 177 (5)
:310–320
.
( 0) 0)
|
| [32] |
Novak J M, Busscher W J, Watts D W, et al.2010. Short-term CO2 mineralization after additions of biochar and switchgrass to a Typic Kandiudult. Geoderma, 154 (3/4)
:281–288
.
( 0) 0)
|
| [33] |
Prayogo C, Jones J E, Baeyens J, et al.2014. Impact of biochar on mineralisation of C and N from soil and willow litter and its relationship with microbial community biomass and structure. Biology and Fertility of Soils, 50 (4)
:695–702
.
( 0) 0)
|
| [34] |
Ringelberg D B, Stair J O, Almeida J, et al.1997. Consequences of rising atmospheric carbon dioxide levels for the belowground microbiota associated with white oak. Journal of Environmental Quality, 26 (2)
:495–503
.
( 0) 0)
|
| [35] |
Sohi S P, Krull E, Lopez-Capel E, et al.2010. A review of biochar and its use and function in soil. Advances in Agronomy, 105 (1)
:47–82
.
( 0) 0)
|
| [36] |
Swallow M, Quideau S A, MacKenzie M D, et al.2009. Microbial community structure and function: the effect of silvicultural burning and topographic variability in northern Alberta. Soil Biology and Biochemistry, 41 (4)
:770–777
.
( 0) 0)
|
| [37] |
Watzinger A, Feichtmair S, Kitzler B, et al.2014. Soil microbial communities responded to biochar application in temperate soils and slowly metabolized 13C-labelled biochar as revealed by 13C-PLFA analyses: results from a short-term incubation and pot experiment. European Journal of Soil Science, 65 (1)
:40–51
.
( 0) 0)
|
| [38] |
White D C, Davis W M, Nickels J S, et al.1979. Determination of the sedimentary microbial biomass by extractible lipid phosphate. Oecologia, 40 (1)
:51–62
.
( 0) 0)
|
| [39] |
Whitman T, Enders A, Lehmann J.2014. Pyrogenic carbon additions to soil counteract positive priming of soil carbon mineralization bplants. Soil Biology and Biochemistry, 73 :33–41
.
( 0) 0)
|
| [40] |
Zavalloni C, Alberti G, Biasiol S, et al.2011. Microbial mineralization of biochar and wheat straw mixture in soil: a short-term study. Applied Soil Ecology, 50 (1)
:45–51
.
( 0) 0)
|
| [41] |
Zimmerman A R, Gao B, Ahn M Y.2011. Positive and negative carbon mineralization priming effects among a variety of biochar-amended soils. Soil Biology and Biochemistry, 43 (6)
:1169–1179
.
( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52

