文章信息
- 任嘉红, 李浩, 刘辉, 叶建仁, 吴小芹
- Ren Jiahong, Li Hao, Liu Hui, Ye Jianren, Wu Xiaoqin
- 吡咯伯克霍尔德氏菌JK-SH007对杨树根际微生物数量及功能多样性的影响
- Influence of Burkholderia pyrrocinia JK-SH007 on the Microbial Population and Functional Diversity of Microbial Communities in the Rhizosphere Soil of Poplar
- 林业科学, 2016, 52(5): 126-133
- Scientia Silvae Sinicae, 2016, 52(5): 126-133.
- DOI: 10.11707/j.1001-7488.201605015
-
文章历史
- 收稿日期:2014-10-13
- 修回日期:2015-10-12
-
作者相关文章
2. 长治学院生物科学与技术系 长治 046011
2. Department of Biological Science and Technology, Changzhi College Changzhi 046011
杨树溃疡病是一类危害严重的枝干病害,近年来大面积发生,严重威胁我国杨树产业的发展(黄烈健等,2003; 张星耀等,2003; 王勇等,2008)。生物防治是国内外植物病害防治的重要手段和发展方向。利用有益微生物进行植物病虫害的生物防治是一项经济、有效、可持续的生防技术途径,已成为植物病虫害综合治理的重要手段(叶建仁等,2013)。洋葱伯克霍尔德氏菌(Burkholderia cepacia)的许多菌株具有生物防治、促进植物生长、生物修复等功能,近年来在植物病害防治中发挥了重要作用(Parra-Cota et al.,2014; Singh et al.,2013)。随着微生物分类技术的不断完善,目前研究认为该类微生物是一个具有17个相近种的复合群体,称为洋葱伯克霍尔德氏菌群(B. cepacia complex,Bcc)(Vanlaere et al.,2009; Agnoli et al.,2012)。自20世纪80年代初,人们陆续发现Bcc部分种在医院环境中存在,是人类条件致病菌(张立新等,2008)。因此,人们认为以Bcc活菌开发的生物农药需重新进行生物安全性评价(叶建仁等,2013)。
在前期研究中,笔者从杨树树体干部分离获得1株杨树溃疡病高效生防菌吡咯伯克霍尔德氏菌(B. pyrrocinia)JK-SH007,隶属于Bcc群的基因型Ⅸ,该菌株具有内生性,对杨树溃疡病具有一定抗性,而且对杨树具有明显的促生长作用。前期已采用BCESM和cblA 毒力基因特异性PCR,洋葱(Allium cepa)、烟草(Nicotiana sp.)及苜蓿(Medicago sp.)模型等Bcc常用安全性检测技术对其毒性进行了初步检测,表明该菌株是一株有潜力的安全生防菌株(Ren et al.,2011)。但许多研究表明,引入大量外源微生物对植物根际微生态系统会产生一定的影响。Bcc的部分菌株是人类条件致病菌,考虑到将大量Bcc活细胞释放到环境中有可能给生态环境中的其他生物群体(微生物、植物等)带来潜在风险,为此,吡咯伯克霍尔德氏菌JK-SH007对环境微生物群落结构与功能的冲击和对非靶标生物的影响也应该成为其环境生态安全性评价的基本内容(叶建仁等,2013)。基于此,本研究以引入杨树溃疡病高效生防菌吡咯伯克霍尔德氏菌JK-SH007菌株的土壤为材料,分别采用传统的微生物培养、Biolog ECO 微孔板法和生物化学分析等手段研究引入该菌株对杨树根际土壤微生物种群数量、结构与功能以及土壤酶活性的影响,以阐明该菌株的引入所产生的微生态效应,评估其生物安全性。
1 材料与方法 1.1 材料 1.1.1 供试菌株吡咯伯克霍尔德氏菌JK-SH007,由本实验室从杨树干部分离筛选获得,保藏于中国典型培养物保藏中心CCTCC(保藏号M 209028,保藏日期 2009年2月18日)。
1.1.2 供试植物美洲黑杨(Populus deltoides)1年生盆栽实生苗。
1.1.3 培养基1)发酵培养基(NB): 牛肉膏3 g,蛋白胨10 g,NaCl 5 g,水1 000 mL,pH7.2~7.4。2)细菌分离及活化培养基(NA): 牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15~20 g,水1 000 mL,pH7.2~7.4。3)高氏1号培养基(放线菌): 可溶性淀粉20 g,KNO3 1 g,NaCl 0.5 g,K2HPO4·3H2O 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,琼脂15~20 g,水1 000 mL,pH7.4~7.6。4)察氏培养基(真菌): NaNO3 2 g,K2HPO4 1 g,KCl 0.5 g,MgSO4 0.5 g,FeSO4 0.01 g,蔗糖30 g,琼脂15~20 g,水1 000 mL;用前加入0.3%灭菌乳酸,使pH降为4.5。
1.2 方法 1.2.1 盆栽试验设计将JK-SH007菌株活化2~3次后,接种于NB培养基中,30 ℃,180 r·min-1摇培24 h。发酵液(4 ℃,6 000 r·min-1)离心5 min,用无菌磷酸缓冲液(0.01 mol·L-1,pH7.2)润洗菌体2~3次后,用缓冲液调节菌悬液(1×108cfu·mL-1)制成接种剂。选择长势一致的1年生盆栽美洲黑杨实生苗作为接种材料,每盆1株。将菌液采用灌根的方式缓慢接种于杨树根表面,接种量为每株20 mL,并以等量无菌缓冲液为对照。盆中基质为土壤、沙和蛭石(体积比为2:1:1)混合物。其中,土壤采自南京林业大学后山,pH7.59,有机质含量2.75 g·kg-1。每处理30个重复,置于温室统一管理,光照为12 h·d-1,适时浇水。分别于接种后10,20,30,60,90,120,150,180天取盆栽苗的根际土壤,每处理随机取样3个重复,混合后带回实验室根据不同试验目的采取不同处理。
1.2.2 土壤中微生物数量测定采用稀释梯度平板法进行土壤样品中细菌、真菌和放线菌的数量测定(赵斌等,2003)。其中,细菌采用NB培养基,真菌采用察氏培养基,放线菌采用高氏1号培养基。稀释分离时,真菌采用10-2,10-3,10-43个浓度梯度; 细菌和放线菌采用10-3,10-4,10-53个浓度梯度。置28 ℃培养,分别于培养2,3,5天后进行细菌、真菌、放线菌计数,并换算出每克干土中各微生物的数量。
1.2.3 土壤酶活性测定对采集土样分别进行酸性磷酸酶、碱性磷酸酶、转化酶及脱氢酶活性的测定。其中,土壤磷酸酶的测定采用苯磷酸二钠法,土壤转化酶采用关松荫(1986)测定方法,土壤脱氢酶的测定参考中国科学院南京土壤研究所(1985)的方法。
1.2.4 杨树根际土壤微生物群落功能多样性微生物群落功能多样性应用Biolog ECO微孔板测定。其中,微生物整体活性指标采用微平板每孔颜色平均变化率(AWCD)来描述; 并采用温育96 h的数据进行微生物种群功能多样性分析,用Shannon、Simpson和MeIntosh等多样性指数计算土壤微生物碳源利用多样性,来反映出土壤微生物功能多样性(Garland et al.,1991; Zak et al.,1994; 时鹏等,2010; 余贤美等,2014)。
2 结果与分析 2.1 JK-SH007对杨树根际微生物种群数量的影响在温室培养条件下,接菌后美洲黑杨根际土壤微生物数量动态变化如图 1所示。从图 1a可以看出,JK-SH007接种后第10天,美洲黑杨根际细菌数量为1.59×109cfu·g-1干土,明显高于对照(9.78×108cfu·g-1干土),其原因可能与人工引入大量JK-SH007菌体细胞相关; 接种10天后,随着时间的延长,接种处理杨树根际细菌数量开始明显低于CK; 90天时,接种处理的根际细菌数量开始高于CK,120天时,则明显高于CK,且差异显著; 在接种后第150天,接种处理和对照组的细菌总数均达到峰值,分别是3.36×109和2.27×109cfu·g-1,可能是该时间段(120~150天)温度适宜,植物生长进入高峰期,根系分泌物增加,营养丰富,微生物代谢速率增加、生长繁殖加快,因此微生物总数达到该时间段内的最大值;接种后180天,接菌处理的可培养细菌数量依然高于对照,但差异减小。以上结果说明美洲黑杨接种生防细菌JK-SH007能显著提高根际土壤中细菌数量,但随着时间的延长,这种作用显著降低。前期研究表明JK-SH007菌株对杨树有明显的促生长作用,其机制尚不清楚(Ren et al.,2011)。土壤中细菌占微生物总量90%以上,因此以上结果表明在杨树根际接种生防细菌JK-SH007后,其极有可能通过显著提高杨树根际土壤中微生物的总量来改善土壤环境,进而对杨树的生长起到一定的促进作用,但这种促进作用程度的多少还有待于进一步探讨。
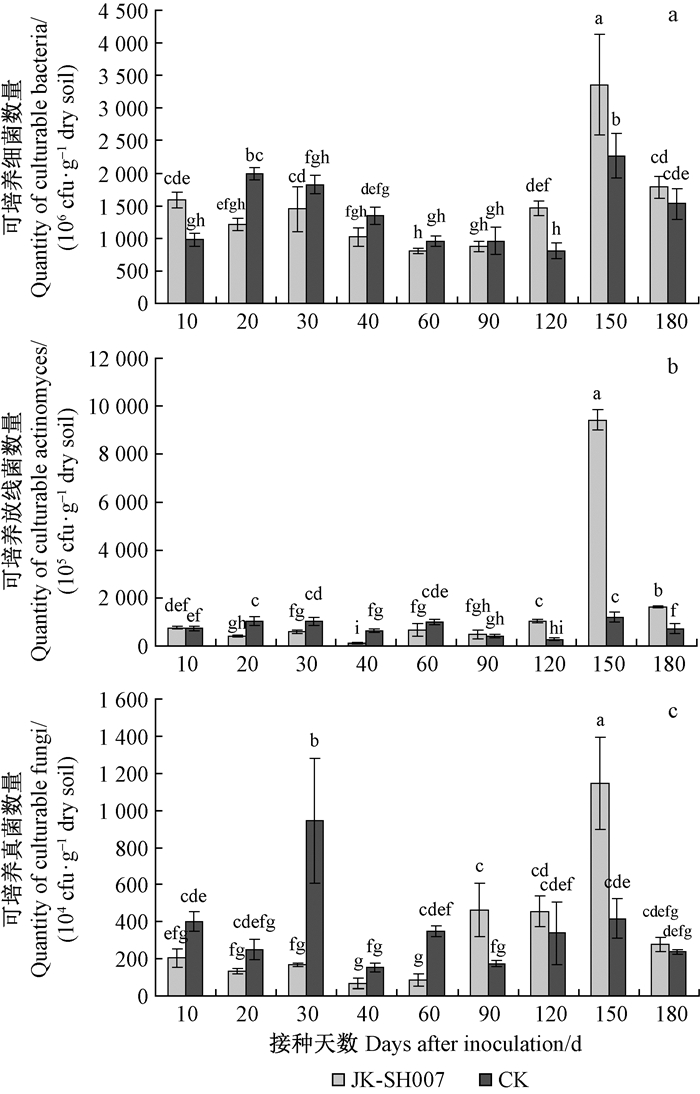
|
图 1 美洲黑杨根际土壤可培养微生物数量的变化 Fig. 1 Variations in the number of culturable microorganisms in rhizosphere soil of P. deltoides |
在整个测试期间,接菌后美洲黑杨根际放线菌数量产生了明显变化(图 1b)。在接种第10天时接种处理根际土壤放线菌数量为7.50×107cfu·g-1干土,高于CK(7.30×107cfu·g-1干土); 随着时间的延长,90天前放线菌数量均低于对照; 从90天起接种处理开始高于对照,到150天时显著高于对照,放线菌数量达到 9.42×108 cfu·g-1;至180天时,接种处理的根际放线菌数量显著降低,但仍明显高于对照。
图 1c表明,接菌处理的美洲黑杨根际真菌数量在接种第90天前均低于CK; 90天后,则明显高于CK,150天时达到峰值(1.14×107cfu·g-1干土),与对照(4.17×106cfu·g-1干土)差异显著; 而180天时,处理之间真菌数量均降低,且差异逐渐减小。
由以上结果可以看出,在美洲黑杨根表面接种吡咯伯克霍尔德氏菌JK-SH007对宿主根际土壤微生物(细菌、真菌、放线菌)的数量增长有一定的促进作用,长期的变化趋势基本相似; 但这种促进作用随着接种时间的延长而逐渐减弱。另外,该作用是否还进而影响到根际土壤微生物群落结构还有待进一步的研究。
2.2 JK-SH007菌株对杨树根际土壤酶活性的影响 2.2.1 磷酸酶活性变化在杨树根际接种JK-SH007菌株后,磷酸酶的活性动态变化如图 2a,b所示。从图 2a可以看出,接种30天时,土壤酸性磷酸酶的活性明显高于未接种处理;随着时间的延长,接种处理土壤酸性磷酸酶的活性迅速降低,至120天后,与对照几乎持平。而且对照组土壤的酸性磷酸酶活性在整个监测期间变化微小,无差异性,说明外界温度、湿度等因子的变化对杨树根际土壤酸性磷酸酶的活性影响甚微。从图 2b可以看出,接种处理显著提高了土壤碱性磷酸酶的活性。在整个检测期间,接种处理的碱性磷酸酶的活性均显著高于CK。土壤磷酸酶活性的提高能够改善土壤中速效磷的供应,该结果也可说明杨树根际引入JK-SH007菌株促进了杨树根际土壤中难溶性有机磷的分解。
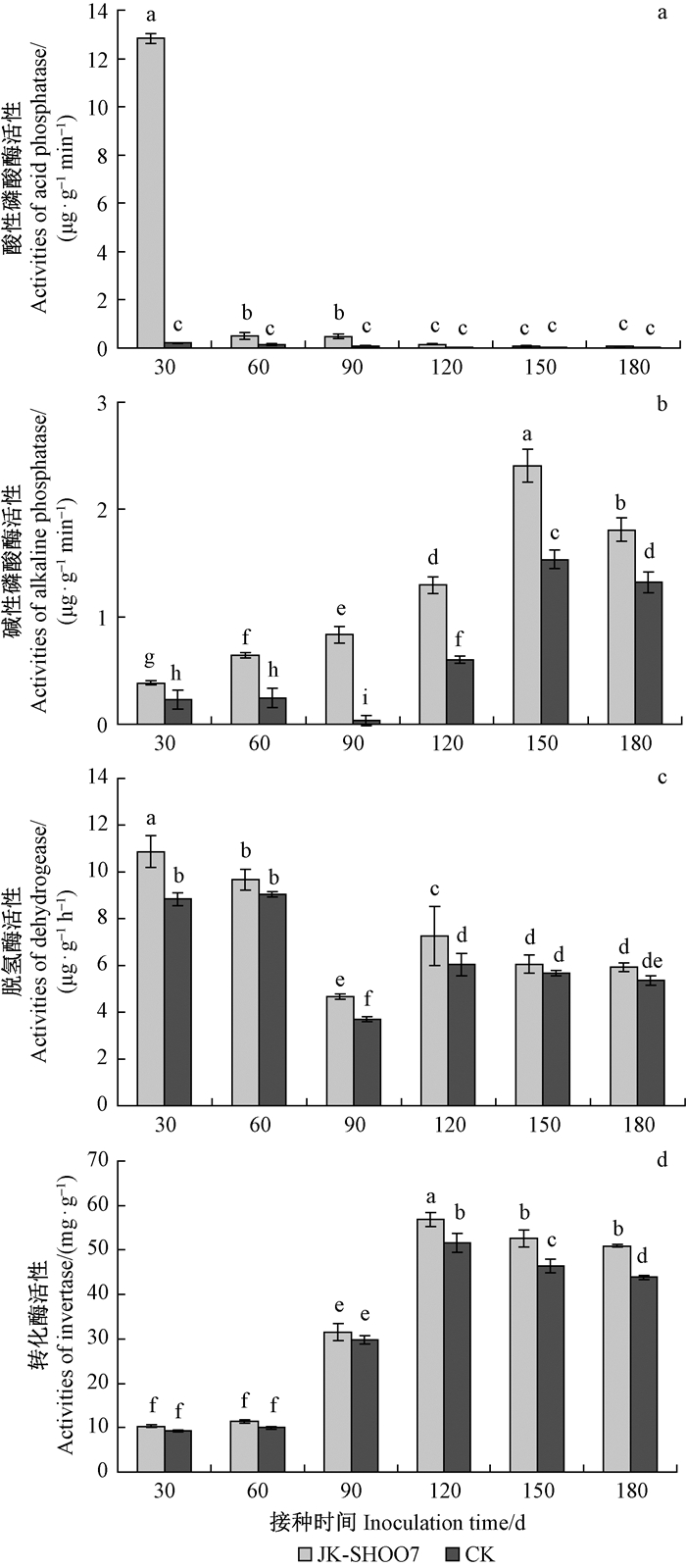
|
图 2 JK-SH007对土壤酶活性的影响 Fig. 2 Effect of introduced antagonistic strain JK-SH007 on the activities of enzyme in the soil |
从图 2c可以看出,JK-SH007对杨树根际土壤脱氢酶的活性有一定的影响。30天时,接种处理土壤脱氢酶的活性高于对照,且差异显著; 60天时虽高于对照,但无差异; 90天和120天时,均高于对照,差异显著; 150,180天时,仍高于对照,但差异不明显。以上结果说明,引入生防菌JK-SH007对杨树根际土壤脱氢酶的活性也具有一定的促进作用。
2.2.3 转化酶活性变化从图 2d可以看出JK-SH007对根际土壤转化酶的活性有一定的影响。在接种期前期(90天前),接种处理转化酶的活性高于对照,但无差异;至120天时,接种处理酶活性达到峰值(56.87 mg·g-1),高于未接种处理(51.68 mg·g-1),二者存在显著差异;随后酶活性逐渐下降,但接种处理仍明显高于对照。以上结果说明,引入生防菌JK-SH007对杨树根际土壤转化酶的活性有一定的促进作用。转化酶活性的提高对植物的生长发育起积极的促进作用,表明JK-SH007对杨树生长的促进作用可能与土壤转化酶活性的提高有一定的相关性。
2.3 BIOLOG方法对杨树根际微生物种群的分析 2.3.1 JK-SH007菌株对杨树根际微生物活性的影响AWCD值随时间变化,是评价微生物整体活性的一个有效指标,其终值与土壤微生物群落中能利用单一碳源的微生物的数目和种类有关。土壤微生物种类越多则能利用单一碳源的种类也越多,而能利用碳源的微生物数量决定利用程度,即微生物数量越多,碳源利用程度越高。从图 3可见,杨树根际接种JK-SH007后不同时间段,采用Biolog生态板测定的不同土样 AWCD 值总体都呈“先上升后稳定”趋势,基本在96 h趋于平衡。在整个测试期间,除了在接种后30,90天时接种处理和未接种处理的AWCD值相当外,接种后10,20,60,120,150,180天时接种处理均高于CK。以上结果表明,接种JK-SH007能够提高杨树根际土壤微生物群落的活性及微生物对碳源的利用率,增加微生物结构功能的多样性。
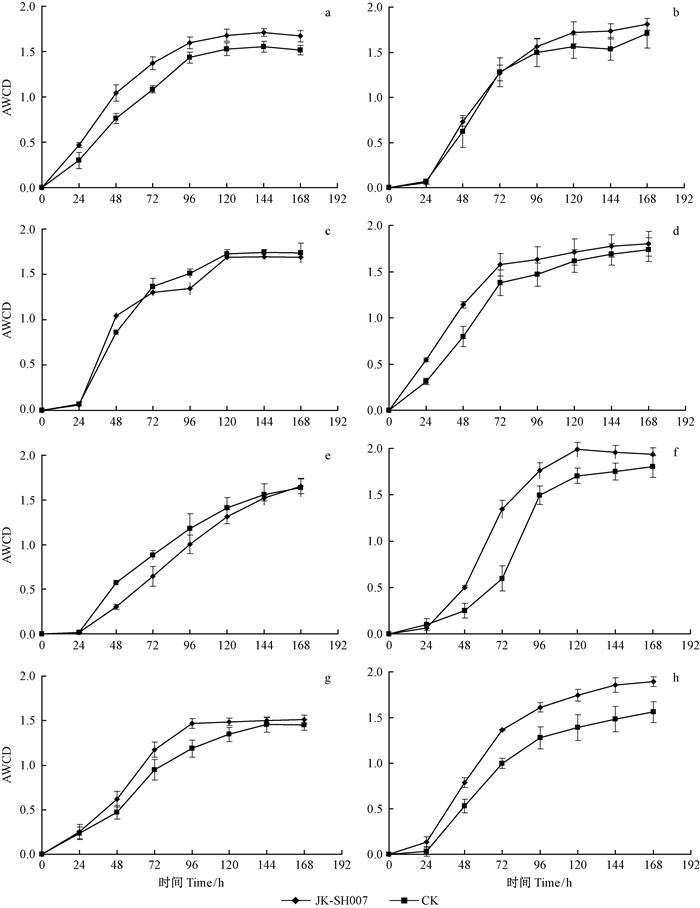
|
图 3 杨树根际土壤微生物培养过程中AWCD动态变化 Fig. 3 Dynamic changes of AWCD during cultivation of soil microorganism in rhizosphere soil of Populus deltoides a, b, c, d, e, f, g, h: 分别指接种后10, 20, 30, 60, 90, 120, 150, 180天 The 10th, 20th, 30th, 60th, 90th, 120th, 150th, 180th day after inoculation, respectively. |
生物多样性指数描述了生物的类型数和均匀度,在一定程度上可反映生物群落的物种丰富程度及分配比例。其中,Shannon指数主要反映了群落中物种丰富度,Simpson指数较多地反映了群落中最常见的物种,而McIntosh指数则用来衡量群落物种的均一性。温育96 h的AWCD值可达到约50%的饱和度,且可获得最大差异性(Li et al.,2007)。因此,本研究以96 h 数据为基础,通过Shannon、Simpson和McIntosh多样性指数模型计算底物利用的多样性指数,用来分析JK-SH007对杨树根际微生物多样性的影响。
如表 1所示,在接种初期(10天),Simpson指数、Shannon指数和McIntosh指数之间均存在着一定差异(P<0.05),接种处理高于对照,说明在杨树根际引入JK-SH007初期,土壤微生物群落的物种丰富度和均一性增加; 接种20天时,接种处理与对照的3个指数无差异; 30天时接种处理Simpson指数、Shannon指数高于对照,但差异不明显,而McIntosh指数值低于对照; 60天时接种处理3个指数均高于对照,但差异不明显; 90天时,接种处理Simpson指数、Shannon指数低于对照,且差异显著,而McIntosh指数值低于对照,但无差异; 120,150,180天时,接种处理的Simpson指数、Shannon指数、McIntosh指数均高于对照,有一定差异,但差异不显著。以上结果与AWCD值的曲线变化趋势基本一致。
|
|
总之,在杨树根际引入生防菌JK-SH007在一定程度上可以增加宿主植物根际微生物的物种多样性,对土壤微生物种群结构和功能多样性产生一定的积极影响。但JK-SH007菌株对杨树根际土著微生物种群的影响有限,对种群的结构改变作用较小。这进一步说明JK-SH007菌株的施入不会对环境中土著微生物构成威胁或威胁较小。以上结果充分表明了该菌株的生物安全性,其环境风险是可控的,符合国际上公认的Bcc群菌株应用的准入条件。
3 结论本研究以引入杨树溃疡病生防菌吡咯伯克霍尔德氏菌JK-SH007菌株的盆栽美洲黑杨苗的根际土壤为材料,通过根际土土壤酶活性的测定,采用稀释涂布平板分离法、Biolog ECO微平板技术分析根际微生物群落多样性及结构特征,从多个方面分析JK-SH007菌株进入自然环境后的微生态效应,对其生物安全性做出科学评估。结果表明,JK-SH007菌株的引入能使杨树根际土壤酸性磷酸酶、碱性磷酸酶、脱氢酶和转化酶活性有所增强,尤其是碱性磷酸酶; 另外,该菌株的引入对杨树根际微生物数量和种群具有一定的影响,使种群结构产生波动,但随着时间的延长(180天),影响效应减弱。这些结果说明将杨树溃疡病生防菌株JK-SH007释放到环境中对土壤根际微生物群落结构是安全的。
4 讨论土壤微生物数量和土壤酶活性是影响根际土壤质量的主要因素,并对植物的生长起着至关重要的作用(Yelena et al.,2006)。土壤中的三大类群微生物(细菌、真菌和放线菌)数量和比例可以反映微生物群落大小和结构特征,它们与土壤肥力、土壤健康状况等密切相关(余贤美等,2014)。本研究中,引入吡咯伯克霍尔德氏菌JK-SH007菌株对盆栽杨树苗根际土壤的3大类群微生物的数量增长均具有一定的促进作用,但随着时间的延长,这种促进作用逐渐减弱。这也表明引入JK-SH007菌株对杨树的抗病促生作用是定殖于杨树根际和树体内部的菌体共同作用的结果,但其在杨树根际的作用可能要弱于其在杨树树体内的菌体所发挥的作用,即该菌株对杨树抗病促生作用的发挥极有可能主要是源于定殖于杨树内部的菌体。
土壤磷酸酶、脱氧酶和转化酶等是土壤中的重要酶。土壤酶活性的增强可促进植物根际土壤的代谢作用,从而导致土壤养分形态发生变化,提高土壤肥力和改善土壤性质,有利于提高植物根际土壤的生产力水平。本研究发现,在美洲黑杨根际接种JK-SH007菌株后,与对照相比,接种使土壤酸性磷酸酶、碱性磷酸酶、脱氢酶和转化酶酶活性有所增强,尤其是碱性磷酸酶。土壤酶活性的增强可提高杨树根际土壤的生产力水平,进而影响到杨树的生长,这与前期的研究结果相一致,即在杨树根部接种JK-SH007对宿主有明显的促生长作用(Ren et al.,2011)。另外,在前期研究中发现JK-SH007菌株在培养早期能分泌大量有机酸,但后期该能力有所降低(王小月,2015)。本文中所采用的盆栽苗基质中性偏碱(pH7.59),测定碱性磷酸酶较合适; 但考虑到该菌株的产有机酸能力有可能对根际土壤pH值产生影响,所以同时开展了酸性磷酸酶活性测定。本研究表明接种前期(30,60天)酸性磷酸酶活性较高,而碱性磷酸酶活性较低,表明JK-SH007菌株早期的产酸性能极有可能对根际微环境产生了较大影响,但随着接种时间的延长,JK-SH007菌株的这种产酸作用对根际的影响逐渐减小。该规律也表现在接种中后期,酸性磷酸酶活性很低,而碱性磷酸酶活性较高。因此笔者认为,在今后开展外源微生物引入对土壤磷酸酶活性影响的研究中,应该结合菌株的特性来开展,这样可以更完整地揭示问题的本质。
另外,微生物群落结构的变化直接影响到土壤的质量和健康状况,土壤微生物多样性指数反映了根际生物群落中物种的丰度及其各类型间的分布,多样性指数越高,土壤中微生物多样性越丰富,土壤微生态系统越复杂,功能越稳定(Rutgers et al.,1998; 余贤美等,2014)。 Biolog方法用于环境微生物结构和功能多样性的研究具有灵敏度高、分辨率强、测定简便等优点,而且由于不需要分离培养纯种微生物,可最大限度地保留微生物群落原有的代谢特征。本研究表明: 接种JK-SH007 后杨树根际土壤微生物的AWCD 值和土壤微生物多样性指数、功能多样性指数均有所变大,Shannon指数、Simpson指数、McIntosh 多样性指数与对照相比有一定差异,说明引入JK-SH007对杨树土壤微生物的整体活性有一定程度的促进作用,丰富了土壤微生物种群,对土壤微生物种群结构和功能多样性产生了积极影响,使杨树土壤微生态系统功能更加稳定。综合分析三大类群微生物(细菌、放线菌、真菌)的分离结果,进一步说明在杨树根际引入JK-SH007菌株在一定程度上能促进土壤微生物数量和种群的增加,并促进土壤酶活性的提高。但这种作用随着时间的延长而减弱,表明JK-SH007对杨树根际土壤中的其他微生物种群不构成潜在威胁,符合国际Bcc的准入原则。这同时也说明将杨树溃疡病生防菌吡咯伯克霍尔德氏菌JK-SH007菌株释放到环境中是安全可行的,本研究结果为该菌株对生态环境的影响及风险性评估提供了科学依据,为将来生防菌的开发应用奠定了基础。
| [1] |
关松荫. 1986. 土壤酶及其研究法. 北京: 农业出版社 .
( Guan S Y. 1986. Methods of soil enzymes. Beijing: Agriculture Publishing House . [in Chinese] ) |
| [2] |
黄烈健, 苏晓华. 2003. 我国杨树溃疡病研究进展. 世界林业研究, 16 (4)
:49–53.
( Huang L J, Su X H.2003. The advance of canker disease-resistance breeding in poplar. World Forest Research, 16 (4) :49–53 . [in Chinese] ) (  0) 0)
|
| [3] |
时鹏, 高强, 王淑平, 等. 2010. 玉米连作及其施肥对土壤微生物群落功能多样性的影响. 生态学报, 30 (22)
:6173–6182.
( Shi P, Gao Q, Wang S P, et al.2010. Effects of continuous cropping of corn and fertilization on soil microbial community functional diversity. Acta Ecologica Sinica, 30 (22) :6173–6182 . [in Chinese] ) (  0) 0)
|
| [4] |
王小月. 2015. 几株优良生防菌的田间应用及促生机制初探. 南京:南京林业大学硕士学位论文. ( Wang X Y. 2015. Field application of biocontrol bacteria and the plant growth promoting mechanisms. Nanjing:MS thesis of Nanjing Forestry University.[in Chinese]).[in Chinese]) |
| [5] |
王勇, 吴小芹. 2008. 苏北杨树黑斑型溃疡病的研究. 南京林业大学学报: 自然科学版, 32 (4)
:101–104.
( Wang Y, Wu X Q.2008. Study on black boltch canker of poplars in north Jiangsu. Journal of Nanjing Forestry University: Natural Sciences Edition, 32 (4) :101–104 . [in Chinese] ) (  0) 0)
|
| [6] |
叶建仁, 任嘉红, 李浩, 等. 2013. 洋葱伯克霍尔德氏菌及其在林木病害防治中的应用. 南京林业大学学报: 自然科学版, 37 (4)
:149–155.
( Ye J R, Ren J H, Li H, et al.2013. Application and its protect analysis for Burkholderia cepacia in forest disease control. Jounal of Nanjing Forestry University: Natural Sciences Edition, 37 (4) :149–155 . [in Chinese] ) (  0) 0)
|
| [7] |
余贤美, 安淼, 王海荣, 等. 2014. 枯草芽孢杆菌Bs-15对板栗土壤微生物种群数量及功能多样性的影响. 生态环境学报, 23 (4)
:598–602.
( Yu X M, An M, Wang H R, et al.2014. Influence of Bacillus subtilis Bs-15 on the microbial population and functional diversity of microbial communities in the chestnut soil. Ecology and Environmental Sciences, 23 (4) :598–602 . [in Chinese] ) (  0) 0)
|
| [8] |
张立新, 宋江华, 谢关林. 2008. 洋葱伯克氏菌基因型的鉴定及其在苜蓿模型上的毒力分析. 微生物学报, 48 (11)
:1145–1150.
( Zhang L X, Song J H, Xie G L.2008. Identification of the Burkholderia cepecia complex genomovars and their virulence in an alfafa infection model. Acta Microbiological Sinica, 48 (11) :1145–1150 . [in Chinese] ) (  0) 0)
|
| [9] |
张星耀, 骆有庆. 2003. 中国森林重大生物灾害. 北京: 中国林业出版社 .
( Zhang X Y, Luo Y Q. 2003. Major forest diseases and insect pests in China. Beijing: Chinese Forestry Publishing House . [in Chinese] ) |
| [10] |
赵斌, 何绍江. 2003. 微生物学实验. 北京: 科学出版社 .
( Zhao B, He S J. 2003. Microbiology experiment. Beijing: Science Press . [in Chinese] ) |
| [11] |
中国科学院南京土壤研究所微生物室. 1985. 土壤微生物研究法. 北京: 科学出版社 .
( Nanjing Soil Research Institute of Chinese Academy of Sciences. 1985. Methods for Soil Microorganism. Beijing: Science Press . [in Chinese] ) |
| [12] |
Agnoli K, Schwager S, Uehlinger S, et al.2012. Exposing the third chromosome of Burkholderia cepacia complex strains as a virulence plasmid. Molecular Microbiology, 83 (2)
:362–378
.
( 0) 0)
|
| [13] |
Garland J L, Mills A L.1991. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization. Applied and Environmental Microbiology, 57 (8)
:2351–2359
.
( 0) 0)
|
| [14] |
Li Z P, Wu X C, Chen B Y.2007. Changes in transformation of soil organic C and functional diversity of soil microbial community under different land uses. Agricultural Sciences in China, 6 (10)
:1235–1245
.
( 0) 0)
|
| [15] |
Parra-Cota F I, Peña-Cabriales J J, de los Santos-Villalobos S, et al.2014. Burkholderia ambifaria and B. caribensis promote growth and increase yield in grain amaranth (Amaranthus cruentus and A. hypochondriacus) by improving plant nitrogen uptake. PLoS ONE, 9 (2)
:e88094.
( 0) 0)
|
| [16] |
Ren J H, Ye J R, Liu H, et al.2011. Isolation and characterization of a new Burkholderia pyrrocinia strain JK-SH007 as a potential biocontrol agent. World Journal of Microbiology and Biotechnology, 27 (9)
:2203–2215
.
( 0) 0)
|
| [17] |
Rutgers M, Vańt V I, Wind B, et al.1998. Rapid method for assessing pollution-induced community tolerance in contaminated soil. Environmental Toxicology Chemistry, 17 (11)
:2210–2213
.
( 0) 0)
|
| [18] |
Singh R K, Malik N, Singh S.2013. Improved nutrient use efficiency increases plant growth of rice with the use of IAA-overproducing strains of endophytic Burkholderia cepacia strain RRE25. Microb Ecol, 66 (2)
:375–384
.
( 0) 0)
|
| [19] |
Vanlaere E, Baldwin A, Gevers D, et al.2009. Taxon K, a complex within the Burkholderia cepacia complex, comprises at least two novel species, Burkholderia contaminans sp. nov. and Burkholderia lata sp. nov. Int J Syst Evol Microbiol, 59 :102–111
.
( 0) 0)
|
| [20] |
Yelena V L, Fritzsche A, Chernyshova M P, et al.2006. Arsenic transformation by Azospirillum brasi lense Sp245 in association with wheat (Triticum aestivum L) roots. Plant and Soil, 286 (1)
:219–227
.
( 0) 0)
|
| [21] |
Zak J C, Willig M R, Moorhead D L, et al.1994. Functional diversity of microbial communities: a quantitative approach. Soil Biology and Biochemistry, 26 (9)
:1101–1108
.
( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52

