文章信息
- 徐永杰, 韩华柏, 王滑, 陈凌娜, 马庆国, 裴东
- Xu Yongjie, Han Huabai, Wang Hua, Chen Lingna, Ma Qingguo, Pei Dong
- 大巴山区核桃实生居群的坚果表型和遗传多样性
- Phenotypic and Genetic Diversities of Nuts of Walnut(Juglans regia) Populations Originated from Seedlings in Daba Mountains
- 林业科学, 2016, 52(5): 111-119
- Scientia Silvae Sinicae, 2016, 52(5): 111-119.
- DOI: 10.11707/j.1001-7488.20160513
-
文章历史
- 收稿日期:2015-12-31
- 修回日期:2016-02-03
-
作者相关文章
2. 湖北省林业科学研究院 武汉 430075;
3. 四川省林木种苗站 成都 610081;
4. 华中农业大学园艺林学学院 武汉 430070;
5. 中国林业科学研究院资源昆虫研究所 昆明 650224
2. Hubei Academy of Forestry Wuhan 430075 ;
3. Sichuan Forest Tree Seeds and Seedlings Service Chengdu 610081 ;
4. College of Horticulture and Forestry Sciences, Huazhong Agricultural University Wuhan 430070 ;
5. Research Institute of Resource Insects, Chinese Academy of Forestry Kunming 650224
大巴山区地处中国东部一级平原低地与西部二级高原山地交汇处,是南北气候的分水岭和自然环境的十字交叉带,世界自然基金会、《中国生物多样性保护行动计划》、《中国生物多样性研究报告》等均将此区列为中国生物多样性保护的关键地区和优先重点保护区域。该区域也是我国核桃(Juglans regia)重要产区。核桃栽培历史悠久,据20世纪70年代四川省青川县发掘的战国时期墓群(公元前307年)中出土的14枚核桃推测,核桃在该区域生长至少有2 300多年的历史(青川县志编纂委员会,1992)。丰富的生境条件(Peng et al.,2005)和悠久的栽培历史(Jarvis et al.,2008)以及长期的天然杂交、实生繁殖更新可能会形成丰富的遗传资源。近年来,随着核桃产业的不断发展,该区域大力推行良种化栽培,一些原有的实生农家类型和自然群体被改接为栽培品种,致使本地种质资源流失和破坏严重。因此,全面系统地研究该区域核桃实生居群特点,科学制定该区域核桃资源保护利用策略,对当前该区域资源开发利用显得尤为迫切和必要。
目前,种质资源的评价研究主要通过形态学标记、细胞学标记、分子标记和生化标记手段完成(Pop et al.,2013)。形态标记虽然直观有效,但常因环境影响而使研究结果重复性差(Kumar,1999)。分子标记虽不够直观,但不受环境和植物组织的影响,可以弥补形态标记的不足,是研究核桃实生居群特点的重要方法(Wang et al.,2015a)。鉴于分子标记和形态标记各自的优缺点,2种方法联用则被认为是行之有效的种质鉴定和分类方法(Fatahi et al.,2010;Pop et al.,2013;Wang et al.,2015b)。而分子标记技术中的SSR分子标记技术由于具有稳定性、共显性和信息量大等优点,其效率远远超越RFLP和RAPD标记,被广泛运用于核桃种质鉴定和居群遗传特点的研究中(Chen et al.,2014;王滑等,2007)。
由于实生居群在遗传变异和自然选择的双重作用下会产生多样的遗传信息,以实生居群作为试验材料,在居群水平进行多样性比较,可了解和掌握某一区域核桃资源的遗传背景和亲缘关系(王滑等,2007;Wang et al.,2015b)。到目前为止,对我国西部的新疆核桃实生居群(李超等,2011)、陕西核桃实生居群(李国田等,2011)和西南核桃实生居群(Wang et al.,2015b)的遗传特点均已有相关研究,而对南北结合部的大巴山区核桃实生居群坚果和遗传特点报道较少。因此,本文以该区域12个实生居群386株单株的坚果和叶片为试材,利用12个坚果表型性状和16对SSR引物进行居群多样性、遗传结构和居群间聚类分析,以期获得该区域核桃实生居群的坚果表型和遗传多样性特点,为制定该区域核桃资源保护与利用策略提供参考依据。
1 材料与方法 1.1 试材采集地的概况根据国家质量监督检验检疫总局第78号《地理标志产品保护规定》和中国经济林协会《中国经济林之乡命名工作暂行办法》授予“地理标志产品”和“核桃之乡”注重原产地的原则,本研究试材确定在大巴山区“中国核桃之乡”和“地理标志产品”所在县(市)及其周边县(市)中选取12个核桃实生居群采集[商洛居群(SL)位于秦岭与大巴山交界区,本研究暂将该居群归入大巴山区],单株为1个样本。12个核桃实生居群名称和采集样本容量见表 1。
|
|
20世纪80年代以前,我国核桃繁殖多以实生繁殖为主,到90年代嫁接技术才获得明显突破并应用于生产(冯连芬等,2006),因此树龄30年以上的大树基本上都是实生繁殖而来。本研究根据试验样品采集地林业部门相关资料,在核桃资源相对集中的区域,采取走访当地群众获取树龄、果实特异性等相关信息的方式,选择有特异性状树龄30年以上的原生实生核桃树为试材。每个样本采集40个大小基本一致、饱满的坚果,其中30个坚果用于表型性状测定,另外10个果实于当年10月经沙藏翌年3月播种,每样本播种5株,于5月上旬采集其中1株嫩叶作为提取DNA的试材。
1.3 试验方法 1.3.1 坚果表型性状测定6个坚果表型质量性状参照“核桃属特异性、一致性和稳定性(DUS)测试指南”(UPOV,1999)进行特征描述和赋值,测试指南中未列出的特征用“其他”表示(表 2)。坚果数量性状纵径、横径、侧径、单果质量、果壳厚及出仁率用游标卡尺、千分尺和天平(精度0.01 g)测得,计算坚果圆度。坚果圆度=(侧径+横径)/(2×纵径)。
|
|
1)DNA提取参照王滑等(2007)的方法。2)PCR扩增与毛细管电泳 利用NCBI数据库全部已知核桃Mbol基因组BAC文库克隆中下载的22 740条末端序列设计合成50对引物(陈凌娜等,2014),从中筛选出多态性较高的16对SSR引物进行DNA分析,引物WJR007,WJR031,WJR061,WJR069,WJR073,WJR100,WJR115,WJR202,WJR265,WJR281特征信息参见Chen等(2014),WJR291特征信息参见陈凌娜等(2014),其他6对引物特征信息见表 3。PCR反应扩增和毛细管电泳参照Chen等(2014)方法。
|
|
运用EXCEL和SAS 8.1软件统计坚果表型性状的平均值和标准差,用类平均法计算居群间的Manhattan距离并进行聚类分析。用性状的变异系数CV表示居群表型多样性水平(徐斌等,2015),并对其做Duncan 检验;对各性状观测值采用巢式设计方差分析比较居群间和居群内的差异显著性(李斌等,2002);用表型分化系数反映居群间表型分化程度(葛颂等,1988)。
用GenAlEx6软件计算等位基因数,用POPGENE version 1.32软件分析居群遗传多样性、遗传结构及各居群的遗传相似系数;用NTSYS2.1软件对遗传相似系数进行聚类分析。
2 结果与分析 2.1 坚果表型和遗传多样性 2.1.1 坚果表型多样性大巴山区核桃坚果4个数量性状多样性分析结果(表 4)表明: 该区域坚果圆度为0.58~1.11,平均0.89;单果质量为4.11~22.87 g,平均11.67 g;出仁率为27.42%~70.95%,平均47.50%;壳厚为0.55~2.38 mm,平均1.19 mm。由表 5可知: 10个表型性状变异程度存在显著差异(P < 0.05),其中变异程度最大的是沿缝合线纵切面形状,变异程度为55.57%;其次是垂直于缝合线纵切面形状,变异程度为51.94%;变异程度最小的为坚果圆度,为8.98%。12个居群内10个坚果表型性状变异系数平均值介于26.75%~34.36%之间,平均为30.60%,其中变异程度最大的是QC居群,为34.36%,显著高于JG和XS居群(分别为26.68%和26.75%)(P < 0.05)。
|
|
|
|
部分样品毛细管电泳图见图 1。12个核桃实生居群的遗传多样性分析见表 6。大巴山区核桃实生居群观察等位基因数(Na)介于4.94~8.13,平均为6.27;有效等位基因数(Ne)介于2.93~3.96,平均为3.28。Shannon指数介于1.112~1.546,平均为1.324;观察杂合度介于0.391~0.453,平均为0.437;期望杂合度介于0.612~0.718,平均为0.688。各居群丰富度和均匀度差异不大。其中BD居群观测等位基因数、Shannon指数、观察杂合度、期望杂合度均高于其他居群,说明其遗传多样性相对较高。

|
图 1 WJR291引物样品BD027(上)和QC07(下)毛细管电泳 Fig. 1 Capillary electrophoresis spectrum diagram at WJR291 primer of BD027 (above) and QC07(below) |
|
|
对12个核桃实生居群的10个表型性状进行巢式方差分析,计算出各分量占变异的比例(表 7)。其中居群内方差分量占总变异的91.85%,居群间方差分量占8.15%。居群间10个表型性状的表型分化系数范围1.38%~24.20%,平均为8.15%。10个表型性状分化最大的是单果质量,最小的是出仁率。10个性状的居群间变异均大于居群内,说明居群内变异是该区域坚果表型变异的主要来源。
|
|
从表 8可以看出,居群间近交系数(FIS)介于-0.024~0.898,平均为0.319,其中WAG-281位点表现出杂合子过剩现象。居群间遗传分化系数(FST)介于0.033 4~0.149 1,平均为0.063 2,说明有6.32%的遗传变异来源于居群间。各位点均存在基因流,平均为3.708,其中WAG-065位点基因流最大,为7.224,WAG-297位点基因流最小,为1.426。
|
|
利用核桃实生居群表型性状的Manhattan距离进行UPGMA聚类分析(图 2A)。 从图中看出,当居群间Manhattan距离为0.75时,12个居群分为3类,QC,WC,JG聚为一类,WX单独聚为一类,其他8个居群聚为一类。利用核桃实生居群间的遗传相似系数进行UPGMA聚类分析(图 2B),当遗传相似系数为0.910时,12个居群分为4类,QC,CT,SL,BD,JG,WC 6个居群聚为一类,BZ,XS,CK,BK 4个居群聚为一类,WX居群和JS居群分别单独为一类。2种聚类分析结果不完全一致,但均呈现出了与地理距离显著正相关的趋势(r(A)=0.523 21,r(B)=0.480 81,r(AB)=0.638 4,P < 0.05)。
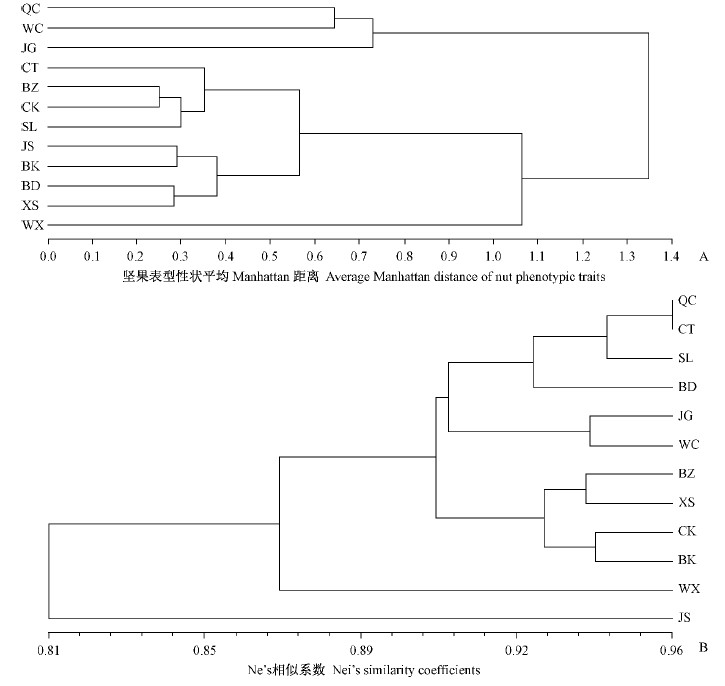
|
图 2 12个实生居群基于表型性状平均Manhattan距离(A)和Nei’s相似系数(B)的UPGMA聚类分析 Fig. 2 Cluster analyses of 12 walnut populations based on average Manhattan distance of nut phenotypic traits(A) and Nei’s similarity coefficients(B) using the UPGMA method |
前人对核桃坚果表型性状进行赋值后计算变异系数并进行比较的论述较少,而对坚果数量性状的研究较多,数量性状中变异幅度最大的多认为是单果质量(王金星等,2012;王滑,2010)。据报道,我国广泛种植的国家首批审定的16个核桃早实品种单果质量介于9.4~16.4 g之间(冯连芬等,2006;裴东等,2011),川西高山峡谷核桃单果质量介于6.07~20.7 g 之间(吴万波等,2007),西藏核桃单果质量变异幅度为6.5~22.5 g(王滑,2010),伊朗中部核桃单果质量6.0~15.2 g(Arzani et al.,2008),罗马尼亚西南部实生种群核桃单果质量介于6.8~18.4 g(Cosmulescu et al.,2012),以上这些区域均未报道单果质量小于6 g的坚果资源,而本研究区域坚果单果质量4.11~22.87 g之间,小于6 g的坚果具有一定比例。我国现行国标《核桃坚果等级》(GB/20398—2006)中要求单果质量越大等级越高,加之近年来无性系品种的推广,必然会导致小果型资源的流失,因此为维持核桃资源多样性,加快该区域小果型资源的保护显得尤为必要和迫切。
期望杂合度是反映种质资源遗传多样性的重要参考指标(徐刚标,2011)。本研究区域平均期望杂合度(He)为0.688,高于来自中国山西、四川、重庆和云南等地9个核桃居群平均水平(He=0.525)(Wang et al.,2008)和西藏核桃居群(He=0.586 4)(Wang et al.,2015a),而低于黑核桃(J. nigra)(He=0.793)(Victory et al.,2006)和核桃楸(J. mandshurica)(He=0.806)(Wang et al.,2008),与中国西藏泡核桃(J. sigillata)居群(He=0.705 7)(Wang et al.,2015a)相近,说明该区域核桃资源遗传多样性较高。
较高的表型和遗传丰富度得益于该区域特异的地理位置。该区域位于我国东部一级平原和西部二级高原的过渡地带,降雨量在700~1 500 mm之间,核桃资源在该区域垂直分布范围在250~1 800 m之间,多样的立地和气候环境形成的小气候是维持该区域资源多样性平衡(Lerner,1954)的重要原因之一。另外核桃是雌雄同株的风媒花树种(Gleeson,1982),传粉距离仅仅300 m 左右(韩唐则等,1996),因此,片段化分布会导致一定水平的遗传漂变(Wang et al.,2008),而居群内自花授粉也可能是居群间遗传多样性稳定的重要因素(Charlesworth et al.,1987)。
3.2 表型与遗传分化本研究区域12个居群间表型分化系数为0.081 5,遗传分化系数为0.063,说明居群内分化是该区域核桃资源变异的主要途径。其中居群间遗传分化系数低于中国8个核桃居群(FST=0.196)(王滑等,2007)、西藏核桃居群(FST=0.103)和泡核桃居群(FST=0.111)(Wang et al.,2015a),说明该区域核桃居群间的遗传分化水平较低。本研究检测到居群间较强的基因流(Nm=3.708),远高于王滑等(2007)检测的Nm=1.603。徐刚标(2011)认为种子扩散和花粉传播是植物基因流最主要的形式。由于大巴山区自古就是巴蜀文化与荆楚文化、巴蜀文化与汉中文化交流通道(邓先瑞,2002),核桃常作为馈赠亲友的礼物,因此种子传播可能是该区域核桃居群间分化较小的主要原因之一。除了种子传播外,人为驯化也是导致遗传分化系数(FST)低下的重要原因(Krutovsky et al.,2009)。作为我国传统的农业区(邓先瑞,2002),该区域的核桃多分布在田埂边、河流边或者房前屋后,较强的人为干扰也许是该区域核桃居群间分化较小的另一个重要原因。
近年来,良种无性系苗在该区域得到了广泛栽培,致使本地资源流失严重。为更好地保护现有核桃资源,建议尽快开展以核桃迁地保护或遗传改良为目的的种质资源保护收集工作。居群间变异反映居群对各种环境的适应性(庞广昌等,1995),因此,对于表型变异比较丰富的区域如QC居群,应及时采取就地和迁地相结合的保护策略。
由于本研究区域交通不便,采集实生大树样品提取DNA难以实现,本研究采用了实生大树种子播种苗叶片提取DNA的办法。采样过程中规避了近年来引种的已知核桃品种,并尽力规避通过“经济贸易、品种交换”等途径引入的本区域的实生种,但无法规避近几年来引入本区域已经始花的早实品种花粉对采样果实的影响,这也是本研究的局限之处。若加快本区域资源收集,并在资源收集基础上研究本区域资源多样性,其开发利用意义将更为明确。
4 结论大巴山区核桃资源丰富,坚果变异最丰富的区域是青川(QC)居群,坚果表型性状中变异程度最大的性状是沿缝合线纵切面形状,而遗传变异最丰富的是巴东(BD)居群;大巴山区核桃实生居群间坚果表型分化系数0.081 5,遗传分化系数0.063 2,说明居群内变异是该区域坚果表型和遗传变异的主要来源。利用坚果表型性状的Manhattan距离和遗传相似系数进行居群间聚类,结果不完全一致,但都呈现出与居群间地理距离正相关的趋势。
| [1] |
陈凌娜, 马庆国, 张俊佩, 等. 2014. 核桃BES-SSR的开发及在遗传多样性分析中的应用. 北京林业大学学报, 36 (6)
:24–29.
( Chen L N, Ma Q G, Zhang J P, et al.2014. BES-SSR markers in walnut and its application in genetic diversity analysis. Journal of Beijing Forestry University, 36 (6) :24–29 . [in Chinese] ) (  0) 0)
|
| [2] |
邓先瑞. 2002. 长江农业文化的自然生态条件. 华中师范大学学报: 自然科学版, 36 (4)
:512–515.
( Deng X R.2002. The natural ecological condition for the agricultural culture of the Yangtze basin. Journal of Central China Normal University: Natural Sciences, 36 (4) :512–515 . [in Chinese] ) (  0) 0)
|
| [3] |
冯连芬, 吕芳德, 张亚萍, 等. 2006. 我国核桃育种及其栽培技术研究进展. 经济林研究, 24 (2)
:69–73.
( Feng L F, Lü F D, Zhang Y P, et al.2006. Literature review of researches on breeding and cultivation techniques of Chinese walnut. Nonwood Forest Research, 24 (2) :69–73 . [in Chinese] ) (  0) 0)
|
| [4] |
葛颂, 王明庥, 陈岳武. 1988. 用同工酶研究马尾松群体的遗传结构. 林业科学, 24 (4)
:399–409.
( Ge S, Wang M X, Chen Y W.1988. Analysis of population genetic structure of Masson Pine by isozyme technique. Scientia Silvae Sinicae, 24 (4) :399–409 . [in Chinese] ) (  0) 0)
|
| [5] |
韩唐则, 罗培珍, 贾唤平, 等. 1996. 核桃人工辅助授粉试验. 果树科学, 13 (1)
:31–32.
( Han T Z, Luo P Z, Jia H P, et al.1996. The experiment of walnut pollination by manpower assistance. Journal of Fruit Science, 13 (1) :31–32 . [in Chinese] ) (  0) 0)
|
| [6] |
李斌, 顾万春, 卢宝明. 2002. 白皮松天然群体种实性状表型多样性研究. 生物多样性, 10 (2)
:181–188.
( Li B, Gu W C, Lu B M.2002. A study on phenotypic diversity of seeds and cones characteristics in Pinus bungeana. Biodiversity Science, 10 (2) :181–188 . [in Chinese] ) (  0) 0)
|
| [7] |
李超, 罗淑萍, 曾斌, 等. 2011. 新疆核桃种质资源遗传多样性的ISSR分析. 中国农业科学, 44 (9)
:1871–1879.
( Li C, Luo S P, Zeng B, et al.2011. Analysis of genetic diversity of germplasm resources of walnut (Juglans regia L.) revealed by ISSR in Xinjiang of China. Scientia Agricultura Sinica, 44 (9) :1871–1879 . [in Chinese] ) (  0) 0)
|
| [8] |
李国田, 艾呈祥, 张力思, 等. 2011. 核桃实生居群遗传多样性ISSR分析. 植物遗传资源学报, 12 (4)
:640–645.
( Li G T, Ai C X, Zhang L S, et al.2011. ISSR analysis of genetic diversity among seedling walnut (Juglans spp) populations.. Journal of Plant Genetic Resources, 12 (4) :640–645 . [in Chinese] ) (  0) 0)
|
| [9] |
庞广昌, 姜冬梅. 1995. 群体遗传多样性和数据分析. 林业科学, 31 (6)
:543–550.
( Pang G C, Jiang D M.1995. Population genetic diversity and data analysis. Scientia Silvae Sinicae, 31 (6) :543–550 . [in Chinese] ) (  0) 0)
|
| [10] |
裴东, 鲁新政. 2011. 中国核桃种质资源. 北京: 中国林业出版社 .
( Pei D, Lu X Z. 2011. Walnut germplasm resources in China. Beijing: China Forestry Publishing House. . [in Chinese] ) |
| [11] |
青川县志编纂委员会. 1992. 青川县志. 成都: 成都科技大学出版社 .
( Compilation Committee of Qingchuan County Annals. 1992. Qingchuan County Annals. Chengdu: Chengdu University of Science and Technology Press . [in Chinese] ) |
| [12] |
王滑, 郝俊民, 王宝庆, 等. 2007. 中国核桃8个天然居群遗传多样性分析. 林业科学, 43 (7)
:120–124.
( Wang H, Hao J M, Wang B Q, et al.2007. SSR analysis of genetic diversity of eight natural walnut populations in China. Scientia Silvae Sinicae, 43 (7) :120–124 . [in Chinese] ) (  0) 0)
|
| [13] |
王 滑. 2010. 西藏核桃种质资源遗传多样性研究. 北京:中国林业科学研究院博士学位论文. ( Wang H. 2010. Genetic diversity of germplasm resources on walnut in Tibet region. Beijing: PhD thesis of Chinese Academy of Forestry.[in Chinese][in Chinese]) |
| [14] |
王金星, 潘刚, 王滑, 等. 2012. 西藏核桃叶片和坚果表型多样性及其相关关系研究. 林业科学研究, 25 (2)
:236–240.
( Wang J X, Pan G, Wang H, et al.2012. The phenotypic polymorphism of walnut leaves and nuts and their correlations in Tibet. Forest Research, 25 (2) :236–240 . [in Chinese] ) (  0) 0)
|
| [15] |
吴万波, 韩华柏, 朱益川, 等. 2007. 川西高山峡谷区核桃种质资源表型多样性调查. 经济林研究, 25 (2)
:42–44.
( Wu W B, Han H B, Zhu Y C, et al.2007. Investigation of phenotypic diversity of walnut germplasm resources in the valley of western Sichuan. Nonwood Forest Research, 25 (2) :42–44 . [in Chinese] ) (  0) 0)
|
| [16] |
徐斌, 彭莉霞, 杨会肖, 等. 2015. 杜鹃红山茶叶片主要性状的遗传多样性分析. 植物研究, 35 (5)
:730–734.
( Xu B, Peng L X, Yang H X, et al.2015. Genetic diversity analysis for leaf main traits of Camellia azalea. Bulletin of Botanical Research, 35 (5) :730–734 . [in Chinese] ) (  0) 0)
|
| [17] |
徐刚标. 2011. 植物群体遗传学. 北京: 科学出版社 .
( Xu G B. 2011. Plant population genetics. Beijing: Science Press . [in Chinese] ) |
| [18] |
Arzani K, Mansouri-Ardakan H, Vezvaei A, et al.2008. Morphological variation among Persian walnut (Juglans regia) genotypes from central Iran. New Zealand Journal of Crop and Horticultural Science, 36 (3)
:159–168
.
( 0) 0)
|
| [19] |
Charlesworth D, Charlesworth B.1987. Inbreeding depression and its evolutionary consequences. Annual Review of Ecology and Systematics, 18 :237–268
.
( 0) 0)
|
| [20] |
Chen L N, Ma Q G, Chen Y K, et al.2014. Identification of major walnut cultivars grown in China based on nut phenotypes and SSR markers. Scientia Horticulturae, 168 :240–248
.
( 0) 0)
|
| [21] |
Cosmulescu S, Botu M.2012. Walnut biodiversity in south-western Romania resource for perspective cultivars. Pak J Bot, 44 (1)
:307–311
.
( 0) 0)
|
| [22] |
Fatahi R., Ebrahimi A, Zamani Z.2010. Characterization of some Iranians and foreign walnut genotypes using morphological traits and RAPD markers. Hortic Environ Biotechnol, 51 (1)
:51–60
.
( 0) 0)
|
| [23] |
Gleeson S K.1982. Heterodichogamy in walnuts: inheritance and stable ratios. Evolution, 36 (5)
:892–902
.
( 0) 0)
|
| [24] |
Jarvis D I, Brown A H, Cuong P H, et al.2008. A global perspective of the richness and evenness of traditional crop-variety diversity maintained by farming communities. Proc Natl Acad Sci USA, 105 (14)
:5326–5331
.
( 0) 0)
|
| [25] |
Krutovsky K V, Clair J B S, Saich R, et al.2009. Estimation of population structure in coastal Douglas-fir[Pseudotsuga menziesii (Mirb.) Franco var. menziesii] using allozyme and microsatellite markers. Tree Genetics & Genomes, 5 (4)
:641–658
.
( 0) 0)
|
| [26] |
Kumar L S.1999. DNA markers in plant improvement: an overview. Biotechnology Advances, 17 (2/3)
:143–182
.
( 0) 0)
|
| [27] | Lerner I M. 1954. Genetic homeostasis. Edinburgh: Oliver and Boyd. |
| [28] |
Peng Y H, Lu Z, Chen K.2005. Population genetic survey of Populus cathayana originating from southeastern Qinghai-Tibetan plateau of China based on SSR markers. Silvae Genetica, 54 (3)
:116–122
.
( 0) 0)
|
| [29] |
Pop I F, Vicol A C, Botu M, et al.2013. Relationships of walnut cultivars in a germplasm collection: Comparative analysis of phenotypic and molecular data. Scientia Horticulturae, 153 :124–135
.
( 0) 0)
|
| [30] | UPOV (International Union for the Protection of New Varieties of Plants). 1999. Guidelines for the conduct of tests for distinctness, uniformity and stability. Walnut (Juglans regia L.). http://www.upov.int/portal/index.html.en. |
| [31] |
Victory E R, Glaubitz J C, Rhodes O E, et al.2006. Genetic homogeneity in Juglans nigra (Juglandaceae) at nuclear microsatellites. Am J Bot, 93 (1)
:118–126
.
( 0) 0)
|
| [32] |
Wang H, Pan G, Ma Q G, et al.2015a. The genetic diversity and introgression of Juglans regia and Juglans sigillata in Tibet as revealed by SSR markers. Tree Genetics & Genomes, 11 (1)
:1–11
.
( 0) 0)
|
| [33] |
Wang H, Wu W B, Pang G, et al.2015b. Analysis of genetic diversity and relationships among 86 Persian walnut (Juglans regia L.) genotypes in Tibet using morphological traits and SSR markers. Journal of Horticultural Science & Biotechnology, 90 (5)
:563–570
.
( 0) 0)
|
| [34] |
Wang H, Pei D, Gu R S, et al.2008. Genetic diversity and structure of walnut populations in central and southwestern China. J Am Soc Hortic Sci, 133 (2)
:197–203
.
( 0) 0)
|
 2016, Vol. 52
2016, Vol. 52

