文章信息
- 孙世娜, 池玉杰, 于存, 李月
- Sun Shina, Chi Yujie, Yu Cun, Li Yue
- 构巢曲霉转化子菌株产MnP条件优化及对3种染料的脱色
- Optimization of Culture Conditions to Produce MnP and Dye Decolorization of TN02A7- He-mnp1 and TN02A7- He-mnp2
- 林业科学, 2016, 52(4): 75-82
- Scientia Silvae Sinicae, 2016, 52(4): 75-82.
- DOI: 10.11707/j.1001-7488.20160409
-
文章历史
- 收稿日期:2015-04-25
- 修回日期:2015-09-05
-
作者相关文章
染料按其化学结构中的特征基团不同可分为偶氮、蒽醌、靛类、酞菁、硫化、甲川、三苯基甲烷和杂环8类。在印染、纺织和造纸等领域,各种染料的使用非常普遍,其工业废水中不仅含有以芳烃及杂环化合物为母体并带有偶氮基等显色基团和磺酸基、羟基和氨基等极性基团的染料成分,而且还含有较多的原料和副产品,如卤化物、硝基物、苯胺、酚类以及无机盐等,对人体及生态环境构成很大的威胁,已成为严重的污染源和国际性环保难题(Shakeri et al ., 2008; 郑永良等,2008)。目前,人们积极探索能够有效降解染料的方法,使其变成环境友好无公害的物质,因此合成染料的脱色降解研究意义重大。利用经济有效的投菌法和生物酶法对染料进行生物脱色,可避免化学和物理方法漂白染料带来的二次污染及高成本、低效益的弊端(Modi et al ., 2010)。木质素是由苯丙烷单元经过碳碳键和碳氧键相互连接和无规则偶合而成的,很多染料与木质素的基本结构相似,大多具有芳香环或杂环,而白腐真菌天然具有降解木质素的特性,具有非特异性的胞外氧化降解酶系统,对染料等异生物质具有广谱的降解能力。锰过氧化物酶(manganese preoxidases -MnPs; EC 1.11.1.13)是白腐菌分泌的1种糖基化胞外过氧化物酶,是启动木质素降解的关键酶,能裂解木质素聚合物和染料中的侧链和芳环部分:一方面,依赖Mn2+的MnP能优先氧化存在于木材和土壤中的Mn2+,以Mn2+作为首选还原底物即电子供体,使其变成高度活性强氧化态的Mn3+,被草酸、丙二酸、苹果酸、酒石酸、乳酸等有机酸螯合后的Mn3+作为可扩散的氧化还原介质,非特异性地进攻和氧化占木质素结构单元10%的芳香环酚结构,螯合的Mn3+可氧化各种单酚和二聚酚、一些甲氧基、硝基、氯代芳香族化合物和有机酸; 另一方面,不饱和脂肪酸类结构经过MnP的过氧化作用,可以产生瞬间的脂肪过氧化基团中介体,这些中介体能够氧化木质素非酚的亚基,使得MnP可以切断原先不能切断的化合键如非酚类的芳基醚、某些多环的芳香族碳氢化合物。木质素和染料中的酚和非酚结构被氧化后形成不稳定的、易于自发裂解的苯氧基团自由基,会进行一系列非酶催化的自发裂解反应继续裂解,从而进行木材的最初脱木质素作用,最终导致木质素大分子和染料发色基团的断裂和脱色(Hofrichter,2002; 王慧等,2009)。近些年来,国内外很多研究者都利用MnPs进行了降解二氯苯胺、多氯联苯等有机污染物及纸浆漂白和染料脱色的研究。
对产酶条件的完善和优化至关重要。为了实现高效表达从而提高MnP基因的表达产量,一方面可进行基因转化与表达,另一方面可进行培养基成分和培养条件的综合调控,从而大幅度提高优良菌种的产酶水平。Larrondo等(2001)研究发现,构巢曲霉( Aspergillus nidulans )适合白腐菌外源基因有效的表达和分泌,是理想的宿主表达菌株。尹立伟等(2013)和尹立伟(2013)已将猴头菌( Hericium erinaceum )的MnP1和MnP2基因转入到了构巢曲霉尿嘧啶尿苷营养缺陷菌株TN02A7的原生质体中,获得了2个转化子菌株TN02A7- He-mnp1 和TN02A7- He-mnp2 。本文在此基础上,对构巢曲霉这2个MnP基因转化子菌株产MnP的初始培养条件进行优化,然后用优化后的酶液对3种染料进行脱色研究,旨在提高MnP的酶活性,以便后期对其纯化研究其酶学性质,并最终在生产实践中得到实际应用。
1 材料与方法 1.1 菌种来源、培养基与菌种复壮猴头菌MnP1和MnP2基因的2个构巢曲霉转化子菌株TN02A7- He-mnp1 和TN02A7- He-mnp2 由东北林业大学林学院森林病虫病理实验室提供,保存在MMPGRT平板培养基上,4℃冰箱冷藏。
MMPGRT培养基(L-1)按照曹进玲(2011)方法配制。
取出在冰箱中冷藏的MMPGRT平板培养基上的构巢曲霉转化子菌株,室温下静置24 h后,转接入新的MMPGRT平板培养基上,37℃下培养5天即可长满平板。然后再进行1次转接培养5天,此时菌种的生长势最旺盛。以后试验中所用菌块,均取自第2次转接培养到第5天的菌种。
1.2 MnP培养条件的优化每项试验对2个构巢曲霉转化子菌株都进行3组重复。
1.2.1 初始培养以及酶活性的测定在100 mL三角瓶中加入50 mL MMPGRT培养液,并加入2 g青杨木屑作为产酶底物,调pH值为6.5,121℃灭菌20 min,然后加入2个 φ =10 mm的菌块,于37℃、220 r·min-1下摇床培养(尹立伟等,2013)。分别在培养0,24,48,72,96,120,144 h时各提取1 mL培养液,6 000 r·min-1离心5 min,取上清液测酶活性(池玉杰等,2009)。以1 mL去离子水作为对照,测定470 nm处吸光度在1 min内的变化值。酶活性单位(U·L-1): 上述条件下,每分钟催化1 μmol 2,6-DMP所需的酶量。酶活性的计算公式如下:
酶活性=[106× V 1×Δ A × N ]/[ V 2× ε ×Δ t ]。 式中: V 1为反应总体积; V 2为酶液的体积; N 为酶液稀释倍数; ε 为摩尔消光系数, ε 470=49 600 mol·L-1cm-1; Δ t 为反应时间; Δ A 为反应时间内吸光度的变化增量。
1.2.2 最适产酶温度的筛选在明确了2个构巢曲霉转化子菌株产MnP酶活性随时间变化的规律后,先对培养温度进行筛选验证。尽量选用适于2个菌株生长和产酶的温度范围,因此选定在29,33,37,41℃下摇床培养与检测酶活性,以进一步确证最适产酶温度。
1.2.3 4因素3水平正交试验Mn2+浓度(Scheel et al ., 2000; Nüske et al ., 2002)、添加与不添加血红素及其浓度(尹立伟等,2013)、培养液pH值(张玉龙等,2011)、培养方式(振荡/静置)、转速等都是影响构巢曲霉转化子菌株分泌MnP的主要因素,因此在正交试验设计中应先固定那些对产酶影响较小和难于控制的因素,而选取一些对产酶影响较大并易于控制的因素作为试验因素。本项正交试验在各单因素预试验的基础上,进行了血红素浓度A(g·L-1)、Mn2+浓度B(μmol·L1)、pH值C和转速D(r·min-1)4个因素在3个水平下(表 1)酶活性的检测和筛选。选择各因素水平的原则是将参数的水平区间拉开,尽可能使最适区域包含在设定的水平区间内。采用SPASS软件设计了4因素3水平L9(34)正交表,在最适产酶温度37℃下,对2个构巢曲霉转化子菌株分别进行9组不同组合的正交试验,然后在预计酶活性最高时的120 h测定酶活性。
|
|
对MMPGRT固体平板培养基进行优化,即分别在培养基中添加最适量的血红素和MnSO4,并调节pH值到最适。分别在平板中心接入2个构巢曲霉转化子菌株的菌块各1块,在37℃下培养,观察并记录2个菌株的生长势,然后以其上 φ =10 mm的菌块为接种体应用于优化后的液体培养基,以没有优化的MMPGRT固体平板培养基上 φ =10 mm的菌块为接种体作为对照,检测优化后的液体培养基内的酶活性,研究优化后的MMPGRT固体培养基其上的菌体作为接种体对后续液体培养酶活性的影响。
1.2.5 优化培养验证试验对于2个构巢曲霉转化子菌株,分别以优化后的MMPGRT固体培养基其上的菌体为接种体,应用于后续优化的液体培养基内进行培养,以没有优化的MMPGRT固体平板培养基上的菌体为接种体接种于初始的液体培养基内培养作为对照,共4组试验,每组5个平行,验证优化产酶条件的结果。
1.3 2个构巢曲霉转化子菌株胞外培养液对3种染料的脱色试验一种特定成分的染料水溶液在特定波长下都有最大的光密度值,通过这一特性可以检测染料的浓度。本研究选择偶氮类的刚果红、杂环类的中性红、三苯基甲烷类的结晶紫3种染料,分别配制50 mg·L-1溶液,用紫外分光光度计在波长300~800 nm区间内进行扫描,以得到各染料最大吸收峰光谱,从中查找最大吸收峰处的吸光值及与其对应的波数,以去离子水为对照。
将2个菌株按照1.2.5中的优化条件进行培养,第5天时产酶量都达到最大值,这时将菌丝滤除,分设成试验组和对照,试验组向培养液中分别加入终浓度为50 mg·L-1的3种染料,对照不加染料,静止培养,在5 min,4 h,8 h,12 h,16 h,20 h时,在最大吸收峰处的波数下测其吸光值,试验组的吸光值减去对照的吸光值记为 Ai 值,以含50 mg·L-13种不同染料水溶液的吸光值减去对照菌液的吸光值记为 A 0值,取3组数据的平均值。2个菌株胞外培养液对3种染料的脱色率计算公式为: 脱色率(%)=[( A 0- Ai )/ A 0]×100%。然后绘制3种染料脱色率随时间的变化图。
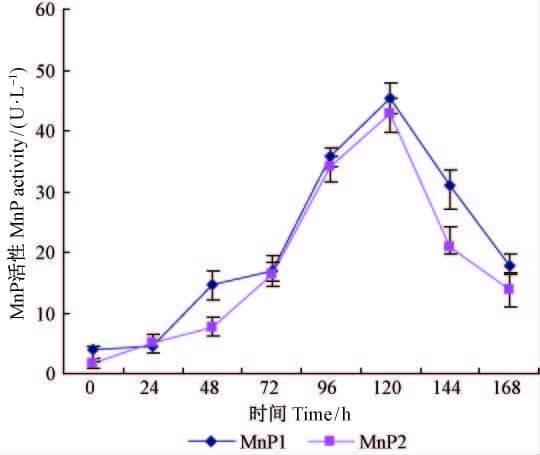
2 结果与分析 2.1 初始培养条件下产MnP的活性在初始培养条件下,TN02A7- He-mnp1 和TN02A7- He-mnp2 分别产TN02A7-He-MnP1和TN02A7-He-MnP2的活性见图 1,3组重复数据的误差线标注其上。从图中可以看出,TN02A7- He-mnp1 和TN02A7- He-mnp2 产MnP的活性规律随时间变化的趋势是一致的: 从开始接入菌块到120 h后,酶活性呈不断上升趋势,在72~120 h之间酶性活增长迅速,在120 h时2个菌株产酶活性都达到最高,分别为45.46和42.74 U·L-1,以后产酶活性都迅速下降。总的来看,TN02A7- He-mnp1 产TN02A7-He-MnP1的活性略高于TN02A7- He-mnp2 产TN02A7-He-MnP2的活性。
|
图1 初始培养条件下TN02A7 -He-mnp1 和TN02A7 -He-mnp2 产MnP的活性 Fig.1 MnP activity over time produced by TN02A7 -He-mnp1 and TN02A7 -He-mnp2 |
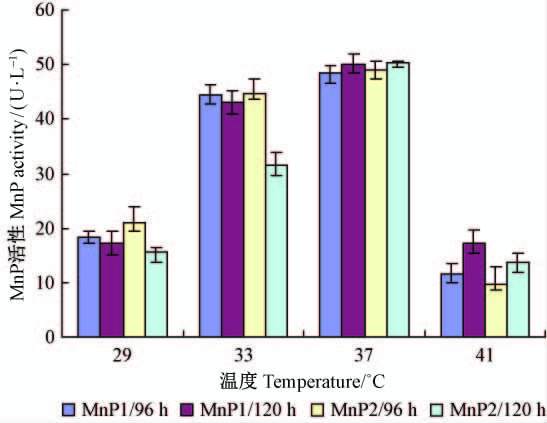
在29,33,37,41℃4种培养温度下,同时对2个构巢曲霉转化子菌株进行培养,检测了96和120 h下的酶活性如图 2所示。在37℃下,2个菌株产MnP的活性均为最高,因此37℃是2个菌株产MnP的最适温度,都是在120 h达到最高。同时,在29,33℃下,2个菌株产MnP的最大酶活性均出现在96 h; 而在37,41℃下,2个菌株产MnP的最大酶活性均出现在120 h。
|
图2 TN02A7 -He-mnp1 和TN02A7 -He-mnp2 在4种温度下的MnP活性 Fig.2 MnP activity of TN02A7 -He-mnp1 and TN02A7 -He-mnp2 at four different temperatures |
2个构巢曲霉转化子菌株TN02A7 -He-mnp1 和TN02A7 -He-mnp2 产MnP的正交试验结果见表 2。通过比较正交试验4因素3水平的均值 ki ,得到各因素的最大平均值,从而得出最佳培养方案。TN02A7 -He-mnp1 产TN02A7-He-MnP1的最佳培养方案是A2B3C3D2,即血红素浓度为0.05 g·L-1、Mn2+浓度为267 μmol·L-1、pH值为7.5、摇床转速为180 r·min-1。通过极差和方差分析可得出4个因素对TN02A7-He-MnP1酶活性影响的主次顺序为A>C>B>D,即血红素对TN02A7-He-MnP1酶活性影响最大,其次是pH值、Mn2+浓度、摇床转速。TN02A7 -He-mnp2 产TN02A7-He-MnP2的最佳培养方案是A1B3C3D3,即血红素浓度为0.03 g·L-1、Mn2+浓度为267 μmol·L-1、pH值为7.5、摇床转速为220 r·min-1。通过极差和方差分析可得出4个因素对TN02A7-He-MnP2酶活性影响的主次顺序为A>D>B>C,即血红素对TN02A7-He-MnP2酶活性影响最大,其次是摇床转速、Mn2+浓度、pH值。
|
|
对于TN02A7 -He-mnp1 ,在MMPGRT固体平板培养基中添加0.05 g·L-1血红素和267 μmol·L-1MnSO4; 对于TN02A7 -He-mnp2 ,在MMPGRT固体平板培养基中添加0.03 g·L-1血红素和267 μmol·L-1MnSO4; 并且都调节pH值为7.5。分别在平板中心接入2个菌株的菌块进行培养,结果发现2个菌株的生长速度都减慢,要到144 h才能基本长满平板培养基(没有添加血红素和MnSO4时都是120 h长满平板)。后期继续进行液体培养试验测其酶活性,发现96 h时TN02A7 -He-mnp1 产TN02A7-He-MnP1的酶活性达到最高,而TN02A7 -He-mnp2 产TN02A7-He-MnP2仍是在120 h的酶活性略高于96 h,即前期的优化可使TN02A7 -He-mnp1 产TN02A7-He-MnP1的酶活性最高峰提前1天出现。
2.5 优化培养验证试验结果对于2个构巢曲霉转化子菌株,以没有优化的MMPGRT固体平板培养基上的菌体为接种体接种于初始的液体培养基内培养作为对照,TN02A7 -He-mnp1 产TN02A7-He-MnP1在120 h时酶活性达到最高为46.21 U·L-1, TN02A7 -He-mnp2 产TN02A7-He-MnP2在120 h时酶活性也达到最高为42.56 U·L-1; 以优化后的MMPGRT固体培养基其上的菌体作为接种体,应用于后续优化的液体培养基内进行培养,TN02A7 -He-mnp1 产TN02A7-He-MnP1在96 h时酶活性达到最高为133.62 U·L-1,是初始条件下培养的2.89倍; TN02A7 -He-mnp2 产TN02A7-He-MnP2在120 h时酶活性达到最高为147.09 U·L-1,是初始条件下培养的3.46倍。
综合以上在初始条件下进行培养、最适产酶温度的单因素试验、4因素3水平的正交试验、固体培养基加入优化条件后试验及优化培养验证试验,可得出2个构巢曲霉转化子菌株产MnP的优化培养条件。TN02A7 -He-mnp1 产TN02A7-He-MnP1的最佳培养方案是: 在MMPGRT固体平板培养基中添加0.05 g·L-1血红素和267 μmol·L-1MnSO4,在37℃下培养至144 h后,取2个 φ =10 mm的菌块接入到后续的优化液体培养基中。液体培养基是在100 mL三角瓶中接入50 mL MMPGRT培养液,并加入2 g青杨木屑作为产酶底物,以及0.05 g·L-1血红素、267 μmol·L-1MnSO4、调节pH值至7.5、在180 r·min-1摇床转速下于37℃进行培养。TN02A7 -He-mnp2 产TN02A7-He-MnP2的最佳培养方案是: 在MMPGRT固体平板培养基中添加0.03 g·L-1血红素和267 μmol·L-1MnSO4,在37℃下培养至144 h后,取2个 φ =10 mm的菌块接入到后续的优化液体培养基中。液体培养基是在100 mL三角瓶中接入50 mL MMPGRT培养液,并加入2 g青杨木屑作为产酶底物,以及0.03 g·L-1血红素、267 μmol·L-1MnSO4、调节pH值到7.5、在220 r·min-1摇床转速下于37℃进行培养。
2.6 染料的脱色试验结果利用紫外分光光度计在波长300~800 nm区间内进行扫描,得到了3种染料的最大吸收峰光谱,从中查找到最大吸收峰处的吸光值及与其对应的波数: 刚果红在496 nm处有最大吸收峰值Abs=1.90; 中性红在485 nm处有最大吸收峰值Abs=2.317; 结晶紫在529 nm处有最大吸收峰值Abs=1.676。
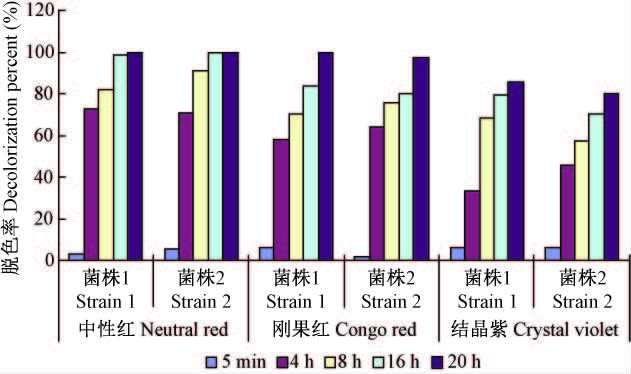
2个构巢曲霉转化子菌株在第5天产酶量最高时的培养液对3种染料脱色率随时间的变化如图 3所示。TN02A7 -He-mnp1 和TN02A7 -He-mnp2 的培养液对3种结构类型的染料都有很大程度的脱色,尤其对杂环类的中性红和双偶氮类的刚果红脱色效果显著。脱色率都是随着时间的延长而增高,在4 h时均达到58%以上的脱色率; 在16 h,TN02A7 -He-mnp1 和TN02A7 -He-mnp2 对中性红的脱色率分别为98.78%和100%,在20 h都为100%; 在20 h,TN02A7 -He-mnp1 和TN02A7 -He-mnp2 对刚果红的脱色率分别为100%和97.43%,对结晶紫的脱色率分别为85.82%和80.23%。
|
图3 2个转化子菌株MnP活性优化后的胞外酶液对3种染料脱色率随时间的变化 Fig.3 The decolorization percents of extracellular enzyme solution to three kinds of dyes of TN02A7 -He-mnp1 and TN02A7 -He-mnp2 |
本研究结果表明,通过优化培养基成分与条件可较大程度地提高2个构巢曲霉转化子菌株MnP的产酶量,TN02A7- He-mnp1 和TN02A7- He-mnp2 对杂环类染料中性红、偶氮类染料刚果红都有高效的脱色作用,对结晶紫的脱色率也相对较高,表明2个菌株对含有中性红和刚果红的工业染料废水具有极强的处理应用潜能。
最适产酶温度试验表明37℃是2个菌株产MnP的最适温度,与构巢曲霉菌丝体的最适生长温度一致,有利于培养。前期固体培养基中也加入血红素和MnSO4,并于pH值为7.5的环境中培养,虽然其生长势并不如未优化时,但转入液体培养基后,菌块能更快地适应环境,缩短后期培养时间。酶活性优化培养的结果也表明,2个构巢曲霉转化子菌株产MnP的优化培养条件相似,酶活性也相近,但二者与大多数白腐菌相比,产酶高峰提早出现很多,表明在实际应用中潜能更大。
细菌、放线菌和真菌等微生物对各种染料都有脱色功能,脱色能力和参与脱色降解的酶不尽相同,对漆酶、MnP、木质素过氧化物酶(LiP)等酶的脱色效果都有研究。任随周等(2006)研究表明,嗜水气单胞菌( Aeromonas hydrophila )菌株DN322所产的细菌脱色酶TpmD对4种三苯基甲烷类染料结晶紫、碱性品红、灿烂绿和孔雀绿都具有较强的脱色能力,结晶紫是该酶的最适反应底物。司静等(2012)研究表明,东方栓孔菌( Trametes orientalis )菌株Cui 6300的菌体加漆酶粗酶液对结晶紫、刚果红、铬天青、中性红和亚甲基蓝5种染料都有脱色作用,在24 h时其粗漆酶液对5种染料的脱色率在15%~35%之间,96 h后粗漆酶液对结晶紫脱色效果最好,达到90.36%,对刚果红的脱色率次之,为86.57%,对铬天青和中性红的脱色率都在60%以上,对亚甲基蓝的脱色率超过40%。糙皮侧耳( Pleurotus ostreatus )纯化后的漆酶在添加小分子介体物质2,2-连氮-双(3-乙基苯并噻唑-6-磺酸)(ABTS)、对-甲氧基酚、黎芦醇条件下,提高了对蒽醌染料活性亮蓝SN4R的脱色率(侯红漫,2003)。韩国民等(2011)研究表明,冷杉附毛孔菌( Trichaptum abietinum )菌株1302BG对苯胺蓝、橙黄G、刚果红、甲基橙、酸性品红、甲基紫、结晶紫、碱性品红、番红花红9种染料都具有脱色能力,优化后的液体培养基在经高压灭菌处理后的培养液、非灭菌敞开式摇动培养及外加微生物污染条件下的3种培养液的脱色能力都很相似,在24 h对酸性品红的脱色率超过96%,对刚果红的脱色率超过90%,在48 h对2种染料的脱色率均接近100%。章燕芳等(2002)研究了黄孢原毛平革菌( Phanerochaete chrysosporium )含有菌体、LiP和MnP的培养液对6种染料的脱色,其中对甲基橙、橙I、次甲基蓝脱色率为90%,对刚果红和直接湖蓝的脱色率为80%,对结晶紫的脱色率为60%。连小英(2009)采用细胞固定化技术以提高 P. chrysosporium 对MnP的合成水平,并利用菌体及所产MnP 对蒽醌染料酸性蓝45脱色降解,当染料浓度在200~600 mg·L-1时,该体系的脱色率在98.26%~94.96%之间。程晓滨(2007)对裂褶菌F17( Schizophyllum sp. F17)所产的MnP进行了纯化,纯化后的MnP能够有效对3种偶氮染料刚果红、金橙G和橙黄Ⅳ进行脱色,用明胶制成的固定化酶对3种染料的脱色能力与游离酶接近。李旭东等(2008)采用稻壳作为基质,对 Schizophyllum sp. F17进行固态发酵产MnP,优化后的发酵体系对5种不同结构类型的染料结晶紫、Poly R-478、刚果红、茜素红、中性红于24 h脱色率分别高达95.6%,93.1%,92.6%,90.3 %和87.3%。Asgher等(2013)对 P. ostreatus 菌株IBL-02在麦草上产生的MnP,纯化后用液胶-凝胶固定化,其对4种纺织工业废水具有高效的脱色作用。与上述研究比较,无论在脱色速度还是脱色率上,本试验2个构巢曲霉转化子菌株对中性红和刚果红的脱色都有较明显的优势。
白腐菌所产漆酶对多种染料都有脱色能力,如漆酶对酸性橙(卢蓉等,2005)、依利尼尔兰、尼龙山红、溴酚蓝和中性黑(张玉等,2006)、结晶紫、靛红、活性黑KN-B(赵丽艳等,2011)等在特定条件下都能脱色。但是,这些结果有的是菌体加上粗酶液的脱色效果,除了菌体的吸附脱色功效外,粗酶液很可能是漆酶和MnP混合酶液的效果,而不单单只是漆酶的功效。
| [1] |
曹进玲.2011. 钙离子通道蛋白MidA在构巢曲霉中的功能特征研究.南京:南京师范大学硕士学位论文. (Cao J L. 2011. Study on the functional characters of stretch-activated Ca2+ channel protein MidA in Aspergillus nidulans. Nanjing:MS thesis of Nanjing Normal University.[in Chinese])(  1) 1)
|
| [2] |
程晓滨. 2007. 裂褶菌F17锰过氧化物酶的分离纯化及其对偶氮染料脱色的研究.合肥:安徽大学硕士学位论文. (Cheng X B. 2007. Purification of a new manganese peroxidase of the white-rot fungus Schizophyllum sp. F17 and decolorization of azo dyes by the enzyme.Hefei:MS thesis of Anhui University.[in Chinese])(  1) 1)
|
| [3] |
池玉杰, 闫洪波.2009. 红平菇木质素降解酶系统漆酶、锰过氧化物酶及木质素过氧化物酶的检测.林业科学, 45(12):154-158. (Chi Y J, Yan H B. 2009. Detection on laccase, manganese peroxidase and lignin peroxidase in ligninolytic enzymes of Pleurotus djamor. Scientia Silvae Sinicae, 45(12):154-158.[in Chinese])(  1) 1)
|
| [4] |
韩国民, 何兴兵, 张 鹏, 等. 2011. 多孔菌Trichaptum abietinum 1302BG自然条件下对合成染料刚果红和酸性品红的高效降解. 微生物学通报, 38(4):603-614. (Han G M, He X B, Zhang P, et al. 2011. Efficient degradation of polyporus fungus Trichaptum abietinum 1302BG on the synthetic dyes congo red and fuchsin acid under non-sterile condition. Microbiology China, 38(4):603-614.[in Chinese])(  1) 1)
|
| [5] |
侯红漫. 2003. 白腐菌Pleurotus ostreatus漆酶及对蒽醌染料和碱木素脱色的研究. 大连:大连理工大学博士学位论文. (Hou H M. 2003. Study on the laccase from white-rot fungus Pleurotus ostreatus and its decolorization for anthraquinone dye and alkali lignin. Dalian:PhD thesis of Dalian University of Technology.[in Chinese])(  1) 1)
|
| [6] |
李旭东, 荚 荣, 程晓滨, 等. 2008. 锰过氧化物酶的固态发酵及其对染料的脱色作用. 环境科学学报, 28(3):490-495. (Li X D, Jia R, Cheng X B, et al. 2008. Solid-state fermentation of MnP and decolorization of dyes. Acta Scientiae Circumstantiae, 28(3):490-495.[in Chinese])(  1) 1)
|
| [7] |
连小英. 2009. 黄孢原毛平革菌产锰酶及其对酸性蓝45的脱色研究.西安:长安大学硕士学位论文. (Lian X Y. 2009. Study on Decolorization of Acid Blue 45 by MnP peroxidase of Phanerochaete chrysosporium. Xi'an:MS thesis of Chang'an University.[in Chinese])(  1) 1)
|
| [8] |
卢 蓉, 沈雪亮, 夏黎明. 2005. 彩绒革盖菌产漆酶及其对染料脱色的研究. 林产化学与工业, 25(1):73-76. (Lu R, Shen X L, Xia L M. 2005. Studieson on laccase prodution by Coriolus versicolor and enzymatic decoloration of dey. Chemistry and Industry of Forest Products, 25(1):73-76.[in Chinese])(  1) 1)
|
| [9] |
任随周, 郭 俊, 王亚丽, 等. 2006. 细菌脱色酶TpmD对三苯基甲烷类染料脱色的酶学特性研究. 微生物学报, 46(3):385-389. (Ren S Z, Guo J, Wang Y L, et al. 2006. Properties of a triphenylmethane dyes decolorization enzyme TpmD from Aeromonas hydrophila strain DN322. Acta Microbiologica Sinica, 46(3):385-389.[in Chinese])(  1) 1)
|
| [10] |
司 静, 崔宝凯, 戴玉成. 2011. 东方栓孔菌在染料脱色中的应用及其脱色条件的优化. 基因组学与应用生物学, 30(3):364-371. (Si J, Cui B K, Dai Y C. 2011. Application in dye decolorization and optimization of conditions in discoloration by Trametes orierctalis. Genomics and Applied Biology, 30(3):364-371.[in Chinese])(  1) 1)
|
| [11] |
王 慧, 郑小伟, 王宾香, 等. 2009. 真菌对染料的脱色研究进展. 应用与环境生物学报, 15(1):147-151. (Wang H, Zheng X W, Wang Y B, et al. 2009. Advance in decolorization of dye by fungi. Chin J Appl Environ Biol, 15(1):147-151.[in Chinese])(  1) 1)
|
| [12] |
尹立伟, 池玉杰. 2013. 猴头菌锰过氧化物酶1基因在构巢曲霉的异源转化与表达.林业科学研究, 26(4):480-487. (Yin L W, Chi Y J.2013.Heterologous transformation and expression of Hericium erinaceum manganese peroxidase 1 gene in Aspergillus nidulans. Forest Research, 26(4):480-487.[in Chinese])(  3) 3)
|
| [13] |
尹立伟. 2013. 猴头菌锰过氧化物酶基因克隆及在构巢曲霉中的表达. 哈尔滨:东北林业大学博士学位论文. (Yin L W.2013. Cloning and heterologous expression in Aspergillus nidulans of genes encoding manganese peroxidase from Hericium erinaceum. Harbin:PhD thesis of Northeast Forestry University.[in Chinese])(  1) 1)
|
| [14] |
章燕芳, 李华钟, 华兆哲, 等. 2002. 黄孢原毛平革菌合成的木质素过氧化物酶、锰过氧化物酶及其菌球在染料脱色过程中的作用. 过程工程学报, 2(3):247-249. (Zhang Y F, Li H Z, Hua Z Z, et al. 2002. Roles of lignin peroxidase, manganese peroxidase and pellet of Phanerochaete chrysosporium in decoloration of dyes. The Chinese Journal of Process Engineering, 2(3):247-249.[in Chinese])(  1) 1)
|
| [15] |
张 玉, 洪 枫. 2006. 优化彩绒革盖菌产漆酶条件及染料脱色研究. 林产化学与工业, 26(3):42-46. (Zhang Y, Hong F. 2006. Optimization of culture conditions for laccase production by Trametes versicolor and dye decolorization by the crude laccase. Chemistry and Industry of Forest Products, 26(3):42-46.[in Chinese])(  1) 1)
|
| [16] |
张玉龙, 池玉杰, 闫洪波. 2011. 偏肿栓菌产锰过氧化物酶条件优化. 林业科学, 47(8):88-94. (Zhang Y L, Chi Y J, Yan H B. 2011. Optimization of ferment conditions of manganese peroxidase produced by Trametes gibbosa. Scientia Silvae Sinicae, 47(8):88-94.[in Chinese])(  1) 1)
|
| [17] |
赵丽艳, 赵 敏, 卢 磊, 等. 2011. 一色齿毛菌漆酶-介体系统在染料脱色中的应用. 北京林业大学学报, 33(4):134-139. (Zhao L Y, Zhao M, Lu L, et al. 2011. Application of Cerrena unicolor laccase-mediator system in dye decolorization. Journal of Beijing Forestry University, 33(4):134-139.[in Chinese])(  1) 1)
|
| [18] |
郑永良, 钟玉林, 徐 红, 等. 2008. 染料脱色菌株的筛选及其特性研究. 华中师范大学学报:自然科学版, 42(3):444-447. (Zheng Y L, Zhong Y L, Xu H, et al. 2008. Isolation and characteristic of bacteria on dye decolorization and their characteristics studies. Journal of Huazhong Normal University:Natural Science, 42(3):444-447.[in Chinese])(  1) 1)
|
| [19] |
Asgher M, Aslam B, Iqbal H M N. 2013. Novel catalytic and effluent decolorization functionalities of sol-gel immobilized Pleurotus ostreatus IBL-02 manganese peroxidase produced from bio-processing of wheat straw. Chinese Journal of Catalysis, 34(9):1756-1761.( 1) 1)
|
| [20] |
Hofrichter M. 2002. Review:lignin conversion by manganese peroxidase(MnP). Enzyme and Microbial Technology, 30(4):454-466.( 1) 1)
|
| [21] |
Larrondo L F, Lobos S, Stewart P J, et al. 2001. Isoenzyme multiplicity and characterization of recombinant manganese peroxidases from Ceriporiopsis subvermispora and Phanerochaete chrysosporium. Applied and Environmental Microbiology, 67(5):2070-2075.( 1) 1)
|
| [22] |
Modi H A, Rajput G, Ambasana C. 2010. Decolorzation of water soluble azo dyes by bacterial cultures, isolated from dye house effluent.Bioresource Technology, 101(16):6580-6583.( 1) 1)
|
| [23] |
Nüske J, Scheibner K, Hofrichter M, et al. 2002. Large scale production of manganese-peroxidase using agaric white-rot fungi. Enzyme and Microbial Technology, 30(4):556-561.( 1) 1)
|
| [24] |
Scheel T, Hfer M, Ludwig S, et al. 2000. Differential expression of manganese peroxidase and laccase in white-rot fungi in the presence of manganese or aromatic compounds. Appl Microbiol Biotechnol, 54(5):686-691.( 1) 1)
|
| [25] |
Shakeri M, Shoda M. 2008. Decolorization of an anthraquinone dye by the recombinant dye-decolorizing peroxidase(rDyP) immobilized on mesoporous materials. Journal of Molecular Catalysis B:Enzymatic, 54:42-49.( 1) 1)
|
 2016, Vol. 52
2016, Vol. 52

