文章信息
- 闫芳, 张恩和, 王勤礼, 毛著鸿
- Yan Fang, Zhang Enhe, Wang Qinli, Mao Zhuhong
- 野生黄瑞香种子的休眠机制与破除方法
- The Mechanisms of Seed Dormancy of Wild Daphne giraldii and Methods for Dormancy Breaking
- 林业科学, 2016, 52(4): 30-37
- Scientia Silvae Sinicae, 2016, 52(4): 30-37.
- DOI: 10.11707/j.1001-7488.20160404
-
文章历史
- 收稿日期:2015-10-16
- 修回日期:2015-11-19
-
作者相关文章
2. 河西学院河西生态与绿洲农业研究院 张掖 734000;
3. 甘肃泰康制药有限责任公司 武威 733000
2. Hexi Ecological & Oasis Agricultural Research Institute of Hexi University Zhangye 734000;
3. Gansu Taikang Pharmaceutical Company Wuwei 733000
种子的休眠特性是植物为适应环境的繁殖策略之一,但往往给实际生产带来不便。因此,研究生产中如何破除种子休眠具有重要的理论和现实意义。黄瑞香(Daphne giraldii)为瑞香科(Thymelaeaceae)瑞香属小灌木,植株高40~120 cm,胸径可达80 cm,分布在我国甘肃、青海等海拔2 000~2 600 m的山坡灌丛、林缘、沟谷地带(张勇等,2001)。黄瑞香适应性强,喜冷凉湿润气候,也耐寒耐热,对土壤要求不严,其叶片墨绿有光泽,花清香淡雅,果色鲜红,具有较高的观赏价值,对改善西北地区的大地面貌和生态保护具有重要的开发价值(李耀阶,1987)。同时黄瑞香的茎皮也是我国治疗风湿和止痛的常用中药,具有祛风除湿、止痛散瘀、抗肿瘤活性等作用(周光雄等,2006)。随着人们对黄瑞香应用价值认识的深入,黄瑞香的需求量与日俱增,导致黄瑞香野生种质资源越来越少,现已被列为国家三级保护植物(李银等,2008)。目前黄瑞香人工栽培技术尚未成熟,相关的基础研究较少,多集中在其茎皮的化学成分和活性成分(Kimura,1985; Li et al., 2005; 王成瑞等,1987)等方面,有关其种子萌发条件及休眠特性的研究和报道极少(王勤礼等,2012)。本试验以祁连山野生黄瑞香为研究对象,旨在通过对黄瑞香种子休眠特性的研究,明确其种子休眠的原因,探索打破其种子休眠的有效方法,为提高黄瑞香的人工种苗繁育效率,促进黄瑞香的野生种群恢复及规范化种植提供理论依据。
1 材料与方法 1.1 试验材料和样地供试的黄瑞香种子于2014年8月采自海拔2 500~2 600 m的甘肃省武威市天祝县祁连乡布尔草原(103°33′26″E,38°43′31″N),坡向东西,坡位中下部,坡度约为25°。果实成熟到果皮呈深红色时采摘,用手搓洗去除果皮和果肉后晾干,挑选饱满种子置于牛皮纸袋内备用。经甘肃农业大学陈垣教授鉴定为黄瑞香。
1.2 试验方法 1.2.1 种子形态观察及特征指标测定采用百粒质量法,从试验样品中随机数取3个重复,每个重复取种子100粒,用千分之一的电子天平称质量,计算其平均值后换算成千粒质量。随机取3×100粒种子,用解剖刀将种子沿纵轴剖开,统计有完整胚的种子占总试验种子数的百分比,求出种子饱满度。种子含水量测定选用烘干称质量法(Li et al., 2012):先将100粒饱满干燥的种子用千分之一的电子天平称质量,然后放入100 ℃烘箱内烘12 h,取出后在干燥器内冷却至室温后称质量;前后2次称量的差值与未烘干前的比值即为含水量,重复3次。
1.2.2 种子吸水率的测定参照杨文权等(2009)的方法测定种子吸水率: 取黄瑞香种子2份,各50粒,1份用解剖刀剥去外种皮,1份为完整种子。分别放入500 mL的烧杯中,加入200 mL蒸馏水在25 ℃下浸泡种子进行吸胀。每隔2 h将种子取出,用吸水纸吸干其表面的水后用千分之一的电子天平称质量、记录,然后再放回烧杯中继续吸水。重复操作直至种子吸水至恒质量,3次重复。吸水率(%)=(浸种后质量-浸种前质量)/浸种前质量×100%。
1.2.3 种子生活力测定和萌发试验采用氯化三苯基四氮唑(TTC)染色法测定种子生活力。随机数取100粒种子,首先将种子在常温下浸种24 h后放入浓度为0.5%的TTC溶液中,于35 ℃ 恒温箱内染色,6 h后取出种子,然后剥取种胚用蒸馏水冲洗干净,观察染色反应(闫芳等,2014)。有生活力的种子胚会被染成红色,无生活力的种子则未被染色。统计被染色的胚并根据胚染色情况测定其生活力。
种子萌发率测定: 将黄瑞香分2份,1份为去皮种子,另1份为完整种子,消毒后放于铺有双层滤纸的培养皿中,加蒸馏水置于25 ℃的恒温培养箱内进行萌发试验,每个处理3次重复,每重复50粒种子。每天定时统计萌发数,截至第10天,种子的萌发以胚根破壳而出为标志。发芽率(%)=(正常发芽种子粒数/供检种子总粒数)×100%。
1.2.4 种子萌发抑制物的提取和生物鉴定参照王小平等(1998)的方法,取黄瑞香饱满种子的外种皮、内种皮、种胚各4 g在预冷的研钵内研碎,分别用20 mL的蒸馏水、80%的乙醇溶液在4 ℃下静提48 h。去残渣后水提取液用蒸馏水定容至18 mL,醇提液先于80 ℃下减压浓缩后用蒸馏水定容至18 mL备用。分别取水提液和醇提液1,2,3 mL用蒸馏水定容至4 mL,制成质量浓度为0.05,1,0.15 g·mL-1的溶液。在25 ℃培养箱内用白菜(Brassica pekinensis)种子进行不同提取液种类及浓度的发芽测定,以同体积蒸馏水为对照。72 h后测定发芽率并随机抽取30株幼苗测量胚根长度。每处理3次重复,每重复50粒种子。
1.2.5 种子休眠的解除1)植物激素溶液浸种处理溶液浓度设置为: 50,100,150,200 mg·L-1 GA3;10,20,30,40 mg·L-1 6-BA;50 mg·L-1GA3+10 mg·L-16-BA,100 mg·L-1GA3+20 mg·L-16-BA,150 mg·L-1GA3+30 mg·L-16-BA,200 mg·L-1 GA3+40 mg·L-1 6-BA。将种子破除种皮后,分别在以上浓度的溶液中分别浸泡5,10,15,20 h,对照为蒸馏水。按1.2.3中的种子萌发试验方法进行萌发测定。
2)低温层积处理和干藏处理低温层积处理:饱满黄瑞香种子用清水浸泡24 h,在0.1%的氯化汞中消毒5 min后与湿沙(含水量质量百分数为15%)以1∶3的体积比混合,置于1,5,10 ℃温度条件下分别层积70,90,120天。定期通气和保持沙子湿润,按1.2.3中方法进行种子萌发试验,将取样时已裂口的种子数统计入各处理的种子总萌发数中。干藏处理: 将干燥新鲜的带种皮种子置于牛皮纸袋内,一份放4 ℃冰箱中进行低温干藏,另一份置于20 ℃的恒温培养箱中进行暖温干藏,分别于70,90,120天后取出按1.2.3中的方法进行萌发率测定。对照均为置于室温下牛皮纸袋中的未处理种子。
3)低温层积前后黄瑞香种皮的微观观察将5 ℃温度条件下层积90天的黄瑞香种子的外种皮和室温下牛皮纸袋中干燥种子的外种皮的横断面(长和宽方向)和表皮用导电胶粘在载物台上,冻干喷金后,移入FEI Quanta 450 FEG场发射扫描电镜下观察,标定特征明显部位后进行拍照。
1.3 数据分析用SPSS 19.0对数据进行统计分析,萌发率数据在统计分析前先进行反正弦转换。使用One way ANOVA进行单因素方差分析,用Duncan法进行多重比较,最小显著差法(LSD)在0.01和0.05水平确定各个平均值之间的差异显著性。用Origin 8.5做图。
2 结果与分析 2.1 黄瑞香种子特征黄瑞香种子形状呈近球形,由外种皮、内种皮和胚3部分组成,外种皮深褐色,表皮光亮、平滑,质地坚韧,内种皮呈浅褐色膜质。新鲜种子含水量6.88%±0.06%,近直径(5.75±0.07)mm,饱满度92.07%±0.08%,千粒质量(44.7±0.21)g。
2.2 黄瑞香种子吸水曲线黄瑞香种子吸胀后的吸水曲线见图 1,新鲜的完整黄瑞香种子的吸水过程符合Logistic 曲线方程。图 2为利用Logistic曲线方程直线化拟合的结果,表 1为直线拟合估算的各参数。吸水率对应浸种时间的 Logistic 直线化方程为y′=1.793+0.104x(R2=0.977,P< 0.01)。由此可知,黄瑞香种子浸水后立即吸胀,浸种2.28 h为急剧吸水期,吸水最快;浸种8.23 h后吸水高峰结束,进入较为缓和的吸水阶段;12.67 h后吸胀结束进入吸水饱和期,最大速率为22.75 g·h-1。虽然黄瑞香完整种子吸水饱和时,总的吸水率没有超过50%,但结果显示黄瑞香种子的种胚能较快地吸收到一定量的水分,透水性较好,其坚韧的外种皮虽存在一定的机械阻力但终究不是影响其种子萌发的主要原因。

|
图1 黄瑞香种子吸水曲线 Fig.1 Water absorption rate curve of D.giraldii |

|
图2 黄瑞香种子吸水率与浸种时间配合Logistic 方程直线化拟合结果 Fig.2 Linear response of water absorption of D.giraldii seed to soaking time based on Logistic equation |
|
|
植物种子生活力是发芽的潜在能力或胚具有的生命力,但具有生活力的种子不一定都能萌发,若是种子萌发率显著低于种子生活力则说明种子处于休眠状态(徐本美等,2007)。黄瑞香种子的生活力测定结果为: 胚呈红色的种子皆有生活力,并具发芽潜力,占84.6%;9.4%为丧失生活力的无色胚种子;空粒种子指无胚或胚已干瘦皱缩,占6%。说明黄瑞香新采收种子具有较高的萌发潜力。而新鲜采收的黄瑞香种子无论去掉种皮与否均无一萌发,说明新鲜的黄瑞香种子存在明显的休眠现象。
2.4 萌发抑制物的生物学鉴定黄瑞香种子外种皮、内种皮和胚的提取液对白菜种子发芽率、胚根长的抑制作用见表 1,可以看出种子不同部位的提取液均对白菜种子萌发有不同程度的抑制作用。对于外种皮而言,比较水提液和醇提液,可以看出水提液对白菜种子萌发和胚根长的抑制作用在相同浓度条件下比醇提液明显,在0.05 g·mL-1的浓度条件下即表现出萌发率下降、胚根长缩短,与对照相比表现出极显著的抑制作用(P< 0.01),而醇提液则需在较高浓度下才会对白菜种子的萌发表现出较强的抑制作用。种胚的浸提液对白菜种子的萌发抑制作用最强,表现为无论是醇提液还是水提液在0.1,0.15 g·mL-1的浓度下完全抑制种子萌发,且在0.05 g·mL-1浓度条件下种胚的水提液对白菜种子的萌发抑制作用显著低于醇提液,而与对照相比均表现出极显著的抑制作用(P < 0.01),且对胚根长也表现出极强的抑制作用(P< 0.01)。内种皮浸提液对白菜种子萌发的抑制情况与其他2个部位的浸提液有所不同,醇提液在低浓度时已对白菜种子的萌发产生极其明显的抑制作用,萌发率下降至22%,胚根长显著缩短,0.1 g·mL-1浓度下只有个别种子萌发,与对照相比差异均达到极显著水平(P < 0.01);但内种皮的水提液无论浓度高低对白菜种子的萌发抑制作用较小,萌发率都在86%以上,胚根长均达到18 mm左右。这说明黄瑞香外种皮中同时存在溶于有机溶剂和水的发芽抑制物质,而溶于水的物质对种子萌发的抑制作用更强;种胚中溶于有机溶剂和水的物质几乎均能完全抑制白菜种子萌发,种胚中存在的抑制物质可能对种子休眠起更大作用;内种皮中溶于有机溶剂的物质对种子休眠有较强影响,而溶于水的物质却对种子萌发影响不大。
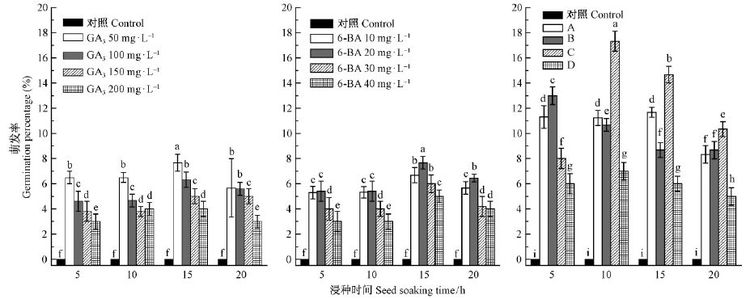
2.5 种子休眠的解除 2.5.1 植物激素溶液浸种处理图 3结果表明,不同浓度的赤霉素(GA3)和细胞分裂素(6-BA)对黄瑞香种子的发芽率有显著的影响。不同浓度的GA3对种子萌发率的影响不同,较低浓度的GA3浸泡15 h有利于种子萌发,高浓度反而会抑制种子萌发;当黄瑞香种子在50 mg·L-1 GA3溶液中浸泡15 h,平均萌发率最高为7.82%。同样,6-BA溶液浸种也显著影响种子萌发率,当20 mg·L-16-BA溶液浸种15 h时黄瑞香种子的最高萌发率为7.75%。但图 3显示黄瑞香种子在150 mg·L-1 GA3+30 mg·L-16-BA混合溶液中浸泡10 h后的种子萌发率为17.33%。因此单独使用赤霉素或细胞分裂素溶液对打破黄瑞香种子休眠有一定效果,二者混合使用则效果增强,但仍然不能有效地打破黄瑞香种子休眠。
|
图3 不同质量浓度的植物激素对黄瑞香种子萌发率的影响 Fig.3 Effects of different plant hormones on D.giraldii seed germination 对照 Control: 清水 Clear water;A: 50 mg·L-1 GA3+10 mg·L-1 6-BA;B: 100 mg·L-1 GA3+20 mg·L-1 6-BA;C: 150 mg·L-1GA3+30 mg·L-1 6-BA; D: 200 mg·L-1 GA3+40 mg·L-1 6-BA. 图中不同小写字母表示在P< 0.05水平上的差异显著性。下同。The different small letters mean the significant differences at P< 0.05. The same below. |
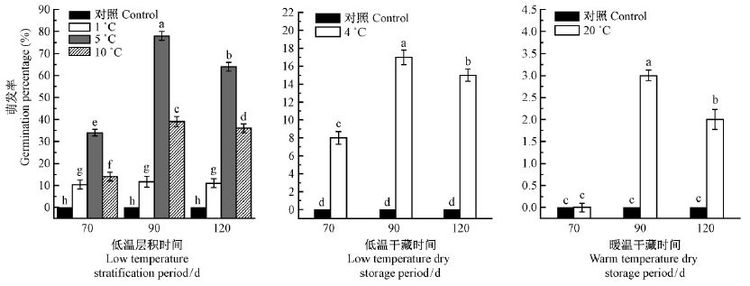
图 4结果表明,低温层积能显著提高黄瑞香种子的萌发率,有效打破其种子休眠。当层积温度为5 ℃时,层积处理90天时黄瑞香种子萌发率最高,接近80%,与其他干藏条件下的种子和置于室温下的黄瑞香种子(对照)相比,显著提高了其萌发率(P< 0.05)。从低温干藏处理和暖温干藏处理的结果来看,以低温干藏的效果较好,最高萌发率为17.2%,而暖温干藏处理只有少数种子萌发。但无论是何种种子干藏方式均不利于黄瑞香种子的长期保存,当层积至120天时各处理的萌发率均显著下降,说明过长的层积时间并不利于黄瑞香种子萌发。
|
图4 不同处理对黄瑞香种子萌发率的影响 Fig.4 Influence of different treatments on germination of D.giraldii seeds |
黄瑞香种皮坚韧,对其种皮横断面和表面结构在放大1 000倍的扫描电镜下扫描观察发现,未处理的黄瑞香种子的种皮表面细胞间隙很小,排列非常致密和平滑,没有孔洞和裂隙(图 5A)。横断面扫描图(图 5B)显示,未处理的种皮中长柱状细胞构成栅栏组织,细胞排列整齐紧密,虽有一定空隙但空隙不大。由此推测,黄瑞香种皮的这种结构对水分的吸收、气体交换可能会有一定影响。但黄瑞香种子在5 ℃下层积90天后,其种皮表面已出现较多的“蚁穴”状孔洞(图 5C),横断面种皮细胞排列越来越疏松,透性加大(图 5D),说明低温层积促进黄瑞香种子内外部物质交换,利于种子的萌发。

|
图5 黄瑞香种子种皮的扫描电镜结构 Fig.5 The microstructures of D.giraldii testa under scanning electron microscope A. 未处理种子的种皮表面; B. 未处理种子的种皮横断面; C. 层积处理后种子的种皮表面; D.层积处理后种子的种皮横断面。 A. Un-pretreated testa surface; B. Cross section of un-pretreated testa; C. Stratified testa surface; D.Cross section of stratified testa. |
种子的休眠现象是植物为适应气候变化、温度差异、水分条件等环境因素并保持自身繁殖发展而形成的一种生物学特性,具有重要的意义(Gusano et al., 2004; Kermode,2005)。因而许多较为寒冷地区生长的植物种子在秋天果实成熟后在适宜的温度、湿度和光照条件下难以萌发,保持休眠状态直到来年春季才萌发。祁连山野生的黄瑞香生长在海拔2 500 m左右的半阴半阳的缓坡地带,是青海云杉(Picea crassifolia)等乔木的伴生小灌木(李耀阶,1987)。为了适应祁连山寒冷的冬季和凉爽的夏季气候,黄瑞香具有较强的耐寒能力且其种子具有休眠特性,另外黄瑞香的果肉也具有抑制种子萌发的物质(王勤礼等,2012)。野生条件下,黄瑞香的果肉具小毒,故动物和鸟类从不取食,再加上祁连山夏季气候凉爽,因此从7月黄瑞香果实成熟直至9月中下旬其果肉一直包裹着种子。秋季果肉发黑腐烂后,种子才会掉出,但只有少量落入松针层或草丛深处的种子第2年的春天能发芽,黄瑞香种子的这种休眠特性导致其野生资源数量稀少。黄瑞香种皮结构致密,电镜扫描结果显示其具有栅栏组织,但新鲜去除种皮的种子也不萌发,依旧表现很强的休眠特性。本文研究结果也显示,黄瑞香种子浸种2.28 h后吸水速率最大为49.8%,12.67 h后吸水饱和,吸水过程所表现的3个阶段符合种子的吸水规律,说明黄瑞香种子种壳不存在严重的透水障碍。因此通过本文的研究,推断生理休眠是黄瑞香种子休眠的主要原因。
在导致种子生理休眠的诸多因素中,抑制物质的存在被认为是最重要的原因之一,种子的不同部位存在的某些抑制物导致了种子休眠(Bewley et al., 1994)。抑制物是指存在于种子的种皮或其他部位的某些化学物质,其存在会阻碍种子生理活动的某些代谢环节,从而影响种子的萌发。黄瑞香种子不同部位浸提液对白菜籽发芽率的影响结果显示,黄瑞香种子的种皮和胚中确实存在有某种溶于有机溶剂和水的萌发抑制物,且种子不同部位都存在着不同程度的发芽抑制物质,尤其是种胚中的醇溶性和水溶性物质对种子发芽均具极显著的抑制作用。据此认为黄瑞香种子内源抑制物,尤其种胚是引起种子休眠的主要原因。黄瑞香种子各部分的内源抑制物的种类和含量尚未见报道,有必要深入展开相关成分分析研究。也有学者认为,导致植物种子休眠的原因不仅是由于抑制物质的存在,也可能是由于缺乏赤霉素和细胞分裂素等植物激素引起的,其中主要调节因子赤霉素能诱导水解酶的产生,使淀粉水解为糖,蛋白质水解为各种氨基酸,从而有利于种子萌发。而细胞分裂素能促进细胞的分裂和器官的分化(Sun et al., 2004),有些植物外施细胞分裂素便能打破种子休眠(Cohn et al., 1982)。Tang等(2012)研究发现用赤霉素和细胞分裂素的混合液浸种会显著提高地菍(Melastoma dodec and rum)的种子萌发率。本研究也发现用这2种植物激素的混合液浸种效果要好于单独使用,但经浸种后的黄瑞香种子的最高萌发率也未超过20%,那么新采收的黄瑞香种子中是否存在其他能促进种子萌发的内源激素还有待于进一步的研究。
生理休眠是种子休眠最常见的一种类型,这种类型表现为种皮能够透水,胚分化发育完全但胚生长能力弱,种子需低温层积或暖层积提高胚的生长能力(Carrick et al., 1994)。而低温层积和干藏是打破植物种子生理休眠的常用方法,能显著提高种子的萌发率(Baskin et al., 2004; 路覃坦等,2009)。尤其是低温层积处理方法,可以软化种皮,增加种子的透水性和通气性,使胚萌发所需的酶和激素等代谢物质以及其他化合物达到足够的水平(Ceccherini et al., 1998)。本研究结果显示,清水浸种24 h后5 ℃湿沙层积90天能有效打破黄瑞香种子休眠,与疏叶香根芹(Osmorhiza aristata var. laxa)种子的研究结果(Walck et al., 2002)一致;扫描电镜图片也直观地反映了低温层积有利于改善黄瑞香致密的种皮结构,从而有助于种子的顺利萌发。但层积时间过长黄瑞香种子萌发率又显著降低,这种长期沙藏导致萌发率下降的原因可能是由于种子所含营养物质经长时间层积消耗过多(Lenartowicz,1988)。本研究结果表明,低温干藏(4 ℃)和暖温干藏(20 ℃)均未有效打破黄瑞香种子的休眠(萌发率分别仅有7.2%和3%),这可能是由于缺乏水分而导致的种子内部激素等代谢物质不能顺利转化,从而不能彻底打破种子的生理休眠。
4 结论黄瑞香种子休眠属于以非深度生理休眠为主的综合休眠,既有胚自身因素,也有内含抑制物质及种皮结构的影响,因此,同时克服致密种皮和有效促进种子生理后熟、分解和转化内源抑制物质是打破其种子休眠的关键环节。本研究采用层积前浸种而后进行时间合理的低温层积方法,打破了黄瑞香种子的休眠,解决了人工种植时种子萌发率低的困难,为野生黄瑞香的开发和人工大规模种植提供指导。
| [1] |
李耀阶.1987.青海木本植物志.西宁:青海人民出版社, 222-224.(Li Y J. 1987. Woody plant of Qinghai. Xining:Qinghai People's Publishing House, 222-224.[in Chinese])( 2) 2)
|
| [2] |
李银, 王凤林, 李书慧, 等. 2008.黄瑞香愈伤组织培养及其二次代谢产物的研究. 北京中医药大学学报, 31(3):199-123. (Li Y, Wang F L, Li S H, et al. 2008. Study on callus culture of D. giraldii and its secondary metabolites. Journal of Beijing University of Traditional Chinese Medicine, 31(3):199-123.[in Chinese])(  1) 1)
|
| [3] |
路覃坦, 张金政, 孙国峰, 等. 2009.四种国产野生无髯鸢尾种子休眠类型的研究. 草业学报, 18(12):130-137. (Lu Q T, Zhang J Z, Sun G F, et al. 2009. Study on the dormancy type of seeds of four species of wildIris in China. Acta Prataculturae Sinica, 18(12):130-137.[in Chinese])(  1) 1)
|
| [4] |
王成瑞, 李士敏, 周炳南, 等. 1987.黄瑞香生物活性二萜的研究.化学学报, 45(10):993-996. (Wang C R, Li S M, Zhou B N, et al. 1987.The studies on the bioactive diterpenes from Daphne giraldii. Acta Chimica Sinica, 45(10):993-996.[in Chinese])(  1) 1)
|
| [5] |
王勤礼, 闫芳, 毛著鸿, 等. 2012.祖师麻(黄瑞香)种子休眠原因初探.中国园艺文摘, 12(2):9-10. (Wang Q L, Yan F, Mao Z H, et al. 2012.The reason of the seed dormancy of Daphne giraldii. Chinese Horticulture Abstract, 12(2):9-10.[in Chinese])(  2) 2)
|
| [6] |
王小平, 王九龄.1998.白皮松种子内含物的提取、分离及生物测定. 种子, (5):19-22. (Wang X P, Wang J L. 1998. Extraction, separation and biological measurement of endogenous growth regulating substance of seeds of Pinus bungeana. Seed, (5):19-22.[in Chinese])(  1) 1)
|
| [7] |
徐本美, 孙运涛, 李锐丽, 等.2007."二年种子"休眠与萌发的研究.林业科学, 43(1):55-62. (Xu B M, Sun Y T, Li R L, et al. 2007.Studies on dormancy and germination of "two-year seeds". Scientia Silvae Sinicae, 43(1):55-62.[in Chinese])(  1) 1)
|
| [8] |
闫芳, 毛著鸿, 王勤礼, 等. 2014.黄瑞香种子生活力测定技术研究.草地学报, 22(1):145-149. (Yan F, Mao Z H, Wang Q L, et al. 2014. Daphne giraldii Nitsche seed viability testing technology. Acta Agrestia Sinica, 22(1):145-149.[in Chinese])(  1) 1)
|
| [9] |
杨文权, 马金星, 寇建村. 2009.披针叶黄华种子硬实与萌发特性研究.种子, 28(4):88-91. (Yang W Q, Ma J X, Kou J C. 2009. Study on the hard and germination characteristics of Thermopsis lanceolata seed. Seed, 28(4):88-91.[in Chinese])(  1) 1)
|
| [10] |
张勇, 刘贤德, 李鹏, 等. 2001.甘肃河西地区维管植物检索表.兰州:兰州大学出版社, 124-126.(Zhang Y, Liu X D, Li P, et al. 2001. Key to the vascular plants in Hexi region of Gansu. Lanzhou:Lanzhou University Press, 124-126.[in Chinese])( 1) 1)
|
| [11] |
周光雄, 杨永春, 石建功. 2006. 祖师麻活性化学成分研究.中国中药杂志, 31(7):555-557. (Zhou G X, Yang Y C, Shi J G. 2006. The study of the active components on Daphne giraldii seed. China Journal of Chinese Materia Medica, 31(7):555-557.[in Chinese])(  1) 1)
|
| [12] |
Baskin J M, Baskin C C. 2004. A classification system for seed dormancy. Seed Sci Res, 14(1):1-16.( 1) 1)
|
| [13] |
Bewley J D, Black M.1994.Seeds:Physiology of development and germination. New York:Plenum Press, 377-341.( 1) 1)
|
| [14] |
Carrick K M, Plyler D B.1994. Interaction of fusicoccin and abscisic acid in breaking and restoring seed dormancy in Spartina alterniflora. ASB Bulletin Association of Southeastern Biologists, 41(2):82.( 1) 1)
|
| [15] |
Ceccherini L, Raddi S, Andreoli C. 1998.The effect of seed stratification on germination of 14 Cupressus species. Seed Science & Technology, 26(1):159-168.( 1) 1)
|
| [16] |
Cohn M A, Butera D L. 1982. Seed dormancy in red rice(Oryza sativa) Ⅱ:response to cytokinin. Weed Science, 30:200-205.( 1) 1)
|
| [17] |
Gusano M G, Gomez P M, Dicenta F. 2004. Breaking seed dormancy in almond(Prunus dulcis(Mill.) D.A. Webb). Scientia Horticulturae, 99(1):363-370.( 1) 1)
|
| [18] |
Kermode A R. 2005. Role of abscisic acid in seed dormancy. Journal of Plant Growth Regulation, 24(7):319-344.( 1) 1)
|
| [19] |
Kimura Y. 1985. Inhibition of the formation of 5-hydroxy-6, 8, 11, 14-eicosatetranenoic acid from arachidonic acid in polymorphonuclear leukocytes by various comarins. Biochem Biophys Acta, 834:224-247.( 1) 1)
|
| [20] |
Lenartowicz A. 1988. Warm-followed-by-cold stratification of mountain-ash(Sorubus aucupariaL.) seeds. Acta Horticulturae, 22(6):231-238.( 1) 1)
|
| [21] |
Li S H, Wu L J, Gao Y H. 2005. A new dicoumarinoid glycoside from Daphne giraldii. Journal of Asian Natural Products Research, 7(6):839-842.( 1) 1)
|
| [22] |
Li B W, Nai W D, Zhao H W. 2012. Two new compounds with cytotoxic activity on the human melanoma A375-S2 cells from Daphne giraldii callus cells. Journal of Asian Natural Products Research, 14(11):1020-1026.( 1) 1)
|
| [23] |
Sun T P, Gubler F. 2004. Molecular mechanism of gibberellin signaling in plants. Annu Rev Plant Physiology and Biochemistry, 55:197-223.( 1) 1)
|
| [24] |
Tang H, Wei J Q, Yang Q H, et al. 2012. Germination and dormancy-breaking of Diren(Melastoma dodecandrum) seeds. Seed Sci & Technol, 40(1):1-10.( 1) 1)
|
| [25] |
Walck J L, Hidayati S N, Okagami N. 2002. Seed germination ecophysiology of the Asian species Osmorhiza aristata(Apiaceae):comparison with its North American congeners and implications for evolution of types of dormancy. American Journal of Botany, 89(5):829-835.( 1) 1)
|
 2016, Vol. 52
2016, Vol. 52

