文章信息
- 慕德宇, 董智, 李周岐
- Mu Deyu, Dong Zhi, Li Zhouqi
- 优良组培白榆无性系对盐分响应的差异性
- Responses of Siberia Elm Clones to Salt Stress
- 林业科学, 2016, 52(3): 36-46
- Scientia Silvae Sinicae, 2016, 52(3): 36-46.
- DOI: 10.11707/j.1001-7488.20160305
-
文章历史
- 收稿日期:2015-11-13
- 修回日期:2016-01-13
-
作者相关文章
2. 山东农业大学林学院 泰安 271018
2. College of Forestry, Shandong Agricultural University Tai'an 271018
海水的NaCl含量约为0.6 mol·L-1(3.5%),而大多数陆地植物很难在其10%(0.35% NaCl)浓度的环境中生长(Waisel,1972)。土壤含盐量在0.2%以上就不利于植物的生长(邴雷等,2008),当土壤盐分超过0.4%会造成植物体液外渗,严重时会导致植物失水死亡(乔慧萍等,2007)。盐分对植物的影响不仅体现在其对生长的抑制作用,而且会引起植物体内生理生化、光合、离子积累等多方面的变化。在光合呼吸方面,盐胁迫可引起植物叶片叶绿素含量降低、光合速率、胞间CO2浓度、气孔导度及蒸腾速率下降等(Allakhverdiev et al.,2000; 鲁少尉等,2012)。同时,盐胁迫会引起植物细胞内氧化还原系统失调,导致大量活性氧的产生而对细胞造成损害,植物可以通过超氧化物歧化酶(SOD)、过氧化物酶(POD)等一系列活性氧保护机制减少活性氧的生成,避免盐伤害(Jaleel et al.,2008); 盐胁迫还会导致植物细胞内大量积累渗透性调节物质,以维持渗透压的稳定(Azooz et al.,2004; 崔强等,2009; 2010)。盐胁迫下,盐离子的吸收会影响植物对其他营养元素的汲取及运输,导致植物体内矿物质元素失调,进而影响植物的正常代谢与生长。不同的植物种或同一种类不同品种的耐盐特性不同,使得其生长特性、组织或细胞的生理生化指标在不同盐浓度胁迫下表现各不相同。
白榆(Ulmus pumila)变种较多,具有抗干旱、耐高温、耐严寒、抗盐碱等特点。近年来,针对白榆植物耐盐性的研究主要集中在耐盐白榆家系、无性系的筛选(李庆贱等,2010; 慕德宇等,2011; 慕德宇,2013)和盐胁迫对白榆生理生化等指标影响等方面(刘炳响,2008; 夏尚光等,2008)。但是有关盐胁迫下白榆无性系耐盐机制,以及对不同耐盐能力的白榆无性系的研究涉及较少。耐盐型与非耐盐型白榆无性系在不同NaCl浓度胁迫下的生理生化和光合特性的表现及其耐盐机制的区别尚不清楚。本研究以前期试验筛选出的耐盐型白榆无性系及非耐盐型白榆无性系为研究对象,在不同浓度NaCl处理下对耐盐能力不同的2组白榆无性系进行对比研究,探索白榆无性系耐盐响应机制。
1 材料与方法 1.1 试验地概况试验地位于泰安市山东农业大学南校区林学试验站(36°06' N,116°08' E),属暖温带半湿润大陆性季风气候区,年平均气温12.8 ℃,年平均降水量741.8 mm,年均相对湿度65%,年均日照时数2 583 h,无霜期平均195天。土壤为中壤土,pH7.0,排灌条件良好。
1.2 试验材料以前期试验为基础,选取耐盐能力强的30号、51号、65225号白榆无性系(统称为耐盐型白榆无性系,下同)以及耐盐能力相对较弱的7号、46号、68号白榆无性系(统称为非耐盐型白榆无性系,下同)组培生根苗作为试验材料,除特别指明无性系号外,下文中均用统称描述其特征。其中30号白榆无性系为14×2④,采集时间2012/05/07; 51号白榆无性系为73006,采集时间2012/04/27; 7号白榆无性系为73001,采集时间2012/05/07; 以上无性系采集地为杉一苗圃,种原地为金乡白洼林场。46号白榆无性系为46,采集时间2012/06/25; 68号白榆无性系为80025,采集时间2012/06/25; 采集地为金乡白洼林场。65225号白榆无性系为65225,采集地杉一苗圃,采集时间2012/04/27,种原地为济南市章丘枣园苗圃。
1.3 试验方法 1.3.1 白榆无性系培育、盐溶液的配制、处理及日常养护选择经过大棚炼苗处理生长良好、无明显病虫害的6个白榆无性系各30盆,运送至山东农业大学南校区林学试验站进行盐胁迫处理试验,盐胁迫处理时间102天。
按照体积质量分别配置相应浓度NaCl盐溶液,其浓度梯度包括: 0,0.3%(3 g·L-1 NaCl)、0.5%(5 g·L-1 NaCl)、0.7%(7 g·L-1 NaCl)、0.9%(9 g·L-1 NaCl)。并将花盆浸泡于相应梯度盐水中进行处理,1周2~3次; 每次浸泡时间不宜过长(6~12 h左右)。每经过6次盐水浸泡后,用清水洗盐1次。
试验期间,各无性系盆栽苗置于带有顶棚的开敞式大棚环境中。在盐水溶液中按体积加入25% Hoagl and (霍格兰溶液)作为营养液; 对照组直接浸泡于25%的营养液中。每次盐处理之后,根据大棚的光线、温度适当轮换调整各盐分梯度栽有白榆无性系苗的花盆的摆放位置,以消除位置效应引起的生长量差异的问题。
1.3.2 生长量测量试验之前测量6个白榆无性系株高、地径、分枝数等; 试验开始之后,每隔20天左右测量1次,在出现死亡现象时开始统计植株的存活率。在试验结束后统计植株地上、地下生物量数据。根据上述指标计算树高增长率、地径增长率,并根据上述数据计算各指标值在不同NaCl处理条件下占对照数据值的百分比。
1.3.3 植株健康状况评价针对盐处理期间植株形态变化进行观察与记录,按照受盐胁迫程度高低给植株打分: 10分为植株正常,未受盐胁迫影响(如受到其他因素影响,如虫害,病害等均算作正常,下同); 8,9分为植株只有叶尖,或很少部分的叶片有部分异常(黄化,褐色斑点),但整体看不出有盐害症状; 6,7分为植株不超过50%叶片或叶缘出现黄化、叶斑、干枯等现象; 4,5分为植株50%~70%出现叶片或叶缘黄化、叶斑、干枯、萎蔫并开始出现落叶现象; 2,3分为植株70%以上叶片或叶缘黄化,叶片干枯或是整体萎蔫或落叶现象; 1分为整体植株呈现濒死状态,没有正常叶片存在; 0分为植株死亡。
1.3.4 生理指标测定盐处理35天后,取不同盐分梯度处理下的植株新鲜叶片,测定可溶性糖含量(Sadasivam et al.,1992)、叶绿素含量(Arnon,1949)、游离脯氨酸含量(Bates et al.,1973)、超氧化物歧化酶活性(Dhindsa et al.,1981)和过氧化物酶活性(Civello et al.,1995)。
1.3.5 叶片光合指标的测定使用CIRAS-2型光合仪,测定各白榆无性系叶片光合作用。选取相同位置的成熟叶片进行测量,每个无性系、每个处理测量6株,每株测量3个以上叶片。测定白榆叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等气体交换参数。叶片水分利用效率(WUE=Pn/Tr)、气孔限制值(Ls =1-Ci/Ca,Ca为大气CO2浓度)、表观叶肉导度(AMC=Pn/Ci)。
1.3.6 元素成分监测试验结束后,将植株根系组织、地上茎部分别做Na+,Cl-含量测定。钠离子检测使用火焰光度计法测定,氯离子浓度采用AgNO3滴定法测定。
1.3.7 数据分析与处理使用SPSS 21数据分析软件对白榆无性系数据进单因素与多因素行方差分析,并使用sigmaplot图形软件作图。
2 结果与分析 2.1 盐胁迫对白榆无性生长的影响 2.1.1 盐胁迫对白榆无性系死亡率影响经过102天的盐胁迫处理之后,6个白榆无性系在不同NaCl梯度处理条件下死亡率统计于表 1。
|
|
耐盐型白榆无性系30号、51号、65225号在各盐分浓度处理条件下均未发现死亡植株。7号、68号白榆无性系在0.7%,0.9% 2个盐分处理中死亡率为100%; 46号白榆无性系在0.9%NaCl盐胁迫下的死亡率达100%。
2.1.2 盐胁迫对白榆无性系植株形态影响经过102天盐分处理,各白榆无性系整体形态评价见表 2。
|
|
6个白榆无性系在盐胁迫条件下均表现出不同程度盐害症状。耐盐型白榆无性系在不同NaCl浓度处理条件下健康评分值高于非耐盐白榆无性系。
2.1.3 盐胁迫对白榆无性系生长和生物量的影响经过102天盐胁迫处理,6个白榆无性系树高增长率、地径增长率、干重均随着NaCl处理浓度的升高而呈现降低趋势(表 3)。
|
|
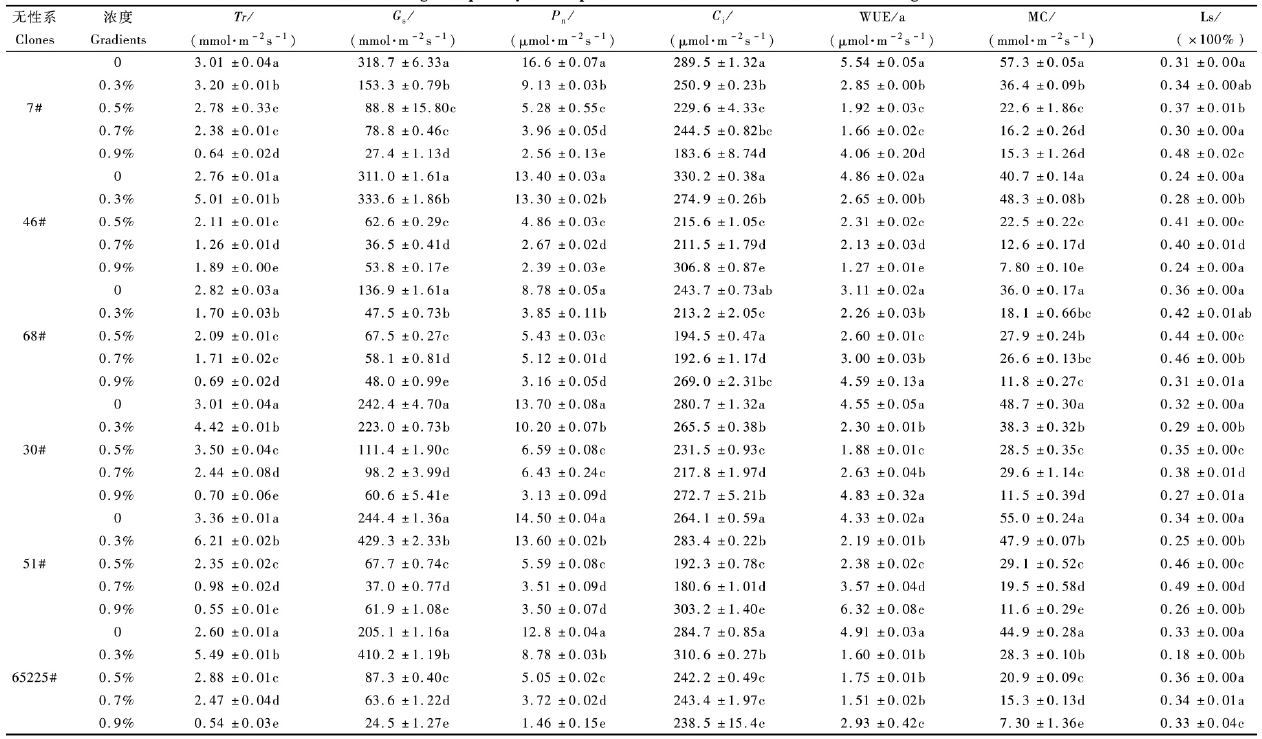
以各组白榆无性系对照处理为基础(100%),计算6个白榆无性系在不同盐分浓度处理条件下的树高增长率百分比、地径增长率百分比、干质量百分比。NaCl盐分处理对白榆无性系树高、地径和生物量生长影响显著(P<0.05),随着盐分浓度的升高,白榆无性系树高、地径以及生物量受到的抑制作用增强。其中耐盐型白榆无性系30号,51号,65225号在0.9% NaCl处理条件下树高增长率、地径增长率与干质量比对照平均降低77.00%,70.78%和47.91%; 非耐盐型白榆无性系在0.9%NaCl处理条件下树高增长率、地径增长率与干质量比对照处理平均降低71.71%,76.34%和46.69%(图 1)。
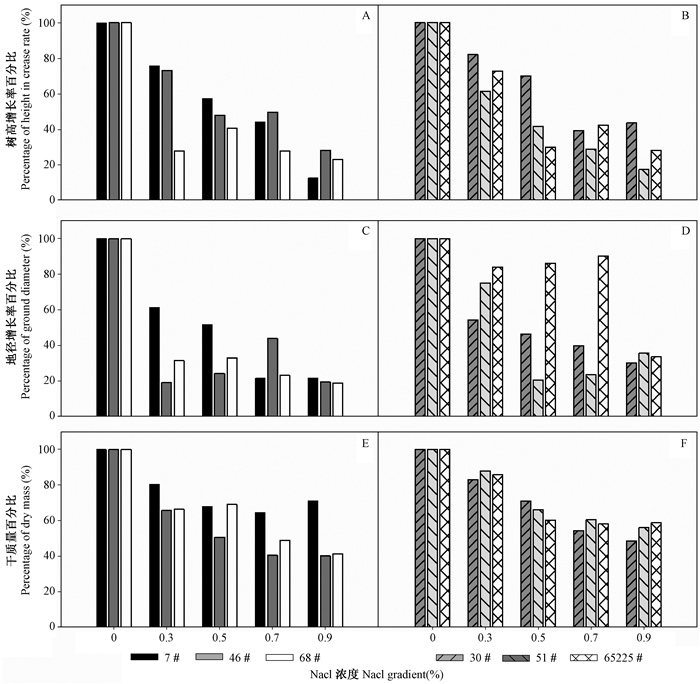 |
图 1 不同NaCl浓度处理下白榆无性系树高(A,B)、地径增长率(C,D)和生物量(E,F)
Fig. 1 The effect of different NaCl gradients on the reduction rate of height(A,B) ground diameter(C,D)
and dry(E,F) compared with controls
|
NaCl胁迫35天后,对6个白榆无性系叶片中POD,SOD酶活性,游离脯氨酸、可溶性蛋白、糖以及叶绿素含量进行分析检测,通过多因素方差分析可知,6个白榆无性系各项指标在不同NaCl浓度处理条件下差异性均极为显著(P<0.01)。
耐盐型白榆无性系POD酶活性在不同处理条件下均随着NaCl浓度的升高呈先升高后下降趋势,非耐盐性无性系呈下降趋势或不规律的下降趋势。耐盐型白榆无性系在0.3%NaCl处理条件下POD酶活性达到最大值,比对照平均升高55.49%; 当NaCl 浓度达到0.9%时,POD酶活性比对照平均降低12.95%,同样浓度下,非耐盐型白榆无性系POD酶活性比对照平均降低44.16%(图 2A)。
 |
图 2 不同浓度NaCl处理对白榆无性系叶绿素、抗氧化酶活性和渗透调节物质变化
Fig. 2 The effect of different NaCl gradients on chlorophyll, antioxidant enzyme and osmotic adjustment substances
|
耐盐型白榆无性系SOD酶活性随着NaCl浓度的升高呈先升高后下降趋势; 在0.3%或0.5%NaCl处理条件下各无性系SOD酶活性达到最大值,比对照平均升高41.95%。相反,在非耐盐型白榆无性系中,SOD酶活性随着NaCl浓度的升高总体呈无规律下降趋势; 在0.9%NaCl浓度条件下,非耐盐型白榆无性系SOD酶活性比对照处理平均降低32.83%(图 2B)。
耐盐型白榆无性系与非耐盐型白榆无性系叶片组织内游离脯氨酸含量均随着NaCl处理浓度的增加呈波动升高趋势。在0.9% NaCl浓度条件下,耐盐型白榆无性系和非耐盐型白榆无性系叶片游离脯氨酸含量均达到最大值,比对照升高326%和508%(图 2C)。
在不同浓度NaCl处理条件下,白榆无性系叶片组织内可溶性蛋白质随着NaCl浓度升高呈波动上升趋势,且非耐盐型白榆无性系叶片组织内平均可溶性蛋白含量均高于耐盐型白榆无性系(图 2D)。
在0.3%和0.5%NaCl浓度条件下白榆无性系叶片内可溶性糖含量下降,低于对照处理; 在0.7%和0.9%NaCl浓度条件下可溶性糖大量积累。在0.9% NaCl浓度下耐盐型白榆无性系叶片内可溶性糖含量大量积累,比对照升高100.8%,而非耐盐型白榆无性系仅比对照升高29.1%(图 2E)。
随着NaCl浓度的升高,白榆无性系叶绿素含量呈下降趋势。在0.9%NaCl浓度条件下耐盐型与非耐盐性白榆无性系叶绿素平均含量比对照分别降低50.5%和65.8%(图 2F)。
2.3 NaCl胁迫对白榆无性系离子分布影响NaCl胁迫试验结束后(102天),检测6个白榆无性系茎段、根系部位Na+与Cl-含量,6个白榆无性系各离子在不同NaCl浓度处理条件下差异性均极显著(P<0.01)。随着NaCl浓度的增加,耐盐型白榆无性系与非耐盐型白榆无性系根系、茎段内Na+含量均呈现出上升趋势; 且随着NaCl浓度的增高,钠离子含量在根系中的积累增加(图 3)。
 |
图 3 不同浓度NaCl处理条件下白榆无性系根系、茎段Na+含量变化
Fig. 3 The changes of Na+ content in root and shoots under different NaCl gradients
A:非耐盐型白榆无性系根系钠离子含量; B:耐盐型白榆无性系根系中钠离子含量;
C:非耐盐型白榆无性系茎段钠离子含量; D:耐盐型白榆无性系茎段中钠离子含量 A:Root Na+ content in salt-sensitive clones; B:Root Na+ content in salt-tolerance clones; C:Shoots Na+ content in salt-sensitive clones; D:Shoots Na+ content in salt-tolerance clones. |
非耐盐型白榆无性系根系中Cl-含量随着NaCl浓度的增加呈上升趋势。在0.9%NaCl处理条件下,根系中Cl-含量比对照处理平均升高123.43%(图 4A)。非耐盐白榆无性系,根系中Cl-含量在0.7%NaCl浓度条件下达到最大值,比对照处理平均升高70.18%(图 4B)。白榆无性系(30号除外)茎段Cl-在NaCl胁迫条件下含量迅速降低(图 4C); 随着NaCl浓度的增加,茎段内Cl-含量缓慢升高(图 4D)。
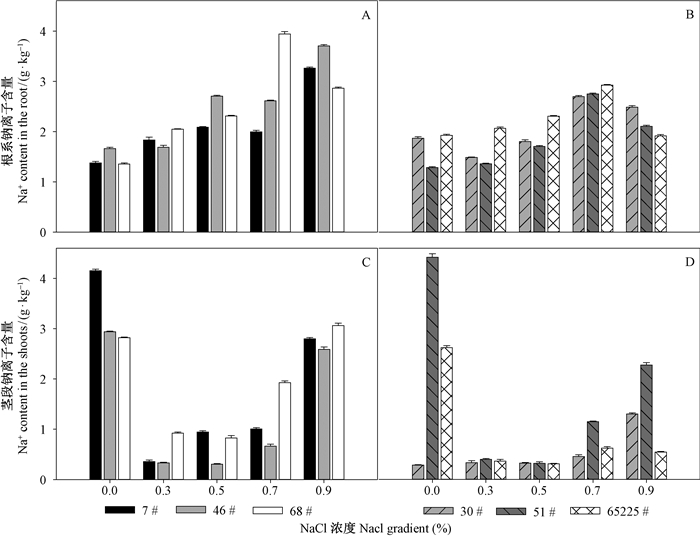 |
图 4 不同浓度NaCl处理条件下白榆无性系根系、茎段Cl-含量变化
Fig. 4 The changes of Cl- content in root and shoots under different NaCl gradients
A:非耐盐型白榆无性系根系氯离子含量; B:耐盐型白榆无性系根系中氯离子含量;
C:非耐盐型白榆无性系茎段氯离子含量; D:耐盐型白榆无性系茎段中氯离子含量 A:Root Cl- content in salt-sensitive clones; B:Root Cl- content in salt-tolerance clones; C:Shoots Cl- content in salt-sensitive clones; D:Shoots Cl- content in salt-tolerance clones. |
由表 4可知,盐胁迫35天后,6个白榆无性系光合速率(Pn)呈显著下降趋势(P<0.05)。在耐盐型白榆无性系中,叶片蒸腾速率在0.3%和(或)0.5% NaCl条件下均较对照显著升高(P<0.05); 在非耐盐型白榆无性系中,7号、46号白榆无性系在0.3%NaCl条件下均较对照处理显著升高(P<0.05),68号白榆无性系在此浓度处理下较对照处理显著降低(P<0.05)。各白榆无性系在NaCl处理条件下,气孔导度(Gs)、胞间CO2浓度(Ci)、表观叶内导度(AMC)均呈现出下降趋势(P<0.05)。46号、65225号白榆无性系中,随着NaCl处理浓度的增加,水分利用效率(WUE)显著降低; 相反,68号、30号、51号白榆无性系在0~0.7%NaCl条件下WUE显著下降; 在0.9%NaCl条件下WUE升高且达到最大值。在非耐盐型白榆无性系中,不同浓度NaCl处理条件下,气孔限制百分率(Ls)总体呈现上升趋势(P<0.05); 在耐盐型白榆无性系中,气孔限制百分率并不随NaCl处理浓度增加而有规律变化。
|
|
盐胁迫对植物的危害表现为改变植物的(促进或抑制)生长、形态,打破生理、生化反应平衡(改变酶活性,使渗透调节物质含量升高或降低)(Ashraf,2009)。在盐胁迫与植物耐盐性研究中,植株存活率是反应植物耐盐能力的可靠指标(张川红等,2002)。NaCl被认为是导致植物受盐胁迫后生长受到抑制甚至死亡的主要因素,20 mmol·L-1(0.117%)NaCl含量就可对植物生长起到抑制作用(Saied et al.,2005)。对杨树(Populus × euramericana 'Zhonglin-46’)、核桃(Juglans regia)、龙爪槐(Sophora japonica)、沙枣(Elaeagnus angustifolia)等木本植物的研究中发现,随着NaCl浓度的增加,植株生物量明显下降甚至死亡(张川红等,2002; 杨升等,2015)。本试验表明,在非环境控制条件下,白榆无性系生长量随NaCl浓度的增加而明显下降。较高浓度(≥0.7%)NaCl处理盐分胁迫对耐盐型与非耐盐型白榆无性系生长量抑制均较大,且可以引起部分非耐盐性白榆无性系的死亡。
随着盐胁迫程度的增加,植物体内活性氧(ROS)大量积累,从而对植物细胞造成损伤(Mudgal et al.,2010),为了应对活性氧的产生,植物体内会启动一系列活性氧清除系统(抗氧化酶系统),以减少活性氧积累对植物造成的伤害,提高植物的耐盐能力(Zhang et al.,2011)。通过对耐盐型与非耐盐型白榆无性系对比研究发现(图 2A,B): 在盐胁迫条件下,耐盐型白榆无性系POD,SOD酶活性随NaCl浓度的升高呈现出先升高后下降趋势,在较高NaCl浓度处理条件下耐盐型白榆无性系SOD酶活性相对非耐盐白榆无性系保持在较高水平。耐盐型白榆无性系可以通过提高组织内抗氧化酶活性来减少活性氧的积累,进而提高白榆无性系耐盐能力。
渗透胁迫和离子毒害是影响植物生长发育的主要因素,而盐分胁迫条件下,细胞内含物质的积累在一定程度上可以帮助植物细胞维持水分的平衡,提高植物的耐盐能力(Horie et al.,2012)。对喜树(Camptotheca acuminata)、五叶地锦(Parthenocis susquinquefolia)的研究中发现,NaCl胁迫处理条件下,细胞内可溶性糖、游离脯氨酸、可溶性蛋白等含量呈现增高趋势(张露婷等,2011; 刘会超等,2004)。本试验中,耐盐型白榆无性系与非耐盐型白榆无性系叶片组织内游离脯氨酸含量以及可溶性蛋白含量均随着NaCl处理浓度的增加呈现出波动升高趋势,且非耐盐型白榆无性系游离脯氨酸、可溶性蛋白含量相对增幅均超过耐盐型白榆无性系。由此表明,白榆无性系组织内游离脯氨酸与可溶性蛋白含量的积累对白榆无性系耐盐能力的提高影响较小或呈负相关。相反,耐盐型白榆无性系组织内可溶性糖含量在高浓度NaCl处理条件下大量积累,在0.9%NaCl处理下可溶性糖含量均超过非耐盐型白榆无性系,这表明在高NaCl浓度处理条件下耐盐型白榆无性系可以通过在细胞内大量积累可溶性糖含量来提高白榆无性系的耐盐能力。
盐分胁迫条件下,盐离子的吸收导致植物体内矿物质元素失调,进而影响植物的正常代谢与生长过程,同时在Na+运输方式中,大多数植物将过多的Na+储存于根系中,当植物根系中Na+达到一定阈值时,根系将过量的Na+运输至地上部位(马焕成等,1998; 杨升等,2012)。本试验结果也表明,NaCl处理条件下,随着盐分梯度的增加,耐盐型白榆无性系与非耐盐型白榆无性系Na+,Cl-在根系部位大量积累,以减少对地上茎部的运输,对地上部分起保护作用。
对楸树(Catalpa bungei)、常绿白蜡(Fraxinus griffithii)、北美红栎(Quercus rubra)、桑树(Morus alba)、沙枣等树种的研究发现,随着盐分处理浓度的增加(1‰~3‰),植物叶片叶绿素含量,光合、蒸腾速率,气孔导度等值呈现明显下降趋势(朱振贤,2007; 柯裕州等,2009; 刘正祥等,2014; Feng et al.,2014)。在本试验中,经过35天NaCl处理得到类似结论,且各白榆无性系光合指标变化趋势相似,表明盐分胁迫条件下白榆无性系组培盆栽苗耐盐能力与叶片光合特性无关。
3.2 结论1)通过白榆无性系组培盆栽苗研究发现,随着NaCl浓度的升高,白榆无性系生长量呈现下降趋势; 叶片细胞内抗氧化酶活性呈现出先升高后降低趋势; 渗透调节物质在叶片组织内大量积累; Na+、Cl-在组织内含量呈现升高趋势,但Na+、Cl-在根系部位大量积累,以减少对地上茎部的运输; 叶绿素含量、光合速率均呈现下降趋势。
2)通过对耐盐型白榆无性系与非耐盐型白榆无性系盐胁迫响应机制对比发现,2组白榆无性系在生长量、POD酶活性、游离脯氨酸含量变化、可溶性蛋白、细胞内盐离子含量分布及变化、光合特性等方面表现出相类似或无明显规律的变化趋势; 与此相反,耐盐型白榆无性系细胞中可溶性糖含量、SOD酶活性在高浓度NaCl处理条件下与非耐盐型白榆无性系呈现出相较大差异或相反的变化规律。这表明细胞内可溶性糖含量与SOD酶活性对白榆无性系耐盐能力强弱以及盐胁迫条件下存活率提高具有重要作用,可以作为白榆无性系耐盐机制的重要指标。
| [1] |
邴雷,赵宝存,沈银柱,等. 2008.植物耐盐性及耐盐相关基因的研究进展.河北师范大学学报:自然科学版, 32(2):243-248. (Bing L,Zhao B C,Shen Y Z, et al. 2008. Progress of study on salt Tolerance and salt tolerant related genes in plant. Journal of Hebei Normal University:Natural Science Edition, 32(2):243-248[in Chinese]).(  1) 1)
|
| [2] |
崔强,王庆成,刘强,等.2010.3种木本植物对NaHCO3胁迫生理响应的比较.东北林业大学学报, 38(5):13-15. (Cui Q,Wang Q C, Liu Q, et al. 2010. Physiological responses od three woody species to NaHCO3 stress. Journal of Northeast Forestry University, 38(5):13-15[in Chinese]).(  1) 1)
|
| [3] |
柯裕州,周金星,张旭东,等. 2009.盐胁迫对桑树幼苗光合生理生态特性的影响.林业科学, 45(8):61-66. (Ke Y Z, Zhou J X, Zhang X D, et al. 2009. Effects of salt stress on photosynthetic characteristics of mulberry seedlings. Scientia Silvae Sinicae, 45(8):61-66[in Chinese]).(  1) 1)
|
| [4] |
李庆贱,陈志强,时瑞亭,等. 2010.白榆家系苗期耐盐碱研究.北京林业大学学报, 32(5):74-81. (Li Q J, Chen Z Q, Shi R T, et al. 2010. Alkaline-salt tolerance indices of Ulmus pumila L. seedling and family evaluation on alkaline-salt tolerance.Journal of Beijing Forestry University, 32(5):74-81[in Chinese]).(  1) 1)
|
| [5] |
刘会超,孙振元,彭镇华. 2004. NaCl胁迫对五叶地锦生长及某些生理特性的影响.林业科学, 40(6):63-67. (Liu H C, Sun Z Y, Peng Z H. 2004. Effect of salt stress on the growth and some physiological characteristics in Parthenocissus quinquefolia cuttings. Scientia Silvae Sinicae, 40(6):63-67[in Chinese]).(  1) 1)
|
| [6] |
刘炳响. 2008.白榆耐盐差异性研究.保定:河北农业大学博士学位论文. (Liu X B. 2008. Studies of the difference of salt resistance of Ulmus Pumila. Baoding:PhD thesis of Agricultural University of Hebei[in Chinese]).(  1) 1)
|
| [7] |
刘正祥,张华新,杨升,等. 2014. NaCl胁迫对沙枣幼苗生长和光合特性的影响.林业科学, 50(1):32-40. (Liu Z X, Zhang H X, Yang S, et al. 2014. Effects of NaCl stress on growth and photosynthetic characteristics of Elaeagnus angustifolia Seedlings. Scientia Silvae Sinicae, 50(1):32-40[in Chinese]).(  1) 1)
|
| [8] |
鲁少尉,齐飞,李天来.2012.NaCl及等渗PEG胁迫对番茄叶片光合特性及蔗糖代谢的影响.华北农学报,27(3):136-141. (Lu S W, Qi F, Li T L. 2012. Effect of NaCl and PEG iso-osmotic stresses on photosynthetic characteristics and sucrose metabolizing in tomato leaf. Acta Agriculturae Boreali-Sinica, 27(3):136-141[in Chinese]).(  1) 1)
|
| [9] |
马焕成,王沙生. 1998.盐胁迫下胡杨的离子响应.西南林学院学报, 18(1):43-48. (Ma H C, Wang S S. 1998. Ion response of P.euphraticato salt stress. Journal of Southwest Forestry College, 18(1):43-48[in Chinese]).(  1) 1)
|
| [10] |
慕德宇. 2012.白榆优良无性系组织培养的耐盐碱筛选研究.杨陵:西北农林科技大学硕士学位论文. (Mu D Y. 2012. Screening of salt-alkali tolerance of tissue cultured Ulmus pumila clones. YangLing:MS thesis of Northwest A&F University.[in Chinese]) |
| [11] |
慕德宇. 2013.离体培养条件下12个白榆优良无性系氯化钠盐分抗性筛选的研究.山东大学学报:理学版, 48(3):19-23. (Mu D Y. 2013. A research of screening of salt-tolerance of 12 elm clones in vitro culture. Journal of Shandong University:Natural Science, 48(3):19-23[in Chinese]).(  1) 1)
|
| [12] |
慕德宇,王强,吉文丽. 2011. 21个白榆无性系差异性分析与评价.山东大学学报:理学版, 46(11):8-11. (Mu D Y, Wang Q, Ji W L. 2011. Analysis and evaluation of 21 kinds of elm variations population diversity. Journal of Shandong University:Natural Science, 46(11):8-11[in Chinese]).(  1) 1)
|
| [13] |
夏尚光,张金池,梁淑英. 2008. NaCl胁迫对3种榆树幼苗生理特性的影响.河北农业大学学报, 31(2):52-56. (Xia S G, Zhang J C, Liang S Y. 2008. Effect of NaCl stress on physiological characteristics of three elm species seedlings. Journal of Agricultural University of Hebei, 31(2):52-56[in Chinese]).(  1) 1)
|
| [14] |
杨升,张华新,刘涛. 2012.盐胁迫对16种幼苗渗透调节物质的影响.林业科学研究, 25(3):269-277. (Yang S, Zhang H X, Liu T. 2012. Effect of salt stress on osmotic adjustment substances in plants. Forest Research, 25(3):269-277[in Chinese]).(  1) 1)
|
| [15] |
杨升,张华新,杨秀艳,等. 2015. NaCl胁迫下不同种源沙枣的生长表现差异.林业科学, 51(9):52-58. (Yang S, Zhang H X, Yang X Y, et al. 2015. Differential growth performance of Elaeagnus angustifolia Provenances under NaCl stress. Scientia Silvae Sinicae, 51(9):52-58[in Chinese]).(  1) 1)
|
| [16] |
张川红,沈应柏,尹伟伦,等. 2002.盐胁迫对几种苗木生长及光合作用的影响.林业科学, 38(2):27-31. (Zhang C H, Shen Y B, Yin W L, et al. 2002. Effect of salt stress on photosynthesis and growth of four tree species seedlings. Scientia Silvae Sinicae, 38(2):27-31[in Chinese]).(  2) 2)
|
| [17] |
张露婷,吴江,梅丽,等. 2011.喜树种源耐盐能力评价及耐盐指标筛选.林业科学, 47(11):66-72. (Zhang L T, Wu J, Mei L, et al. 2011. Saline tolerance of Camptotheca acuminata provenances and the index selection for saline tolerance. Scientia Silvae Sinicae, 47(11):66-72[in Chinese]).(  1) 1)
|
| [18] |
朱振贤. 2007.几种主要造林树种盐胁迫响应及耐盐机理研究.南京:南京林业大学硕士学位论文. (Zhu Z X. 2007. Studies on effects and salt-tolerance mechanism of several planting species under salt stress. Nanjing:MS thesis of Nanjing Forestry University[in Chinese]).(  1) 1)
|
| [19] |
Allakhverdiev,Suleyman I. 2000. Ionic and osmotic effects of NaCl-induced inactivation of photosystems I and II in Synechococcus sp. Plant physiology, 123(3):1047-1056.( 1) 1)
|
| [20] |
Jaleel C A, Lakshmanan G M A, Gomathinayagam M, et al. 2008.Triadimefon induced salt stress tolerance in Withania somnifera and its relationship to antioxidant defense system. South African Journal of Botany, 74(1):126-132.( 1) 1)
|
| [21] |
Arnon D I. 1949. Copper enzymes in isolated chloroplasts-poly phenol oxidase in Beta-Vulgaris. Plant Physiology, 24(1):1-15.( 1) 1)
|
| [22] | Ashraf M,Ali Q. 2008. Relative membrane permeability and activities of some antioxidant enzymes as the key determinants of salt tolerance in canola (Brassica napus L.). Environmental and Experimental Botany, 63(1/3):266-273. |
| [23] |
Azooz M M,Shaddad M A,Abdel-Latef A A. 2004.The accumulation and compartmentation of proline in relation to salt tolerance of three sorghum cultivars. Indian Journal of Plant Physiology,9(1):1-8.( 1) 1)
|
| [24] |
Bates L S, Waldren R P, Teare I D. 1973. Rapid determination of free proline for water-stress studies. Plant and Soil, 39(1):205-207.( 1) 1)
|
| [25] |
Civello P M, Martinez G A, Chaves A R, et al. 1995. Peroxidase from strawberry fruit (Fragaria Ananassa-Duch)-partial-purification and determination of some properties. Journal of Agricultural and Food Chemistry, 43(10):2596-2601.( 1) 1)
|
| [26] |
Dhindsa R S, Matowe W. 1981. Drought tolerance in 2 mosses-correlated with enzymatic defense against lipid-peroxidation. Journal of experimental Botany, 32(126):79-91.( 1) 1)
|
| [27] |
Feng Z T, Deng Y Q, Fan H, Sun QJ, Sui N, Wang BS.2014. Effects of NaCl stress on the growth and photosynthetic characteristics of Ulmus pumila L. seedlings in sand culture. Photosynthetica, 52(2):313-320.( 1) 1)
|
| [28] |
Horie T, Karahara I, Katsuhara, M. 2012. Salinity tolerance mechanisms in glycophytes:an overview with the central focus on rice plants. Rice, 5(1):11.( 1) 1)
|
| [29] |
Mudgal V, Madaan N, Mudgal A. 2010. Biochemical mechanisms of salt tolerance in plants:a review. International Journal of Botany, 6(2):136-143.( 1) 1)
|
| [30] | Sadasivam S, Manickam A. 1996. Biochemical methods (revised second edition). New age international, New Delhi. |
| [31] |
Saied A S, Keutgen A J, Noga G. 2005. The influence of NaCl salinity on growth, yield and fruit quality of strawberry cvs. ‘Elsanta’ and ‘Korona’. Scientia Horticulturae, 103(3):289-303.( 1) 1)
|
| [32] |
Waisel Y.1972. Biology of halophytes. Physiological ecology. New York:Academic Press.( 1) 1)
|
| [33] |
Zhang H, Han B, Wang T, et al. 2011. Mechanisms of plants salt response:insights from proteomics. Journal of Proteome research 11(1):49-67.( 1) 1)
|
 2016, Vol. 52
2016, Vol. 52