文章信息
- 梁艳, 沈海龙, 高美玲, 范震宇, 朱琨, 陈阳, 张鹏, 杨玲
- Liang Yan, Shen Hailong, Gao Meiling, Fan Zhenyu, Zhu Kun, Chen Yang, Zhang Peng, Yang Ling
- 红松种子发育过程中内源激素含量的动态变化
- Content Dynamics of Endogenous Hormones in Different Seed Developmental Stages of Korean Pine
- 林业科学, 2016, 52(3): 105-111
- Scientia Silvae Sinicae, 2016, 52(3): 105-111.
- DOI: 10.11707/j.1001-7488.20160213
-
文章历史
- 收稿日期:2015-01-29
- 修回日期:2015-06-22
-
作者相关文章
2. 齐齐哈尔大学生命科学与农林学院 齐齐哈尔 161006
2. School of Life Sciences and A & F, Qiqihar University Qiqihar 161006
植物激素在植物胚胎发育、种子萌发、营养生长、果实成熟、叶片衰老等植物生长发育的各阶段均发挥重要的作用,其中种子和胚胎发育过程受到植物激素的调控,尤其是生长素(IAA)、细胞分裂素(ZR)、赤霉素(GAs)和脱落酸(ABA),激素合成、运输和信号转导等调控网络的相关研究为胚胎发育过程及作用机制的深入研究奠定基础(许智宏等,2012;Pullman et al.,2014)。近年来对于植物种子发育过程中内源激素变化的分析多集中于被子植物,裸子植物的种子发育过程内源激素的研究相对较少,仅有关于火炬松(Pinus taeda)、欧洲赤松(Pinus sylvestris)、白云杉(Picea glauca)、窄叶南洋杉(Araucaria angustifolia)、花旗松(Pseudotsuga menziesii)的生长素和脱落酸的研究(Sandberg et al.,1987;Kapik et al.,1995;Kong et al.,1997;Carrier et al.,1999;Chiwocha et al.,2002;Astarita et al.,2003;Silveira et al.,2004),而对于红松(Pinus koraiensis)种子发育过程中内源激素的研究未见相关报道。
红松是温带地带性顶极群落—阔叶红松林的建群种,木材材质优良,其果实营养丰富,是我国及东亚地区极其重要的优质珍贵用材树种和坚果树种(Cairney et al.,2007;Chen et al.,2010)。由于针叶树合子胚的发育主要由周围的雌配子体提供营养来源,因此开展红松胚胎生长发育环境中雌配子内化学物质的研究可为探明红松胚胎发育生理过程及其分子作用机理奠定基础,同时为红松杂交育种、胚培养、人工授精以及分子育种等方面提供理论依据。此外,由于红松生产周期长、种子结实率低、子代优良性状降低等问题限制了其生产的大量应用,而体胚发生技术不仅在植物的遗传改良和产业化快速繁殖等方面有着重要实践意义,也是开展植物发育生物学理论研究的理想模型(梁艳等,2012)。体胚发生与合子胚发育过程中生物化学物质合成方式类似(Jimenez,2005;Pullman et al.,2014),研究合子胚发育过程中的生物化学、生理学等方面的变化可以为体胚发生中更好的模拟合子胚发育环境条件提供参考。本研究旨在通过分析红松胚胎发育过程中4个重要阶段雌配子体(含合子胚)的IAA,ZR,GAs、ABA 4种内源激素的动态变化,揭示内源激素在红松合子胚形态发育过程调控作用,也可为红松体胚发生研究中相应外源激素的添加种类和浓度提供参考。
1 材料与方法 1.1 试验材料红松未成熟球果采自黑龙江省苇河红松种子园中开放授粉的057,059 2个无性系,取材时参照马尾松(Pinus massoniana)研究中种子的取材方法(Silveira et al.,2004; Yan et al.,2012),每个无性系分别采集固定单株上向阳中部的3个球果,从6月15日—8月15日每隔1周进行样品采集,未成熟球果采集后用冰盒在24 h内带回实验室后立即去除种鳞和种皮取出种子,在每个球果的中间部分选择健康发育的种子,采用体视解剖镜(OLYMPUS SZX7)进行种子形态学和胚胎发育时期鉴定并拍照,将分别处于原胚团、裂生多胚、柱状胚、子叶胚前期中同一个发育时期的种子分别取出,相同无性系的每个球果中各取20粒种子(包含雌配子体和合子胚)均匀混合,液氮速冻后-80 ℃保存,用于植物内源激素的提取。
1.2 试验方法植物内源激素的测定采用酶联免疫吸附测定法(ELISA),试剂盒由中国农业大学作物化控室提供,分别检测赤霉素(GAs)、吲哚乙酸(IAA)、玉米素核苷(ZR)及脱落酸(ABA)的含量,植物激素提取测定方法参照试剂盒附带操作说明书进行,3次重复。
1.3 数据分析试验数据采用Microsoft Excel 2003和SPSS17.0 分析软件进行分析处理,用邓肯氏新复极差法(Duncan)进行显著性检验。
2 结果与分析 2.1 红松胚胎发育过程连续2年跟踪监测结果表明,6月中下旬红松胚胎处于原胚期,种子呈透明状,内部溶蚀腔尚未形成,珠孔闭合(图 1A);7月初原胚柄延长将末端的初生胚细胞推入雌配子体,雌配子体的溶蚀腔随着胚柄伸长而扩大空间并推动胚胎更深入到雌配子体中,先后经历裂生多胚期(图 1B,C)和柱状胚期(图 1D,E);裂生多胚期的特点为胚柄进一步发育同时出现多个初级胚胎,该阶段种子较原胚期种子体积增大,去掉种皮后的种子逐渐变为不透明,种子内出现溶蚀腔及2个或2个以上的具有胚头和胚柄的胚胎,珠孔打开,随后多个胚胎之间出现竞争,保留1个优势胚胎(极少有2个)进一步发育(其他幼胚都在胚胎选择时逐渐退化解体)最终发育成种子的成熟胚;7月中旬红松胚胎发育成为1个伸长的圆柱体,胚胎发育进入柱状胚期,该时期种子变为不透明,内部溶蚀腔变的更大,优势柱状胚的胚头变大,胚柄伸长;7月底至8月初,种子形态进一步增大,大小与成熟时接近,去除种皮后的种子呈现不透明的乳白色,外观接近成熟胚,种子内部胚柄退化,胚胎发育至具根分生组织、芽分生组织,并分化出子叶,此时为子叶前期(图 1F,G)。
 |
图 1 不同发育阶段的红松种子形态
Fig. 1 Morphology of Korean pine seeds at different developmental stages
|
1)ZR含量 2个无性系的不同发育阶段红松雌配子体ZR含量变化的结果如图 2A,整体来看ZR含量在2个无性系中均呈现下降趋势;在原胚期ZR含量最高,057和059中分别为12.901和13.622 4 ng ·g-1FW,随后的发育过程中含量逐渐降低,在子叶前期ZR含量降至最低,057和059中含量分别为5.388 5和7.398 5 ng ·g-1FW,原胚期的含量约为子叶前期含量的2倍。方差分析结果表明,2个无性系中原胚期内源ZR含量均显著高于后面3个发育时期(P<0.05),裂生多胚期与柱状胚期差异不显著,但显著高于子叶前期,在接近种子成熟的干燥期含量最低。本结果表明,ZR在红松胚胎发育前期作用明显,随着胚胎的发育作用逐渐降低。
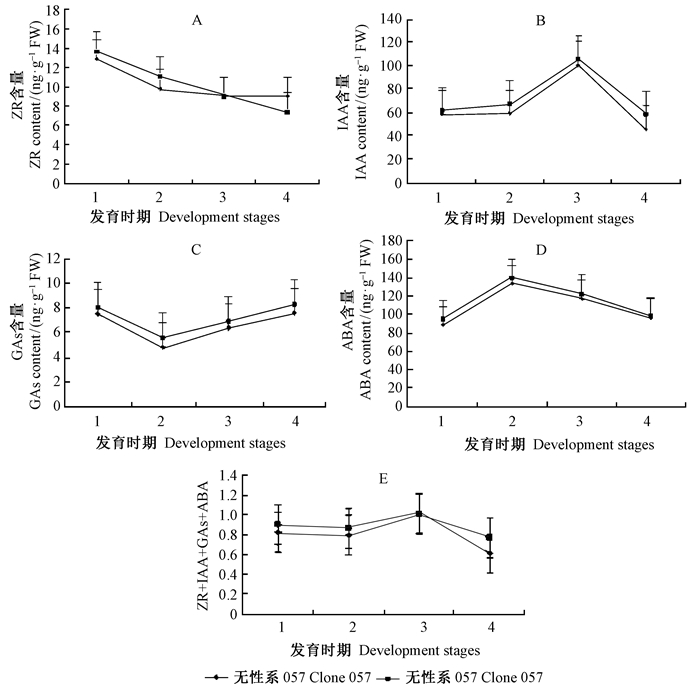 |
图 2 不同发育时期红松种子内源激素含量变化
Fig. 2 The changes of endogenous hormone content at different developmental stages of Korean pine seeds
|
2)IAA含量 2个无性系不同发育阶段红松雌配子体中内源IAA的含量呈现相同的动态变化趋势(图 2B),从原胚期至裂生多胚期含量略有增加,而随后的裂生多胚期至柱状胚期增加幅度变大,柱状胚期含量达到整个发育过程中的最高值,无性系057和059含量分别为101.923 0和107.256 4 ng ·g-1FW,子叶胚前期含量最低,无性系057和059含量分别为46.957 5 ng ·g-1FW和59.650 2 ng ·g-1FW。方差分析表明,4个发育时期的IAA含量均差异显著,柱状胚期含量显著高于其他时期,此外,IAA与ZR,GA相比含量全程均维持在较高的水平。由此笔者推测IAA在原胚期至柱状胚期作用显著,发育至子叶前期胚胎发育分化基本完成时生长素作用减弱。
3)GAs含量 2个无性系供试材料中GAs含量动态变化趋势一致,均呈现先降低后增加的变化趋势(图 2C),在原胚期GAs含量较高,发育至裂生多胚期含量降低,此时无性系057和059含量分别为4.823 5和5.588 8 ng ·g-1FW,柱状胚期含量再次增加,该趋势一直持续至子叶胚前期达到峰值(含量分别为7.536 5,8.040 ng ·g-1FW)。方差分析表明,原胚期与子叶胚前期GAs含量差异不显著,但显著高于裂生多胚期和柱状胚期的GAs含量,这表明种子发育全程GAs含量均维持较低的水平,据此推测GAs在胚胎发育过程中的作用不显著。
4)ABA含量 2个无性系供发育全程内源ABA含量相对较高,数值与IAA含量接近,且在2个无性系中变化趋势基本一致,均呈现先上升后递减的趋势(图 2D)。在原胚期含量为4个发育期的最低,此时无性系057和059中含量分别为88.497 4和94.847 3 ng ·g-1FW,随后一直保持上升的趋势直至发育至裂生多胚期达到最高水平(含量分别为133.200 1和139.983 9 ng ·g-1FW),在裂生多胚期、柱状胚期和子叶胚前期ABA含量呈现持续递减的动态变化,发育至子叶胚前期ABA含量降至最低,接近原胚期的水平。方差分析表明,裂生多胚期ABA含量显著高于其他各时期的值,除无性系057原胚期外,其余各时期ABA含量与子叶前期差异均显著。ABA在红松胚胎发育过程中尤其是中后期的胚胎形态建成及成熟早期阶段起着关键性作用。
5)胚胎发育过程中内源激素含量比值不同植物激素对植物生理活动的影响既相互制约又相互促进。整体来看,2个无性系的种子的内源激素含量的比值在0.621~1.016,波动幅度较大。由图 2E可知,ZT+ IAA+GAs/ABA的比值整体呈现先增加后降低,且供试的2个无性系变化趋势一致。前3个发育时期的ZT+ IAA+GAs/ABA相对值显著高于子叶前期的值,无性系057和059子叶期的激素含量比值分别为0.621和0.771,最高值出现在柱状胚期,其中柱状胚期的激素含量的比值分别为1.016和1.007,柱状胚的比值显著高于原胚期和裂生多胚期的值,而原胚期和裂生多胚期比值差异不显著。由此可知:在红松胚胎发育的早期促进生长类的激素占主导地位,而形态建成及分化基本完成之后的发育逐渐由抑制生长、促进成熟和有机物积累的激素起作用。
3 讨论 3.1 ZR含量变化ZR含量的变化现在细胞分裂和蛋白质合成过程中起重要的作用,细胞分裂素有利于雌配子体的细胞分裂、伸长及原胚期胚胎发育所需的养分吸收(樊卫国等,2004)。本研究结果表明,ZR含量在红松胚胎发育4个关键时期的变化较为明显,在原胚期的ZR含量最高,在随后的发育过程中ZR含量持续降低,由此推测红松胚胎发育细胞分裂素的影响表现为前期作用显著,随着胚胎的发育作用逐渐减弱,接近种子脱水干燥期细胞分裂素作用最小,该研究结果与前人对于其他植物种子发育中的研究结论一致(Chiwocha et al.,2002)。由此推测在红松种子发育原胚期可能通过高水平的ZR诱导细胞分裂、促进细胞伸长并促进营养物质向种子转移;随后在裂生多胚期、柱状胚期和子叶胚期ZR含量逐渐降低,这可能是由于种子发育后期生长速度变慢,仅需要低水平的ZR。此外,在针叶树的体胚发生研究中,通常在胚性愈伤组织的诱导阶段需要添加高水平的外源ZR类激素(如6-BA,KT),而在诱导原胚和体胚成熟期中仅需要低水平的ZR(Pullman et al.,2014),体胚中的上述研究结果与本研究中ZR含量变化趋势相一致。
3.2 IAA含量的变化IAA是种子发育期间主要作用的生长素类物质,在胚胎发育过程中IAA含量的变化被认为是胚胎发生的早期信号,高水平的IAA与种子的生长发育阶段相关联,通过细胞伸长实现种子的膨大(Kong et al., 1997;Thomas et al.,2002;Pullman et al.,2014)。本试验结果表明,在红松种子胚胎发育前3个发育时期IAA含量持续上升,发育至柱状胚期达到峰值,随后降低,由此可见IAA在红松胚胎发育过程中起重要作用,尤其在发育前期作用显著(原胚期至柱状胚期);该研究结果与火炬松、南洋杉等合子胚发育过程中的IAA的研究结果类似(Chiwocha et al.,2002;Silveira et al.,2004;Monika et al.,2013)。生长素在胚胎发育早期的胚胎分化事件和胚胎双侧对称的形成过程中起重要的作用,如在云杉的胚胎发育过程中器官组织的开始分化期伴随着生长素含量的增加(Kong et al.,1997;Carrier et al.,1999),本研究中IAA峰值出现在柱状胚期可能是在该发育阶段分生组织开始发育前需要更多的IAA含量来维持更强的胚胎细胞活性(Pipino et al.,2013;Bosco et al.,2015),在种子发育后期IAA含量降低可能是由于自由态IAA发生转化形成结合态或者其他产物导致(Silveira et al.,2004)。针叶树体胚发生研究中外源添加生长素情况与本研究内源IAA含量变化趋势相一致,即在胚性愈伤诱导过程中需要高浓度的生长素类激素(如2,4-D,6-BA)处理,通过IAA可以使体细胞获得胚性,原胚诱导及成熟培养中需要降低浓度或不添加生长素(Fehr,2003;Silveira et al.,2004;Pullman et al.,2014)。
3.3 GAs含量的变化GAs在针叶树营养生长及生殖生长过程发挥着重要的作用,主要体现在促进早熟、提早开花和促进种子生长发育等方面,而GAs主要通过促进生长素的合成而间接促进种子的发育(Rademacher,2000)。本研究表明,在红松合子胚发育早期,GAs含量的变化呈现逐渐升高的趋势,裂生多胚期达到最高,成熟发育期含量逐渐降低,但在整个发育阶段GAs含量较低,笔者推测在胚胎发育过程中GAs可能作用不大。尽管在被子植物的体胚发生研究中有GAs含量增加的报道,对于针叶树青冈云杉(Picea glauca)的研究也证实GAs家族在胚胎发育中的作用不明显(Kong et al.,1997;Pullman et al.,2014)。对于GAs促进胚胎发育的作用尚需通过外源施加GAs来进一步验证。
3.4 ABA含量的变化ABA在促进种子成熟期的贮藏蛋白的合成及在种子成熟后期促进种子耐受干燥所需蛋白的合成过程中调控相关基因的表达及抑制萌发方面起着重要作用(Chiwocha et al.,2002;Fehr,2003;Pullman et al.,2014)。本研究中在原胚期至裂生多胚期的ABA含量持续增加,随后的发育过程逐渐降低,这与其他物种合子胚发育过程中ABA含量的变化情况基本一致,即在种子发育早期ABA含量呈现递增的趋势,后期的胚胎成熟干燥期呈现递减的趋势(Kapik et al.,1995;Kong et al.,1997;Carrier et al.,1999;Silveira et al.,2004;Bosco et al.,2015)。脱落酸此外,在针叶树的原胚诱导及体胚成熟试验研究中加入外源ABA会增加体胚成熟的数量和质量,而缺少外源ABA不会促进成熟(Kong et al.,1997;Silveira et al.,2004),上述研究也证实ABA在胚胎发育过程中的重要作用,同时ABA添加的诱导时期也与本研究相对应的合子胚发育时期相吻合。
3.5 激素间动态平衡对种子发育的影响胚胎和种子发育过程不仅与植物内源激素的绝对含量有关,还与各类激素之间的平衡,尤其是在促进生长的激素与抑制生长的激素之间的比例及平衡有关,ZR,IAA,GAs属于促进生长类激素,而ABA属于抑制生长类激素(许智宏等,2012)。本研究中,GAs+ IAA + ZT/ABA的比值整体呈现先增加后降低趋势,柱状胚期达到最大值,表明早期的原胚、裂生多胚和柱状胚发育均需要较高浓度的生长促进因子,以器官开始分化作为转折点,随后抑制生长的激素起主导作用来促进胚胎和种子的成熟。红松胚胎和种子发育过程的演变不仅与GAs,ABA,ZR和IAA绝对含量有关,还与ZR+IAA+GAs / ABA比值有关。在胚胎发育前期,生长促进激素与生长抑制激素的比值较高有利于胚胎和胚乳细胞快速分裂进而影响胚胎分化及种子的大小;而胚胎成熟后期,二者比值降低则促进种子的成熟同时抑制生长,该研究结果在其他植物的相关研究中也得到了证实(Ma et al.,2010,张新友等,2013)。
4 结论本研究通过红松发育过程遵循松属的胚胎发育过程(林金星等,2000;张华新,2000;Von Androa et al.,2002),即胚胎发育从受精卵开始先后经历原胚期、裂生多胚期、柱状胚期、子叶前期、子叶胚期。此外,本研究中对激素的分析结果表明,红松种子雌配子体发育过程中内源激素的含量随着胚胎形态发育的变化而发生动态变化,无性系间变化趋势一致,IAA,ABA,ZR及激素间的比值在红松胚胎发育过程中起重要调节作用,尤其是IAA和ABA作用较大,而GAs对发育过程没有明显的作用。
根据红松胚胎发育阶段在受精早期加强树体营养和土肥水管理,保证胚胎发育所需的养分要求,也可根据测得激素变化趋势在胚胎发育不同时期通过施加外源激素来实现红松种子发育的人工调控。此外,根据上述发育过程中激素变化规律可以为体胚发生的相关外源激素的添加提供参考。
| [1] |
樊卫国,安华明,刘国琴,等. 2004.刺梨果实与种子内源激素含量变化及其与果实发育的关系.中国农业科学, 37(5):728-733. (Fan W G, An H M, Liu G Q, et al. 2007. Changes of endogenous hormones contents in fruit, seeds and their effects on the fruit development of Rosa roxburghii. Scientia Agricultura Sinicae, 37(5):728-733.)(  1) 1)
|
| [2] |
梁艳,沈海龙,李玉花,等. 2012.植物体细胞胚胎发生中乙烯和多胺作用的研究进展.林业科学, 48(9):145-153. (Liang Y, Shen H L, Li Y H, et al. 2012. Role of ethylene and polyamines in plant somatic Embryogenesis. Scientia Silvae Sinicae, 48(9):145-153.)(  1) 1)
|
| [3] |
林金星,胡玉熹. 2000.裸子植物结构图集.北京:科学出版社, 199-212. (Lin J X, Hu Y X. 2000. Atlas of structure of gymnosperms. Beijing:Science Press, 199-212.)(  1) 1)
|
| [4] |
许智宏,薛红卫. 2012.植物激素作用的分子机理.上海:上海科学技术出版社,382-395. (Xu Z H, Xue W H. 2012. Plant hormones:function and molecular mechanism. Shanghai:Shanghai scientific & Technical Publishers, 382-395.)(  2) 2)
|
| [5] |
张华新. 2000.油松种子园生殖系统研究.北京:中国林业出版社,17-23. (Zhang H X. 2000. The research on the reproductive system of Pinus tabulaeformis Carr. seed orechard. Beijing:China Forestry Publishing House, 17-23.)(  1) 1)
|
| [6] |
张新友,徐静,汤丰收,等. 2013.花生种间杂种胚胎发育及内源激素变化.作物学报,39(6):1127-1133. (Zhang X Y, Xu J, Tang F S, et al. 2013. Embryonic development and changes of endogenous hormones in interspecific hybrids between Peanut (A. hypogaea L.) and wild arachis species. acta Agronomica Sinica, 39(6):1127-1133.)(  1) 1)
|
| [7] |
Astarita L V, Floh E I S, Handro W. 2003. Changes in IAA,tryptophan and activity of soluble peroxidase associated with zygotic embryogenesis in Araucaria angustifolia (Brazilian pine).Plant Growth Regulation, 39(2):113-118.( 1) 1)
|
| [8] |
Bosco R, Caser M, Ghione G G, et al. 2015. Dynamics of abscisic acid and indole-3-acetic acid during the early-middle stage of seed development in Rosa hybrida. Plant Growth Regulation, 75(1):265-270.( 2) 2)
|
| [9] |
Cairney J, Pullman G S. 2007. The cellular and molecular biology of conifer embryogenesis. New Phytologist, 176(3):511-536.( 1) 1)
|
| [10] |
Carrier D J, Kendall E J, Bock C A,et al. 1999. Water content, lipid deposition, and (+)-abscisic acid content in developing white spruce seeds. Journal of Experimental Botany, 50(337):1359-1364.( 3) 3)
|
| [11] |
Chen M M, Feng F J, Sui X, et al. 2010. Construction of a framework map for Pinus koraiensis Sieb. et Zucc. using SRAP. SSR and ISSR markers. Trees, 24(4):685-693.( 1) 1)
|
| [12] |
Chiwocha S, Aderkas P. 2002. Endogenous levels of free and conjugated forms of auxin, cytokinins and abscisic acid during seed development in Douglas fir. Plant Growth Regulation, 36(3):191-200.( 4) 4)
|
| [13] |
Fehr A. 2003. Transition of somatic plant cells to an embryogenic state. Plant Cell, Tissue and Organ culture, 74(3):201-228.( 2) 2)
|
| [14] |
Jimenez V M. 2005. Involvement of plant hormones and plant growth regulators on in vitro somatic embryogenesis. Plant Growth Regulation,47(2):91-100.( 1) 1)
|
| [15] |
Kapik R H, Dinus R J, Dean J F D. 1995. Abscisic acid and zygotic embryogenesis in Pinus taeda. Tree Physiology, 15(7):485-490.( 2) 2)
|
| [16] |
Kong L, Attree S M, Fowke L C. 1997. Changes of endogenous hormone levels in developing seeds, zygotic embryos and megagametophytes in Picea glauca. Physiolog Plantarum, 101(1):23-30.( 6) 6)
|
| [17] | Lulsdorf M M, Yuan H Y, Slater S M H, et al. 2013. Endogenous hormone profiles during early seed development of C. arietinum and C. anatolicum. Plant Growth Regulation, 71(2):191-198. |
| [18] |
Ma H, Liang Z, Wu H, et al. 2010. Role of endogenous hormones, glumes, endosperm and temperature on germination of Leymus chinensis (Poaceae) seeds during development. Journal of Plant Ecology, 3(4):269-277.( 1) 1)
|
| [19] |
Pipino L, Leus L, Scariot V, et al. 2013. Embryo and hip development in hybrid roses. Plant Growth Regulation, 69(2):107-116.( 1) 1)
|
| [20] |
Pullman G S, Bucalo K. 2014. Pine somatic embryogenesis:analyses of seed tissue and medium to improve protocol development. New Forests, 45(3):353-377.( 7) 7)
|
| [21] |
Rademacher W. 2000. Growth retardants:effects on gibberellin biosynthesis and other metabolic pathways. Annual Review of Plant Physiology and Plant Molecular Biology, 51(7):501-531.( 1) 1)
|
| [22] |
Sandberg G, Ernstsen A, Hamnede M. 1987. Dynamics of indole-3-acetic acid andindole-3-ethanol during development and germination of Pinus sylvestris seeds. Physiology Plantarum, 71(4):411-418.( 1) 1)
|
| [23] |
Silveira V, Balbuena T S, Santa-Catarina C, et al. 2004. Biochemical changes during seed development in Pinus taeda L. Plant Growth Regulation, 44(2):147-156.( 7) 7)
|
| [24] |
Thomas C, Bronner R, Molinier J, et al. 2002. Immuno-cytochemical localization of indole-3-acetic acid during induction of somatic embryogenesis in cultured sunflower embryos. Planta, 215(4):577-583.( 1) 1)
|
| [25] |
Von Androa S, Sabala I, Bozhkov P, et al. 2002. Developmental pathways of somatic embryogenesis. Plant Cell, Tissue and Organ Culture, 69(3):233-249.( 1) 1)
|
| [26] |
Yan Z, Zhao Z Z, Zheng R H, et al. 2012. Proteomic analysis of early seed development in Pinus massoniana L. Plant Physiology and Biochemistry, 54(5):97-104.( 1) 1)
|
 2016, Vol. 52
2016, Vol. 52

