文章信息
- 陈红, 田根林, 吴智慧, 费本华
- Chen Hong, Tian Genlin, Wu Zhihui, Fei Benhua
- AFM技术观察慈竹纤维和薄壁细胞断面微纤丝聚集体特征
- Cellulose Microfibril Aggregates in Cross-Section of Bamboo Fiber and Parenchyma Cell Wall with Atomic Force Microscopy
- 林业科学, 2016, 52(2): 99-105
- Scientia Silvae Sinicae, 2016, 52(2): 99-105.
- DOI: 10.11707/j.1001-7488.20160212
-
文章历史
- 收稿日期:2015-04-08
- 修回日期:2015-09-11
-
作者相关文章
2. 国际竹藤中心 北京 100102
2. International Centre for Bamboo and Rattan Beijing 100102
竹纤维是竹材的主要力学强度承担者,而纤维素微纤丝聚集体是竹纤维细胞壁的主要组成单元,所以细胞壁中纤维素微纤丝聚集体一直是学者们的研究兴趣。由于竹纤维细胞壁质地较硬,制样较困难,尤其是细胞壁横截面样品的制备,导致竹材细胞壁中纤维素微纤丝聚集体的研究进展较慢。目前关于纤维素微纤丝聚集体的研究多集中在位于竹纤维细胞壁表面的初生壁(余雁等,2008;陈红等,2014),而竹材细胞壁横截面上纤维素微纤丝聚集体的研究未见报道。
近些年发展起来的原子力显微镜(atomic force microscopy, AFM)作为一种在纳米尺度上研究生物质材料的重要手段,能够在天然条件下或者接近天然条件下获得具有纳米尺度的图像,成为研究植物细胞壁的理想手段之一(Kirby et al., 1996;Thimm et al., 2000;Davies et al., 2003;Niimura et al., 2010),利用AFM研究木材及其他植物细胞壁纤维素微纤丝聚集体也取得了一些进展(Fahlén et al., 2002;2003;2005;Zimmermann et al., 2006;Thimm et al., 2009;Cybulska et al., 2013)。
本文以1年生慈竹(Neosinocalamus affinis)为研究对象,通过处理制备出适合直接观察的样品,利用AFM研究竹纤维细胞和竹薄壁细胞纤维素微纤丝聚集体的分布规律,为竹纤维及竹材的加工利用提供理论支持。
1 材料与方法 1.1 试验材料慈竹,1年生,采自四川长宁,气干,放置至含水率为8%~12%;30%双氧水、冰醋酸均为分析纯。
1.2 试验方法 1.2.1 样品制备将竹肉部分切成小竹条放入30%双氧水和冰醋酸的体积比为1∶ 1的溶液中,在60 ℃水浴锅中保持14 h进行脱木素处理。用去离子水将脱木素样品洗至中性,并冷冻干燥24 h,获得竹材样品(图 1A)。从样品中挑出一小束,用Spurr树脂包埋,70 ℃聚合8 h(图 1B)。通过滑走切片机修块,超薄切片机钻石刀抛光(图 1C),最后在原子力显微镜下观察(图 1D)。

|
图1 样品制作过程 Fig.1 Preparation of samples A.脱木素冻干样品Freeze dried delignified bamboo strips;B.树脂包埋Fixed in spurr resin;C.修块和抛光Cutting and polishing;D.AFM下观察Observation with AFM. |
采用AFM(Icon, Burker Corperation, Santa Barbara, US)中的Tapping模式成像,室温(23±2)℃,相对湿度35%±5%,微悬臂长度125 μm, 力常数42 N·m-1,使用商用硅探针,针尖半径为8 nm,振动频率为320 kHz。扫描速度1.0 Hz,扫描角度0°,Tapping 频率范围340~380 kHz。在不影响图像测量精度的前提下,利用仪器自带的软件(NanoScope Analysis 4.0)处理图像以获得更清晰的图像,图像分辨率为512□512。
2 结果与分析在AFM中一次扫描可以得到不同数据类型的图像,其中高度图反映材料表面形貌的高度特征,可以直接利用此类图像的高度数据来评价材料表面的粗糙度;相图适合反映材料表面不同区域力学性质的差异,并且常能够显示一些高度图中不可见或者只能隐约可见的特征(Hansma et al., 1997;Fahlén et al., 2003;余雁等,2008)。 在高度图中,不同的亮度代表不同的高度,越亮的地方表示高度越高,越暗的地方表示高度越低,是衡量样品平整度的有效指标(Thimm et al., 2009)。在相图中,纤维素微纤丝是亮色的部分,非纤维素多糖基质及微纤丝之间的空隙是深色部分,因为这种基质的弹性和硬度明显小于微纤丝(Fahlén et al., 2003;2005)。
2.1 细胞壁横截面纤维素微纤丝聚集体分布采用AFM观察竹纤维细胞壁横截面,首先在光镜下定位到需要观察的细胞(图 2A),十字相交点为扫描位置,扫描成像的高度图和相图分别为对应的图 2B和图 2C,图 2D为三维相图。由图 2可以看出,不管是高度图还是相图,都能够看出竹纤维细胞壁呈现出多壁层结构,这与以往基于TEM和偏振光显微镜等技术手段的研究结论是一致的(Parameswaran et al., 1976;1980)。此外,在相图的二维图和三维图中能够清晰地观察到纤维细胞壁层中微纤丝聚集体的分布。
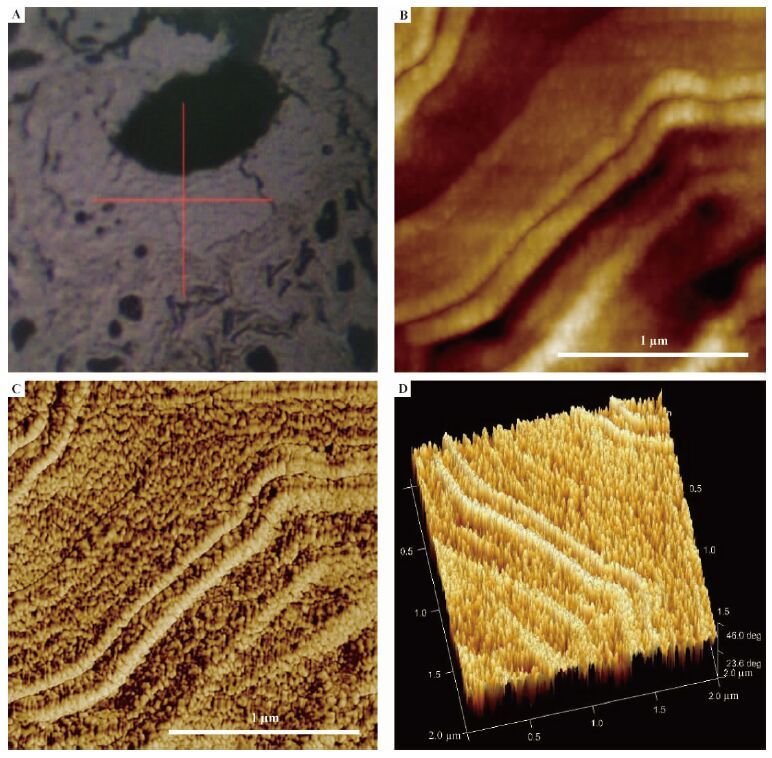
|
图2 竹纤维细胞壁微纤丝聚集体分布 Fig.2 Typical AFM images of bamboo fiber cell wall A.光镜定位图Cross section of bamboo cell wall;B.高度图Height image;C.相图Phase image;D.三维相图Three dimensional phase image. |
图 3是一个维管束内不同位置竹纤维细胞壁横截面的成像,图 3B中纤维素微纤丝聚集体的分布密度比图 3D小,且从细胞壁内侧到细胞壁外侧,纤维素微纤丝聚集体的密度都呈不均匀分布。这说明处于不同位置的纤维细胞壁,各壁层的纤维素微纤丝分布密度不同,在一个细胞壁内,所处的位置不同,纤维素微纤丝的分布密度也不同。但从图 2C,D以及图 3B,D中都可以看出壁层相邻的位置处亮度高而且高亮度的物质比较密集,这说明无论位于何处的纤维,其细胞壁中壁层与壁层相邻的位置纤维素微纤丝聚集体的数量明显比壁层内多,而且排列紧密。
另外,在整个细胞壁的横截面,纤维素微纤丝聚集体排列形式都呈随机的无序排列。Fahlén等(2003)研究挪威云杉(Picea abies)纤维细胞壁横截面纤维素微纤丝聚集体排列,结果表明纤维素微纤丝聚集体沿着弦向呈一定顺序排列,但Zimmermann等(2006)通过研究不同方式制备出的挪威云杉纤维细胞壁横截面纤维素微纤丝聚集体的排列方式,观察到细胞壁横截面上纤维素微纤丝聚集体的排列方式因制备方式不同而不同,其中通过打磨的纤维横截面被认为最接近原始状态,其纤维素微纤丝聚集体呈随机排列。Zimmermann等(2006)认为Fahlén等(2003)观察到纤维素微纤丝聚集体沿着弦向呈一定顺序排列可能是因为在利用钻石刀切片制备样品中导致纤维素微纤丝聚集体重新排列导致的。本研究中采用是与Fahlén等(2003)相似的钻石刀切片方法,但Fahlén等(2003)制备的是单根纤维树脂包埋切出0.5 μm的切片,而本研究只是竹材部分脱木素后进行树脂包埋,并且只是对需要观察的面用钻石刀进行剖光,所以对细胞壁横截面纤维素微纤丝排列形式影响较小,得到了与Zimmermann等(2006)打磨木材细胞壁横截面纤维素微纤丝聚集体排列类似的结论。
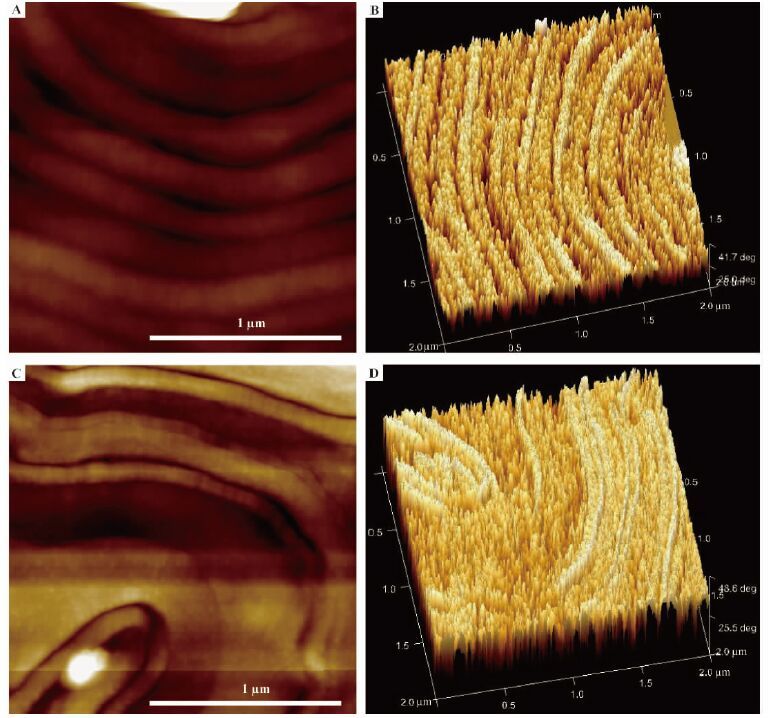
|
图3 不同位置竹纤维细胞壁中微纤丝聚集体的分布 Fig.3 Typical AFM images of different bamboo fiber cell wall A.高度图Height image;B.三维相图Phase image;C.高度图Height image;D.三维相图Phase image. |
微纤丝聚集体作为细胞壁力学性能的主要承担者,在一定程度上决定了细胞壁的力学强度。以往竹纤维细胞壁拉伸力学性能的研究中,1年生慈竹纤维的拉伸强度可高达1 780 MPa(Chen et al., 2011),而马尾松(Pinus massoniana)细胞壁的拉伸强度不到1 000 MPa(张双燕,2011),这很可能是因为竹纤维细胞壁中微纤丝聚集体与木材细胞壁中微纤丝聚集体不同造成。在以往研究中显示木材细胞壁中微纤丝聚集体在整个细胞壁中分布密度相对均匀(Fahlén et al., 2005;Zimmermann et al., 2006),而竹纤维整个细胞壁中微纤丝聚集体的分布密度因位置不同而改变,这也为仿生材料的结构设计提供了理论依据。
为了与竹纤维细胞壁对比,同样定位扫描了竹薄壁细胞横截面,结果发现薄壁细胞壁层结构和纤维素微纤丝聚集体分布与竹纤维细胞壁有一定的差别(图 4)。薄壁细胞也呈多层结构,且壁层数量比竹纤维细胞壁多,这与刘波(2008)基于TEM研究的结果一致: 纤维细胞从出笋到1年形成3~6层次生壁,而竹薄壁细胞形成6~11层次生壁。从图 4B和D可以看出,竹薄壁细胞壁中的纤维素微纤丝聚集体密度比竹纤维细胞壁小很多,纤维素微纤丝聚集体是细胞壁力学强度的主要承担者,这也是造成薄壁细胞力学强度比纤维细胞壁低很多的原因之一。而壁层与壁层相邻的地方纤维素微纤丝聚集体的密度比壁层内大,且比竹纤维细胞壁中更明显。同时,薄壁细胞壁中纤维素微纤丝聚集体排列也和纤维细胞壁中一样,都呈随机的无序排列。
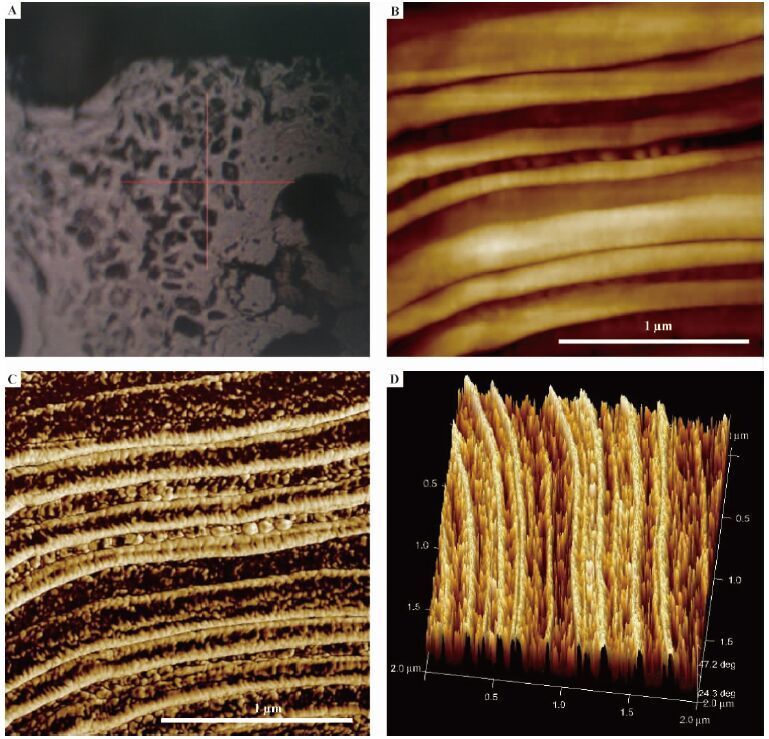
|
图4 竹材薄壁细胞壁横截面微纤丝聚集体分布 Fig.4 Typical AFM images of bamboo parenchyma cell wall A. 光镜定位图Cross section of bamboo cell wall;B. 高度图Height image;C. 相图Phase image;D. 三维相图Three dimensional phase image. |
对竹纤维细胞壁壁层内纤维素微纤丝聚集体的大小进行观察(见图 5)。不难发现,不仅纤维素微纤丝聚集体的分布密度会因为竹纤维在竹材中的位置而不同,纤维素微纤丝聚集体的大小也因为竹纤维在竹材中的位置不同而改变。在图 5B中大多单根纤维素微纤丝聚集体直径比图 5D中纤维素微纤丝聚集体的大,但在一个细胞壁的不同壁层,纤维素微纤丝聚集体的尺寸变化不大,这与整个木材细胞壁横截面上纤维素微纤丝聚集体的平均尺寸相差不大的结论是一致的(Fahlén et al., 2005;Salmén et al., 2006)。对于竹薄壁细胞壁,在一个细胞壁不同壁层内,纤维素微纤丝聚集体的尺寸变化很大,如图 6中箭头所指的纤维素微纤丝聚集体,其直径就是一个壁层的直径,而其他壁层内的纤维素微纤丝要小很多。由于纤维素微纤丝聚集体是纤维细胞和薄壁细胞壁的力学主要载体,纤维素微纤丝聚集体的尺寸大小以及这种尺寸分布规律,也是造成二者力学性能差异的部分原因。另外,在研究细胞壁力学性能时,发现细胞壁横截面不同位置模量差异比较大,可能主要是纤维素微纤丝聚集体在细胞壁中尺寸变化及分布规律造成的。

|
图5 不同位置竹纤维细胞壁微纤丝聚集体尺寸分布 Fig.5 Typical AFM images of cellulose microfibril aggregates in bamboo fiber cell wall A.高度图Height image;B.相图Phase image;C.高度图Height image;D.相图Phase image. |

|
图6 竹材薄壁细胞壁微纤丝聚集体尺寸分布 Fig.6 Typical AFM images of microfibril aggregates in bamboo parenchyma cell wall A.高度图Height image;B.相图Phase |
利用AFM对竹材细胞壁进行观察,通过对样品进行适当处理,不仅操作相对同分辨率的手段简单,而且还可以进行定位观察,除了能够获得传统手段得到的细胞壁多壁层结构外,还能获得纤维素微纤丝聚集体的分布,是一种便捷、有效的手段;竹纤维细胞壁和竹薄壁细胞的横截面纤维素微纤丝聚集体都呈随机的无序排列;不同位置的纤维细胞壁各壁层的纤维素微纤丝聚集体分布密度不同;一个细胞壁内各层内的纤维素微纤丝聚集体的密度也不同,并且在壁层与壁层相邻的位置纤维素微纤丝聚集体的密度明显大于壁层内纤维素微纤丝聚集体的密度,同时,这一现象在竹薄壁细胞横截面上表现的更明显;纤维素微纤丝聚集体的尺寸在一个竹纤维细胞壁中大小变化不大,而在薄壁细胞中变化较大。
| [1] |
陈红,田根林,费本华. 2014.利用AFM技术研究毛竹纤维初生壁微纤丝. 林业科学, 50(4):90-94. (Chen H, Tian G L, Fei B H.2014.Arrangement of cellulose microfibrils in primary cell wall of moso bamboo fiber studied with AFM. Scientia Silvae Sinicae, 50 (4):90-94.[in Chinese])(  1) 1)
|
| [2] |
刘波. 2008.毛竹发育过程中细胞壁形成的研究. 北京:中国林业科学研究院博士学位论文, 36-61. (Liu B. 2008.Formation of cell wall in development culms of Phyllostachys pubescens. Beijing:PhD thesis of Chinese Academy of Forestry, 36-61.[in Chinese])(  1) 1)
|
| [3] |
余雁,江泽慧,王戈,等.2008.毛竹纤维微纤丝取向的原子力显微镜的观察. 北京林业大学学报,30 (1):124-127. (Yu Y, Jiang Z H, Wang G, et al. 2008.visualization of cellulose microfibrils of Moso bamboo fibers with atomic force microscopy. Journal of Beingjing Forestry University, 30 (1):124-127.[in Chinese])(  2) 2)
|
| [4] |
张双燕.2011.化学成分对木材细胞壁力学性能影响的研究. 北京:中国林业科学研究院博士学位论文,59. (Zhang S Y. 2011.Chemical components effect on mechanical properties of wood cell wall. Beijing:PhD thesis of Chinese Academy of Forestry, 59.[in Chinese])(  1) 1)
|
| [5] |
Chen H, Wang G, Cheng H T. 2011.Properties of single bamboo fibers isolated by different chemical methods.Woodand Fiber Science, 43(2):111-120.( 1) 1)
|
| [6] |
Cybulska J, Zdunek A, Psonka-Antonczyk K M, et al.2013.The relation of apple texture with cell wall nanostructure studied using an atomic force microscope. Carbohydrate Polymer, 92(1):128-137.( 1) 1)
|
| [7] |
Davies L M, Harris P J. 2003.Atomic force microscopy of microfibrils in primary cell walls.Planta, 217(2):283-289.( 1) 1)
|
| [8] |
Fahlén J, Salmén L. 2002.On the lamellar structure of the tracheid cell wall. Plant Biology, 4(3):339-345.( 1) 1)
|
| [9] |
Fahlén J, Salmén L. 2003.Cross-sectional structure of the secondary wall of wood fibers as affected by processing. Journal of Materials Science, 38(1):119-126.( 6) 6)
|
| [10] |
Fahlén J, Salmén L.2005.Pore and matrix distribution in the fibre wall revealed by atomic force microscopy and image analysis.Biomacromolecules, 6(1):433- 438.( 4) 4)
|
| [11] |
Hansma H G, Kim K J, Laney D E, et al.1997.Properties of biomolecules measured from atomic force microscope images:a review. Journal of Structural Biology, 119(2):99-108.( 1) 1)
|
| [12] |
Kirby A R, Gunning A P, Waldron K W, et al.1996.Visualization of plant cell walls by atomic force microscopy. Biophysical Journal, 70(3):1138-1143.( 1) 1)
|
| [13] |
Niimura H, Yokoyama T, Kimura S, et al.2010.AFM observation of ultrathin microfibrils in fruit tissues. Cellulose, 17(1):13-18.( 1) 1)
|
| [14] |
Parameswaran N, Liese W. 1976.On the fine structure of bamboo fibres. Wood Science and Technology, 10(4):231-246.( 1) 1)
|
| [15] |
Parameswaran N, Liese W. 1980.Ultrastructural aspects of bamboo cells. Cellulose Chemistry and Technology, 14:587-609.( 1) 1)
|
| [16] |
Salmén L, Fahlén J. 2006.Reflections on the ultrastructure of softwood fibres. Cellulose Chemistry and Technology, 40(3/4):181-185.( 1) 1)
|
| [17] |
Thimm J C, Burritt D J, Ducker W A, et al.2000.Celery (Apium graveolens L.) parenchyma cell walls examined by atomic force microscopy:effect of dehydration on cellulose microfibrils. Planta, 212(1):25-32.( 1) 1)
|
| [18] |
Thimm J C, Burritt D J, Ducker W A, et al.2009.Pectins influence microfibril aggregation in celery walls:an atomic force microscopy study. Journal of Structural Biology, 168 (2):337-344.( 2) 2)
|
| [19] |
Zimmermann T, Thommen V, Reimann P, et al.2006.Ultrastructural appearance of embedded and polished wood cell walls as revealed by atomic force microscopy. Journal of Structural Biology, 156(2):363-369.( 5) 5)
|
 2016, Vol. 52
2016, Vol. 52

